Method Article
Osservazione diretta e misurazione automatizzata delle risposte stomatiche a Pseudomonas syringae pv. pomodoro DC3000 in Arabidopsis thaliana
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un metodo semplice per l'osservazione diretta e la misurazione automatizzata delle risposte stomatiche all'invasione batterica in Arabidopsis thaliana. Questo metodo sfrutta un dispositivo di imaging stomatico portatile, insieme a una pipeline di analisi delle immagini progettata per le immagini delle foglie catturate dal dispositivo.
Abstract
Gli stomi sono pori microscopici che si trovano nell'epidermide fogliare della pianta. La regolazione dell'apertura stomatica è fondamentale non solo per bilanciare l'assorbimento di anidride carbonica per la fotosintesi e la perdita d'acqua traspirante, ma anche per limitare l'invasione batterica. Mentre le piante chiudono gli stomi al riconoscimento di microbi, i batteri patogeni, come Pseudomonas syringae pv. pomodoro DC3000 (Pto), riaprire gli stomi chiusi per accedere all'interno della foglia. Nei saggi convenzionali per la valutazione delle risposte stomatiche all'invasione batterica, i peeling epidermici delle foglie, i dischi fogliari o le foglie staccate vengono fatti galleggiare su una sospensione batterica, quindi gli stomi vengono osservati al microscopio seguiti dalla misurazione manuale dell'apertura stomatica. Tuttavia, questi saggi sono ingombranti e potrebbero non riflettere le risposte stomatiche all'invasione batterica naturale in una foglia attaccata alla pianta. Recentemente, è stato sviluppato un dispositivo di imaging portatile in grado di osservare gli stomi pizzicando una foglia senza staccarla dalla pianta, insieme a una pipeline di analisi delle immagini basata sul deep learning progettata per misurare automaticamente l'apertura stomatica dalle immagini delle foglie catturate dal dispositivo. Qui, sulla base di questi progressi tecnici, viene introdotto un nuovo metodo per valutare le risposte stomatiche all'invasione batterica in Arabidopsis thaliana . Questo metodo consiste in tre semplici fasi: inoculazione a spruzzo di Pto che imita i processi di infezione naturali, osservazione diretta degli stomi su una foglia della pianta inoculata con presa di forza utilizzando il dispositivo di imaging portatile e misurazione automatizzata dell'apertura stomatica tramite la pipeline di analisi delle immagini. Questo metodo è stato utilizzato con successo per dimostrare la chiusura e la riapertura stomatica durante l'invasione della presa di forza in condizioni che imitano da vicino l'interazione naturale pianta-batterio.
Introduzione
Gli stomi sono pori microscopici circondati da un paio di cellule di guardia sulla superficie delle foglie e di altre parti aeree delle piante. In ambienti in continua evoluzione, la regolazione dell'apertura stomatica è fondamentale per le piante per controllare l'assorbimento di anidride carbonica necessario per la fotosintesi a scapito della perdita d'acqua attraverso la traspirazione. Pertanto, la quantificazione dell'apertura stomatica è stata fondamentale per comprendere l'adattamento ambientale delle piante. Tuttavia, la quantificazione dell'apertura stomatica è intrinsecamente dispendiosa in termini di tempo e ingombrante in quanto richiede il lavoro umano per individuare e misurare i pori stomatici in un'immagine fogliare catturata da un microscopio. Per aggirare queste limitazioni, sono stati sviluppati vari metodi per facilitare la quantificazione dell'apertura stomatica in Arabidopsis thaliana, una pianta modello ampiamente utilizzata per studiare la biologia stomatica 1,2,3,4,5,6. Ad esempio, un porometro può essere utilizzato per misurare il tasso di traspirazione come metrica della conduttanza stomatica. Tuttavia, questo metodo non fornisce informazioni dirette sul numero stomatico e sull'apertura che determinano la conduttanza stomatica. Alcuni studi hanno utilizzato tecniche di microscopia confocale che evidenziano i pori stomatici utilizzando un marcatore di actina fluorescente, un colorante fluorescente o l'autofluorescenza della parete cellulare 1,2,3,4,5. Sebbene questi approcci facilitino il rilevamento degli stomi, il costo sia del funzionamento di una struttura di microscopia confocale che della preparazione dei campioni di microscopia può essere un ostacolo all'applicazione di routine. In un lavoro pionieristico di Sai et al., è stato sviluppato un modello di rete neurale profonda per misurare automaticamente l'apertura stomatica da immagini microscopiche in campo chiaro di peeling epidermici di A. thaliana 6. Tuttavia, questa innovazione non esenta i ricercatori dal compito di preparare un peeling epidermico per l'osservazione microscopica. Recentemente, questo ostacolo è stato superato sviluppando un dispositivo di imaging portatile in grado di osservare gli stomi pizzicando una foglia di A. thaliana, insieme a una pipeline di analisi delle immagini basata sul deep learning che misura automaticamente l'apertura stomatica dalle immagini delle foglie catturate dal dispositivo7.
Gli stomi contribuiscono all'immunità innata delle piante contro i patogeni batterici. La chiave di questa risposta immunitaria è la chiusura stomatica che limita l'ingresso dei batteri attraverso il poro microscopico all'interno della foglia, dove i patogeni batterici proliferano e causano malattie8. La chiusura stomatica è indotta dal riconoscimento di pattern molecolari associati a microbi (MAMP), molecole immunogeniche spesso comuni a una classe di microbi, da parte dei recettori di riconoscimento dei pattern localizzati sulla membrana plasmatica (PRR)9. Un epitopo di 22 amminoacidi della flagellina batterica noto come flg22 è un tipico MAMP che induce la chiusura stomatica attraverso il suo riconoscimento da parte del PRR FLS210. Come contromisura, patogeni batterici come Pseudomonas syringae pv. pomodoro DC3000 (presa di forza) e Xanthomonas campestris pv. Le vesciche hanno sviluppato meccanismi di virulenza per riaprire gli stomi 9,11,12. Queste risposte stomatiche ai patogeni batterici sono state convenzionalmente analizzate in saggi in cui le bucce epidermiche delle foglie, i dischi fogliari o le foglie staccate vengono fatti galleggiare su una sospensione batterica, quindi gli stomi vengono osservati al microscopio seguiti dalla misurazione manuale dell'apertura stomatica. Tuttavia, questi saggi sono ingombranti e potrebbero non riflettere le risposte stomatiche all'invasione batterica naturale che si verificano in una foglia attaccata alla pianta.
Qui, viene presentato un metodo semplice per studiare la chiusura e la riapertura stomatica durante l'invasione della presa di forza in condizioni che imitano da vicino l'interazione naturale pianta-batterio. Questo metodo sfrutta il dispositivo di imaging portatile per l'osservazione diretta degli stomi di A. thaliana su una foglia attaccata alla pianta inoculata con Pto, insieme alla pipeline di analisi delle immagini per la misurazione automatizzata dell'apertura stomatica.
Protocollo
1. Piante in crescita
- Per interrompere la dormienza, risospendere i semi di A. thaliana (Col-0) in acqua deionizzata e incubarli a 4 °C per 4 giorni al buio.
- Semina i semi sul terreno e coltiva in una camera dotata di luce fluorescente bianca. Mantenere le seguenti condizioni di crescita: temperatura di 22 °C, intensità luminosa di 6.000 lux (ca. 100 μmol/m2/s) per 10 ore e umidità relativa del 60%.
- Quando necessario, annaffia le piante con un fertilizzante liquido. Astenersi dall'annaffiare da 1 settimana a 2 giorni prima dell'inoculazione e innaffiare bene 1 giorno prima dell'inoculazione.
2. Preparazione dell'inoculo batterico
- Striare il Pto da stock di glicerolo su terreno solidificato King's B (KB) (20 g di triptone, 1,5 g di K2HPO4 e 15 g di glicerolo per 1 L, 1,5% Agar) con 50 μg/mL di rifampicina e incubare a 28 °C per 2 giorni.
- Inoculare una singola colonia in 5 mL di terreno liquido KB con rifampicina 50 μg/mL e incubare a 28 °C con agitazione a 200 rpm fino alla fase di crescita logaritmica tardiva.
- Centrifugare la coltura a 6.000 x g per 2 minuti, scartare il surnatante e risospendere il pellet in 1 mL di acqua sterile. Ripeti questo passaggio ancora una volta.
- Rimuovere il surnatante, risospendere il pellet in 1 mL di tampone di apertura degli stomi (25 mM MES-KOH pH 6,15, 10 mM KCl) e misurare il OD600.
- Diluire la sospensione a OD600 0,2 con tampone di apertura degli stomi contenente lo 0,04% di tensioattivo siliconico.
3. Inoculazione a spruzzo di batteri
- Da 1 giorno prima dell'inoculazione fino alla fine dell'esperimento, esporre le piante a un'intensità luminosa di circa 10.000 lux (ca. 170 μmol/m2/s).
- Per garantire che la maggior parte degli stomi sia aperta, tenere le piante su un vassoio coperto con un coperchio trasparente sotto la luce per almeno 3 ore prima dell'inoculazione spray.
- Rimuovere il coperchio e utilizzare un aerografo per spruzzare il lato abassiale delle foglie con 2,5 ml di sospensione batterica per tre piante su un singolo vaso.
- Incubare le piante inoculate su un vassoio coperto da un coperchio trasparente per mantenere un'umidità relativa di circa l'85%.
- Acquisire immagini degli stomi a 1 ora e 3 ore dopo l'inoculazione spray utilizzando il metodo descritto al paragrafo 4.
4. Osservazione diretta degli stomi utilizzando il dispositivo di imaging portatile
NOTA: Il dispositivo portatile per l'imaging stomatico è dotato di una luce LED e di un modulo telecamera e può acquisire 2.592 × 1.944 immagini (altezza × larghezza; pixel) con una risoluzione di circa 0,5 μm/pixel.
- Collegare il dispositivo portatile di imaging stomatico a un personal computer (PC) dotato di software di acquisizione delle immagini.
- Rimuovere delicatamente ma completamente le goccioline d'acqua dalle foglie inoculate con un pezzo di carta.
- Aprire il coperchio superiore del dispositivo, posizionare l'anta sul tavolino e chiudere il coperchio superiore (Figura 1).
- Regolare la messa a fuoco dell'immagine manipolando la vite di regolazione, quindi fare clic sul pulsante Salva immagine sullo schermo del PC. L'immagine verrà acquisita all'istante. In genere, un'immagine focalizzata contiene circa 10 stomi analizzabili. Per ottenere risultati robusti, acquisisci immagini stomatiche da sei foglie di tre piante diverse (due foglie per pianta).
5. Misurazione manuale dell'apertura stomatica
NOTA: Il software ImageJ può essere scaricato all'indirizzo https://imagej.nih.gov/ij/download.html
- Aprire un file di immagine in ImageJ.
- Apri Gestione ROI selezionando Analizza strumenti > > Gestione ROI.
- Utilizzare lo strumento di selezione Linea retta per disegnare una linea corrispondente alla larghezza di uno stoma (Figura 2) e registrare il ROI facendo clic su Aggiungi in Gestione ROI.
- Tracciare una linea corrispondente alla lunghezza dello stesso stoma (Figura 2A) e registrare il ROI come descritto al punto 5.3.
- Fare clic su Misura in Gestione ROI per misurare la larghezza e la lunghezza.
- Dividere la larghezza per la lunghezza per ottenere l'apertura stomatica (rapporto). Per una quantificazione robusta, utilizzare 60 o più stomi per ogni trattamento e punto temporale. Non scegliere stomi prematuri o oscuri per l'analisi (Figura 2B, C).
6. Misurazione automatizzata dell'apertura stomatica
NOTA: la pipeline di analisi delle immagini viene eseguita in Google Colaboratory, un ambiente eseguibile del linguaggio di programmazione Python cloud. Gli utenti devono disporre di un account Google valido con un Google Drive funzionante, un browser Google Chrome e una connessione Internet stabile come prerequisito.
- Scarica il notebook di Google Colaboratory da Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) e apri il notebook.
- Crea una copia locale del taccuino su Google Drive selezionando File > Salva una copia in Drive. Quando viene visualizzata una nuova scheda, chiudere in modo sicuro la scheda del blocco appunti originale.
- Premere una volta il pulsante Esegui sotto la sezione Impostazione ambientale nel notebook senza aprire i blocchi di celle per importare le librerie richieste.
- Esegui la sezione Impostazioni directory per creare tre cartelle utilizzate per l'analisi (ad esempio, example_result, inference_results e modello) in Google Drive.
NOTA: in questo caso, le cartelle denominate example_result, inference_results e model vengono utilizzate come directory padre, memorizzando rispettivamente i risultati dell'inferenza e i modelli sottoposti a training. In questo notebook viene illustrato un esempio di costruzione di directory come procedura rappresentativa. Per modificare il nome, riscrivere il percorso pardir, infdir o modeldir . - In base alla sezione Preparazione delle immagini , spostare le immagini acquisite in example_result, raggruppate in titoli di immagini per trattamento o campione (ad esempio, mock_1h_XXXXXX.jpg) per la generazione finale del grafico. Immagini di esempio sono disponibili presso Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528).
- Eseguire la parte Download Trained Models per scaricare i file ONNX dei modelli addestrati da Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) e posizionarli nella directory del modello .
- Eseguire la parte Inferenza e misurazione dell'apertura stomatica per quantificare l'apertura stomatica da singole immagini. Le immagini risultanti con inferenza sovrapposta e il file csv denominato example_result.csv verranno esportati nella directory inference_results.
- Eseguire la sezione Generazione grafico per creare un grafico relativo al rapporto di apertura stomatica, esportato nella directory inference_results .
Risultati
Dopo l'inoculazione spray di Pto, gli stomi sulle foglie attaccate alle piante inoculate sono stati osservati direttamente dal dispositivo di imaging stomatico portatile. Utilizzando misurazioni manuali e automatizzate, le stesse immagini delle foglie sono state utilizzate per calcolare l'apertura stomatica prendendo rapporti tra larghezza e lunghezza di circa 60 stomi. Le misurazioni manuali e automatizzate hanno indicato costantemente una diminuzione dell'apertura stomatica nelle piante inoculate con presa di forza rispetto alle piante finte inoculate a 1 ora dopo l'inoculazione (hpi) (Figura 3A,B), indicando che le piante di A thaliana chiudono gli stomi in risposta all'invasione della presa di forza. A 3 hpi, l'apertura stomatica nelle piante inoculate con presa di forza e nelle piante finte inoculate era praticamente la stessa (Figura 3C,D), ricordando la riapertura stomatica da parte della presa di forza. Sorprendentemente, la misurazione automatica dell'apertura stomatica ha richiesto solo circa 5 secondi per elaborare un'immagine (Tabella 1), riducendo il tempo di misurazione di oltre il 95% rispetto alla misurazione manuale. Pertanto, questo protocollo offre un mezzo semplice dal punto di vista operativo e che consente di risparmiare manodopera per tracciare le risposte stomatiche dinamiche di A. thaliana al patogeno batterico.

Figura 1: Dispositivo di imaging portatile. Immagini che ritraggono il dispositivo di imaging portatile con un'anta sul tavolino (a sinistra) e con il coperchio superiore chiuso (a destra). Fare clic qui per visualizzare una versione più grande di questa figura.
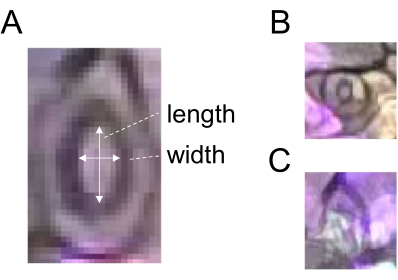
Figura 2: Diagramma schematico della misurazione dell'apertura stomatica. (A) L'apertura stomatica viene determinata calcolando il rapporto tra larghezza e lunghezza di uno stoma, come indicato da frecce bianche. (B) Gli stomi prematuri e (C) oscuri devono essere esclusi dalla misurazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Risposte stomatiche alla presa di forza in una pianta intera intatta. Le piante di A. thaliana sono state inoculate a spruzzo con finta o presa di forza, e gli stomi sulle foglie attaccate alle piante inoculate sono stati osservati direttamente a (A,B) 1 hpi e (C,D) 3 hpi dal dispositivo di imaging stomatico portatile. L'apertura stomatica (rapporto) è stata calcolata mediante misurazioni manuali (A,C) e (B,D) automatizzate. I valori P sono stati calcolati mediante un test t a due code. Fare clic qui per visualizzare una versione più grande di questa figura.
| Tempo di elaborazione (s) | ||
| Metodo | Significare | SD |
| Manuale | 130.1 | 48.8 |
| Automatizzato | 4.7 | 0.8 |
Tabella 1: Tempo di elaborazione per le misurazioni manuali e automatiche dell'apertura stomatica per immagine. Le medie e le deviazioni standard (SD) del tempo di elaborazione sono state calcolate dalle misurazioni di nove immagini rappresentative.
Discussione
Studi precedenti hanno utilizzato peeling epidermici, dischi fogliari o foglie staccate per studiare le risposte stomatiche alle invasioni batteriche 9,11,12. Al contrario, il metodo proposto in questo studio sfrutta il dispositivo portatile di imaging stomatico per osservare direttamente gli stomi su una foglia attaccata alla pianta dopo l'inoculazione spray di Pto, imitando le condizioni naturali di invasione batterica. Inoltre, poiché questo metodo non comporta processi distruttivi di preparazione del campione come il distacco delle foglie, l'escissione del disco fogliare e il peeling epidermico, è possibile evitare la ferita e la perdita d'acqua associate a questi processi di preparazione del campione. Questi effetti non devono essere presi alla leggera, poiché la ferita e la perdita d'acqua producono inevitabilmente segnali di origine vegetale come i fitormoni jasmonato e acido abscissico che influenzano i movimenti stomatici13,14.
Esistono diverse linee guida per l'uso ottimale del dispositivo portatile di imaging stomatico. In primo luogo, rimuovere accuratamente le goccioline d'acqua dalle superfici fogliari è fondamentale per ottenere immagini di nitidezza e messa a fuoco ottimali. In secondo luogo, si consiglia di acquisire più immagini da aree fogliari identiche manipolando la vite di regolazione per regolare con precisione la messa a fuoco. Si prevede che questa pratica aumenterà il numero di stomi analizzabili per area fogliare, mitigando così potenziali distorsioni di campionamento. Infine, quando si pizzica una foglia con il dispositivo, è necessaria un'attenta manipolazione per evitare di causare danni alla foglia. Questo è fondamentale perché la ferita è uno dei segnali che provocano la chiusura stomatica14.
L'apertura stomatica tendeva ad essere più variabile nella misurazione automatizzata rispetto alla misurazione manuale (Figura 3). Ci sono diverse possibili ragioni per questo. In precedenza è stato riportato che i pori stomatici dedotti dalla pipeline di analisi delle immagini spesso includono pareti cellulari e/o ombre di cellule di guardia che circondano il poro stomatico7, il che non è il caso nella misurazione manuale da parte di occhi umani. Gli stomi con forme insolite possono anche influenzare la variazione tra le misurazioni manuali e automatizzate, sebbene il modello di rilevamento degli stomi sia stato addestrato per escludere tali stomi dall'analisi7. Ad alcuni stomi sono stati dati valori zero per l'apertura stomatica nella misurazione automatizzata, ma nessuno nella misurazione manuale per ragioni sconosciute. Per risolvere questi problemi potrebbero essere necessari futuri aggiornamenti dei modelli. Tuttavia, poiché la misurazione automatica dell'apertura stomatica corrispondeva essenzialmente alla misurazione manuale, la versione attuale della pipeline di analisi delle immagini è di utilità pratica.
L'osservazione diretta e la misurazione automatizzata dell'apertura stomatica in A. thaliana descritta in questo studio sono promettenti per varie applicazioni volte a chiarire il ruolo degli stomi nell'adattamento ambientale delle piante. Ad esempio, il metodo presentato dovrebbe essere ampiamente applicabile per quantificare rapidamente l'apertura stomatica in un intero sistema vegetale intatto dopo l'esposizione a stress biotici come MAMP e patogeni microbici, nonché a stress abiotici come la siccità. A sostegno di ciò, uno studio precedente ha applicato con successo la pipeline di analisi delle immagini per quantificare con precisione l'apertura stomatica dei "dischi fogliari" trattati con la tossina fungina fusicoccina che induce l'apertura stomatica o l'acido abscissico dell'ormone dello stress che induce la chiusura stomatica7. Inoltre, in linea di principio, il dispositivo di imaging portatile consente un'analisi a lungo termine del decorso temporale dell'apertura stomatica su una singola foglia identica attaccata alla pianta. Questo potrebbe far luce su nuovi aspetti delle interazioni pianta-microbi perché la maggior parte degli studi si è concentrata sulle risposte stomatiche ai patogeni batterici per le prime ore dell'interazione 9,10,11. Sarà anche interessante utilizzare e modificare il metodo presentato per esplorare le risposte stomatiche all'invasione batterica in varie condizioni ambientali. Ciò è particolarmente rilevante per comprendere gli impatti di fattori ambientali come la temperatura, l'umidità e la disponibilità di acqua nel suolo che influenzano i movimenti stomatici e lo sviluppo di malattie da parte di patogeni batterici 8,15. In conclusione, il metodo presentato sarà concepito per accelerare la ricerca sulle funzioni stomatiche all'interno e al di là delle interazioni pianta-microbi in contesti sperimentali finora irraggiungibili.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Ringraziamo tutti i membri del progetto di ricerca, "Co-creazione di tratti adattativi vegetali tramite assemblaggio di olobionte pianta-microbo", per le fruttuose discussioni. Questo lavoro è stato sostenuto da Grant-in-Aid for Transformative Research Areas (21H05151 e 21H05149 ad A.M. e 21H05152 a Y.T.) e Grant-in-Aid for Challenging Exploratory Research (22K19178 ad A. M.).
Materiali
| Name | Company | Catalog Number | Comments |
| Agar | Nakarai tesque | 01028-85 | |
| Airbrush kits | ANEST IWATA | MX2900 | Accessory kits for SPRINT JET |
| Biotron | Nippon Medical & Chemical Instruments | LPH-411S | Plant Growth Chamber with white fluorescent light |
| Glycerol | Wako | 072-00626 | |
| Half tray | Sakata | 72000113 | A set of tray and lid |
| Hyponex | Hyponex | No catalogue number available | Dilute the solution of Hyponex at a ratio of 1:2000 in deionized water for watering plants |
| Image J | Natinal Institute of Health | Download at https://imagej.nih.gov/ij/download.html | Used for manual measurement of stomatal aperture |
| K2HPO4 | Wako | 164-04295 | |
| KCl | Wako | 163-03545 | |
| KOH | Wako | 168-21815 | For MES-KOH |
| MES | Wako | 343-01621 | For MES-KOH |
| Portable stomatal imaging device | Phytometrics | Order at https://www.phytometrics.jp/ | Takagi et al.(2023) doi: 10.1093/pcp/pcad018. |
| Rifampicin | Wako | 185-01003 | Dissolve in DMSO |
| Silwet-L77 | Bio medical science | BMS-SL7755 | silicone surfactant used in spray inoculation |
| SPRINT JET | ANEST IWATA | IS-800 | Airbrush used for spray inoculation |
| SuperMix A | Sakata seed | 72000083 | Mix with Vermiculite G20 in equal proportions for preparing soil |
| Tryptone | Nakarai tesque | 35640-95 | |
| Vermiculite G20 | Nittai | No catalogue number available | Mix with Super Mix A in equal proportions for preparing soil |
| White fluorescent light | NEC | FHF32EX-N-HX-S | Used for Biotron |
Riferimenti
- Shimono, M., Higaki, T., Kaku, H., Shibuya, N., Hasezawa, S., Day, B. Quantitative evaluation of stomatal cytoskeletal patterns during the activation of immune signaling in Arabidopsis thaliana. PLoS One. 11, e0159291 (2016).
- Bourdais, G., et al. The use of quantitative imaging to investigate regulators of membrane trafficking in Arabidopsis stomatal closure. Traffic. 20 (2), 168-180 (2019).
- Higaki, T., Kutsuna, N., Hasezawa, S. CARTA-based semi-automatic detection of stomatal regions on an Arabidopsis cotyledon surface. Plant Morphology. 26 (1), 9-12 (2014).
- Eisele, J. F., Fäßler, F., Bürgel, F., Chaban, C. A. A rapid and simple method for microscopy-based stomata analyses. PLoS One. 11, e0164576 (2016).
- Chitraker, R., Melotto, M. Assessing stomatal response to live bacterial cells using whole leaf imaging. Journal of Visualized Experiments. 44, 2185 (2010).
- Sai, N., et al. StomaAI: an efficient and user-friendly tool for measurement of stomatal pores and density using deep computer vision. New Phytologist. 238 (2), 904-915 (2023).
- Takagi, M., et al. Image-based quantification of Arabidopsis thaliana stomatal aperture from leaf images. Plant and Cell Physiology. pcad018, (2023).
- Melotto, M., Zhang, L., Oblessuc, P. R., He, S. Y. Stomatal defense a decade later. Plant Physiology. 174 (2), 561-571 (2017).
- Melotto, M., Underwood, W., Koczan, J., Nomura, K., He, S. Y. Plant stomata function in innate immunity against bacterial invasion. Cell. 126 (5), 969-980 (2006).
- Zeng, W., He, S. A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiology. 153 (3), 1188-1198 (2010).
- Zheng, X. Y., et al. Coronatine promotes Pseudomonas syringae virulence in plants by activating a signaling cascade that inhibits salicylic acid accumulation. Cell Host and Microbe. 11 (6), 587-596 (2012).
- Raffeiner, M., et al. The Xanthomonas type-III effector XopS stabilizes CaWRKY40a to regulate defense responses and stomatal immunity in pepper (Capsicum annuum). The Plant Cell. 34 (5), 1684-1708 (2022).
- Munemasa, S., Hauser, F., Park, J., Waadt, R., Brandt, B., Schroeder, J. I. Mechanisms of abscisic acid-mediated control of stomatal aperture. Current Opinion in Plant Biology. 28, 154-162 (2015).
- Förster, S., et al. Wounding-induced stomatal closure requires jasmonate-mediated activation of GORK K+ channels by a Ca2+ sensor-kinase CBL1-CIPK5 complex. Developmental Cell. 48 (1), 87-99 (2018).
- Cheng, Y. T., Zhang, L., He, S. Y. Plant-microbe interactions facing environmental challenge. Cell Host and Microbe. 26 (2), 183-192 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon