Method Article
Direkte Beobachtung und automatisierte Messung der stomatalen Reaktionen auf Pseudomonas syringae pv. Tomate DC3000 in Arabidopsis thaliana
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir eine einfache Methode zur direkten Beobachtung und automatisierten Messung der stomatären Reaktionen auf bakterielle Invasion in Arabidopsis thaliana vor. Diese Methode nutzt ein tragbares stomatales Bildgebungsgerät zusammen mit einer Bildanalyse-Pipeline, die für vom Gerät aufgenommene Blattbilder ausgelegt ist.
Zusammenfassung
Spaltöffnungen sind mikroskopisch kleine Poren in der Epidermis der Pflanzenblätter. Die Regulierung der stomatalen Öffnung ist nicht nur für den Ausgleich der Kohlendioxidaufnahme für die Photosynthese und den transpirativen Wasserverlust von entscheidender Bedeutung, sondern auch für die Begrenzung der bakteriellen Invasion. Während Pflanzen bei der Erkennung von Mikroben Spaltöffnungen schließen, können pathogene Bakterien wie Pseudomonas syringae pv. Tomate DC3000 (Zapfwelle), öffnen Sie die geschlossenen Spaltöffnungen wieder, um Zugang zum Flügelinneren zu erhalten. Bei herkömmlichen Assays zur Beurteilung der Stomatareaktionen auf eine bakterielle Invasion werden Blattepidermisschalen, Blattscheiben oder abgelöste Blätter auf Bakteriensuspension geschwommen, und dann werden die Spaltöffnungen unter einem Mikroskop beobachtet, gefolgt von einer manuellen Messung der Stomataöffnung. Diese Assays sind jedoch umständlich und spiegeln möglicherweise nicht die stomatalen Reaktionen auf die natürliche bakterielle Invasion in einem an der Pflanze befestigten Blatt wider. Kürzlich wurde ein tragbares Bildgebungsgerät entwickelt, das Stomata beobachten kann, indem es ein Blatt einklemmt, ohne es von der Pflanze zu lösen, zusammen mit einer Deep-Learning-basierten Bildanalyse-Pipeline, die entwickelt wurde, um die Stomataöffnung aus den vom Gerät aufgenommenen Blattbildern automatisch zu messen. Aufbauend auf diesen technischen Fortschritten wird hier eine neue Methode zur Bewertung der stomatären Reaktionen auf die bakterielle Invasion in Arabidopsis thaliana vorgestellt. Diese Methode besteht aus drei einfachen Schritten: Sprühinokulation von Pto, die natürliche Infektionsprozesse nachahmt, direkte Beobachtung von Spaltöffnungen auf einem Blatt der Pto-inokulierten Pflanze mit dem tragbaren Bildgebungsgerät und automatisierte Messung der Stomataöffnung durch die Bildanalysepipeline. Diese Methode wurde erfolgreich eingesetzt, um den Verschluss und die Wiedereröffnung von Stomata während der Zapfwelleninvasion unter Bedingungen zu demonstrieren, die die natürliche Pflanzen-Bakterien-Interaktion genau nachahmen.
Einleitung
Spaltöffnungen sind mikroskopisch kleine Poren, die von einem Paar Schließzellen auf der Oberfläche von Blättern und anderen oberirdischen Pflanzenteilen umgeben sind. In sich ständig verändernden Umgebungen ist die Regulierung der Stomataöffnung für Pflanzen von zentraler Bedeutung, um die für die Photosynthese erforderliche Kohlendioxidaufnahme auf Kosten des Wasserverlusts durch Transpiration zu steuern. Daher war die Quantifizierung der Stomataöffnung entscheidend für das Verständnis der Anpassung an die Pflanzenumwelt. Die Quantifizierung der Stomataöffnung ist jedoch von Natur aus zeitaufwändig und umständlich, da menschliche Arbeit erforderlich ist, um Stomataporen in einem Blattbild zu erkennen und zu messen, das mit einem Mikroskop aufgenommen wurde. Um diese Einschränkungen zu umgehen, wurden verschiedene Methoden entwickelt, um die Quantifizierung der Stomataöffnung in Arabidopsis thaliana zu erleichtern, einer Modellpflanze, die häufig zur Untersuchung der Stomatabiologie verwendet wird 1,2,3,4,5,6. Beispielsweise kann ein Porometer verwendet werden, um die Transpirationsrate als Metrik für die stomatäre Leitfähigkeit zu messen. Diese Methode liefert jedoch keine direkten Informationen über die Stomatazahl und die Öffnung, die den stomatären Leitwert bestimmen. In einigen Studien wurden konfokale Mikroskopietechniken verwendet, bei denen Stomataporen mit einem fluoreszierenden Aktinmarker, einem Fluoreszenzfarbstoff oder einer Zellwandautofluoreszenz hervorgehoben wurden 1,2,3,4,5. Während diese Ansätze den Nachweis von Spaltöffnungen erleichtern, können die Kosten sowohl für den Betrieb einer konfokalen Mikroskopieanlage als auch für die Vorbereitung von Mikroskopieproben ein Hindernis für die Routineanwendung darstellen. In einer bahnbrechenden Arbeit von Sai et al. wurde ein tiefes neuronales Netzwerkmodell entwickelt, um die stomatale Öffnung aus hellfeldmikroskopischen Bildern von A. thaliana-Epidermisschalen automatisch zu messen6. Diese Innovation entbindet die Forscher jedoch nicht von der Aufgabe, ein epidermales Peeling für die mikroskopische Beobachtung vorzubereiten. Kürzlich wurde dieses Hindernis durch die Entwicklung eines tragbaren Bildgebungsgeräts überwunden, das Stomata durch Einklemmen eines Blattes von A. thaliana beobachten kann, zusammen mit einer Deep-Learning-basierten Bildanalyse-Pipeline, die automatisch die Stomataöffnung aus Blattbildern misst, die mit dem Gerät aufgenommen wurden7.
Spaltöffnungen tragen zur angeborenen Immunität der Pflanze gegen bakterielle Krankheitserreger bei. Der Schlüssel zu dieser Immunantwort ist der Stomataverschluss, der den Eintritt von Bakterien durch die mikroskopisch kleine Pore in das Blattinnere einschränkt, wo sich bakterielle Krankheitserreger vermehren und Krankheiten verursachen8. Der Stomataverschluss wird bei der Erkennung von mikrobenassoziierten molekularen Mustern (MAMPs), immunogenen Molekülen, die häufig einer Klasse von Mikroben gemeinsam sind, durch Plasmamembran-lokalisierte Mustererkennungsrezeptoren (PRRs) induziert9. Ein 22-Aminosäuren-Epitop des bakteriellen Flagellins, bekannt als flg22, ist ein typisches MAMP, das durch seine Erkennung durch das PRR FLS210 einen Stomataverschluss induziert. Als Gegenmaßnahme können bakterielle Krankheitserreger wie Pseudomonas syringae pv. Tomate DC3000 (Zapfwelle) und Xanthomonas campestris pv. Vesitorien haben Virulenzmechanismen entwickelt, um Stomata wieder zu öffnen 9,11,12. Diese stomatalen Reaktionen auf bakterielle Krankheitserreger wurden konventionell in Assays analysiert, bei denen entweder epidermale Blattschalen, Blattscheiben oder abgelöste Blätter auf der Bakteriensuspension schwimmen und dann die Spaltöffnungen unter einem Mikroskop beobachtet werden, gefolgt von einer manuellen Messung der Stomataöffnung. Diese Assays sind jedoch umständlich und spiegeln möglicherweise nicht die stomatalen Reaktionen auf die natürliche bakterielle Invasion wider, die in einem an der Pflanze befestigten Blatt auftreten.
Hier wird eine einfache Methode vorgestellt, um den Verschluss und die Wiedereröffnung von Stomata während der Zapfwelleninvasion unter Bedingungen zu untersuchen, die die natürliche Pflanzen-Bakterien-Interaktion genau nachahmen. Diese Methode nutzt das tragbare Bildgebungsgerät für die direkte Beobachtung von A. thaliana-Stomata auf einem Blatt, das an der mit Pto inokulierten Pflanze befestigt ist, zusammen mit der Bildanalyse-Pipeline zur automatisierten Messung der Stomata-Öffnung.
Protokoll
1. Pflanzen anbauen
- Um die Ruhephase zu unterbrechen, suspendieren Sie die Samen von A. thaliana (Col-0) in deionisiertem Wasser und inkubieren Sie sie 4 Tage lang bei 4 °C im Dunkeln.
- Säen Sie die Samen in die Erde und wachsen Sie in einer Kammer, die mit weißem Leuchtstoffröhrenlicht ausgestattet ist. Halten Sie folgende Wachstumsbedingungen aufrecht: Temperatur von 22 °C, Lichtintensität von 6.000 Lux (ca. 100 μmol/m2/s) für 10 h und relative Luftfeuchtigkeit von 60%.
- Gießen Sie die Pflanzen bei Bedarf mit einem Flüssigdünger. Von 1 Woche bis 2 Tage vor der Impfung nicht gießen und 1 Tag vor der Impfung gut gießen.
2. Bakterielles Inokulum vorbereiten
- Streifen Sie Zapfen aus Glycerin-Stamm auf erstarrtem King's B (KB)-Medium (20 g Trypton, 1,5 g K2HPO4 und 15 g Glycerin für 1 l, 1,5 % Agar) mit 50 μg/ml Rifampicin und inkubieren Sie 2 Tage lang bei 28 °C.
- Eine einzelne Kolonie mit 5 ml KB-Flüssigmedium mit 50 μg/ml Rifampicin beimpfen und bei 28 °C mit Schütteln bei 200 U/min bis zur späten logarithmischen Wachstumsphase inkubieren.
- Zentrifugieren Sie die Kultur 2 Minuten lang bei 6.000 x g , entsorgen Sie den Überstand und resuspendieren Sie das Pellet in 1 ml sterilem Wasser. Wiederholen Sie diesen Schritt noch einmal.
- Entfernen Sie den Überstand, resuspendieren Sie das Pellet in 1 ml Stomata-Öffnungspuffer (25 mM MES-KOH PH 6,15, 10 mM KCl) und messen Sie den OD600.
- Verdünnen Sie die Suspension auf OD600 0,2 mit einem Spaltöffnungspuffer mit 0,04 % Silikontensid.
3. Sprühimpfung von Bakterien
- Von 1 Tag vor der Inokulation bis zum Ende des Versuchs werden die Pflanzen einer Lichtintensität von ca. 10.000 Lux (ca. 170 μmol/m2/s) ausgesetzt.
- Um sicherzustellen, dass die meisten Spaltöffnungen offen sind, bewahren Sie die Pflanzen vor der Sprühimpfung mindestens 3 h lang auf einer mit einem transparenten Deckel abgedeckten Schale unter dem Licht auf.
- Nehmen Sie den Deckel ab und besprühen Sie mit einer Airbrush die abaxiale Seite der Blätter mit 2,5 ml Bakteriensuspension pro drei Pflanzen auf einem einzigen Topf.
- Inkubieren Sie die inokulierten Pflanzen auf einer Schale, die mit einem transparenten Deckel bedeckt ist, um eine relative Luftfeuchtigkeit von etwa 85% aufrechtzuerhalten.
- Erfassen Sie Bilder der Spaltöffnungen 1 h und 3 h nach der Sprühimpfung mit der in Abschnitt 4 beschriebenen Methode.
4. Direkte Beobachtung der Spaltöffnungen mit dem tragbaren Bildgebungsgerät
HINWEIS: Das tragbare Stomata-Bildgebungsgerät ist mit einer LED-Leuchte und einem Kameramodul ausgestattet und kann 2.592 × 1.944 (Höhe × Breite; Pixel) Bilder mit einer Auflösung von ca. 0,5 μm/Pixel aufnehmen.
- Schließen Sie das tragbare stomatale Bildgebungsgerät an einen PC an, der mit einer Bilderfassungssoftware ausgestattet ist.
- Entfernen Sie vorsichtig aber vollständig Wassertropfen von den beimpften Blättern mit einem Stück Papier.
- Öffnen Sie die obere Abdeckung des Geräts, legen Sie das Blatt auf die Bühne, und schließen Sie die obere Abdeckung (Abbildung 1).
- Stellen Sie den Fokus des Bildes ein, indem Sie die Einstellschraube betätigen, und klicken Sie dann auf der Schaltfläche Bild speichern auf dem PC-Bildschirm. Das Bild wird sofort erfasst. Typischerweise enthält ein fokussiertes Bild etwa 10 analysierbare Spaltöffnungen. Um robuste Ergebnisse zu erhalten, nehmen Sie Stomatabilder von sechs Blättern von drei verschiedenen Pflanzen auf (zwei Blätter pro Pflanze).
5. Manuelle Messung der Stomataöffnung
HINWEIS: Die ImageJ-Software kann unter heruntergeladen werden https://imagej.nih.gov/ij/download.html
- Öffnen Sie eine Bilddatei im ImageJ.
- Öffnen Sie den ROI-Manager, indem Sie > Tools analysieren > ROI-Manager auswählen.
- Zeichnen Sie mit dem Auswahlwerkzeug "Geradlinig" eine Linie, die der Breite eines Stomas entspricht (Abbildung 2), und registrieren Sie den ROI, indem Sie im ROI-Manager auf "Hinzufügen" klicken.
- Zeichnen Sie eine Linie, die der Länge desselben Stomas entspricht (Abbildung 2A), und registrieren Sie den ROI wie in Schritt 5.3 beschrieben.
- Klicken Sie im ROI-Manager auf Messen, um die Breite und Länge zu messen.
- Teilen Sie die Breite durch die Länge, um die Stomataöffnung (Verhältnis) zu erhalten. Verwenden Sie für eine robuste Quantifizierung 60 oder mehr Stomata für jede Behandlung und jeden Zeitpunkt. Wählen Sie keine vorzeitigen oder obskuren Spaltöffnungen für die Analyse (Abbildung 2B, C).
6. Automatisierte Messung der Stomataöffnung
HINWEIS: Die Bildanalyse-Pipeline wird in Google Colaboratory ausgeführt, einer ausführbaren Cloud-Umgebung für die Programmiersprache Python. Benutzer müssen über ein gültiges Google-Konto mit einem funktionierenden Google Drive- und Google Chrome-Browser und eine stabile Internetverbindung verfügen.
- Laden Sie das Google Colaboratory-Notebook von Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) herunter und öffnen Sie das Notebook.
- Erstellen Sie eine lokale Kopie des Notizbuchs in Google Drive, indem Sie Datei > Kopie in Drive speichern auswählen. Nachdem eine neue Registerkarte angezeigt wird, schließen Sie die Registerkarte des ursprünglichen Notizbuchs sicher.
- Drücken Sie die Schaltfläche Ausführen einmal unter dem Abschnitt Umgebungseinstellungen im Notebook, ohne die Zellenblöcke zu öffnen, um die erforderlichen Bibliotheken zu importieren.
- Führen Sie den Abschnitt Verzeichniseinstellungen aus, um drei Ordner zu erstellen, die für die Analyse verwendet werden (z. B. example_result, inference_results und Modell) in Google Drive.
HINWEIS: In diesem Fall werden die Ordner example_result, inference_results und model als übergeordnetes Verzeichnis verwendet, in dem Rückschlussergebnisse bzw. trainierte Modelle gespeichert werden. Dieses Notizbuch zeigt ein Beispiel für die Verzeichniskonstruktion als repräsentative Prozedur. Um den Namen zu ändern, schreiben Sie den Pardir-, Infdir- oder Modeldir-Pfad neu. - Verschieben Sie die aufgenommenen Bilder gemäß dem Abschnitt Vorbereitung der Bilder nach example_result, gruppiert in Bildtiteln nach Behandlung oder Probe (z. B. mock_1h_XXXXXX.jpg) für die endgültige Diagrammerstellung. Beispielbilder sind bei Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) erhältlich.
- Führen Sie den Teil Trainierte Modelle herunterladen aus, um die ONNX-Dateien der trainierten Modelle von Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) herunterzuladen und im Modellverzeichnis abzulegen.
- Führen Sie den Teil Inferenz und Messung der Stomata-Apertur aus, um die Stomata-Apertur aus einzelnen Bildern zu quantifizieren. Die Ergebnisbilder mit überlagerter Inferenz und die CSV-Datei mit dem Namen example_result.csv werden in das inference_results Verzeichnis exportiert.
- Führen Sie den Abschnitt Diagrammgenerierung aus, um ein Diagramm über das stomatale Öffnungsverhältnis zu erstellen, das in das Verzeichnis inference_results exportiert wird.
Ergebnisse
Nach der Sprühinokulation von Pto wurden Stomata auf Blättern, die an den inokulierten Pflanzen befestigt waren, direkt mit dem tragbaren stomatalen Bildgebungsgerät beobachtet. Unter Verwendung manueller und automatisierter Messungen wurden dieselben Blattbilder verwendet, um die Stomataöffnung zu berechnen, indem das Verhältnis von Breite zu Länge von etwa 60 Spaltöffnungen genommen wurde. Manuelle und automatisierte Messungen zeigten durchweg eine Abnahme der Stomataöffnung bei Pto-geimpften Pflanzen im Vergleich zu scheingeimpften Pflanzen 1 Stunde nach der Inokulation (hpi) (Abbildung 3A,B), was darauf hindeutet, dass A-thaliana-Pflanzen Stomata als Reaktion auf eine Pto-Invasion schließen. Bei 3 hpi war die Stomataöffnung bei Pto-inokulierten Pflanzen und Scheininokulierten Pflanzen praktisch gleich (Abbildung 3C,D), was an die Stomata-Wiedereröffnung durch Pto erinnert. Bemerkenswert ist, dass die automatisierte Messung der Stomata-Apertur nur etwa 5 s dauerte, um ein Bild zu verarbeiten (Tabelle 1), was die Messzeit im Vergleich zur manuellen Messung um mehr als 95 % reduzierte. Somit bietet dieses Protokoll ein operativ einfaches und arbeitssparendes Mittel, um die dynamischen stomatären Reaktionen von A. thaliana auf den bakteriellen Erreger zu verfolgen.

Abbildung 1: Tragbares Bildgebungsgerät. Bilder zeigen das tragbare Bildgebungsgerät mit einem Blatt auf der Bühne (links) und geschlossener oberer Abdeckung (rechts). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
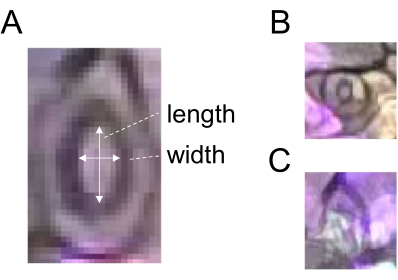
Abbildung 2: Schematische Darstellung der Messung der Stomata-Öffnung. (A) Die Stomata-Apertur wird durch Berechnung des Verhältnisses von Breite zu Länge eines Stomas bestimmt, wie durch weiße Pfeile angezeigt. (B) Vorzeitige und (C) dunkle Spaltöffnungen sollten von der Messung ausgeschlossen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Stomatale Reaktionen auf Pto in einer intakten ganzen Pflanze. A. thaliana-Pflanzen wurden mit Mock oder Pto besprüht, und Stomata auf Blättern, die an den inokulierten Pflanzen befestigt waren, wurden direkt bei (A,B) 1 hpi und (C,D) 3 hpi mit dem tragbaren stomatalen Bildgebungsgerät beobachtet. Die Stomataöffnung (Verhältnis) wurde durch (A,C) manuelle und (B,D) automatisierte Messungen berechnet. Die p-Werte wurden durch einen zweiseitigen t-Test berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Bearbeitungszeit (s) | ||
| Methode | Bedeuten | SD |
| Manuell | 130.1 | 48.8 |
| Automatisiert | 4.7 | 0.8 |
Tabelle 1: Verarbeitungszeit für manuelle und automatisierte Messungen der Stomataöffnung pro Bild. Mittelwerte und Standardabweichungen (SD) der Verarbeitungszeit wurden aus den Messungen von neun repräsentativen Bildern berechnet.
Diskussion
Frühere Studien verwendeten epidermale Schalen, Blattscheiben oder abgelöste Blätter, um stomatale Reaktionen auf bakterielle Invasionen zu untersuchen 9,11,12. Im Gegensatz dazu nutzt die in dieser Studie vorgeschlagene Methode das tragbare stomatale Bildgebungsgerät, um Stomata auf einem an der Pflanze befestigten Blatt nach der Sprühimpfung von Pto direkt zu beobachten und die natürlichen Bedingungen der bakteriellen Invasion nachzuahmen. Da diese Methode keine destruktiven Probenvorbereitungsprozesse wie Blattablösung, Blattscheibenentfernung und epidermales Peeling beinhaltet, können Wunden und Wasserverluste, die mit diesen Probenvorbereitungsprozessen verbunden sind, vermieden werden. Diese Effekte sollten nicht auf die leichte Schulter genommen werden, da Wunden und Wasserverlust unweigerlich pflanzliche Signale wie die Phytohormone Jasmonat und Abscisinsäure erzeugen, die die Stomatabewegungen beeinflussen13,14.
Es gibt mehrere Richtlinien für die optimale Verwendung des tragbaren stomatalen Bildgebungsgeräts. Erstens ist die gründliche Entfernung von Wassertropfen von den Blattoberflächen von größter Bedeutung, um Bilder mit optimaler Klarheit und Schärfe zu erhalten. Zweitens wird empfohlen, mehrere Bilder von identischen Blattbereichen aufzunehmen, indem Sie die Einstellschraube manipulieren, um den Fokus fein abzustimmen. Es wird erwartet, dass diese Praxis die Anzahl der analysierbaren Spaltöffnungen pro Blattfläche erhöht und dadurch potenzielle Stichprobenverzerrungen abschwächt. Schließlich ist beim Einklemmen eines Blattes mit dem Gerät eine sorgfältige Handhabung erforderlich, um Schäden am Blatt zu vermeiden. Dies ist von entscheidender Bedeutung, da die Verwundung einer der Hinweise ist, die einen Stomataverschluss auslösen14.
Die Stomataöffnung war bei der automatisierten Messung tendenziell variabler als bei der manuellen Messung (Abbildung 3). Dafür gibt es mehrere mögliche Gründe. Es wurde zuvor berichtet, dass Stomataporen, die von der Bildanalyse-Pipeline abgeleitet werden, oft Zellwände und/oder Schatten von Schließzellen enthalten, die die Stomatapore7 umgeben, was bei der manuellen Messung mit menschlichen Augen nicht der Fall ist. Stomata mit ungewöhnlichen Formen können auch die Variation zwischen manuellen und automatisierten Messungen beeinflussen, obwohl das Stomata-Detektionsmodell trainiert wurde, um solche Stomata von der Analyse auszuschließen7. Einige Stomata erhielten bei der automatisierten Messung Nullwerte für die Stomataöffnung, bei der manuellen Messung jedoch aus unbekannten Gründen keinen. Zukünftige Aktualisierungen der Modelle können erforderlich sein, um diese Probleme zu beheben. Da die automatisierte Messung der stomatalen Apertur jedoch im Wesentlichen mit der manuellen Messung übereinstimmte, ist die aktuelle Version der Bildanalyse-Pipeline von praktischem Nutzen.
Die in dieser Studie beschriebene direkte Beobachtung und automatisierte Messung der Stomataöffnung in A. thaliana ist vielversprechend für verschiedene Anwendungen zur Aufklärung der Rolle von Stomata bei der Anpassung an die Umwelt von Pflanzen. Beispielsweise sollte die vorgestellte Methode breit anwendbar sein, um die stomatale Öffnung in einem intakten Ganzpflanzensystem nach Exposition gegenüber biotischen Belastungen wie MAMPs und mikrobiellen Krankheitserregern sowie abiotischen Belastungen wie Trockenheit schnell zu quantifizieren. Um dies zu unterstützen, wurde in einer früheren Studie die Bildanalyse-Pipeline erfolgreich angewendet, um die Stomataöffnung von "Blattscheiben" genau zu quantifizieren, die mit dem Pilzgift Fusicoccin behandelt wurden, das die Stomataöffnung induziert, oder dem Stresshormon Abscisinsäure, das den Stomataverschluss induziert7. Darüber hinaus ermöglicht das tragbare Bildgebungsgerät im Prinzip eine langfristige Zeitverlaufsanalyse der Stomataöffnung an einem einzigen identischen Blatt, das an der Pflanze befestigt ist. Dies könnte Aufschluss über neue Aspekte der Pflanzen-Mikroben-Interaktionen geben, da sich die meisten Studien in den ersten Stunden der Interaktion auf stomatale Reaktionen auf bakterielle Krankheitserreger konzentriert haben 9,10,11. Es wird auch interessant sein, die vorgestellte Methode anzuwenden und zu modifizieren, um stomatale Reaktionen auf bakterielle Invasion unter verschiedenen Umweltbedingungen zu untersuchen. Dies ist besonders relevant für das Verständnis der Auswirkungen von Umweltfaktoren wie Temperatur, Luftfeuchtigkeit und Bodenwasserverfügbarkeit, die die Stomatabewegungen und die Krankheitsentwicklung durch bakterielle Krankheitserreger beeinflussen 8,15. Zusammenfassend soll die vorgestellte Methode die Erforschung von Stomatafunktionen in und über Pflanzen-Mikroben-Interaktionen hinaus unter bisher unerreichten experimentellen Bedingungen beschleunigen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Wir danken allen Mitgliedern des Forschungsprojekts "Co-creation of plant adaptive traits via assembly of plant-microbe holobiont" für fruchtbare Diskussionen. Diese Arbeit wurde durch Grant-in-Aid for Transformative Research Areas (21H05151 und 21H05149 to A.M. und 21H05152 to Y.T.) und Grant-in-Aid for Challenging Exploratory Research (22K19178 to A. M.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Agar | Nakarai tesque | 01028-85 | |
| Airbrush kits | ANEST IWATA | MX2900 | Accessory kits for SPRINT JET |
| Biotron | Nippon Medical & Chemical Instruments | LPH-411S | Plant Growth Chamber with white fluorescent light |
| Glycerol | Wako | 072-00626 | |
| Half tray | Sakata | 72000113 | A set of tray and lid |
| Hyponex | Hyponex | No catalogue number available | Dilute the solution of Hyponex at a ratio of 1:2000 in deionized water for watering plants |
| Image J | Natinal Institute of Health | Download at https://imagej.nih.gov/ij/download.html | Used for manual measurement of stomatal aperture |
| K2HPO4 | Wako | 164-04295 | |
| KCl | Wako | 163-03545 | |
| KOH | Wako | 168-21815 | For MES-KOH |
| MES | Wako | 343-01621 | For MES-KOH |
| Portable stomatal imaging device | Phytometrics | Order at https://www.phytometrics.jp/ | Takagi et al.(2023) doi: 10.1093/pcp/pcad018. |
| Rifampicin | Wako | 185-01003 | Dissolve in DMSO |
| Silwet-L77 | Bio medical science | BMS-SL7755 | silicone surfactant used in spray inoculation |
| SPRINT JET | ANEST IWATA | IS-800 | Airbrush used for spray inoculation |
| SuperMix A | Sakata seed | 72000083 | Mix with Vermiculite G20 in equal proportions for preparing soil |
| Tryptone | Nakarai tesque | 35640-95 | |
| Vermiculite G20 | Nittai | No catalogue number available | Mix with Super Mix A in equal proportions for preparing soil |
| White fluorescent light | NEC | FHF32EX-N-HX-S | Used for Biotron |
Referenzen
- Shimono, M., Higaki, T., Kaku, H., Shibuya, N., Hasezawa, S., Day, B. Quantitative evaluation of stomatal cytoskeletal patterns during the activation of immune signaling in Arabidopsis thaliana. PLoS One. 11, e0159291 (2016).
- Bourdais, G., et al. The use of quantitative imaging to investigate regulators of membrane trafficking in Arabidopsis stomatal closure. Traffic. 20 (2), 168-180 (2019).
- Higaki, T., Kutsuna, N., Hasezawa, S. CARTA-based semi-automatic detection of stomatal regions on an Arabidopsis cotyledon surface. Plant Morphology. 26 (1), 9-12 (2014).
- Eisele, J. F., Fäßler, F., Bürgel, F., Chaban, C. A. A rapid and simple method for microscopy-based stomata analyses. PLoS One. 11, e0164576 (2016).
- Chitraker, R., Melotto, M. Assessing stomatal response to live bacterial cells using whole leaf imaging. Journal of Visualized Experiments. 44, 2185 (2010).
- Sai, N., et al. StomaAI: an efficient and user-friendly tool for measurement of stomatal pores and density using deep computer vision. New Phytologist. 238 (2), 904-915 (2023).
- Takagi, M., et al. Image-based quantification of Arabidopsis thaliana stomatal aperture from leaf images. Plant and Cell Physiology. pcad018, (2023).
- Melotto, M., Zhang, L., Oblessuc, P. R., He, S. Y. Stomatal defense a decade later. Plant Physiology. 174 (2), 561-571 (2017).
- Melotto, M., Underwood, W., Koczan, J., Nomura, K., He, S. Y. Plant stomata function in innate immunity against bacterial invasion. Cell. 126 (5), 969-980 (2006).
- Zeng, W., He, S. A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiology. 153 (3), 1188-1198 (2010).
- Zheng, X. Y., et al. Coronatine promotes Pseudomonas syringae virulence in plants by activating a signaling cascade that inhibits salicylic acid accumulation. Cell Host and Microbe. 11 (6), 587-596 (2012).
- Raffeiner, M., et al. The Xanthomonas type-III effector XopS stabilizes CaWRKY40a to regulate defense responses and stomatal immunity in pepper (Capsicum annuum). The Plant Cell. 34 (5), 1684-1708 (2022).
- Munemasa, S., Hauser, F., Park, J., Waadt, R., Brandt, B., Schroeder, J. I. Mechanisms of abscisic acid-mediated control of stomatal aperture. Current Opinion in Plant Biology. 28, 154-162 (2015).
- Förster, S., et al. Wounding-induced stomatal closure requires jasmonate-mediated activation of GORK K+ channels by a Ca2+ sensor-kinase CBL1-CIPK5 complex. Developmental Cell. 48 (1), 87-99 (2018).
- Cheng, Y. T., Zhang, L., He, S. Y. Plant-microbe interactions facing environmental challenge. Cell Host and Microbe. 26 (2), 183-192 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten