Method Article
Pseudomonas syringae pvに対する気孔応答の直接観察と自動測定。トマトシロイヌナズナのDC3000
要約
ここでは、 シロイヌナズナの細菌侵入に対する気孔応答の直接観察と自動測定のための簡単な方法を紹介します。この方法では、ポータブル気孔イメージングデバイスと、デバイスによってキャプチャされた葉の画像用に設計された画像解析パイプラインを活用します。
要約
気孔は、植物の葉の表皮に見られる微細な気孔です。気孔開口部の調節は、光合成のための二酸化炭素の取り込みと水分損失のバランスをとるだけでなく、細菌の侵入を制限するためにも極めて重要です。植物は微生物を認識すると気孔を閉じますが、病原菌、 Pseudomonas syringae pv. トマト DC3000(Pto)、閉じた気孔を再度開いて、葉の内部にアクセスします。細菌の侵入に対する気孔の反応を評価するための従来のアッセイでは、葉の表皮の皮、葉のディスク、または剥離した葉を細菌懸濁液に浮かせ、気孔を顕微鏡で観察した後、気孔の開口部を手動で測定します。しかし、これらのアッセイは煩雑であり、植物に付着した葉の自然な細菌侵入に対する気孔反応を反映していない可能性があります。最近では、葉を植物から切り離さずにつまんで気孔を観察できる携帯型イメージングデバイスや、撮影した葉の画像から気孔の開口を自動計測するディープラーニングによる画像解析パイプラインを開発しました。ここでは、これらの技術的進歩に基づいて、 シロイヌナズ ナの細菌侵入に対する気孔応答を評価する新しい方法を紹介します。この手法は、自然感染過程を模倣した Pto の噴霧接種、携帯型イメージングデバイスを用いた Pto接種植物の葉上の気孔の直接観察、画像解析パイプラインによる気孔開口の自動測定の3つの簡単なステップで構成されています。この方法は、自然な植物と細菌の相互作用を厳密に模倣した条件下で、 PTO 浸潤中の気孔の閉鎖と再開を実証するために成功裏に使用されました。
概要
気孔は、植物の葉やその他の地上部の表面にある一対のガードセルに囲まれた微細な気孔です。絶え間なく変化する環境下では、植物が光合成に必要な二酸化炭素の取り込みを制御し、蒸散による水分の損失を犠牲にして、気孔開口部の調節が中心となります。このように、気孔開口の定量化は、植物の環境適応を理解するのに役立っています。しかし、気孔の開口を定量化することは、顕微鏡で撮影した葉の画像から気孔孔を見つけて測定するのに人手がかかるため、本質的に時間と煩雑さがあります。これらの制限を回避するために、気孔生物学の研究に広く使用されているモデル植物であるシロイヌナズナの気孔開口の定量化を容易にするためのさまざまな方法が開発されています1,2,3,4,5,6。例えば、気孔コンダクタンスの指標として蒸散速度を測定するために、ポロメーターを使用することができる。ただし、この方法では、気孔コンダクタンスを決定する気孔数と開口部に関する直接的な情報は得られません。いくつかの研究では、蛍光アクチンマーカー、蛍光色素、または細胞壁自家蛍光を使用して気孔孔を強調する共焦点顕微鏡技術が使用されています1,2,3,4,5。これらのアプローチは気孔の検出を容易にしますが、共焦点顕微鏡施設の運用と顕微鏡サンプルの調製の両方にかかるコストが、日常的なアプリケーションの障害となる可能性があります。Saiらによる画期的な研究で、A. thalianaの表皮剥離の明視野顕微鏡画像から気孔開口部を自動的に測定するディープニューラルネットワークモデルが開発されました6。しかし、このイノベーションは、顕微鏡観察のために表皮皮を調製する作業から研究者を免除するものではありません。最近、A. thalianaの葉をつまんで気孔を観察できる携帯型撮像装置と、その装置で撮影した葉の画像から気孔の開口を自動計測する深層学習による画像解析パイプラインを開発することで、この課題を克服した7。
気孔は、細菌性病原体に対する植物の自然免疫に寄与します。この免疫応答の鍵となるのは、細菌の病原体が増殖して病気を引き起こす葉の内部への微細な細孔からの細菌の侵入を制限する気孔閉鎖です8。気孔閉鎖は、ある種の微生物によく見られる免疫原性分子である微生物関連分子パターン(MAMP)が、原形質膜局在パターン認識受容体(PRR)によって認識されると誘導されます9。flg22として知られる細菌の鞭毛の22アミノ酸エピトープは、PRR FLS2 10による認識を通じて気孔閉鎖を誘導する典型的なMAMPPです10。その対策として、Pseudomonas syringae pv.トマトDC3000(Pto)およびXanthomonas campestris pv。膀胱は、気孔9,11,12を再開するために病原性メカニズムを進化させました。細菌性病原体に対するこれらの気孔応答は、従来、葉の表皮剥離、葉の円盤、または剥離した葉のいずれかを細菌懸濁液上に浮かべ、その後、気孔を顕微鏡で観察した後、気孔の開口部を手動で測定するアッセイで解析されてきました。しかし、これらのアッセイは煩雑であり、植物に付着した葉に生じる自然細菌の侵入に対する気孔応答を反映していない可能性があります。
ここでは、自然な植物と細菌の相互作用を厳密に模倣した条件下で、Pto浸潤中の気孔の閉鎖と再開を調査するための簡単な方法が提示されます。この方法では、Ptoを接種した植物に付着した葉のA. thaliana stomataを直接観察するポータブルイメージングデバイスと、気孔の開口部を自動測定するための画像解析パイプラインを活用します。
プロトコル
1.植物を育てる
- 休眠状態を打破するには、 A. thaliana (Col-0)の種子を脱イオン水に再懸濁し、暗所で4°Cで4日間インキュベートします。
- 土に種を蒔き、白色蛍光灯を備えたチャンバーで育てます。生育条件は、温度22°C、光強度6,000ルクス(約100μmol/m2/s)を10時間、相対湿度60%に維持してください。
- 必要に応じて、液体肥料で植物に水をやります。接種の1週間前から2日前までは水やりを控え、接種の1日前に井戸に水をやりましょう。
2.細菌接種の準備
- 固化したKing's B(KB)培地(20 gのトリプトン、1.5 gのK2HPO4、および15 gのグリセロール、1 L、1.5%寒天)上のグリセロールストックから50 μg/mLのリファンピシンでストリークPtoを採取し、28°Cで2日間インキュベートします。
- 50 μg/mLのリファンピシンを5 mLのKB液体培地にシングルコロニーを接種し、28°Cで200 rpmで振とうしながら、対数増殖期が遅くなるまでインキュベートします。
- 培養液を6,000 x g で2分間遠心分離し、上清を廃棄し、ペレットを1 mLの滅菌水に再懸濁します。この手順をもう一度繰り返します。
- 上清を除去し、ペレットを1 mLの気孔開口緩衝液(25 mM MES-KOH pH 6.15、10 mM KCl)に再懸濁し、OD600を測定します。
- 懸濁液をOD600 0.2に希釈し、0.04%シリコーン界面活性剤を含む気孔開口バッファーで希釈します。
3.細菌のスプレー接種
- 接種の1日前から実験終了まで、植物に約10,000ルクス(約170μmol/m2/s)の光を照射する。
- ほとんどの気孔が開いていることを確認するために、スプレー接種の前に、光の下で透明な蓋で覆われたトレイに植物を少なくとも3時間保管してください。
- 蓋を外し、エアブラシを使用して、1つの鉢に3つの植物あたり2.5mLの細菌懸濁液を葉の軸面にスプレーします。
- 接種した植物を透明な蓋で覆われたトレイの上でインキュベートし、相対湿度を約85%に保ちます。
- セクション4に記載の方法を用いて、スプレー接種後1時間および3時間後に気孔の画像を取得する。
4. 携帯型撮像装置による気孔の直接観察
注:ポータブル気孔イメージングデバイスは、LEDライトとカメラモジュールを装備しており、約0.5μm/ピクセルの解像度で2,592×1,944(高さ×幅;ピクセル)の画像を取得できます。
- ポータブル気孔イメージングデバイスを画像取得ソフトウェアを搭載したパーソナルコンピュータ(PC)に接続します。
- 接種した葉から水滴を紙で優しく、しかし完全に取り除きます。
- デバイスのトップカバーを開き、リーフをステージに置き、トップカバーを閉じます(図1)。
- アジャスターネジを操作して画像のピントを調整し、PC画面の[ 画像を保存 ]ボタンをクリックします。画像は即座に取得されます。典型的には、焦点を合わせた画像には、約10個の分析可能な気孔が含まれる。ロバストな結果を得るには、3つの異なる植物の6枚の葉(1株あたり2枚の葉)から気孔画像を取得します。
5.気孔開口部の手動測定
注: ImageJ ソフトウェアは、https://imagej.nih.gov/ij/download.html
- ImageJ で画像ファイルを開きます。
- ROI マネージャーの [分析>ツール] > を選択して、ROI マネージャーを開きます。
- 直線選択ツールを使用してストーマの幅に対応する線を描画し(図2)、ROIマネージャーの[追加]をクリックしてROIを登録します。
- 同じストーマの長さに対応する線を引き(図2A)、ステップ5.3の説明に従ってROIを登録します。
- ROI マネージャーの [測定] をクリックして、幅と長さを測定します。
- 幅を長さで割って、気孔の開口部(比率)を求めます。頑健な定量のために、各治療および時点に60個以上の気孔を使用します。分析には、時期尚早または不明瞭な気孔を選択しないでください(図2B、C)。
6. 気孔開口部の自動測定
注: 画像解析パイプラインは、クラウド Python プログラミング言語の実行可能環境である Google Colaboratory で実行されます。ユーザーは、前提条件として、動作するGoogleドライブ、Google Chromeブラウザ、および安定したインターネット接続を備えた有効なGoogleアカウントを持っている必要があります。
- Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) から Google Colaboratory ノートブックをダウンロードし、ノートブックを開きます。
- ノートブックのローカル コピーを Google ドライブに作成するには 、[ファイル] > [コピーをドライブに保存] を選択します。新しいタブが表示されたら、元のノートブックのタブを安全に閉じます。
- ノートブックの [環境設定] セクションの下にある [実行] ボタンを 1 回押し、セル ブロックを展開して必要なライブラリをインポートします。
- ディレクトリ設定セクションを実行して、分析に使用する3つのフォルダ(example_result、inference_results、モデルなど)をGoogleドライブに作成します。
注: この場合、 example_result、inference_results、 model という名前のフォルダーが親ディレクトリとして使用され、それぞれ推論結果とトレーニング済みモデルが格納されます。このノートブックでは、代表的な手順としてディレクトリ構築の例を示しています。名前を変更するには、 pardir、 infdir、または modeldir のパスを書き換えます。 - 画像の準備セクションに従って、取得した画像をexample_resultに移動し、処理またはサンプル(mock_1h_XXXXXX.jpgなど)ごとに画像タイトルにグループ化して、最終的なグラフ生成を行います。サンプル画像はZenodo(https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528)から入手できます。
- トレーニング 済みモデルのダウンロード 部分を実行して、トレーニング済みモデルの ONNX ファイルを Zenodo (https://doi-org.remotexs.ntu.edu.sg/10.5281/zenodo.8062528) からダウンロードし、モデル ディレクトリの下に配置します。
- Inference and Measurement of Stomatal Aperture (気孔開口の推論と測定) パートを実行して、個々の画像から気孔開口を定量化します。推論がオーバーレイされた結果画像と example_result.csv という名前の csv ファイルが inference_results ディレクトリにエクスポートされます。
- Graph Generationセクションを実行して、気孔開口率に関するグラフを作成し、inference_resultsディレクトリにエクスポートします。
結果
Ptoの噴霧接種後、接種した植物に付着した葉の気孔を携帯型気孔イメージング装置で直接観察した。手動および自動測定を使用して、同じ葉の画像を使用して、約60気孔の幅と長さの比率を取ることにより、気孔の開口部を計算しました。手動および自動測定では、接種後1時間(hpi)で模擬接種した植物と比較して、Pto接種植物の気孔開口部の減少が一貫して示され(図3A、B)、Aタリアナ植物はPtoの侵入に応答して気孔を閉じることが示されました。3 hpiでは、Pto接種植物と模擬接種植物の気孔開口はほぼ同じであり(図3C、D)、Ptoによる気孔再開を彷彿とさせます。驚くべきことに、気孔開口の自動測定は、1枚の画像を処理するのに約5秒しかかからず(表1)、手動測定と比較して測定時間を95%以上短縮しました。従って、このプロトコルは細菌の病原体にA.のthalianaの動的気孔の応答を追跡するための操作上簡単で、省力化手段を提供する。

図1:ポータブルイメージングデバイス。 ステージに葉っぱをセットしたポータブル撮像装置(左)とトップカバーを閉じた状態(右)の写真。 この図の拡大版をご覧になるには、ここをクリックしてください。
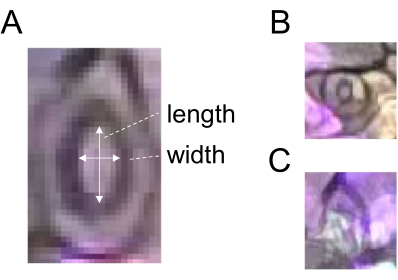
図2:気孔開口測定の模式図。 (A)気孔開口は、白い矢印で示すように、ストーマの幅と長さの比率を計算することによって決定されます。(B)時期尚早および(C)不明瞭な気孔は測定から除外する必要があります。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:無傷の全植物におけるPTOに対する気孔反応。 A. thaliana植物にモックまたはPTOを噴霧接種し、接種した植物に付着した葉の気孔を携帯型気孔イメージング装置によって(A,B)1 hpiおよび(C,D)3 hpiで直接観察した。気孔開口(比率)は、(A,C)手動測定および(B,D)自動測定によって計算された。p値は両側t検定によって計算されました。この図の拡大版をご覧になるには、ここをクリックしてください。
| 処理時間 (秒) | ||
| 方式 | 意味する | SDの |
| 手動 | 130.1 | 48.8 |
| 自動 | 4.7 | 0.8 |
表1:画像あたりの気孔開口の手動および自動測定の処理時間。 処理時間の平均と標準偏差(SD)は、9つの代表的な画像の測定値から計算されました。
ディスカッション
以前の研究では、表皮の皮、葉の円盤、または剥離した葉を使用して、細菌の侵入に対する気孔の反応を調査しました9,11,12。これに対し、本研究で提案する手法は、携帯型気孔イメージング装置を用いて、Ptoを噴霧接種した後、植物に付着した葉の気孔を直接観察し、細菌の侵入の自然条件を模倣するものです。さらに、この方法は、葉の剥離、葉のディスク切除、表皮の剥離などの破壊的なサンプル前処理プロセスを伴わないため、これらのサンプル前処理プロセスに関連する傷や水分の損失を回避できます。創傷や水分の損失は、気孔の動きに影響を与える植物ホルモンのジャスモン酸やアブシジン酸などの植物由来のシグナルを必然的に生成するため、これらの影響を軽視すべきではありません13,14。
携帯型気孔イメージング装置の最適な使用には、いくつかのガイドラインがある。まず、葉の表面から水滴を完全に取り除くことは、最適な鮮明さと焦点の合った画像を得るために最も重要です。次に、アジャスターネジを操作してフォーカスを微調整することにより、同じリーフ領域から複数の画像を撮影することをお勧めします。この手法により、葉の面積あたりの分析可能な気孔の数が増加し、それによって潜在的なサンプリングバイアスが軽減されることが期待されます。最後に、装置で葉をつまむときは、葉を傷つけないように注意して取り扱う必要があります。創傷は気孔閉鎖を誘発する手がかりの1つであるため、これは重要です14。
気孔開口は、手動測定よりも自動測定の方が変動する傾向がありました(図3)。これにはいくつかの理由が考えられます。画像解析パイプラインによって推測される気孔孔には、気孔孔7を取り囲む細胞壁および/またはガード細胞の影が含まれることが多いことが以前に報告されているが、これは人間の目による手動測定には当てはまらない。異常な形状の気孔も、手動測定と自動測定の間の変動に影響を与える可能性があるが、気孔検出モデルは、そのような気孔を分析から除外するように訓練された7。いくつかの気孔は、自動測定では気孔開口部にゼロ値が与えられましたが、手動測定では不明な理由でゼロ値が与えられませんでした。これらの問題に対処するには、今後のモデルの更新が必要になる可能性があります。しかし、気孔開口の自動測定は手動測定と本質的に一致していたため、現在のバージョンの画像解析パイプラインは実用的です。
本研究で紹介したA. thalianaの気孔開口の直接観察と自動測定は、植物の環境適応における気孔の役割の解明に向けた様々な応用が期待されています。例えば、提示された方法は、MAMPや微生物病原体などの生物的ストレスや干ばつなどの非生物的ストレスにさらされた後、無傷の全植物システムにおける気孔開口部を迅速に定量化するために広く適用できるはずです。これを裏付けるように、以前の研究では、画像解析パイプラインを適用して、気孔の開口部を誘導する真菌毒素フシコッシンまたは気孔閉鎖を誘導するストレスホルモンアブシジン酸で処理された「葉の円盤」の気孔開口部を正確に定量化することに成功しました7。さらに、原理的には、携帯型イメージング装置は、植物に付着した単一の同一の葉の気孔開口部の長期的な経時変化分析を可能にします。ほとんどの研究は、相互作用の最初の数時間の細菌性病原体に対する気孔応答に焦点を当てているため、これは植物と微生物の相互作用の新しい側面に光を当てる可能性があります9,10,11。また、提示された方法を採用および変更して、さまざまな環境条件下での細菌の侵入に対する気孔の応答を調査することも興味深いでしょう。これは、細菌性病原体による気孔の動きや病気の発症に影響を与える温度、湿度、土壌水の利用可能性などの環境要因の影響を理解するのに特に関連しています8,15。結論として、提示された方法は、これまで達成できなかった実験環境下での植物と微生物の相互作用における気孔機能の研究を加速することを想定しています。
開示事項
著者は、宣言すべき利益相反を持っていません。
謝辞
「植物微生物ホロビオントの集合体による植物適応形質の共創」研究プロジェクトのメンバーの皆様に感謝いたします。本研究は、科学研究費補助金学術変革領域研究(21H05151、21H05149、Y.T.、21H05152、Y.T.)および科学研究費補助金挑戦的萌芽研究(22K19178、A.M.)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| Agar | Nakarai tesque | 01028-85 | |
| Airbrush kits | ANEST IWATA | MX2900 | Accessory kits for SPRINT JET |
| Biotron | Nippon Medical & Chemical Instruments | LPH-411S | Plant Growth Chamber with white fluorescent light |
| Glycerol | Wako | 072-00626 | |
| Half tray | Sakata | 72000113 | A set of tray and lid |
| Hyponex | Hyponex | No catalogue number available | Dilute the solution of Hyponex at a ratio of 1:2000 in deionized water for watering plants |
| Image J | Natinal Institute of Health | Download at https://imagej.nih.gov/ij/download.html | Used for manual measurement of stomatal aperture |
| K2HPO4 | Wako | 164-04295 | |
| KCl | Wako | 163-03545 | |
| KOH | Wako | 168-21815 | For MES-KOH |
| MES | Wako | 343-01621 | For MES-KOH |
| Portable stomatal imaging device | Phytometrics | Order at https://www.phytometrics.jp/ | Takagi et al.(2023) doi: 10.1093/pcp/pcad018. |
| Rifampicin | Wako | 185-01003 | Dissolve in DMSO |
| Silwet-L77 | Bio medical science | BMS-SL7755 | silicone surfactant used in spray inoculation |
| SPRINT JET | ANEST IWATA | IS-800 | Airbrush used for spray inoculation |
| SuperMix A | Sakata seed | 72000083 | Mix with Vermiculite G20 in equal proportions for preparing soil |
| Tryptone | Nakarai tesque | 35640-95 | |
| Vermiculite G20 | Nittai | No catalogue number available | Mix with Super Mix A in equal proportions for preparing soil |
| White fluorescent light | NEC | FHF32EX-N-HX-S | Used for Biotron |
参考文献
- Shimono, M., Higaki, T., Kaku, H., Shibuya, N., Hasezawa, S., Day, B. Quantitative evaluation of stomatal cytoskeletal patterns during the activation of immune signaling in Arabidopsis thaliana. PLoS One. 11, e0159291 (2016).
- Bourdais, G., et al. The use of quantitative imaging to investigate regulators of membrane trafficking in Arabidopsis stomatal closure. Traffic. 20 (2), 168-180 (2019).
- Higaki, T., Kutsuna, N., Hasezawa, S. CARTA-based semi-automatic detection of stomatal regions on an Arabidopsis cotyledon surface. Plant Morphology. 26 (1), 9-12 (2014).
- Eisele, J. F., Fäßler, F., Bürgel, F., Chaban, C. A. A rapid and simple method for microscopy-based stomata analyses. PLoS One. 11, e0164576 (2016).
- Chitraker, R., Melotto, M. Assessing stomatal response to live bacterial cells using whole leaf imaging. Journal of Visualized Experiments. 44, 2185 (2010).
- Sai, N., et al. StomaAI: an efficient and user-friendly tool for measurement of stomatal pores and density using deep computer vision. New Phytologist. 238 (2), 904-915 (2023).
- Takagi, M., et al. Image-based quantification of Arabidopsis thaliana stomatal aperture from leaf images. Plant and Cell Physiology. pcad018, (2023).
- Melotto, M., Zhang, L., Oblessuc, P. R., He, S. Y. Stomatal defense a decade later. Plant Physiology. 174 (2), 561-571 (2017).
- Melotto, M., Underwood, W., Koczan, J., Nomura, K., He, S. Y. Plant stomata function in innate immunity against bacterial invasion. Cell. 126 (5), 969-980 (2006).
- Zeng, W., He, S. A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiology. 153 (3), 1188-1198 (2010).
- Zheng, X. Y., et al. Coronatine promotes Pseudomonas syringae virulence in plants by activating a signaling cascade that inhibits salicylic acid accumulation. Cell Host and Microbe. 11 (6), 587-596 (2012).
- Raffeiner, M., et al. The Xanthomonas type-III effector XopS stabilizes CaWRKY40a to regulate defense responses and stomatal immunity in pepper (Capsicum annuum). The Plant Cell. 34 (5), 1684-1708 (2022).
- Munemasa, S., Hauser, F., Park, J., Waadt, R., Brandt, B., Schroeder, J. I. Mechanisms of abscisic acid-mediated control of stomatal aperture. Current Opinion in Plant Biology. 28, 154-162 (2015).
- Förster, S., et al. Wounding-induced stomatal closure requires jasmonate-mediated activation of GORK K+ channels by a Ca2+ sensor-kinase CBL1-CIPK5 complex. Developmental Cell. 48 (1), 87-99 (2018).
- Cheng, Y. T., Zhang, L., He, S. Y. Plant-microbe interactions facing environmental challenge. Cell Host and Microbe. 26 (2), 183-192 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved