Method Article
Gözenekli Ortamlarda Biyotıkanıklığı İncelemek için Mikroakışkan Bir Platform
Bu Makalede
Özet
Mevcut protokol, yüksek çözünürlüklü mikroskopi görüntülemeyi eşzamanlı basınç farkı ölçümleriyle birleştirerek yarı-2D gözenekli ortamlarda biyofilm gelişimini incelemek için mikroakışkan bir platformu tanımlamaktadır. Platform, gözenekli ortamlardaki gözenek boyutunun ve sıvı akış hızlarının biyotıkanma üzerindeki etkisini ölçer.
Özet
Bakteriyel biyofilmler, topraklar ve filtrasyon membranları dahil olmak üzere çeşitli çevresel ve endüstriyel gözenekli ortamlarda bulunur. Biyofilmler belirli akış koşulları altında büyür ve gözenekleri tıkayabilir, böylece yerel sıvı akışını yeniden yönlendirebilir. Biyofilmlerin gözenekleri tıkama yeteneği, biyotıkanma olarak adlandırılır, gözenekli ortamın yerel geçirgenliği üzerinde muazzam bir etkiye sahip olabilir, sistemde bir basınç birikimi yaratabilir ve içinden geçen kütle akışını etkileyebilir. Farklı fiziksel koşullar altında (örneğin, farklı akış hızlarında ve gözenek boyutlarında) biyofilm büyümesi ve sıvı akışı arasındaki etkileşimi anlamak için, bu çalışmada, biyofilm gelişimini dışarıdan dayatılan, kontrollü fiziksel koşullar altında bir mikroskop kullanarak görselleştirmek için mikroakışkan bir platform geliştirilmiştir. Gözenekli ortamdaki biyofilm kaynaklı basınç birikimi, basınç sensörleri kullanılarak aynı anda ölçülebilir ve daha sonra biyofilmin yüzey kaplaması ile ilişkilendirilebilir. Sunulan platform, akış koşulları altında gözenekli ortamlarda biyofilmlerin neden olduğu biyotıkanıklığı araştırmak için sistematik bir yaklaşım için bir temel oluşturur ve çevresel izolatları veya çok türlü biyofilmleri incelemek için uyarlanabilir.
Giriş
Biyofilmler - ekstra-polimerik maddelerin (EPS) kendiliğinden salgılanan bir matrisine gömülü bakteri kolonileri - topraklar ve akiferler1 gibi doğal gözenekli ortamlarda ve biyoremediasyon2, su filtrasyonu3 ve tıbbi cihazlar4 gibi teknik ve tıbbi uygulamalarda her yerde bulunur. Biyofilm matrisi, polisakkaritler, protein lifleri ve hücre dışı DNA 5,6'dan oluşur ve mikroorganizmalara, besin maddelerinin mevcudiyetine ve çevresel koşullara güçlü bir şekilde bağlıdır7. Oysa matrisin işlevleri evrenseldir; Biyofilm yapısının iskelesini oluşturur, mikrobiyal topluluğu mekanik ve kimyasal streslerden korur ve biyofilmlerin reolojik özelliklerinden büyük ölçüde sorumludur5.
Gözenekli ortamlarda, biyofilmlerin büyümesi gözenekleri tıkayabilir ve sözde biyotıkanıklığa neden olabilir. Biyofilm gelişimi, gözenekli ortamın iki sütununu ayıran mesafe olarak tanımlanansıvı akışı ve gözenek boyutu 8,9,10 ile kontrol edilir. Hem gözenek boyutu hem de sıvı akışı, besin taşınımını ve yerel kesme kuvvetlerini kontrol eder. Buna karşılık, büyüyen biyofilm gözenekleri tıkar, sıvının hız dağılımını etkiler 11,12,13, kütle taşımacılığı ve gözenekli ortamın hidrolik iletkenliği 14,15. Hidrolik iletkenlikteki değişiklikler, kapalı sistemlerdeki artan basınçla yansıtılır16,17,18,19. Biyofilm geliştirme ve biyotıkanma konusundaki mevcut mikroakışkan çalışmalar, homojen geometriler16,20 (yani tekil gözenek boyutu ile) veya heterojen gözenekli ortam 12,21,22'deki akış hızlarının etkisini incelemeye odaklanmaktadır. Bununla birlikte, akış hızlarının ve gözenek boyutunun biyofilm gelişimi üzerindeki etkilerini ve biyotıkanmış gözenekli ortamda ortaya çıkan basınç değişikliklerini çözmek için, farklı gözenekli ortam geometrilerinin ve çevresel koşulların paralel olarak incelenmesine izin veren oldukça kontrol edilebilir ve çok yönlü bir deneysel platform gereklidir.
Bu çalışma, basınç ölçümlerini gözenekli ortam içinde gelişen biyofilmin eşzamanlı görüntülenmesi ile birleştiren mikroakışkan bir platform sunmaktadır. Kanal geometrisi tasarımındaki gaz geçirgenliği, biyo-uyumluluk ve esnekliği nedeniyle, polidimetilsiloksandan (PDMS) yapılmış mikroakışkan bir cihaz, gözenekli ortamlarda biyofilm gelişimini incelemek için uygun bir araçtır. Mikroakışkanlar, mikrobiyal habitatların çevresini taklit etmek için fiziksel ve kimyasal koşulların (örneğin, sıvı akışı ve besin konsantrasyonu) yüksek hassasiyetle kontrol edilmesini sağlar23. Ayrıca, mikroakışkan cihazlar optik mikroskop kullanılarak mikrometrik çözünürlükle kolayca görüntülenebilir ve çevrimiçi ölçümlerle (örneğin, yerel basınç) birleştirilebilir.
Bu çalışmada, deneyler, kontrollü empoze edilen akış koşulları altında homojen gözenekli bir ortam analoğundaki gözenek boyutunun etkisini incelemeye odaklanmaktadır. Bir kültür ortamının akışı bir şırınga pompası kullanılarak uygulanır ve mikroakışkan kanaldaki basınç farkı basınç sensörleriyle aynı anda ölçülür. Biyofilm gelişimi, mikroakışkan kanalda Bacillus subtilis'in planktonik bir kültürünün tohumlanmasıyla başlatılır. Gelişen biyofilmin düzenli olarak görüntülenmesi ve görüntü analizi, çeşitli deneysel koşullar altında yüzey kapsamı hakkında gözenek ölçeğinde çözülmüş bilgilerin elde edilmesini sağlar. Basınç değişiminin ilişkili bilgileri ve biyotıkanıklığın derecesi, biyotıkanmış gözenekli ortamların geçirgenlik tahminleri için çok önemli girdiler sağlar.
Protokol
1. Silikon gofret hazırlama
- Mikroakışkan kanalın geometrilerini bilgisayar destekli tasarım (CAD; bkz. Malzeme Tablosu) yazılımında tasarlayın ve fotomaskeyi oluşturmak için şeffaf bir film üzerine yazdırın (Şekil 1A).
- Ana kalıbı aşağıdaki adımları izleyerek yumuşak litografi (temiz oda koşullarında) ile imal edin.
- Silikon gofreti 200 °C'de 2 saat pişirin.
- Gofreti bir spin-coater'ın ortasına yerleştirin ve gofret üzerine SU8 3050 fotorezistini ( bakınız Malzeme Tablosu) dökün. 10 s/100 rpm rampa süresi ile 40 s için 1.700 rpm'de spin coat.
NOT: Spin kaplama parametreleri, SU8 3050 için 100 μm'lik bir hedef kalınlık elde edecek şekilde ayarlanmıştır. - Sıkma kaplama işleminden sonra, silikon gofreti 600 s için 65 ° C'de ve 2.700 s için 95 ° C'de yumuşak bir şekilde pişirin. Gofreti gece boyunca oda sıcaklığında soğumaya bırakın.
NOT: Gece soğutması, SU8'in gofrete yapışmasını arttırır. - Fotomaskeyi (adım 1.1) gofret üzerine yerleştirin ve 250 mJ /cm2 pozlama enerjisinde ve 350 nm dalga boyunda UV ışığına maruz bırakın.
- Pozlamadan sonra, maruz kalan substratı 60 s için 65 ° C'de ve 300 s için 95 ° C'de pişirin.
- Ana kalıbı elde etmek için silikon gofreti mrDev600 geliştiricisi ile doldurulmuş bir beher kabına batırarak geliştirin (bkz. Polimerize edilmemiş direnci yıkamak için beheri 1.800 s boyunca yavaşça sallayın. Daha sonra, silikon gofret üzerine izopropanol püskürterek ve havayla kurutarak yıkayın.
- Silikon gofreti 200 °C'de 1.800 s boyunca sert bir şekilde pişirin.
- Ana kalıbı, bir vakum kurutucuda 40 dakika boyunca kalıbın yanındaki bir cam slayt üzerine yerleştirilen 20 μL Trikloro (1H, 1H, 2H, 2H-perflorooktil) silan buhar birikimi yoluyla silanize edin (bakınız Malzeme Tablosuna bakınız) ve 100 mbar'lık bir gösterge basıncı oluşturur.
2. Mikroakışkan cihazın imalatı
NOT: Burada açıklanan imalat prosedürü, bir mikroakışkan kanala sahip bir mikroakışkan cihaz içindir. Bununla birlikte, aynı yöntem, paralel olarak birden fazla mikroakışkan kanala sahip bir mikroakışkan cihaz üretmek için de uygulanabilir.
- Bir PDMS karışımı hazırlamak için elastomeri çapraz bağlayıcısıyla 10:1 oranında karıştırın ( bkz. Karışımı düzgün bir şekilde karışana ve kapalı hava kabarcıkları nedeniyle opak hale gelene kadar karıştırın.
- Karışımı bir vakum kurutucuda gazdan arındırın, sıkışmış hava kabarcıkları giderilene ve şeffaf görünene kadar 100 mbar'lık bir gösterge basıncı oluşturun. Gazdan arındırma için gereken süre tipik olarak 30 dakikadır.
- Ana kalıbı (adım 1) bir hücre kültürü kabına yerleştirin (bkz. Son kalınlığı 5 mm olan kanallar üretmek için ana kalıba 20 g PDMS karışımı dökün.
- Ana kalıbı 70 °C'de 2 saat pişirin.
- Kürlenmiş PDMS'yi bir bıçak kullanarak mikroakışkan kanalın etrafında (yaklaşık 3 mm'lik bir mesafede) kesin ve ardından PDMS mikroakışkan kanalını ana kalıptan çıkarın.
- Mikroakışkan kanalların giriş ve çıkışını oluşturmak için, uçlarında biyopsi zımbasıyla (çapı 1,5 mm) delikler açın (üçgenlerin tepesi, bkz. Şekil 1A). Basınç sensörünü daha sonra takmak için giriş üçgeninin ortasına bir delik daha açın.
- Bir cam slaytı ve mikroakışkan kanalı ticari olarak temin edilebilen% 1'lik bir deterjan çözeltisi ile ( Malzeme Tablosuna bakınız) 5 dakika yıkayın, ardından deiyonize suyla durulayın. Daha sonra, PDMS mikroakışkan kanalını ve cam slaytı izopropanol ile yıkayın. Ardından, deiyonize suyla tekrar durulayın. PDMS mikroakışkan kanalını ve cam sürgüyü basınçlı hava ile 1 bar'da 1 dakika kurutun.
NOT: Yapıştırmanın etkili olabilmesi için PDMS'nin gözenekli yapısının tamamen kuru olması gerekir. - Cam sürgüyü ve mikroakışkan kanalı bir plazma temizleyiciye yerleştirin (bkz. Malzeme Tablosu) ve yapıştırılacak yüzeylerin yukarı baktığından emin olun. Plazma temizleyiciyi açın ve mikroakışkan kanalı ve cam sürgüyü 1 dakika boyunca 1 SL / s (saatte standart litre) hava akışında hava plazması ile tedavi edin. Mikroakışkan kanalı, temizleyiciden çıkardıktan hemen sonra birbirleriyle temas ettirerek cam sürgüye bağlayın.
NOT: İşlem görmüş yüzeylere dokunmadığınızdan emin olun, çünkü bu yapıştırmayı etkileyebilir. Birden fazla mikroakışkan kanala sahip bir mikroakışkan cihaz üretirken, mikroakışkan kanalları aynı anda açığa çıkarın ve tek bir adımda bağlayın. - Bağlı mikroakışkan cihazı en az 15 dakika boyunca 80 ° C'lik bir sıcak plakaya yerleştirin.
- Mikroakışkan cihazı, deney başlayana kadar temiz bir hücre kültürü kabında saklayın.
3. Bakteriyel süspansiyonun hazırlanması
- Deneyin başlamasından 20 saat önce, 15 mL'lik bir kültür tüpünde dondurulmuş bir gliserol stoğundan 3 mL besin suyu no. 3 kültür ortamını (bkz. Gece boyunca 30 ° C ve 200 rpm'de (16 saat boyunca) çalkalayan bir inkübatörde inkübe edin.
- 15 mL'lik bir kültür tüpünde 3 mL taze kültür ortamına (1:1.000 seyreltme) 3 μL gece kültürü ekleyerek deneyin başlamasından 4 saat önce gece kültüründen bir alt kültür yapın. 600 nm'de (OD600) 0,1'lik bir optik yoğunluk elde etmek için alt kültürü 200 rpm'de 30 ° C'de 3,5-4 saat boyunca çalkalayan bir inkübatörde inkübe edin.
4. Biyofilm büyüme deneyi
- 25 ° C'lik sabit bir sıcaklık sağlamak için deneyden 3 saat önce mikroskobun kutu inkübatörünü açın. Şırınga pompasını ve basınç sensörlerini monte edin (bkz.
- Giriş ve çıkış borusunu mikroakışkan cihaza bağlayın. Boru ile şırınga arasındaki bağlantıyı sağlamak için giriş borusuna doğrudan bir iğne (dış çapı 0,6 mm olan) yerleştirin.
- Mikroakışkan cihazı, 30 mL deiyonize suyu ve 30 mL kültür ortamını vakumlu bir kurutucuya yerleştirin ve en az 1 saat boyunca gazlarını giderin. Ardından, kültür ortamını ve deiyonize suyu yavaşça iki ayrı 30 mL şırıngaya çekin.
NOT: Bu adım, kültür ortamıyla yıkanırken kanalda kabarcık oluşumunu önlemek için çok önemlidir. - Mikroakışkan cihazı mikroskopa monte edin ve çıkış borusunu bir atık kabına yerleştirin.
- Deiyonize su ile doldurulmuş şırıngayı mikroakışkan boru aracılığıyla mikroakışkan kanala bağlayın ve basınç sensörü çıkışından çıkana kadar suyu yavaşça enjekte edin. Basınç sensörünü suyla doldurun ve mikroakışkan kanalı ve basınç sensörünü birbirine bağlayan borudaki tüm kabarcıkları yıkayın. Basınç sensörünün çıkışını, basınç sensörüne ayrılmış vidalarla kapatın.
NOT: Açıklanan doldurma prosedürü, mikroakışkan kanalların girişindeki basınç değişikliklerinin hassas bir şekilde kaydedilmesini sağlar. Birden fazla mikroakışkan kanalla bir deneme çalıştırırken, tüm kanallarda eşit akış koşulları sağlamak için her kanalı ayrı bir şırıngaya bağlayın.
- Deiyonize su ile doldurulmuş şırıngayı mikroakışkan boru aracılığıyla mikroakışkan kanala bağlayın ve basınç sensörü çıkışından çıkana kadar suyu yavaşça enjekte edin. Basınç sensörünü suyla doldurun ve mikroakışkan kanalı ve basınç sensörünü birbirine bağlayan borudaki tüm kabarcıkları yıkayın. Basınç sensörünün çıkışını, basınç sensörüne ayrılmış vidalarla kapatın.
- Mikroakışkan kanalın geri kalanını deiyonize suyla doldurun.
- Kültür ortamı şırıngasına 1,2 μm'lik bir filtre (bkz. Malzeme Tablosu) yerleştirin. Ardından, su şırıngasını çıkarın ve kültür ortamı şırıngasını giriş mikroakışkan borusuna dikkatlice bağlayın. Şırıngayı şırınga pompasına monte edin ve kanalı 1 saat boyunca 2 mL / s akış hızında kültür ortamıyla yıkayın.
NOT: Filtre, yükleme sırasında bakteri hücrelerinin şırıngaya girmesini önler. Mikroakışkan kanalın kültür ortamı ile yıkanması, gözenekli yapıdaki kalan kabarcıkları giderecektir. - Deney sırasında şırınga pompasını istenen akış hızına (burada 1 mL / s) ayarlayın ve basınç sensörlerinin basınç okumasını sıfıra ayarlayın.
NOT: İlk basınç okumasını sıfıra ayarlayarak, yalnızca deney sırasında biyofilm gelişiminin neden olduğu basınç farkı ölçülecektir. - 1,5 mL'lik bir santrifüj şişesinde 0,1'lik bir OD600'de bakteri kültürünün 1 mL'sini pipetleyin. Çıkış tüpünü santrifüj şişesine yerleştirerek bakteri kültürünü mikroakışkan kanala yükleyin. Tüplerin çıkışından herhangi bir potansiyel hava kabarcığını çıkarmak için 5 dakika bekledikten sonra, mikroakışkan kanal bakteri kültürü ile dolana kadar 1 mL / s akış hızında 150 μL bakteri çözeltisini geri çekin.
- Kültür ortamı şırınga filtresini dikkatlice çıkarın ve çıkışı atık kabına yerleştirin. Bakteriyel hücreleri, gözenekli ortamda yüzey yapışmalarına izin vermek için mikroakışkan kanalda 3 saat boyunca sıfır akış koşullarında bırakın.
NOT: Bakteri hücrelerini 3 saat boyunca sıfır akış koşullarında bırakmak, iyi oksijenlenmiş bir bakteri kültürü sağlarken kullanılan bakteri suşunun bağlanması için optimize edilmiştir. Diğer bakteri suşları az ya da çok zaman gerektirebilir. - Deneyi başlatmak için, şırınga pompasını istenen akış hızına (burada 1 mL / s) ayarlayarak akışı başlatın ve basınç okumasını 1 Hz'de başlatın.
- İstenilen zaman aralığında, optik konfigürasyonda ve büyütmede büyüyen biyofilmin görüntülerini elde edin.
NOT: Bu çalışmada, gözenekli ortamın tüm alanını kapsayan 18 pozisyonda parlak alan modunda 4x büyütmede görüntüler 24 saat boyunca her 6 dakikada bir elde edilmiştir.
5. Görüntü analizi
- Görüntü analiz yazılımı (bkz. Malzeme Tablosu) ve bir dikiş algoritması24 kullanarak 18 konumdan görüntüleri dikerek kaydedilen görüntü dizilerinden tüm gözenekli ortamı yeniden oluşturun.
- Dikişli görüntü dizilerini tekil görüntü dizisi olarak kaydedin.
NOT: Dosyalar çok büyükse, bu noktada, görüntüler yeniden ölçeklendirilebilir ve daha fazla işlem için makul bir boyuta bağlanabilir. - Analizden çıkarmak için gözenekli ortamın sütunlarının bir maskesini oluşturun.
- Görüntülerin arka planını, t = 0 h'de çekilen görüntüyle arka planlarına bölerek çıkarın (Şekil 2A) ve görüntüleri biyofilmi segmentlere ayırmak için uygun bir eşikte ikili hale getirin (Şekil 2B).
- Biyofilmin doygunluğunu, biyofilmin kapladığı alanı (biyofilme atfedilen piksel sayısı) gözenekli alanın boşluk alanına kıyasla hesaplayarak hesaplayın (Şekil 3).
Sonuçlar
Bu çalışmada, gözenekli ortamlarda biyofilm oluşumunu sistematik olarak incelemek için farklı gözenek boyutlarına sahip üç paralel mikroakışkan kanala sahip bir mikroakışkan cihaz kullanılmıştır (Şekil 1). Biyofilm oluşum süreci parlak alan mikroskobu kullanılarak görselleştirildi. Bakteri hücreleri ve biyofilm görüntülerde daha koyu pikseller olarak ortaya çıktı (Şekil 2). Ek olarak, kademeli bir tıkanma süreci gözlendi; 24 saatlik bir deney sırasında, başlangıçta rastgele büyüyen biyofilm neredeyse tüm gözenekli ortamı kolonize etti.
Biyofilmin zaman içinde yüzey kaplaması, 0.96 mm / s'lik ortalama bir başlangıç sıvı akış hızına karşılık gelen Q = 1 mL / s akış hızında büyüdü, üç farklı gözenek boyutu (75 μm, 150 μm ve 300 μm) için ölçüldü (Şekil 3, siyah çizgiler). Biyotıkanma derecesi için bir vekil olarak kullanılan yüzey kaplamasının, t = 20 h'deki yüzey kapsamı karşılaştırıldığında, 75 μm'lik en küçük gözenek boyutunda, en büyük gözenek boyutuna (300 μm) göre% 10 daha hızlı gerçekleştiği bulunmuştur. Daha sonra, yüzey kaplaması biyofilmin neden olduğu basınç birikimi ile ilişkilendirildi (Şekil 3, mavi çizgiler). Daha küçük gözenek boyutundaki mikroakışkan kanaldaki tıkanma, giriş ve çıkış arasında daha büyük gözenek boyutundaki mikroakışkan kanallardan daha yüksek bir basınç farkına yol açmıştır, bu da daha küçük boyutlu gözenekli ortamın biyotıkanmaya maruz kaldığında daha yüksek basınç birikimi geliştireceğini göstermektedir.
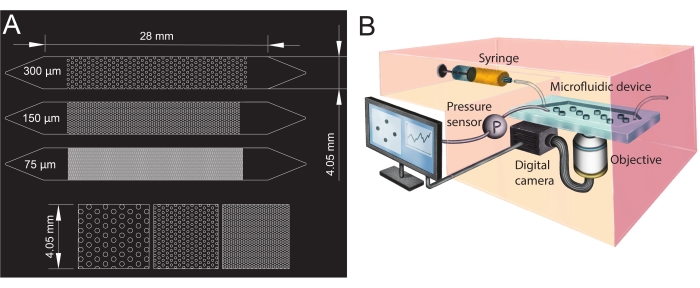
Resim 1: Mikroakışkan kanal tasarımı ve deney düzeneği. (A) Gözenekli ortam analogları olarak kullanılan farklı gözenek boyutlarına (75 μm, 150 μm ve 300 μm) sahip mikroakışkan kanalların fotomaskesi ve sütunların düzeninin yakınlaştırılmış bir görünümü (alt sıra). Daireler, gözenekli ortamın katı fazını temsil eden sütunların (geçirimsiz engeller) yerini gösterir. (B) Şırıngayı, basınç sensörünü, mikroakışkan cihazı (tek bir mikroakışkan kanalla) ve dijital kamera kurulumunu objektif (yani mikroskop) gösteren deney düzeneğinin şeması. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: Gözenekli ortamda biyofilm gelişiminin görselleştirilmesi ve nicelleştirilmesi. (A) Q = 1 mL/s empoze edilen akış hızında (0,96 mm/s'lik ortalama başlangıç sıvı akış hızına karşılık gelir) ve t = 5 h deneysel zaman noktaları için gösterilen d = 300 μm'lik bir gözenek boyutunda biyofilm gelişiminin temsili görüntü dizisi, t = 10 h, t = 15 h ve t = 20 h . Parlak alan görüntüleri dikildi ve arka plan kaldırıldı. (B) Bu görüntülerin ikilileştirilmesi ve biyofilm (koyu pikseller) tarafından işgal edilen alanın nicelleştirilmesi, Şekil 3'teki yüzey kapsamının nicelleştirilmesine yol açmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
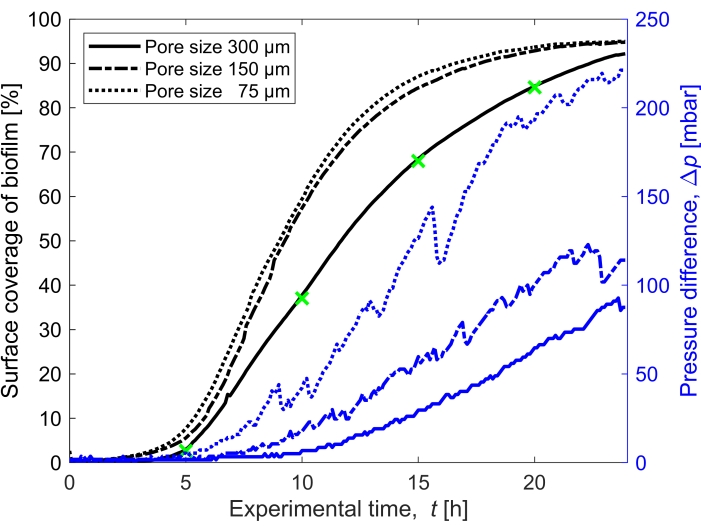
Şekil 3: Biyofilm kapsamının zamansal evrimi ve basınç üzerindeki etkisi. Şekil 2 ile aynı deneysel koşullarda üç gözenek boyutu (300 μm, 150 μm ve 75 μm) için eşzamanlı basınç okuması ile biyofilm kapsamı. Sağ y ekseninde gösterilen gözenekli ortam mikroakışkan kanalı Δp'deki (mavi çizgiler) biyofilmin neden olduğu basınç farkı, biyofilmin yüzey kapsamının artmasıyla (siyah çizgiler) artar. Yeşil işaretçiler, Şekil 2'de gösterilen görüntülerin veri noktalarına karşılık gelir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Basınç sensörleri ile birleştirilmiş mikroakışkan gözenekli ortam analogları, gözenekli ortamlarda biyofilm gelişimini incelemek için uygun bir araç sağlar. Mikroakışkan gözenekli ortamın tasarımındaki çok yönlülük, özellikle çap, düzensiz şekiller ve gözenek boyutu dahil olmak üzere sütunların düzenlenmesi, birçok geometrinin araştırılmasına izin verir. Bu geometriler, tek gözeneklerden, farklı doğal (örneğin topraklar) ve endüstriyel (örneğin, membranlar ve filtreler) gözenekli ortamları taklit eden son derece karmaşık, düzensiz düzenlenmiş engellere kadar uzanır. Mevcut mikroakışkan platformda, sıvı akış hızının deney başına seçilebildiği düzenli olarak düzenlenmiş silindirik sütunlarla (gözenek boyutları: 75 μm, 150 μm ve 300 μm) üç gözenekli ortam geometrisi oluşturulmuştur. Sunulan platform, uygulanan bir sıvı akış hızı yerine sabit bir basınç kafası ile biyotıkanıklığı incelemek için kolayca uyarlanabilir. Bu durumda, akış kontrol cihazı, bir şırınga pompası yerine bir kültür ortamı rezervuarına sahip bir basınç kontrolörü olmalıdır. Biyotıkanma nedeniyle akış hızında ortaya çıkan değişiklikler, bir akış hızı sensörü kullanılarak zaman içindeki çıkışın ölçülmesiyle izlenebilir.
Biyofilm büyümesi ile başarılı bir mikroakışkan deney yapmak için birkaç kritik nokta göz önünde bulundurulmalıdır. Deney sırasında mikroakışkan kanalda hava kabarcığı oluşumunu önlemek için, mikroakışkan kanal ve kültür ortamı gazdan arındırıldı (adım 4.3). Daha sonra, mikroakışkan kanalın gazdan arındırılmış kültür ortamı ile doldurulması, herhangi bir hava kabarcığı olmadan tamamen doymuş bir kanal elde etmek için hızlı ama dikkatli bir şekilde yapılmalıdır. Hava kabarcıklarının gözenekli ortamda sıkışması durumunda, mikroakışkan kanalı daha yüksek bir akış hızında yıkamak, kabarcıkları kısa bir süre sonra temizleyebilir. İkinci önemli adım, biyofilm büyümesini tutarlı bir şekilde yeniden üretmek için sabit bir sıcaklık ortamı sağlamaktır. Mikroorganizmaların büyümesisıcaklık 25'e göre değişir, bu da deney sırasında sıcaklığı sabit tutmadığında tekrarlanamayan sonuçlara yol açabilir (bu durumda, 24 saat). Mevcut platform için, mikroskop etrafında bir kutu inkübatörü kullanıldı, ancak mikroakışkan cihaz için daha küçük bir sıcaklığa dayanıklı muhafaza da muhtemelen yeterli olacaktır. Son olarak, görüntü toplama sırasında, dikiş algoritması24 için yeterli örtüşme elde etmek için tek tek görüntülerin konumları en az% 15'lik bir örtüşme ile seçilmelidir.
Mevcut mikroakışkan platform iki boyutlu gözlem ile sınırlıdır, oysa toprak veya membranlar gibi gözenekli ortam uygulamaları üç boyutlu bir yapıya sahiptir. Bununla birlikte, yarı-2D mikroakışkan platformun biyotıkanıklığı incelemek için 3D gözenekli medya platformlarına kıyasla avantajları, tam optik erişim ve yüksek zaman çözünürlüğüdür, çünkü 3D platformlar genellikle uç nokta görüntüleme26,27 gerçekleştirir. Ek olarak, biyotıkanma işleminin (yani, yüzey kapsamının zaman evrimi) 3D sistemlerde26,27'de devam etmesi beklenmektedir, çünkü aynı zamanda 2D ve 3D sistemlerde aynı ölçeklemeyi sunan gözenekli ortam 28 içindeki karışmaz bir fazın küme boyutu dağılımı için de meydana gelir.
Bu yöntem, gözenekli ortamlarda biyofilm büyümesine basınç tepkisinin ölçülmesine izin verirken, uzaysal-zamansal gelişimini yüksek zamansal ve mekansal çözünürlükte ve farklı gözenek boyutlarında inceler. Bu tür ölçümlerden elde edilen veri setleri, gözenek ölçekli biyofilm gelişiminin biyofilm-gözenekli ortam sisteminin basınç tepkileri ile korelasyonuna dair fikir verir ve biyofilmlerin sayısal modellemesi için bir ölçüt sağlayabilir. Bu modelleme çabaları, özellikle deneysel kapasiteleri aşan koşulların (örneğin, gözenek boyutları, akış hızları ve diğer türler veya çok türlü biyofilmler için biyofilm özellikleri) genişletilmesiyle ilgilidir. İkincisi, kuyuların çevresindeki biyotıkanma mekanizmalarını, biyoremediasyon uygulamalarını ve biyomineralizasyon 29,30,31'i anlamak için oldukça önemlidir. Genel olarak, bu yöntem biyomineralizasyonu incelemek veya kirleticilerin gözenekli ortamlardaki biyofilmler tarafından biyotransformasyonunu izlemek için kolayca uyarlanabilir.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, SNSF PRIMA hibe 179834 (E.S.'ye), ETH'den (RS'ye), ETH Zürih Araştırma Hibesinden (RS ve J.J.M.'ye) isteğe bağlı fonlamadan ve Eawag'dan (J.J.M.'ye) isteğe bağlı fonlamadan destek kabul etmektedir. Yazarlar, Şekil 1B'deki deney düzeneğini gösterdiği için Roberto Pioli'ye ve silikon gofret hazırlığı için Ela Burmeister'e teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
Referanslar
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221 (2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197 (2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107 (2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116 (2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316 (2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536 (2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır