Method Article
Uma plataforma microfluídica para o estudo do bioentupimento em meios porosos
Neste Artigo
Resumo
O presente protocolo descreve uma plataforma microfluídica para estudar o desenvolvimento de biofilme em meios porosos quase-2D, combinando imagens de microscopia de alta resolução com medidas simultâneas de diferença de pressão. A plataforma quantifica a influência do tamanho dos poros e das taxas de fluxo de fluido em meios porosos no bioentupimento.
Resumo
Biofilmes bacterianos são encontrados em diversos meios porosos ambientais e industriais, incluindo solos e membranas de filtração. Os biofilmes crescem sob certas condições de fluxo e podem obstruir os poros, redirecionando assim o fluxo de fluido local. A capacidade dos biofilmes de obstruir os poros, o chamado bioentupimento, pode ter um tremendo efeito sobre a permeabilidade local do meio poroso, criando um acúmulo de pressão no sistema e impactando o fluxo de massa através dele. Para entender a interação entre o crescimento do biofilme e o fluxo de fluido sob diferentes condições físicas (por exemplo, em diferentes velocidades de fluxo e tamanhos de poros), no presente estudo, uma plataforma microfluídica é desenvolvida para visualizar o desenvolvimento do biofilme usando um microscópio sob condições físicas controladas e impostas externamente. O acúmulo de pressão induzido pelo biofilme no meio poroso pode ser medido simultaneamente com o uso de sensores de pressão e, posteriormente, correlacionado com a cobertura superficial do biofilme. A plataforma apresentada fornece uma linha de base para uma abordagem sistemática para investigar o bioentupimento causado por biofilmes em meios porosos sob condições de fluxo e pode ser adaptada para estudar isolados ambientais ou biofilmes multiespécies.
Introdução
Os biofilmes - colônias bacterianas embutidas em uma matriz autosecretada de substâncias extrapoliméricas (EPS) - são onipresentes em meios porosos naturais, como solos e aquíferos1, e aplicações técnicas e médicas, como biorremediação2, filtração de água3 e dispositivos médicos4. A matriz do biofilme é composta por polissacarídeos, fibras proteicas e DNA extracelular5,6 e depende fortemente dos microrganismos, da disponibilidade de nutrientes e das condições ambientais7. No entanto, as funções da matriz são universais; Forma o arcabouço da estrutura do biofilme, protege a comunidade microbiana de estresses mecânicos e químicos e é o grande responsável pelas propriedades reológicas dos biofilmes5.
Em meios porosos, o crescimento de biofilmes pode obstruir os poros, causando o chamado bioentupimento. O desenvolvimento do biofilme é controlado pelo fluxo de fluido e tamanho dos poros, definidos como a distância que separa dois pilares, do meio poroso 8,9,10. Tanto o tamanho dos poros quanto o fluxo de fluido controlam o transporte de nutrientes e as forças de cisalhamento locais. Por sua vez, o biofilme crescente obstrui os poros, afetando a distribuição de velocidade do fluido 11,12,13, o transporte de massa e a condutividade hidráulica do meio poroso 14,15. As mudanças na condutividade hidráulica são refletidas através do aumento da pressão em sistemas confinados16,17,18,19. Os estudos microfluídicos atuais em desenvolvimento de biofilme e bioentupimento concentram-se no estudo do impacto das velocidades de fluxo em geometrias homogêneas16,20 (isto é, com tamanho de poro singular) ou meios porosos heterogêneos12,21,22. No entanto, para desvendar os efeitos das vazões e do tamanho dos poros no desenvolvimento do biofilme e as consequentes mudanças de pressão no meio poroso bioentupido, é necessária uma plataforma experimental altamente controlável e versátil que permita o estudo de diferentes geometrias de meios porosos e condições ambientais em paralelo.
O presente estudo introduz uma plataforma microfluídica que combina medidas de pressão com imagens simultâneas do biofilme em evolução dentro do meio poroso. Devido à sua permeabilidade a gás, biocompatibilidade e flexibilidade no projeto da geometria do canal, um dispositivo microfluídico feito de polidimetilsiloxano (PDMS) é uma ferramenta adequada para estudar o desenvolvimento de biofilme em meios porosos. A microfluídica permite o controle das condições físicas e químicas (por exemplo, fluxo de fluidos e concentração de nutrientes) com alta precisão para mimetizar o ambiente de habitats microbianos23. Além disso, os dispositivos microfluídicos podem ser facilmente fotografados com resolução micrométrica usando um microscópio óptico e acoplados a medições on-line (por exemplo, a pressão local).
Neste trabalho, os experimentos se concentram em estudar o impacto do tamanho dos poros em um meio poroso homogêneo análogo sob condições controladas de escoamento imposto. O fluxo de um meio de cultura é imposto usando uma bomba de seringa, e a diferença de pressão através do canal microfluídico é medida simultaneamente com sensores de pressão. O desenvolvimento do biofilme é iniciado pela semeadura de uma cultura planctônica de Bacillus subtilis no canal microfluídico. Imagens regulares do biofilme em evolução e análise de imagens permitem obter informações resolvidas em escala de poros na cobertura da superfície sob várias condições experimentais. As informações correlacionadas da mudança de pressão e a extensão do bioentupimento fornecem subsídios cruciais para estimativas de permeabilidade de meios porosos bioentupidos.
Protocolo
1. Preparação do wafer de silício
- Projetar as geometrias do canal microfluídico em software de projeto assistido por computador (CAD; ver Tabela de Materiais) e imprimi-lo em um filme transparente para criar a fotomáscara (Figura 1A).
- Fabricar o molde mestre por litografia suave (em condições de sala limpa) seguindo os passos abaixo.
- Asse a bolacha de silicone a 200 °C por 2 h.
- Coloque o wafer no centro de um spin-coater e despeje o fotorresiste SU8 3050 (consulte a Tabela de Materiais) sobre o wafer. Spin coat a 1.700 rpm por 40 s com um tempo de rampa de 10 s/100 rpm.
NOTA: Os parâmetros de spin-coating foram ajustados para obter uma espessura alvo de 100 μm para o SU8 3050. - Após o processo de spin-coat, leve ao forno de silício a 65 °C por 600 s e 95 °C por 2.700 s. Deixe a bolacha esfriar em temperatura ambiente durante a noite.
NOTA: O arrefecimento noturno aumenta a aderência do SU8 ao wafer. - Colocar a fotomáscara (passo 1.1) sobre o wafer e expô-lo à luz UV, com uma energia de exposição de 250 mJ/cm2 e um comprimento de onda de 350 nm.
- Após a exposição, asse o substrato exposto a 65 °C por 60 s e 95 °C por 300 s.
- Desenvolva o wafer de silício para obter o molde mestre mergulhando-o em um copo preenchido com o revelador mrDev600 (consulte Tabela de Materiais). Agite suavemente o copo por 1.800 s para lavar a resistência não polimerizada. Em seguida, lave com salpicos borrifando isopropanol no wafer de silicone e seque ao ar.
- Leve ao forno duro o wafer de silicone a 200 °C por 1.800 s.
- Silanizar o molde mestre através da deposição de vapor de 20 μL de silano Tricloro (1H, 1H, 2H, 2H-perfluorooctil) (ver Tabela de Materiais) colocado em uma lâmina de vidro ao lado do molde por 40 min em um dessecador a vácuo, criando uma pressão manométrica de 100 mbar.
2. Fabricação do dispositivo microfluídico
NOTA: O procedimento de fabricação descrito aqui é para um dispositivo microfluídico com um canal microfluídico. No entanto, o mesmo método pode ser aplicado para fabricar um dispositivo microfluídico com múltiplos canais microfluídicos em paralelo.
- Misture o elastômero com seu reticulante na proporção de 10:1 (ver Tabela de Materiais) para preparar uma mistura de PDMS. Mexa a mistura até que fique uniformemente misturada e fique opaca devido às bolhas de ar fechadas.
- Desgaseifique a mistura em um dessecador a vácuo, criando uma pressão manométrica de 100 mbar até que as bolhas de ar aprisionadas sejam removidas e ela pareça transparente. O tempo necessário para a desgaseificação é tipicamente de 30 min.
- Coloque o molde mestre (etapa 1) em uma placa de cultura de células (consulte a Tabela de Materiais). Despeje 20 g da mistura de PDMS sobre o molde mestre para produzir canais com espessura final de 5 mm.
- Asse a molde mestra a 70 °C por 2 h.
- Corte o PDMS curado ao redor do canal microfluídico (a uma distância de aproximadamente 3 mm) usando uma lâmina e, em seguida, descasque o canal microfluídico PDMS do molde mestre.
- Para criar a entrada e saída dos canais microfluídicos, faça orifícios com um punch de biópsia (diâmetro de 1,5 mm) em suas extremidades (topo dos triângulos, ver Figura 1A). Faça um furo adicional no centro do triângulo de entrada para instalar o sensor de pressão mais tarde.
- Lave uma lâmina de vidro e o canal microfluídico com uma solução de detergente a 1% disponível comercialmente (ver Tabela de Materiais) durante 5 minutos e, em seguida, enxágue-os com água deionizada. Em seguida, lavar o canal microfluídico do PDMS e a lâmina de vidro com isopropanol. Em seguida, enxágue-os novamente com água deionizada. Secar o canal microfluídico do PDMS e a lâmina de vidro com ar comprimido a 1 bar por 1 min.
OBS: A estrutura porosa do PDMS deve estar completamente seca para que a colagem seja efetiva. - Coloque a lâmina de vidro e o canal microfluídico num limpador de plasma (ver Tabela de Materiais) e certifique-se de que as superfícies a serem coladas estão viradas para cima. Ligue o limpador de plasma e trate o canal microfluídico e a lâmina de vidro com plasma de ar a um fluxo de ar de 1 SL/h (litro padrão por hora) por 1 min. Ligue o canal microfluídico à lâmina de vidro imediatamente após retirá-los do limpador, colocando-os em contato uns com os outros.
NOTA: Certifique-se de não tocar nas superfícies tratadas, pois isso pode afetar a colagem. Ao fabricar um dispositivo microfluídico com múltiplos canais microfluídicos, exponha os canais microfluídicos simultaneamente e cole-os em uma única etapa. - Colocar o dispositivo microfluídico ligado numa placa quente a 80 °C durante, pelo menos, 15 minutos.
- Armazenar o dispositivo microfluídico em uma placa de cultura de células limpa até o início do experimento.
3. Preparação da suspensão bacteriana
- Cultivar uma população de Bacillus subtilis NCIB 3610 20 h antes do início do experimento, inoculando diretamente 3 mL de meio de cultura de caldo nutriente nº 3 (ver Tabela de Materiais) a partir de um estoque congelado de glicerol em um tubo de cultura de 15 mL. Incubar numa incubadora de agitação a 30 °C e 200 rpm durante a noite (durante 16 h).
- Fazer um subcultivo a partir da cultura noturna 4 h antes do início do experimento, adicionando 3 μL da cultura noturna em 3 mL de meio de cultura fresco (diluição 1:1.000) em um tubo de cultura de 15 mL. Incubar a subcultura em uma incubadora de agitação a 30 °C a 200 rpm por 3,5-4 h para obter uma densidade óptica a 600 nm (OD600) de 0,1.
4. Experimento de crescimento de biofilme
- Ligue a incubadora da caixa do microscópio 3 h antes do experimento para garantir uma temperatura estável de 25 °C. Monte a bomba de seringa e os sensores de pressão (consulte a Tabela de Materiais).
- Conecte a tubulação de entrada e saída ao dispositivo microfluídico. Introduza directamente uma agulha (com um diâmetro exterior de 0,6 mm) no tubo de entrada para assegurar a ligação entre o tubo e a seringa.
- Colocar o dispositivo microfluídico, 30 mL de água deionizada e 30 mL de meio de cultura em um exsicador a vácuo e desgaseificá-los por pelo menos 1 h. Em seguida, puxe lentamente o meio de cultura e a água deionizada em duas seringas separadas de 30 mL.
NOTA: Esta etapa é crucial para evitar a formação de bolhas no canal durante a lavagem com o meio de cultura. - Monte o dispositivo microfluídico no microscópio e coloque a tubulação de saída em um recipiente de resíduos.
- Conecte a seringa cheia de água deionizada ao canal microfluídico através da tubulação microfluídica e injete lentamente a água até que ela saia da saída do sensor de pressão. Encha o sensor de pressão com água e lave todas as bolhas da tubulação que conecta o canal microfluídico e o sensor de pressão. Feche a saída do sensor de pressão com os parafusos dedicados ao sensor de pressão.
NOTA: O procedimento de enchimento descrito garante que as mudanças de pressão na entrada dos canais microfluídicos serão registradas com precisão. Ao executar um experimento com vários canais microfluídicos, conecte cada canal a uma seringa separada para garantir condições de fluxo iguais em todos os canais.
- Conecte a seringa cheia de água deionizada ao canal microfluídico através da tubulação microfluídica e injete lentamente a água até que ela saia da saída do sensor de pressão. Encha o sensor de pressão com água e lave todas as bolhas da tubulação que conecta o canal microfluídico e o sensor de pressão. Feche a saída do sensor de pressão com os parafusos dedicados ao sensor de pressão.
- Encha o restante do canal microfluídico com a água deionizada.
- Coloque um filtro de 1,2 μm (ver Tabela de Materiais) na seringa do meio de cultura. Em seguida, remova a seringa de água e conecte cuidadosamente a seringa do meio de cultura à tubulação microfluídica de entrada. Monte a seringa na bomba da seringa e lave o canal com o meio de cultura a uma taxa de fluxo de 2 mL/h por 1 h.
NOTA: O filtro impede que as células bacterianas entrem na seringa durante o carregamento. A lavagem do canal microfluídico com o meio de cultura removerá as bolhas remanescentes na estrutura porosa. - Ajuste a bomba de seringa na vazão desejada (aqui 1 mL/h) durante o experimento e ajuste a leitura de pressão dos sensores de pressão para zero.
NOTA: Definindo a leitura de pressão inicial para zero, somente a diferença de pressão causada pelo desenvolvimento do biofilme durante o experimento será medida. - Pipetar 1 mL da cultura bacteriana em um OD600 de 0,1 em um frasco de centrífuga de 1,5 mL. Coloque a cultura bacteriana no canal microfluídico colocando o tubo de saída no frasco da centrífuga. Depois de esperar por 5 min para remover quaisquer bolhas de ar potenciais da saída dos tubos, retirar 150 μL de solução bacteriana a uma taxa de fluxo de 1 mL/h, até que o canal microfluídico seja preenchido com a cultura bacteriana.
- Retire cuidadosamente o filtro da seringa do meio de cultura e coloque a saída no recipiente de resíduos. Deixar as células bacterianas em condições de fluxo zero no canal microfluídico por 3 h para permitir sua fixação superficial no meio poroso.
NOTA: Deixar as células bacterianas em condições de fluxo zero por 3 h foi otimizado para a fixação da cepa bacteriana utilizada, garantindo uma cultura bacteriana bem oxigenada. Outras cepas bacterianas podem exigir mais ou menos tempo. - Para iniciar o experimento, inicie o fluxo ajustando a bomba de seringa para a vazão desejada (aqui 1 mL/h) e inicie a leitura da pressão em 1 Hz.
- Adquira imagens do biofilme em crescimento no intervalo de tempo, configuração óptica e ampliação desejados.
OBS: No presente estudo, imagens em aumento de 4x no modo de campo claro em 18 posições abrangendo todo o domínio do meio poroso foram adquiridas a cada 6 min durante 24 h.
5. Análise das imagens
- Reconstruir todo o meio poroso a partir das sequências de imagens gravadas costurando as imagens das 18 posições utilizando um software de análise de imagens (ver Tabela de Materiais) e um algoritmo de costura24.
- Salve as sequências de imagens costuradas como uma sequência de imagens singulares.
Observação : se os arquivos são muito grandes, neste ponto, as imagens podem ser redimensionadas e binned para um tamanho razoável para processamento posterior. - Crie uma máscara dos pilares do meio poroso para removê-los da análise.
- Remova o fundo das imagens dividindo-as pelo fundo com a imagem obtida em t = 0 h (Figura 2A) e binarize as imagens em um limiar adequado para segmentar o biofilme (Figura 2B).
- Calcular a saturação do biofilme calculando a área coberta pelo biofilme (número de pixels atribuídos ao biofilme) em comparação com a área vazia do domínio poroso (Figura 3).
Resultados
Para o presente estudo, um dispositivo microfluídico com três canais microfluídicos paralelos com diferentes tamanhos de poros foi utilizado (Figura 1) para estudar sistematicamente a formação de biofilme em meios porosos. O processo de formação do biofilme foi visualizado por microscopia de campo claro. As células bacterianas e o biofilme apareceram nas imagens como pixels mais escuros (Figura 2). Além disso, observou-se um processo gradual de entupimento; Durante um experimento de 24 horas, o biofilme inicialmente cultivado aleatoriamente colonizou quase todo o meio poroso.
A cobertura superficial do biofilme no tempo crescido a uma vazão de Q = 1 mL/h, que corresponde a uma velocidade média inicial do fluxo de fluido de 0,96 mm/s, foi quantificada para três diferentes tamanhos de poros (75 μm, 150 μm e 300 μm) (Figura 3, linhas pretas). Verificou-se que a cobertura superficial, que foi usada como proxy para o grau de bioentupimento, ocorreu 10% mais rápido no menor tamanho de poro de 75 μm do que no maior tamanho de poro (300 μm) quando comparada a cobertura superficial em t = 20 h. Em seguida, correlacionou-se a cobertura superficial com o acúmulo de pressão causado pelo biofilme (Figura 3, linhas azuis). O entupimento no canal microfluídico de tamanho de poro menor levou a uma maior diferença de pressão entre a entrada e a saída do que nos canais microfluídicos de tamanho de poro maior, indicando que meios porosos de menor tamanho desenvolverão maior acúmulo de pressão quando submetidos ao bioentupimento.
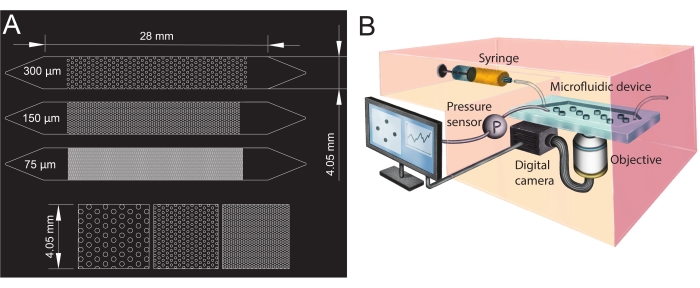
Figura 1: Projeto de canais microfluídicos e configuração experimental. (A) Fotomáscara dos canais microfluídicos com diferentes tamanhos de poros (75 μm, 150 μm e 300 μm) utilizada como análogos de meios porosos e uma visão ampliada da disposição dos pilares (fileira inferior). Os círculos mostram a localização dos pilares (obstáculos impermeáveis), representando a fase sólida do meio poroso. (B) Esquema do arranjo experimental mostrando a seringa, o sensor de pressão, o dispositivo microfluídico (com um único canal microfluídico) e o dispositivo da câmera digital com a objetiva (i.e., o microscópio). Clique aqui para ver uma versão maior desta figura.

Figura 2: Visualização e quantificação do desenvolvimento do biofilme no meio poroso. (A) Sequência de imagens representativa do desenvolvimento do biofilme na vazão imposta de Q = 1 mL/h (corresponde a uma velocidade média inicial de fluxo de fluido de 0,96 mm/s) e um tamanho de poro de d = 300 μm mostrado para os pontos de tempo experimentais t = 5 h, t = 10 h, t = 15 h e t = 20 h. As imagens de campo claro foram costuradas, e o fundo foi removido. (B) A binarização dessas imagens e a quantificação da área ocupada pelo biofilme (pixels escuros) levaram à quantificação da cobertura superficial na Figura 3. Clique aqui para ver uma versão maior desta figura.
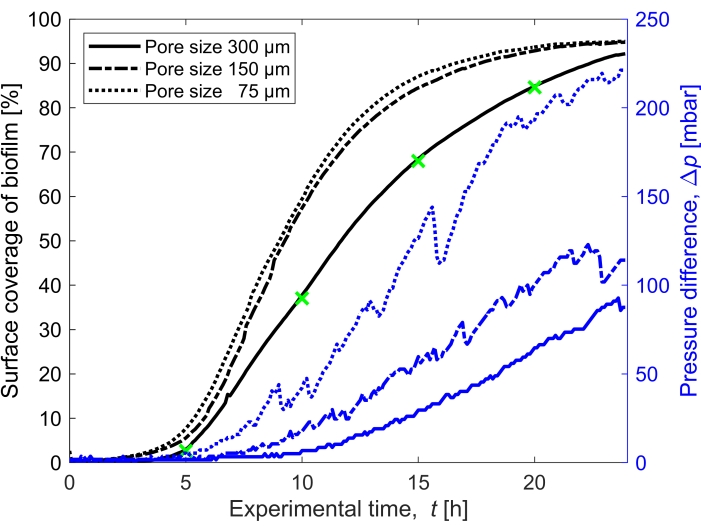
Figura 3: Evolução temporal da cobertura do biofilme e impacto na pressão. Cobertura de biofilme com leitura simultânea de pressão para os três tamanhos de poros (300 μm, 150 μm e 75 μm) nas mesmas condições experimentais da Figura 2. A diferença de pressão causada pelo biofilme no canal microfluídico do meio poroso, Δp, (linhas azuis) mostrado no eixo y direito, aumenta com o aumento da cobertura superficial do biofilme (linhas pretas). Os marcadores verdes correspondem aos pontos de dados das imagens mostradas na Figura 2. Clique aqui para ver uma versão maior desta figura.
Discussão
Análogos de meios porosos microfluídicos acoplados a sensores de pressão fornecem uma ferramenta adequada para estudar o desenvolvimento de biofilme em meios porosos. A versatilidade no projeto do meio microfluídico poroso, especificamente na disposição dos pilares, incluindo diâmetro, formas irregulares e tamanho de poros, permite a investigação de muitas geometrias. Essas geometrias variam de poros simples a obstáculos altamente complexos e irregularmente dispostos que imitam diferentes meios porosos naturais (por exemplo, solos) e industriais (por exemplo, membranas e filtros). Na presente plataforma microfluídica, três geometrias de meios porosos foram criadas com pilares cilíndricos regularmente dispostos (tamanhos de poros: 75 μm, 150 μm e 300 μm), onde a vazão de fluido pôde ser escolhida por experimento. A plataforma apresentada pode ser facilmente adaptada para estudar o bioentupimento com uma cabeça de pressão fixa em vez de uma taxa de fluxo de fluido imposta. Neste caso, o dispositivo de controle de fluxo deve ser um controlador de pressão com um reservatório de meio de cultura em vez de uma bomba de seringa. As mudanças resultantes na taxa de fluxo devido ao bioentupimento podem ser monitoradas medindo a vazão ao longo do tempo usando um sensor de vazão.
Vários pontos críticos devem ser considerados para a realização de um experimento microfluídico bem-sucedido com crescimento de biofilme. Para evitar a formação de bolhas de ar no canal microfluídico durante o experimento, o canal microfluídico e o meio de cultura foram desgaseificados (etapa 4.3). Em seguida, o preenchimento do canal microfluídico com o meio de cultura desgaseificado deve ser conduzido rapidamente, mas cuidadosamente, para obter um canal totalmente saturado, sem bolhas de ar. Caso as bolhas de ar estejam presas no meio poroso, a lavagem do canal microfluídico a uma taxa de fluxo mais alta pode remover as bolhas após um curto período de tempo. O segundo passo crucial é garantir um ambiente de temperatura constante para reproduzir o crescimento do biofilme de forma consistente. O crescimento de microrganismos varia com a temperatura 25, o que pode levar a resultados não reprodutíveis quando não se mantém a temperatura estável durante o experimento (neste caso,24 h). Para a plataforma atual, uma incubadora de caixa foi usada ao redor do microscópio, embora um invólucro menor estável à temperatura para o dispositivo microfluídico provavelmente também seria suficiente. Finalmente, durante a aquisição das imagens, as posições das imagens individuais devem ser escolhidas com sobreposição de pelo menos 15% para obter sobreposição suficiente para o algoritmo decostura24.
A plataforma microfluídica atual é limitada à observação bidimensional, enquanto aplicações em meios porosos como solo ou membranas têm uma estrutura tridimensional. No entanto, as vantagens da plataforma microfluídica quase-2D em relação às plataformas de meios porosos 3D para o estudo do bioclogging são o acesso óptico total e a alta resolução temporal, já que as plataformas 3D geralmente realizam imagens deendpoint26,27. Além disso, espera-se que o processo de bioentupimento (ou seja, a evolução temporal da cobertura superficial) persista em sistemas 3D 26,27, assim como ocorre para a distribuição de tamanho de agrupamento de uma fase imiscível dentro de meios porosos28, que apresenta a mesma escala em sistemas2D e 3D.
Este método permite medir a resposta pressórica ao crescimento do biofilme em meios porosos enquanto estuda seu desenvolvimento espaço-temporal em alta resolução temporal e espacial e diferentes tamanhos de poros. Os conjuntos de dados obtidos a partir dessas medidas trazem informações sobre a correlação do desenvolvimento de biofilme em escala de poros com as respostas de pressão do sistema biofilme-meio poroso, e podem fornecer uma referência para a modelagem numérica de biofilmes. Esses esforços de modelagem são especialmente relevantes para estender a gama de condições (por exemplo, tamanhos de poros, velocidades de fluxo e propriedades de biofilme para outras espécies ou biofilmes multiespécies) que excedem as capacidades experimentais. Este último é de grande relevância para o entendimento dos mecanismos de bioentupimento nas proximidades de poços, aplicações de biorremediação e biomineralização 29,30,31. Em geral, este método poderia ser facilmente adaptado para estudar a biomineralização ou rastrear a biotransformação de contaminantes por biofilmes em meios porosos.
Divulgações
Os autores declaram a inexistência de conflitos de interesse.
Agradecimentos
Os autores agradecem o apoio da 179834 de subvenção SNSF PRIMA (para E.S.), financiamento discricionário da ETH (para R.S.), ETH Zurich Research Grant (para R.S. e J.J.M.) e financiamento discricionário da Eawag (para J.J.M.). Os autores agradecem a Roberto Pioli pela ilustração do arranjo experimental na Figura 1B e Ela Burmeister pela preparação do wafer de silicone.
Materiais
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
Referências
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221 (2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197 (2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107 (2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116 (2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316 (2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536 (2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados