Method Article
研究多孔介质中生物堵塞的微流体平台
摘要
本协议描述了一个微流体平台,通过将高分辨率显微镜成像与同时压差测量相结合来研究 准二维多孔介质中的生物膜发展。该平台量化了多孔介质中孔径和流体流速对生物堵塞的影响。
摘要
细菌生物膜存在于几种环境和工业多孔介质中,包括土壤和过滤膜。生物膜在某些流动条件下生长并会堵塞孔隙,从而改变局部流体流动的方向。生物膜堵塞孔隙的能力,即所谓的生物堵塞,会对多孔介质的局部渗透性产生巨大影响,在系统中产生压力积聚,并影响通过它的质量流。为了了解生物膜生长与流体流动在不同物理条件下(例如,在不同的流速和孔径下)之间的相互作用,在本研究中,开发了一个微流体平台,以在外部施加的受控物理条件下使用显微镜可视化生物膜的发展。可以使用压力传感器同时测量多孔介质中生物膜引起的压力积聚,然后与生物膜的表面覆盖率相关联。所提出的平台为研究流动条件下多孔介质中生物膜引起的生物堵塞的系统方法提供了基线,并且可以适用于研究环境分离物或多物种生物膜。
引言
生物膜 - 嵌入自分泌的超聚合物物质(EPS)基质中的细菌菌落 - 在天然多孔介质中无处不在,例如土壤和含水层1,以及技术和医疗应用,例如生物修复2,水过滤3和医疗设备4。生物膜基质由多糖、蛋白质纤维和细胞外 DNA5,6 组成,并且在很大程度上取决于微生物、营养物质的可用性以及环境条件7。然而,矩阵的功能是通用的;它形成生物膜结构的支架,保护微生物群落免受机械和化学应力的影响,并且主要负责生物膜的流变特性5。
在多孔介质中,生物膜的生长会堵塞毛孔,导致所谓的生物堵塞。生物膜的形成由流体流动和孔径控制,定义为多孔介质8,9,10的两根支柱之间的距离。孔径和流体流量都控制着养分的输送和局部剪切力。反过来,生长的生物膜堵塞孔隙,影响流体11,12,13的速度分布,质量传递和多孔介质14,15的导水率。水力传导率的变化通过密闭系统中压力的增加反映出来16,17,18,19。目前生物膜开发和生物堵塞的微流体研究集中在研究均匀几何形状16,20(即具有单一孔径)或异质多孔介质12,21,22中的流速的影响。然而,为了解开流速和孔径对生物膜发育的影响以及生物堵塞多孔介质中由此产生的压力变化,需要一个高度可控和多功能的实验平台,可以并行研究不同的多孔介质几何形状和环境条件。
本研究引入了一种微流体平台,该平台将压力测量与多孔介质内不断发展的生物膜同时成像相结合。由于其透气性、生物相容性和通道几何形状设计的灵活性,由聚二甲基硅氧烷(PDMS)制成的微流体装置是研究多孔介质中生物膜发育的合适工具。微流体允许高精度地控制物理和化学条件(例如,流体流动和营养浓度),以模拟微生物栖息地的环境23.此外,微流体装置可以使用光学显微镜以微米分辨率轻松成像,并与在线测量(例如,局部压力)相结合。
在这项工作中,实验的重点是研究在受控的强加流动条件下均匀多孔介质模拟中孔径的影响。使用注射泵施加培养基的流量,并通过压力传感器同时测量通过微流体通道的压差。通过在微流体通道中播种 枯草芽孢 杆菌的浮游培养物来启动生物膜开发。对不断发展的生物膜进行定期成像和图像分析,可以在各种实验条件下获得有关表面覆盖的孔隙尺度分辨信息。压力变化和生物堵塞程度的相关信息为生物堵塞多孔介质的渗透率估计提供了重要的输入。
研究方案
1. 硅片制备
- 在计算机辅助设计(CAD;见 材料表)软件中设计微流体通道的几何形状,并将其打印到透明薄膜上以创建光掩模(图1A)。
- 按照以下步骤通过软光刻(在洁净室条件下)制造母模。
- 将硅片在200°C下烘烤2小时。
- 将晶圆放在旋涂机的中心,然后将SU8 3050光刻胶(见 材料表)倒在晶圆上。以 1,700 rpm 的速度旋转涂层 40 秒,坡道时间为 10 s/100 rpm。
注意: 旋转涂层参数设置为获得 SU8 3050 的 100 μm 目标厚度。 - 旋涂过程后,将硅片在65°C下软烘烤600秒,在95°C下软烘烤2,700秒。让晶圆在室温下冷却过夜。
注意:过夜冷却增强了SU8对晶圆的附着力。 - 将光掩模(步骤1.1)放在晶圆上并将其暴露在紫外光下,曝光能量为250 mJ / cm2 ,波长为350 nm。
- 曝光后,将暴露的基材在65°C下烘烤60秒,在95°C烘烤300秒。
- 通过将硅晶圆浸入装有mrDev600显影剂的烧杯中来开发硅晶圆以获得主模具(参见 材料表)。轻轻摇晃烧杯1,800秒以洗掉未聚合的抗蚀剂。然后,通过在硅片上喷洒异丙醇并风干来飞溅洗涤。
- 将硅晶片在200°C下硬烤1,800秒。
- 通过在真空干燥器中将20μL三氯(1H,1H,2H,2H-全氟辛基)硅烷(参见材料表)气相沉积在模具旁边的载玻片上40分钟,产生100mbar的 表压,使母模硅烷化。
2. 微流控装置的制造
注意:此处描述的制造程序适用于具有一个微流体通道的微流体装置。然而,相同的方法可以应用于制造具有多个微流控通道并联的微流控装置。
- 将弹性体与其交联剂以10:1的比例混合(参见 材料表)以制备PDMS混合物。搅拌混合物,直到它均匀混合并因封闭的气泡而变得不透明。
- 在真空干燥器中对混合物进行脱气,产生 100 mbar 的表压,直到夹留的气泡被去除并且看起来透明。脱气所需的时间通常为30分钟。
- 将母模(步骤1)放入细胞培养皿中(见 材料表)。将 20 g PDMS 混合物倒在母模上,以生产最终厚度为 5 mm 的通道。
- 将母模在70°C烘烤2小时。
- 使用刀片在微流体通道周围(距离约3mm)切割固化的PDMS,然后将PDMS微流体通道从母模上剥离。
- 为了创建微流体通道的入口和出口,在其末端(三角形顶部,见 图1A)处用活检打孔(直径为1.5毫米)。在入口三角形的中心再打一个孔,以便稍后安装压力传感器。
- 用市售的1%洗涤剂溶液(参见 材料表)洗涤载玻片和微流体通道5分钟,然后用去离子水冲洗。此后,用异丙醇洗涤PDMS微流体通道和载玻片。然后,用去离子水再次冲洗。用1巴的压缩空气干燥PDMS微流体通道和载玻片1分钟。
注意:PDMS的多孔结构必须完全干燥才能有效粘合。 - 将载玻片和微流体通道放入等离子清洁器中(参见 材料表),并确保要粘合的表面朝上。打开等离子清洁器,用空气等离子体以1 SL / h(每小时标准升)的气流处理微流体通道和载玻片1分钟。将微流体通道从清洁器中取出后,立即将它们相互接触,将它们粘合到载玻片上。
注意:确保不要接触处理过的表面,因为这可能会影响粘合。在制造具有多个微流控通道的微流控装置时,同时暴露微流控通道并将它们粘合在一个步骤中。 - 将粘合的微流体装置放在80°C热板上至少15分钟。
- 将微流体装置储存在干净的细胞培养皿中,直到实验开始。
3.细菌悬浮液的制备
- 在实验开始前20小时培养枯 草芽孢杆菌 NCIB 3610群体,方法是直接从15mL培养管中的冷冻甘油原液中接种3mL营养肉汤3号培养基(参见 材料表)。在振荡培养箱中以30°C和200rpm孵育过夜(16小时)。
- 在实验开始前 4 小时从过夜培养物中制备传代培养物,方法是在 15 mL 培养管中的 3 mL 新鲜培养基(1:1,000 稀释度)中加入 3 μL 过夜培养物。将传代培养物在30°C的振荡培养箱中以200rpm孵育3.5-4小时,以获得600nm处的光密度(OD600)为0.1。
4. 生物膜生长实验
- 在实验前3小时打开显微镜的箱式培养箱,以确保温度稳定在25°C。 安装注射泵和压力传感器(见 材料表)。
- 将入口和出口管连接到微流体装置。直接将针头(外径为0.6毫米)插入入口管中,以确保管子和注射器之间的连接。
- 将微流体装置,30mL去离子水和30mL培养基置于真空干燥器中并脱气至少1小时。然后,缓慢地将培养基和去离子水拉入两个单独的 30 mL 注射器中。
注意:此步骤对于防止在使用培养基冲洗时在通道中形成气泡至关重要。 - 将微流体装置安装在显微镜上,并将出口管放入废物容器中。
- 通过微流体管将装满去离子水的注射器连接到微流体通道,然后缓慢注入水,直到水从压力传感器出口流出。用水填充压力传感器,并冲洗连接微流体通道和压力传感器的管道中的所有气泡。用专用于压力传感器的螺钉关闭压力传感器的出口。
注意:所描述的填充程序可确保精确记录微流体通道入口处的压力变化。当使用多个微流体通道进行实验时,将每个通道连接到单独的注射器,以确保所有通道中的流动条件相同。
- 通过微流体管将装满去离子水的注射器连接到微流体通道,然后缓慢注入水,直到水从压力传感器出口流出。用水填充压力传感器,并冲洗连接微流体通道和压力传感器的管道中的所有气泡。用专用于压力传感器的螺钉关闭压力传感器的出口。
- 用去离子水填充微流体通道的其余部分。
- 在培养基注射器上放置1.2μm过滤器(见 材料表)。然后,取出水注射器并小心地将培养基注射器连接到入口微流体管。将注射器安装在注射泵上,并以2mL / h的流速用培养基冲洗通道1小时。
注意:过滤器可防止细菌细胞在装载过程中进入注射器。用培养基冲洗微流体通道将去除多孔结构中剩余的气泡。 - 在实验过程中将注射泵设置为所需的流速(此处为1 mL / h),并将压力传感器的压力读数设置为零。
注意:通过将初始压力读数设置为零,将仅测量实验期间由生物膜发育引起的压力差。 - 在 1.5 mL 离心瓶中以 OD600 的 0.1 吸取 1 mL 细菌培养物。通过将出口管放入离心机小瓶中,将细菌培养物加载到微流体通道中。等待 5 分钟以去除管出口中的任何潜在气泡后,以 1 mL/h 的流速提取 150 μL 细菌溶液,直到微流体通道充满细菌培养物。
- 小心地取出培养基注射器过滤器并将出口放入废物容器中。将细菌细胞在微流体通道中的零流条件下放置3小时,以允许它们在多孔介质中的表面附着。
注意:将细菌细胞置于零流量条件下3小时,针对所用细菌菌株的附着进行了优化,同时确保氧合良好的细菌培养物。其他细菌菌株可能需要或多或少的时间。 - 要开始实验,通过将注射泵设置为所需的流速(此处为1 mL / h)来启动流量,并以1 Hz开始压力读数。
- 以所需的时间间隔、光学配置和放大倍率获取生长生物膜的图像。
注意:在本研究中,每6分钟采集一次4倍放大倍率的图像,在明场模式下跨越多孔介质的整个域的18个位置,持续24小时。
5. 图像分析
- 通过使用图像分析软件(参见 材料表)和拼接算法24,从18个位置拼接图像,从记录的图像序列重建整个多孔介质。
- 将拼接的图像序列另存为单个图像序列。
注意:如果文件太大,此时可以将图像重新缩放并装箱为合理的大小以进行进一步处理。 - 创建多孔介质支柱的掩码以将其从分析中移除。
- 通过将图像的背景除以背景与在t = 0小时拍摄的图像(图2A)来去除图像的背景,并在适合分割生物膜的阈值下将图像二值化(图2B)。
- 通过计算生物膜覆盖的面积(归因于生物膜的像素数)与多孔域的空隙面积(图3)相比,计算生物膜的饱和度。
结果
在本研究中,使用具有三个具有不同孔径的平行微流控通道的微流控装置(图1)系统地研究多孔介质中生物膜的形成。使用明场显微镜可视化生物膜形成过程。细菌细胞和生物膜在图像中显示为较暗的像素(图2)。此外,观察到逐渐堵塞的过程;在24小时的实验中,最初随机生长的生物膜定植了几乎整个多孔介质。
在 Q = 1 mL / h的流速下,生物膜的表面覆盖率在时间上生长,对应于0.96 mm / s的平均初始流体流速,针对三种不同的孔径(75 μm,150 μm和300 μm)进行了量化(图3,黑线)。结果发现,在 t = 20 h时比较表面覆盖率时,用作生物堵塞程度代表的表面覆盖率在最小孔径75μm处比在最大孔径(300μm)下发生快10%。然后,表面覆盖率与生物膜引起的压力积聚相关(图3,蓝线)。与孔径较大的微流控通道相比,孔径较小的微流控通道中的堵塞导致入口和出口之间的压差更高,表明较小的多孔介质在受到生物堵塞时会产生更高的压力积聚。
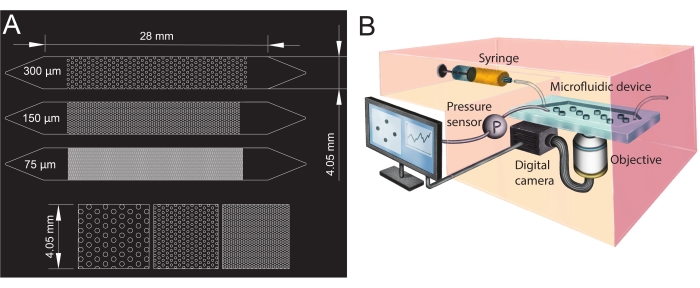
图1:微流体通道设计和实验设置。 (A)具有不同孔径(75μm,150μm和300μm)的微流体通道的光掩模用作多孔介质类似物和柱子排列的放大视图(底行)。圆圈表示柱子(不透水障碍物)的位置,代表多孔介质的固相。(B)显示注射器,压力传感器,微流体装置(具有单个微流体通道)和带物镜的数码相机设置(即显微镜)的实验装置示意图。 请点击此处查看此图的大图。

图 2:多孔介质中生物膜发育的可视化和量化。 (A)在施加流速Q = 1 mL / h(对应于0.96 mm / s的平均初始流体流速)和孔径d = 300μm的施加流速下生物膜发育的代表性图像序列,显示实验时间点t = 5小时, t = 10 小时,t = 15 小时,t = 20 小时。拼接明场图像,并去除背景。(B)这些图像的二值化和生物膜所占区域(暗像素)的量化导致了图3中表面覆盖率的量化。请点击此处查看此图的大图。
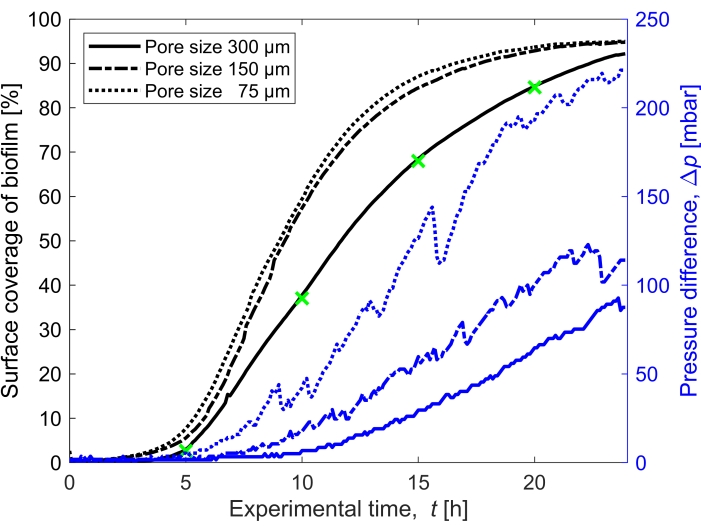
图3:生物膜覆盖率的时间演变和对压力的影响。 在 与图2相同的实验条件下,三种孔径(300 μm、150 μm和75 μm)同时压力读数的生物膜覆盖。由多孔介质微流体通道中的生物膜引起的压差Δp(右Y轴上显示的蓝线)随着生物膜表面覆盖率的增加而增加(黑线)。绿色标记对应于 图2所示图像的数据点。 请点击此处查看此图的大图。
讨论
微流体多孔介质类似物与压力传感器相结合,为研究多孔介质中的生物膜发展提供了合适的工具。微流体多孔介质设计的多功能性,特别是柱子的排列,包括直径、不规则形状和孔径,允许研究许多几何形状。这些几何形状的范围从单个孔隙到高度复杂、不规则排列的障碍物,模仿不同的自然(例如土壤)和工业(例如膜和过滤器)多孔介质。在目前的微流体平台中,创建了三种多孔介质几何形状,这些几何形状具有规则排列的圆柱形柱(孔径:75μm,150μm和300μm),每个实验可以选择流体流速。所提出的平台可以很容易地适应使用固定压力头而不是施加的流体流速来研究生物堵塞。在这种情况量控制装置应该是带有培养基储液器的压力控制器,而不是注射泵。通过使用流速传感器测量流出量,可以监测由于生物堵塞引起的流速变化。
要成功运行生物膜生长的微流体实验,必须考虑几个关键点。为避免在实验过程中微流控通道中形成气泡,对微流控通道和培养基进行脱气(步骤4.3)。接下来,必须快速但小心地用脱气培养基填充微流体通道,以获得没有任何气泡的完全饱和通道。如果气泡被困在多孔介质中,以较高的流速冲洗微流体通道可以在短时间内去除气泡。第二个关键步骤是确保恒温环境以一致地再现生物膜生长。微生物的生长随温度25而变化,当在实验过程中未保持温度稳定(在这种情况下为24小时)时,这可能会导致不可重复的结果。对于目前的平台,在显微镜周围使用了一个箱式培养箱,尽管用于微流体装置的较小温度稳定的外壳也可能就足够了。最后,在图像采集过程中,应选择重叠至少15%的单个图像的位置,以获得足够的重叠,以便拼接算法24。
目前的微流体平台仅限于二维观察,而土壤或膜等多孔介质应用具有三维结构。然而,与研究生物堵塞的3D多孔介质平台相比,准2D微流控平台的优势在于全光学通道和高时间分辨率,因为3D平台通常执行端点成像26,27。此外,预计生物堵塞过程(即表面覆盖的时间演变)在3D系统26,27中持续存在,因为它也发生在多孔介质28内不混溶相的簇大小分布中,这在2D和3D系统中呈现相同的缩放。
该方法允许测量对多孔介质中生物膜生长的压力响应,同时在高时间和空间分辨率以及不同孔径下研究其时空发展。从这些测量中获得的数据集可以深入了解孔隙尺度生物膜发育与生物膜多孔介质系统的压力响应的相关性,并为生物膜的数值建模提供基准。这些建模工作对于扩展超出实验能力的条件范围(例如,孔径、流速和其他物种或多物种生物膜的生物膜特性)特别相关。后者与理解井附近生物堵塞的机制、生物修复应用和生物矿化高度相关29,30,31。总体而言,该方法可以很容易地用于研究生物矿化或跟踪多孔介质中生物膜对污染物的生物转化。
披露声明
作者声明不存在利益冲突。
致谢
作者感谢SNSF PRIMA赠款179834(给E.S.),ETH(给RS),苏黎世联邦理工学院研究基金(给R.S.和J.J.M.)的酌情资助,以及Eawag(给J.J.M.)的酌情资助。作者要感谢Roberto Pioli在 图1B 中说明实验设置,并感谢Ela Burmeister用于硅晶圆制备。
材料
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
参考文献
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221(2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197(2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107(2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116(2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316(2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536(2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。