Method Article
Une plateforme microfluidique pour étudier le biocolmatage en milieu poreux
Dans cet article
Résumé
Le présent protocole décrit une plateforme microfluidique pour étudier le développement de biofilms dans des milieux poreux quasi-2D en combinant l’imagerie microscopique à haute résolution avec des mesures simultanées de différence de pression. La plateforme quantifie l’influence de la taille des pores et des débits de fluide dans les milieux poreux sur le biocolmatage.
Résumé
Les biofilms bactériens se trouvent dans plusieurs milieux poreux environnementaux et industriels, y compris les sols et les membranes de filtration. Les biofilms se développent dans certaines conditions d’écoulement et peuvent obstruer les pores, redirigeant ainsi l’écoulement local du fluide. La capacité des biofilms à obstruer les pores, ce qu’on appelle le biocolmatage, peut avoir un effet considérable sur la perméabilité locale du milieu poreux, créant une accumulation de pression dans le système et ayant un impact sur le flux massique qui le traverse. Pour comprendre l’interaction entre la croissance du biofilm et l’écoulement du fluide dans différentes conditions physiques (p. ex., à différentes vitesses d’écoulement et tailles de pores), dans la présente étude, une plateforme microfluidique est développée pour visualiser le développement du biofilm à l’aide d’un microscope dans des conditions physiques contrôlées imposées de l’extérieur. L’accumulation de pression induite par le biofilm dans le milieu poreux peut être mesurée simultanément à l’aide de capteurs de pression et, plus tard, corrélée avec la couverture de surface du biofilm. La plateforme présentée fournit une base de référence pour une approche systématique visant à étudier le biocolmatage causé par les biofilms dans les milieux poreux dans des conditions d’écoulement et peut être adaptée à l’étude d’isolats environnementaux ou de biofilms multi-espèces.
Introduction
Les biofilms - colonies bactériennes intégrées dans une matrice autosécrétée de substances extra-polymères (PSE) - sont omniprésents dans les milieux poreux naturels, tels que les sols et les aquifères1, et les applications techniques et médicales, telles que la bioremédiation2, la filtration de l’eau3 et les dispositifs médicaux4. La matrice du biofilm est composée de polysaccharides, de fibres protéiques et d’ADN extracellulaire5,6, et dépend fortement des micro-organismes, de la disponibilité des nutriments, ainsi que des conditions environnementales7. Pourtant, les fonctions de la matrice sont universelles; Il forme l’échafaudage de la structure du biofilm, protège la communauté microbienne des contraintes mécaniques et chimiques et est en grande partie responsable des propriétés rhéologiques des biofilms5.
Dans les milieux poreux, la croissance de biofilms peut obstruer les pores, provoquant ce qu’on appelle le biocolmatage. Le développement du biofilm est contrôlé par l’écoulement du fluide et la taille des pores, définis comme la distance séparant deux piliers, du milieu poreux 8,9,10. La taille des pores et l’écoulement du fluide contrôlent le transport des nutriments et les forces de cisaillement locales. À son tour, le biofilm en croissance obstrue les pores, affectant la distribution de vitesse du fluide 11,12,13, le transport de masse et la conductivité hydraulique du milieu poreux 14,15. Les changements de conductivité hydraulique se traduisent par une augmentation de la pression dans les systèmes confinés16,17,18,19. Les études microfluidiques actuelles sur le développement de biofilms et le biocolmatage se concentrent sur l’étude de l’impact des vitesses d’écoulement dans des géométries homogènes16,20 (c’est-à-dire avec une taille de pores singulière) ou des milieux poreux hétérogènes12,21,22. Cependant, pour démêler les effets des débits et de la taille des pores sur le développement du biofilm et les changements de pression qui en résultent dans le milieu poreux biobouché, une plate-forme expérimentale hautement contrôlable et polyvalente permettant l’étude de différentes géométries de milieux poreux et conditions environnementales en parallèle est nécessaire.
La présente étude présente une plateforme microfluidique qui combine des mesures de pression avec l’imagerie simultanée du biofilm en évolution dans le milieu poreux. En raison de sa perméabilité aux gaz, de sa biocompatibilité et de sa flexibilité dans la conception de la géométrie du canal, un dispositif microfluidique en polydiméthylsiloxane (PDMS) est un outil approprié pour étudier le développement de biofilms dans des milieux poreux. La microfluidique permet de contrôler les conditions physiques et chimiques (p. ex., l’écoulement des fluides et la concentration en éléments nutritifs) avec une grande précision pour imiter l’environnement des habitats microbiens23. De plus, les dispositifs microfluidiques peuvent facilement être imagés avec une résolution micrométrique à l’aide d’un microscope optique et couplés à des mesures en ligne (par exemple, la pression locale).
Dans ce travail, les expériences se concentrent sur l’étude de l’impact de la taille des pores dans un milieu poreux homogène analogue dans des conditions d’écoulement imposé contrôlé. Le débit d’un milieu de culture est imposé à l’aide d’une pompe à seringue et la différence de pression à travers le canal microfluidique est mesurée simultanément avec des capteurs de pression. Le développement du biofilm est initié par l’ensemencement d’une culture planctonique de Bacillus subtilis dans le canal microfluidique. L’imagerie régulière du biofilm en évolution et l’analyse d’images permettent d’obtenir des informations résolues à l’échelle des pores sur la couverture de surface dans diverses conditions expérimentales. Les informations corrélées sur le changement de pression et l’étendue du biocolmatage fournissent des données cruciales pour les estimations de la perméabilité des milieux poreux bioobstrués.
Protocole
1. Préparation de plaquettes de silicium
- Concevoir les géométries du canal microfluidique dans un logiciel de conception assistée par ordinateur (CAO; voir Tableau des matériaux) et l’imprimer sur un film transparent pour créer le photomasque (Figure 1A).
- Fabriquez le moule maître par lithographie douce (dans des conditions de salle blanche) en suivant les étapes ci-dessous.
- Cuire la plaquette de silicium à 200 °C pendant 2 h.
- Placez la plaquette au centre d’une centrifugne et versez la résine photosensible SU8 3050 (voir Tableau des matériaux) sur la plaquette. Spin coat à 1 700 tr/min pendant 40 s avec un temps de rampe de 10 s/100 tr/min.
NOTE: Les paramètres de spin-coating ont été réglés pour obtenir une épaisseur cible de 100 μm pour le SU8 3050. - Après le processus de spin-coating, cuire doucement la plaquette de silicium à 65 °C pendant 600 s et 95 °C pendant 2 700 s. Laissez la gaufrette refroidir à température ambiante pendant la nuit.
REMARQUE: Le refroidissement de nuit améliore l’adhérence du SU8 à la plaquette. - Placez le photomasque (étape 1.1) sur la plaquette et exposez-le à la lumière UV, avec une énergie d’exposition de 250 mJ/cm2 et à une longueur d’onde de 350 nm.
- Après exposition, cuire le substrat exposé à 65 °C pendant 60 s et à 95 °C pendant 300 s.
- Développer la plaquette de silicium pour obtenir le moule maître en l’immergeant dans un bécher rempli de révélateur mrDev600 (voir Tableau des matériaux). Secouez doucement le bécher pendant 1 800 s pour laver la résistance non polymérisée. Ensuite, lavez par éclaboussures en pulvérisant de l’isopropanol sur la plaquette de silicium et séchez-la à l’air.
- Cuire dur la plaquette de silicium à 200 °C pendant 1 800 s.
- Silaniser le moule maître par dépôt en phase vapeur de 20 μL de trichloro (1H, 1H, 2H, 2H-perfluorooctyl) silane (voir Tableau des matériaux) placé sur une lame de verre à côté du moule pendant 40 minutes dans un dessiccateur sous vide, créant une pression manométrique de 100 mbar.
2. Fabrication du dispositif microfluidique
REMARQUE: La procédure de fabrication décrite ici concerne un dispositif microfluidique avec un canal microfluidique. Cependant, la même méthode peut être appliquée pour fabriquer un dispositif microfluidique avec plusieurs canaux microfluidiques en parallèle.
- Mélanger l’élastomère avec son agent de réticulation dans un rapport de 10:1 (voir le tableau des matériaux) pour préparer un mélange PDMS. Remuez le mélange jusqu’à ce qu’il soit uniformément mélangé et devienne opaque en raison des bulles d’air enfermées.
- Dégazez le mélange dans un dessiccateur sous vide, créant une pression manométrique de 100 mbar jusqu’à ce que les bulles d’air emprisonnées soient éliminées et qu’il semble transparent. Le temps nécessaire au dégazage est généralement de 30 min.
- Placer le moule maître (étape 1) dans une boîte de culture cellulaire (voir Tableau des matériaux). Verser 20 g du mélange PDMS sur le moule maître pour obtenir des canaux d’une épaisseur finale de 5 mm.
- Cuire le moule maître à 70 °C pendant 2 h.
- Coupez le PDMS durci autour du canal microfluidique (à une distance d’environ 3 mm) à l’aide d’une lame, puis décollez le canal microfluidique PDMS du moule maître.
- Pour créer l’entrée et la sortie des canaux microfluidiques, percez des trous avec un poinçon de biopsie (diamètre de 1,5 mm) à ses extrémités (sommet des triangles, voir Figure 1A). Percez un trou supplémentaire au centre du triangle d’entrée pour installer le capteur de pression plus tard.
- Laver une lame de verre et le canal microfluidique avec une solution détergente à 1 % disponible dans le commerce (voir le tableau des matières) pendant 5 min, puis les rincer à l’eau désionisée. Ensuite, lavez le canal microfluidique PDMS et la lame de verre avec de l’isopropanol. Ensuite, rincez-les à nouveau à l’eau désionisée. Sécher le canal microfluidique PDMS et la lame de verre avec de l’air comprimé à 1 bar pendant 1 min.
REMARQUE: La structure poreuse du PDMS doit être complètement sèche pour que la liaison soit efficace. - Placez la lame de verre et le canal microfluidique dans un nettoyant plasma (voir le tableau des matériaux) et assurez-vous que les surfaces à coller sont orientées vers le haut. Allumez le nettoyant plasma et traitez le canal microfluidique et la lame de verre avec du plasma d’air à un débit d’air de 1 SL / h (litre standard par heure) pendant 1 min. Collez le canal microfluidique à la lame de verre immédiatement après les avoir sortis du nettoyant en les mettant en contact les uns avec les autres.
REMARQUE: Assurez-vous de ne pas toucher les surfaces traitées, car cela pourrait affecter le collage. Lors de la fabrication d’un dispositif microfluidique avec plusieurs canaux microfluidiques, exposez les canaux microfluidiques simultanément et collez-les en une seule étape. - Placer le dispositif microfluidique collé sur une plaque chauffante à 80 °C pendant au moins 15 min.
- Stockez le dispositif microfluidique dans une boîte de culture cellulaire propre jusqu’au début de l’expérience.
3. Préparation de la suspension bactérienne
- Cultiver une population de Bacillus subtilis NCIB 3610 20 h avant le début de l’expérience en inoculant directement 3 mL de bouillon nutritif no 3 milieu de culture (voir le tableau des matières) à partir d’un stock de glycérol congelé dans un tube de culture de 15 mL. Incuber dans un incubateur à agitation à 30 °C et 200 tr/min pendant une nuit (pendant 16 h).
- Faire une sous-culture à partir de la culture de nuit 4 h avant le début de l’expérience en ajoutant 3 μL de la culture de nuit dans 3 mL de milieu de culture frais (dilution de 1:1 000) dans un tube de culture de 15 mL. Incuber la sous-culture dans un incubateur à agitation à 30 °C à 200 tr/min pendant 3,5-4 h pour obtenir une densité optique à 600 nm (OD600) de 0,1.
4. Expérience de croissance du biofilm
- Allumez l’incubateur du microscope 3 h avant l’expérience pour assurer une température stable de 25 °C. Montez la pompe à seringue et les capteurs de pression (voir le tableau des matériaux).
- Connectez le tube d’entrée et de sortie au dispositif microfluidique. Insérez directement une aiguille (d’un diamètre extérieur de 0,6 mm) dans le tube d’entrée pour fixer la connexion entre le tube et la seringue.
- Placez le dispositif microfluidique, 30 mL d’eau désionisée et 30 mL de milieu de culture dans un dessiccateur sous vide et dégazez-les pendant au moins 1 h. Ensuite, tirez lentement le milieu de culture et l’eau désionisée dans deux seringues distinctes de 30 mL.
REMARQUE: Cette étape est cruciale pour empêcher la formation de bulles dans le canal lors du rinçage avec le milieu de culture. - Montez le dispositif microfluidique sur le microscope et placez le tube de sortie dans un conteneur à déchets.
- Connectez la seringue remplie d’eau désionisée au canal microfluidique à travers le tube microfluidique et injectez lentement l’eau jusqu’à ce qu’elle sorte de la sortie du capteur de pression. Remplissez le capteur de pression avec de l’eau et rincez toutes les bulles du tube reliant le canal microfluidique et le capteur de pression. Fermez la sortie du capteur de pression avec les vis dédiées au capteur de pression.
NOTE: La procédure de remplissage décrite garantit que les changements de pression à l’entrée des canaux microfluidiques seront enregistrés avec précision. Lors de l’exécution d’une expérience avec plusieurs canaux microfluidiques, connectez chaque canal à une seringue distincte pour garantir des conditions d’écoulement égales dans tous les canaux.
- Connectez la seringue remplie d’eau désionisée au canal microfluidique à travers le tube microfluidique et injectez lentement l’eau jusqu’à ce qu’elle sorte de la sortie du capteur de pression. Remplissez le capteur de pression avec de l’eau et rincez toutes les bulles du tube reliant le canal microfluidique et le capteur de pression. Fermez la sortie du capteur de pression avec les vis dédiées au capteur de pression.
- Remplissez le reste du canal microfluidique avec l’eau désionisée.
- Placez un filtre de 1,2 μm (voir le tableau des matériaux) sur la seringue du milieu de culture. Ensuite, retirez la seringue à eau et connectez soigneusement la seringue du milieu de culture au tube microfluidique d’entrée. Montez la seringue sur la pompe à seringue et rincez le canal avec le milieu de culture à un débit de 2 mL/h pendant 1 h.
REMARQUE: Le filtre empêche les cellules bactériennes de pénétrer dans la seringue pendant le chargement. Le rinçage du canal microfluidique avec le milieu de culture éliminera les bulles restantes dans la structure poreuse. - Réglez la pompe de la seringue au débit souhaité (ici 1 mL/h) pendant l’expérience et réglez la lecture de pression des capteurs de pression à zéro.
REMARQUE: En réglant la lecture de pression initiale à zéro, seule la différence de pression causée par le développement du biofilm pendant l’expérience sera mesurée. - Pipeter 1 mL de la culture bactérienne à une DO600 de 0,1 dans un flacon de centrifugeuse de 1,5 mL. Chargez la culture bactérienne dans le canal microfluidique en plaçant le tube de sortie dans le flacon de centrifugeuse. Après avoir attendu 5 minutes pour éliminer les bulles d’air potentielles de la sortie des tubes, prélever 150 μL de solution bactérienne à un débit de 1 mL/h, jusqu’à ce que le canal microfluidique soit rempli de la culture bactérienne.
- Retirez délicatement le filtre de la seringue du milieu de culture et placez la sortie dans le conteneur à déchets. Laisser les cellules bactériennes à écoulement nul dans le canal microfluidique pendant 3 h pour permettre leur fixation à la surface dans le milieu poreux.
NOTE: Laisser les cellules bactériennes à des conditions d’écoulement nul pendant 3 h a été optimisé pour la fixation de la souche bactérienne utilisée tout en assurant une culture bactérienne bien oxygénée. D’autres souches bactériennes peuvent nécessiter plus ou moins de temps. - Pour commencer l’expérience, démarrez le débit en réglant la pompe de la seringue sur le débit souhaité (ici 1 mL/h) et commencez la lecture de pression à 1 Hz.
- Acquérir des images du biofilm en croissance à l’intervalle de temps, à la configuration optique et au grossissement souhaités.
NOTE: Dans la présente étude, des images à grossissement 4x en mode champ clair dans 18 positions couvrant tout le domaine du milieu poreux ont été acquises toutes les 6 minutes pendant 24 heures.
5. Analyse d’images
- Reconstruire l’ensemble du support poreux à partir des séquences d’images enregistrées en assemblant les images à partir des 18 positions à l’aide d’un logiciel d’analyse d’images (voir Tableau des matériaux) et d’un algorithme d’assemblage 24.
- Enregistrez les séquences d’images assemblées en tant que séquence d’images singulières.
REMARQUE: Si les fichiers sont trop volumineux, à ce stade, les images peuvent être redimensionnées et regroupées à une taille raisonnable pour un traitement ultérieur. - Créez un masque des piliers du milieu poreux pour les retirer de l’analyse.
- Supprimer l’arrière-plan des images en les divisant par leur arrière-plan avec l’image prise à t = 0 h (Figure 2A) et binariser les images à un seuil adapté à la segmentation du biofilm (Figure 2B).
- Calculer la saturation du biofilm en calculant la surface couverte par le biofilm (nombre de pixels attribués au biofilm) par rapport à la zone vide du domaine poreux (Figure 3).
Résultats
Pour la présente étude, un dispositif microfluidique avec trois canaux microfluidiques parallèles avec différentes tailles de pores a été utilisé (Figure 1) pour étudier systématiquement la formation de biofilm dans des milieux poreux. Le processus de formation du biofilm a été visualisé à l’aide de la microscopie à fond clair. Les cellules bactériennes et le biofilm sont apparus dans les images sous forme de pixels plus foncés (Figure 2). De plus, un processus de colmatage progressif a été observé; Au cours d’une expérience de 24 heures, le biofilm initialement cultivé au hasard a colonisé presque tout le milieu poreux.
La couverture de surface du biofilm dans le temps cultivé à un débit de Q = 1 mL/h, ce qui correspond à une vitesse initiale moyenne d’écoulement du fluide de 0,96 mm/s, a été quantifiée pour trois tailles de pores différentes (75 μm, 150 μm et 300 μm) (Figure 3, lignes noires). Il a été constaté que la couverture de surface, qui a été utilisée comme approximation du degré de biocolmatage, s’est produite 10% plus rapidement à la plus petite taille de pores de 75 μm qu’à la plus grande taille de pores (300 μm) en comparant la couverture de surface à t = 20 h. Ensuite, la couverture de surface a été corrélée à l’accumulation de pression causée par le biofilm (Figure 3, lignes bleues). Le colmatage dans le canal microfluidique de plus petite taille de pores a entraîné une différence de pression plus élevée entre l’entrée et la sortie que dans les canaux microfluidiques de plus grande taille de pores, ce qui indique que les milieux poreux de plus petite taille développeront une accumulation de pression plus élevée lorsqu’ils sont soumis à un biocolmatage.
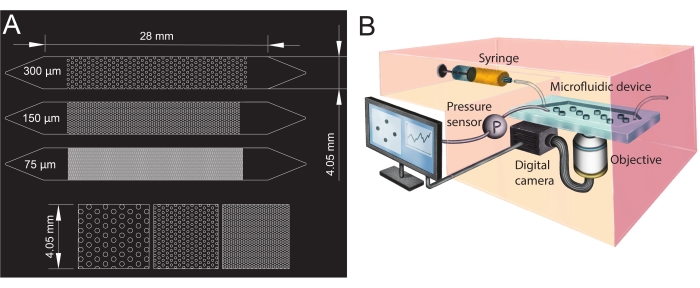
Figure 1 : Conception des canaux microfluidiques et configuration expérimentale. (A) Photomasque des canaux microfluidiques de différentes tailles de pores (75 μm, 150 μm et 300 μm) utilisés comme analogues de milieux poreux et vue zoomée de la disposition des piliers (rangée du bas). Les cercles montrent l’emplacement des piliers (obstacles imperméables), représentant la phase solide du milieu poreux. (B) Schéma de la configuration expérimentale montrant la seringue, le capteur de pression, le dispositif microfluidique (avec un seul canal microfluidique) et la configuration de la caméra numérique avec l’objectif (c.-à-d. le microscope). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Visualisation et quantification du développement du biofilm dans le milieu poreux. (A) Séquence d’images représentative du développement du biofilm au débit imposé de Q = 1 mL/h (correspond à une vitesse initiale moyenne d’écoulement du fluide de 0,96 mm/s) et une taille de pores de d = 300 μm montrée pour les points temporels expérimentaux t = 5 h, t = 10 h, t = 15 h et t = 20 h . Les images en champ clair ont été assemblées et l’arrière-plan a été supprimé. (B) La binarisation de ces images et la quantification de la surface occupée par le biofilm (pixels foncés) ont conduit à la quantification de la couverture de surface de la figure 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
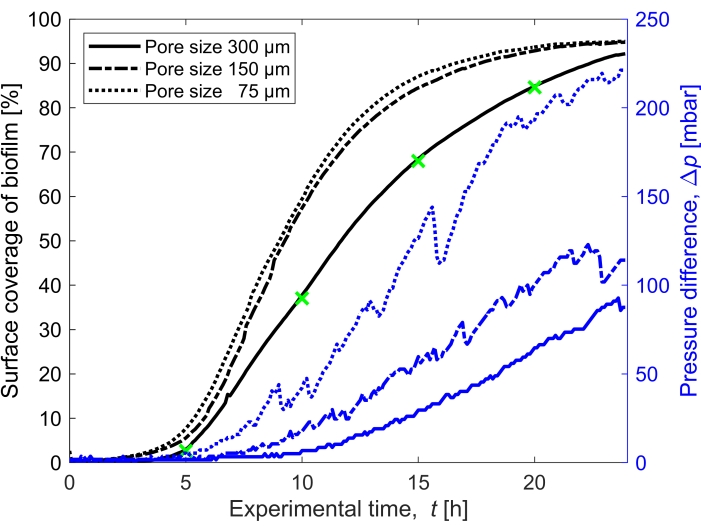
Figure 3 : Évolution temporelle de la couverture du biofilm et impact sur la pression. Couverture du biofilm avec lecture simultanée de la pression pour les trois tailles de pores (300 μm, 150 μm et 75 μm) dans les mêmes conditions expérimentales que la figure 2. La différence de pression causée par le biofilm dans le canal microfluidique du milieu poreux, Δp, (lignes bleues) montrées sur l’axe des y droit, augmente avec une couverture de surface accrue du biofilm (lignes noires). Les marqueurs verts correspondent aux points de données des images illustrées à la figure 2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les analogues de milieux poreux microfluidiques couplés à des capteurs de pression fournissent un outil approprié pour étudier le développement du biofilm dans les milieux poreux. La polyvalence dans la conception du milieu poreux microfluidique, en particulier la disposition des piliers, y compris le diamètre, les formes irrégulières et la taille des pores, permet l’étude de nombreuses géométries. Ces géométries vont des pores simples aux obstacles très complexes et disposés de manière irrégulière imitant différents milieux poreux naturels (p. ex., sols) et industriels (p. ex., membranes et filtres). Dans la plate-forme microfluidique actuelle, trois géométries de milieux poreux ont été créées avec des piliers cylindriques disposés régulièrement (tailles de pores: 75 μm, 150 μm et 300 μm), où le débit de fluide pouvait être choisi par expérience. La plate-forme présentée peut être facilement adaptée pour étudier le biocolmatage avec une tête de pression fixe plutôt qu’un débit de fluide imposé. Dans ce cas, le dispositif de contrôle de débit doit être un régulateur de pression avec un réservoir de milieu de culture au lieu d’une pompe à seringue. Les changements de débit qui en résultent en raison du biocolmatage pourraient être surveillés en mesurant le débit sortant au fil du temps à l’aide d’un capteur de débit.
Plusieurs points critiques doivent être pris en compte pour mener à bien une expérience microfluidique avec la croissance du biofilm. Pour éviter la formation de bulles d’air dans le canal microfluidique pendant l’expérience, le canal microfluidique et le milieu de culture ont été dégazés (étape 4.3). Ensuite, le remplissage du canal microfluidique avec le milieu de culture dégazé doit être effectué rapidement mais avec précaution pour obtenir un canal complètement saturé sans bulles d’air. Dans le cas où des bulles d’air sont piégées dans le milieu poreux, le rinçage du canal microfluidique à un débit plus élevé peut éliminer les bulles après un court laps de temps. La deuxième étape cruciale consiste à assurer un environnement à température constante pour reproduire la croissance du biofilm de manière cohérente. La croissance des micro-organismes varie avec la température 25, ce qui peut conduire à des résultats non reproductibles lorsque la température n’est pas stable pendant l’expérience (dans ce cas,24 h). Pour la plate-forme actuelle, un incubateur à boîte a été utilisé autour du microscope, bien qu’un boîtier plus petit et stable à la température pour le dispositif microfluidique serait probablement suffisant aussi. Enfin, lors de l’acquisition de l’image, les positions des images individuelles doivent être choisies avec un chevauchement d’au moins 15% pour obtenir un chevauchement suffisant pour l’algorithme d’assemblage24.
La plate-forme microfluidique actuelle est limitée à l’observation bidimensionnelle, alors que les applications de milieux poreux comme le sol ou les membranes ont une structure tridimensionnelle. Cependant, les avantages de la plate-forme microfluidique quasi-2D par rapport aux plates-formes de milieux poreux 3D pour étudier le biocolmatage sont l’accès optique complet et la résolution temporelle élevée, car les plates-formes 3D effectuent généralement l’imagerie des pointsde terminaison 26,27. En outre, on s’attend à ce que le processus de biocolmatage (c’est-à-dire l’évolution temporelle de la couverture de surface) persiste dans les systèmes 3D 26,27, comme il se produit également pour la distribution de la taille des grappes d’une phase non miscible dans les milieux poreux28, qui présente la même échelle dans les systèmes2D et 3D.
Cette méthode permet de mesurer la réponse en pression à la croissance du biofilm dans les milieux poreux tout en étudiant son développement spatio-temporel à haute résolution temporelle et spatiale et différentes tailles de pores. Les ensembles de données obtenus à partir de ces mesures permettent de mieux comprendre la corrélation entre le développement du biofilm à l’échelle interstitielle et les réponses à la pression du système de milieu poreux du biofilm, et peuvent fournir une référence pour la modélisation numérique des biofilms. Ces efforts de modélisation sont particulièrement pertinents pour élargir la gamme de conditions (p. ex. tailles des pores, vitesses d’écoulement et propriétés du biofilm pour d’autres espèces ou des biofilms multispécifiques) qui dépassent les capacités expérimentales. Ce dernier est très pertinent pour comprendre les mécanismes de biocolmatage à proximité des puits, les applications de biorestauration et la biominéralisation 29,30,31. Dans l’ensemble, cette méthode pourrait facilement être adaptée pour étudier la biominéralisation ou suivre la biotransformation des contaminants par des biofilms dans des milieux poreux.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs saluent le soutien de la 179834 de subsides PRIMA du FNS (à E.S.), le financement discrétionnaire de l’ETH (à la R.S.), le Zurich Research Grant (à R.S. et J.J.M.) et le financement discrétionnaire de l’Eawag (à J.J.M.). Les auteurs tiennent à remercier Roberto Pioli pour avoir illustré la configuration expérimentale de la figure 1B et Ela Burmeister pour la préparation de la plaquette de silicium.
matériels
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
Références
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221(2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197(2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107(2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116(2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316(2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536(2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon