Method Article
Eine mikrofluidische Plattform zur Untersuchung von Bioverstopfung in porösen Medien
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt eine mikrofluidische Plattform zur Untersuchung der Biofilmentwicklung in quasi-2D-porösen Medien durch die Kombination von hochauflösender Mikroskopie-Bildgebung mit gleichzeitigen Druckdifferenzmessungen. Die Plattform quantifiziert den Einfluss von Porengröße und Flüssigkeitsdurchflussraten in porösen Medien auf die Bioverstopfung.
Zusammenfassung
Bakterielle Biofilme finden sich in verschiedenen porösen Umwelt- und Industriemedien, einschließlich Böden und Filtrationsmembranen. Biofilme wachsen unter bestimmten Strömungsbedingungen und können Poren verstopfen, wodurch der lokale Flüssigkeitsstrom umgeleitet wird. Die Fähigkeit von Biofilmen, Poren zu verstopfen, das sogenannte Bioclogging, kann einen enormen Einfluss auf die lokale Durchlässigkeit des porösen Mediums haben, einen Druckaufbau im System erzeugen und den Massenstrom durch das System beeinflussen. Um das Zusammenspiel zwischen Biofilmwachstum und Fluidströmung unter verschiedenen physikalischen Bedingungen (z.B. bei unterschiedlichen Strömungsgeschwindigkeiten und Porengrößen) zu verstehen, wird in der vorliegenden Studie eine mikrofluidische Plattform entwickelt, um die Biofilmentwicklung mit einem Mikroskop unter externen, kontrollierten physikalischen Bedingungen zu visualisieren. Der Biofilm-induzierte Druckaufbau im porösen Medium kann gleichzeitig mit Drucksensoren gemessen und später mit der Oberflächenbedeckung des Biofilms korreliert werden. Die vorgestellte Plattform bietet eine Grundlage für einen systematischen Ansatz zur Untersuchung von Bioverstopfungen, die durch Biofilme in porösen Medien unter Strömungsbedingungen verursacht werden, und kann an die Untersuchung von Umweltisolaten oder Multispezies-Biofilmen angepasst werden.
Einleitung
Biofilme - Bakterienkolonien, die in eine selbstsekretierte Matrix aus extrapolymeren Substanzen (EPS) eingebettet sind - sind in natürlichen porösen Medien wie Böden und Grundwasserleitern1 sowie in technischen und medizinischen Anwendungen wie der biologischen Sanierung2, der Wasserfiltration3 und medizinischen Geräten4 allgegenwärtig. Die Biofilmmatrix besteht aus Polysacchariden, Proteinfasern und extrazellulärer DNA5,6 und hängt stark von den Mikroorganismen, der Verfügbarkeit von Nährstoffen sowie den Umweltbedingungenab 7. Die Funktionen der Matrix sind jedoch universell; Es bildet das Gerüst der Biofilmstruktur, schützt die mikrobielle Gemeinschaft vor mechanischen und chemischen Belastungen und ist maßgeblich für die rheologischen Eigenschaften der Biofilme verantwortlich5.
In porösen Medien kann das Wachstum von Biofilmen die Poren verstopfen, was zu einer sogenannten Bioverstopfung führt. Die Biofilmentwicklung wird durch den Flüssigkeitsfluss und die Porengröße, definiert als der Abstand zwischen zwei Säulen, des porösen Mediums 8,9,10 gesteuert. Sowohl die Porengröße als auch der Flüssigkeitsfluss steuern den Nährstofftransport und die lokalen Scherkräfte. Der wachsende Biofilm wiederum verstopft die Poren, was sich auf die Geschwindigkeitsverteilung des Fluids 11,12,13, den Stofftransport und die hydraulische Leitfähigkeit des porösen Mediums 14,15 auswirkt. Die Änderungen der hydraulischen Leitfähigkeit spiegeln sich durch erhöhten Druck in geschlossenen Systemenwider 16,17,18,19. Aktuelle mikrofluidische Studien zur Biofilmentwicklung und Bioverstopfung konzentrieren sich auf die Untersuchung des Einflusses von Strömungsgeschwindigkeiten in homogenen Geometrien16,20 (d.h. mit einer singulären Porengröße) oder heterogenen porösen Medien12,21,22. Um jedoch die Auswirkungen von Fließgeschwindigkeiten und Porengröße auf die Biofilmentwicklung und die daraus resultierenden Druckänderungen im bioverstopften porösen Medium zu entwirren, ist eine hochgradig kontrollierbare und vielseitige Versuchsplattform erforderlich, die es ermöglicht, verschiedene poröse Mediengeometrien und Umgebungsbedingungen parallel zu untersuchen.
Die vorliegende Studie stellt eine mikrofluidische Plattform vor, die Druckmessungen mit gleichzeitiger Bildgebung des sich entwickelnden Biofilms im porösen Medium kombiniert. Aufgrund seiner Gasdurchlässigkeit, Biokompatibilität und Flexibilität bei der Gestaltung der Kanalgeometrie ist ein mikrofluidisches Gerät aus Polydimethylsiloxan (PDMS) ein geeignetes Werkzeug, um die Biofilmentwicklung in porösen Medien zu untersuchen. Die Mikrofluidik ermöglicht die Kontrolle physikalischer und chemischer Bedingungen (z. B. Flüssigkeitsfluss und Nährstoffkonzentration) mit hoher Präzision, um die Umgebung mikrobieller Lebensräume nachzuahmen23. Darüber hinaus können mikrofluidische Geräte leicht mit mikrometrischer Auflösung unter Verwendung eines optischen Mikroskops abgebildet und mit Online-Messungen (z. B. dem lokalen Druck) gekoppelt werden.
In dieser Arbeit konzentrieren sich die Experimente auf die Untersuchung des Einflusses der Porengröße in einem homogenen porösen Medium analog unter kontrollierten auferlegten Strömungsbedingungen. Der Durchfluss eines Nährmediums wird mit einer Spritzenpumpe aufgebracht, und die Druckdifferenz durch den mikrofluidischen Kanal wird gleichzeitig mit Drucksensoren gemessen. Die Biofilmentwicklung wird durch die Aussaat einer planktonischen Kultur von Bacillus subtilis in den mikrofluidischen Kanal eingeleitet. Die regelmäßige Bildgebung des sich entwickelnden Biofilms und die Bildanalyse ermöglichen es, porenaufgelöste Informationen über die Oberflächenbedeckung unter verschiedenen experimentellen Bedingungen zu erhalten. Die korrelierten Informationen über die Druckänderung und das Ausmaß der Bioverstopfung liefern entscheidende Informationen für die Abschätzung der Permeabilität von bioverstopften porösen Medien.
Protokoll
1. Vorbereitung des Siliziumwafers
- Entwerfen Sie die Geometrien des mikrofluidischen Kanals in der CAD-Software ( Computer-Aided Design; siehe Materialtabelle) und drucken Sie sie auf eine transparente Folie, um die Fotomaske zu erstellen (Abbildung 1A).
- Stellen Sie die Urform durch weiche Lithographie (unter Reinraumbedingungen) her, indem Sie die folgenden Schritte ausführen.
- Den Siliziumwafer bei 200 °C 2 h backen.
- Platzieren Sie den Wafer in der Mitte eines Schleuderlackers und gießen Sie SU8 3050 Fotolack (siehe Materialtabelle) auf den Wafer. Schleudern Sie die Beschichtung bei 1.700 U/min für 40 s mit einer Rampenzeit von 10 s/100 U/min.
HINWEIS: Die Spin-Coating-Parameter wurden so eingestellt, dass eine Zieldicke von 100 μm für die SU8 3050 erreicht wird. - Nach dem Schleuderverfahren wird der Siliziumwafer bei 65 °C für 600 s und 95 °C für 2.700 s weich gebacken. Lassen Sie die Waffel über Nacht bei Raumtemperatur abkühlen.
HINWEIS: Die Kühlung über Nacht verbessert die Haftung des SU8 auf dem Wafer. - Setzen Sie die Fotomaske (Schritt 1.1) auf den Wafer und belichten Sie ihn UV-Licht mit einer Belichtungsenergie von 250 mJ/cm2 und einer Wellenlänge von 350 nm.
- Backen Sie das belichtete Substrat nach der Belichtung bei 65 °C für 60 s und 95 °C für 300 s.
- Entwickeln Sie den Siliziumwafer, um die Masterform zu erhalten, indem Sie ihn in ein Becherglas tauchen, das mit dem mrDev600-Entwickler gefüllt ist (siehe Materialtabelle). Schütteln Sie das Becherglas 1.800 s lang vorsichtig, um den nicht polymerisierten Resist auszuwaschen. Anschließend mit Isopropanol auf den Siliziumwafer spritzen und an der Luft trocknen.
- Der Siliziumwafer wird bei 200 °C 1.800 s lang hart gebacken.
- Silanisieren Sie die Urform durch Aufdampfen von 20 μl Trichlorsilan (1H, 1H, 2H, 2H-Perfluoroctyl) (siehe Materialtabelle), das 40 Minuten lang in einem Vakuum-Exsikkator auf einen Objektträger neben der Form gelegt wird, wodurch ein Überdruck von 100 mbar erzeugt wird.
2. Herstellung der mikrofluidischen Vorrichtung
HINWEIS: Das hier beschriebene Herstellungsverfahren gilt für eine mikrofluidische Vorrichtung mit einem mikrofluidischen Kanal. Die gleiche Methode kann jedoch angewendet werden, um eine mikrofluidische Vorrichtung mit mehreren mikrofluidischen Kanälen parallel herzustellen.
- Mischen Sie das Elastomer mit seinem Vernetzer im Verhältnis 10:1 (siehe Materialtabelle), um eine PDMS-Mischung herzustellen. Rühren Sie die Mischung, bis sie gleichmäßig vermischt ist und aufgrund der eingeschlossenen Luftblasen undurchsichtig wird.
- Entgasen Sie das Gemisch in einem Vakuum-Exsikkator und erzeugen Sie einen Überdruck von 100 mbar, bis die eingeschlossenen Luftblasen entfernt sind und es transparent aussieht. Die für die Entgasung benötigte Zeit beträgt typischerweise 30 min.
- Legen Sie die Urform (Schritt 1) in eine Zellkulturschale (siehe Materialtabelle). Gießen Sie 20 g der PDMS-Mischung auf die Urform, um Kanäle mit einer Enddicke von 5 mm herzustellen.
- Die Urform bei 70 °C 2 h backen.
- Schneiden Sie das ausgehärtete PDMS mit einer Klinge um den Mikrofluidikkanal herum (in einem Abstand von ca. 3 mm) und ziehen Sie dann den PDMS-Mikrofluidikkanal von der Urform ab.
- Um den Ein- und Auslass der mikrofluidischen Kanäle zu erzeugen, stanzen Sie Löcher mit einem Biopsienstanzer (Durchmesser von 1,5 mm) an den Enden (oben auf den Dreiecken, siehe Abbildung 1A). Stanzen Sie ein zusätzliches Loch in die Mitte des Einlassdreiecks, um den Drucksensor später zu installieren.
- Waschen Sie einen Objektträger und den mikrofluidischen Kanal 5 Minuten lang mit einer handelsüblichen 1%igen Reinigungslösung (siehe Materialtabelle) und spülen Sie sie dann mit deionisiertem Wasser ab. Waschen Sie anschließend den PDMS-Mikrofluidikkanal und den Objektträger mit Isopropanol. Spülen Sie sie dann erneut mit deionisiertem Wasser ab. Trocknen Sie den PDMS-Mikrofluidikkanal und den Objektträger mit Druckluft bei 1 bar für 1 Minute.
HINWEIS: Die poröse Struktur des PDMS muss vollständig trocken sein, damit die Verklebung wirksam ist. - Legen Sie den Objektträger und den Mikrofluidikkanal in einen Plasmareiniger (siehe Materialtabelle) und stellen Sie sicher, dass die zu verklebenden Oberflächen nach oben zeigen. Schalten Sie den Plasmareiniger ein und behandeln Sie den Mikrofluidikkanal und den Objektträger 1 Minute lang mit Luftplasma bei einem Luftstrom von 1 SL/h (Standardliter pro Stunde). Verkleben Sie den mikrofluidischen Kanal unmittelbar nach dem Herausnehmen aus dem Reiniger mit dem Objektträger, indem Sie sie miteinander in Kontakt bringen.
HINWEIS: Achten Sie darauf, die behandelten Oberflächen nicht zu berühren, da dies die Verklebung beeinträchtigen kann. Wenn Sie ein mikrofluidisches Gerät mit mehreren mikrofluidischen Kanälen herstellen, legen Sie die mikrofluidischen Kanäle gleichzeitig frei und verbinden Sie sie in einem einzigen Schritt. - Legen Sie das geklebte mikrofluidische Gerät für mindestens 15 Minuten auf eine 80 °C heiße Platte.
- Lagern Sie das mikrofluidische Gerät in einer sauberen Zellkulturschale, bis das Experiment beginnt.
3. Herstellung der Bakteriensuspension
- Züchten Sie eine Population von Bacillus subtilis NCIB 3610 20 h vor Beginn des Experiments durch direkte Inokulation von 3 ml Nährbrühe Nr. 3 Nährmedium (siehe Materialtabelle) aus einem gefrorenen Glycerinvorrat in einem 15 ml Kulturröhrchen. In einem Schüttelinkubator bei 30 °C und 200 U/min über Nacht (für 16 h) inkubieren.
- Stellen Sie 4 Stunden vor Beginn des Experiments eine Subkultur aus der Nachtkultur her, indem Sie 3 μl der Nachtkultur in 3 ml frischem Kulturmedium (1:1.000 Verdünnung) in ein 15-ml-Kulturröhrchen geben. Inkubation der Subkultur in einem Schüttelinkubator bei 30 °C bei 200 U/min für 3,5-4 h, um eine optische Dichte bei 600 nm (OD600) von 0,1 zu erhalten.
4. Experiment zum Wachstum von Biofilmen
- Schalten Sie den Box-Inkubator des Mikroskops 3 h vor dem Experiment ein, um eine stabile Temperatur von 25 °C zu gewährleisten. Montieren Sie die Spritzenpumpe und die Drucksensoren (siehe Materialtabelle).
- Verbinden Sie den Einlass- und Auslassschlauch mit dem mikrofluidischen Gerät. Führen Sie eine Nadel (mit einem Außendurchmesser von 0,6 mm) direkt in den Einlassschlauch ein, um die Verbindung zwischen dem Schlauch und der Spritze zu sichern.
- Legen Sie das mikrofluidische Gerät, 30 ml deionisiertes Wasser und 30 ml Nährmedium in einen Vakuum-Exsikkator und entgasen Sie sie mindestens 1 Stunde lang. Ziehen Sie dann das Nährmedium und das deionisierte Wasser langsam in zwei separate 30-ml-Spritzen.
HINWEIS: Dieser Schritt ist entscheidend, um die Blasenbildung im Kanal beim Spülen mit dem Nährmedium zu verhindern. - Montieren Sie das mikrofluidische Gerät am Mikroskop und legen Sie den Auslassschlauch in einen Abfallbehälter.
- Schließen Sie die mit deionisiertem Wasser gefüllte Spritze durch den mikrofluidischen Schlauch an den mikrofluidischen Kanal an und injizieren Sie das Wasser langsam, bis es aus dem Ausgang des Drucksensors austritt. Füllen Sie den Drucksensor mit Wasser und spülen Sie alle Blasen aus dem Schlauch, der den mikrofluidischen Kanal und den Drucksensor verbindet. Schließen Sie den Auslass des Drucksensors mit den Schrauben, die für den Drucksensor vorgesehen sind.
HINWEIS: Der beschriebene Füllvorgang stellt sicher, dass die Druckänderungen am Einlass der mikrofluidischen Kanäle genau aufgezeichnet werden. Wenn Sie ein Experiment mit mehreren mikrofluidischen Kanälen durchführen, schließen Sie jeden Kanal an eine separate Spritze an, um gleiche Durchflussbedingungen in allen Kanälen zu gewährleisten.
- Schließen Sie die mit deionisiertem Wasser gefüllte Spritze durch den mikrofluidischen Schlauch an den mikrofluidischen Kanal an und injizieren Sie das Wasser langsam, bis es aus dem Ausgang des Drucksensors austritt. Füllen Sie den Drucksensor mit Wasser und spülen Sie alle Blasen aus dem Schlauch, der den mikrofluidischen Kanal und den Drucksensor verbindet. Schließen Sie den Auslass des Drucksensors mit den Schrauben, die für den Drucksensor vorgesehen sind.
- Füllen Sie den Rest des mikrofluidischen Kanals mit dem deionisierten Wasser.
- Setzen Sie einen 1,2-μm-Filter (siehe Materialtabelle) auf die Nährmedienspritze. Entfernen Sie dann die Wasserspritze und verbinden Sie die Nährmedienspritze vorsichtig mit dem mikrofluidischen Einlassschlauch. Montieren Sie die Spritze auf der Spritzenpumpe und spülen Sie den Kanal mit dem Nährmedium mit einer Durchflussrate von 2 ml/h für 1 h.
HINWEIS: Der Filter verhindert, dass Bakterienzellen während des Ladens in die Spritze gelangen. Durch Spülen des mikrofluidischen Kanals mit dem Nährmedium werden die verbleibenden Blasen in der porösen Struktur entfernt. - Stellen Sie die Spritzenpumpe während des Experiments auf die gewünschte Durchflussrate (hier 1 ml/h) ein und stellen Sie den Druckwert der Drucksensoren auf Null.
HINWEIS: Wenn Sie den anfänglichen Druckwert auf Null setzen, wird nur die Druckdifferenz gemessen, die durch die Biofilmentwicklung während des Experiments verursacht wird. - Pipettieren Sie 1 ml der Bakterienkultur mit einem OD600 von 0,1 in einem 1,5-ml-Zentrifugenfläschchen. Laden Sie die Bakterienkultur in den mikrofluidischen Kanal, indem Sie das Auslassrohr in das Zentrifugenfläschchen legen. Nachdem Sie 5 Minuten gewartet haben, um mögliche Luftblasen aus dem Auslass der Röhrchen zu entfernen, ziehen Sie 150 μl Bakterienlösung mit einer Flussrate von 1 ml/h zurück, bis der mikrofluidische Kanal mit der Bakterienkultur gefüllt ist.
- Entfernen Sie vorsichtig den Spritzenfilter des Nährmediums und legen Sie den Auslass in den Abfallbehälter. Lassen Sie die Bakterienzellen 3 h lang unter Null-Flow-Bedingungen im mikrofluidischen Kanal, um ihre Oberflächenanhaftung im porösen Medium zu ermöglichen.
HINWEIS: Das Belassen der Bakterienzellen bei Nullflussbedingungen für 3 h wurde für die Anheftung des verwendeten Bakterienstamms optimiert und gleichzeitig eine gut sauerstoffreiche Bakterienkultur gewährleistet. Andere Bakterienstämme benötigen möglicherweise mehr oder weniger Zeit. - Um das Experiment zu starten, starten Sie den Durchfluss, indem Sie die Spritzenpumpe auf die gewünschte Durchflussrate (hier 1 ml/h) einstellen und die Druckmessung bei 1 Hz starten.
- Nehmen Sie Bilder des wachsenden Biofilms im gewünschten Zeitintervall, in der gewünschten optischen Konfiguration und in der gewünschten Vergrößerung auf.
HINWEIS: In der vorliegenden Studie wurden Bilder bei 4-facher Vergrößerung im Hellfeldmodus in 18 Positionen, die den gesamten Bereich des porösen Mediums abdeckten, alle 6 Minuten für 24 Stunden aufgenommen.
5. Bildanalyse
- Rekonstruieren Sie das gesamte poröse Medium aus den aufgenommenen Bildsequenzen, indem die Bilder von den 18 Positionen mit einer Bildanalysesoftware (siehe Materialtabelle) und einem Stitching-Algorithmus24 zusammengefügt werden.
- Speichern Sie die zusammengefügten Bildsequenzen als Sequenz einzelner Bilder.
HINWEIS: Wenn die Dateien zu groß sind, können die Bilder an dieser Stelle neu skaliert und für die weitere Verarbeitung auf eine angemessene Größe aufgeteilt werden. - Erstellen Sie eine Maske der Säulen des porösen Mediums, um sie aus der Analyse zu entfernen.
- Entfernen Sie den Hintergrund der Bilder, indem Sie sie durch ihren Hintergrund teilen, wobei das Bild bei t = 0 h aufgenommen wurde (Abbildung 2A), und binarisieren Sie die Bilder mit einem Schwellenwert, der für die Segmentierung des Biofilms geeignet ist (Abbildung 2B).
- Berechnen Sie die Sättigung des Biofilms, indem Sie die vom Biofilm bedeckte Fläche (Anzahl der dem Biofilm zugeordneten Pixel) im Vergleich zur Hohlraumfläche der porösen Domäne berechnen (Abbildung 3).
Ergebnisse
Für die vorliegende Studie wurde ein mikrofluidisches Gerät mit drei parallelen mikrofluidischen Kanälen mit unterschiedlichen Porengrößen verwendet (Abbildung 1), um die Biofilmbildung in porösen Medien systematisch zu untersuchen. Der Prozess der Biofilmbildung wurde mittels Hellfeldmikroskopie sichtbar gemacht. Die Bakterienzellen und der Biofilm erschienen in den Bildern als dunklere Pixel (Abbildung 2). Darüber hinaus wurde ein allmählicher Verstopfungsprozess beobachtet; Während eines 24-stündigen Experiments besiedelte der zunächst zufällig wachsende Biofilm fast das gesamte poröse Medium.
Die Oberflächenbedeckung des Biofilms in der Zeit, die mit einer Flussrate von Q = 1 mL/h gewachsen ist, was einer mittleren anfänglichen Strömungsgeschwindigkeit von 0,96 mm/s entspricht, wurde für drei verschiedene Porengrößen (75 μm, 150 μm und 300 μm) quantifiziert (Abbildung 3, schwarze Linien). Es zeigte sich, dass die Oberflächenbedeckung, die als Proxy für den Bioverstopfungsgrad verwendet wurde, bei der kleinsten Porengröße von 75 μm 10% schneller auftrat als bei der größten Porengröße (300 μm), wenn man die Oberflächenbedeckung bei t = 20 h vergleicht. Anschließend wurde die Oberflächenbedeckung mit dem durch den Biofilm verursachten Druckaufbau korreliert (Abbildung 3, blaue Linien). Die Verstopfung im mikrofluidischen Kanal mit kleinerer Porengröße führte zu einem höheren Druckunterschied zwischen dem Einlass und dem Auslass als in den mikrofluidischen Kanälen mit größerer Porengröße, was darauf hindeutet, dass kleinere poröse Medien bei Bioverstopfung einen höheren Druckaufbau entwickeln.
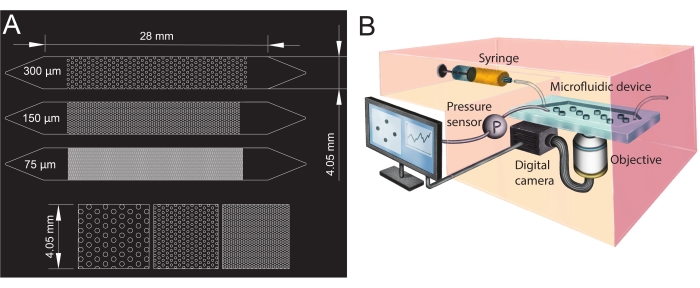
Abbildung 1: Mikrofluidisches Kanaldesign und Versuchsaufbau. (A) Fotomaske der mikrofluidischen Kanäle mit unterschiedlichen Porengrößen (75 μm, 150 μm und 300 μm), die als poröse Medienanaloga verwendet werden, und eine vergrößerte Ansicht der Anordnung der Säulen (untere Reihe). Die Kreise zeigen die Position der Säulen (undurchlässige Hindernisse), die die feste Phase des porösen Mediums darstellen. (B) Schematische Darstellung des Versuchsaufbaus, der die Spritze, den Drucksensor, das mikrofluidische Gerät (mit einem einzigen mikrofluidischen Kanal) und den Aufbau der Digitalkamera mit dem Objektiv (d. h. dem Mikroskop) zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Visualisierung und Quantifizierung der Biofilmentwicklung im porösen Medium. (A) Repräsentative Bildsequenz der Biofilmentwicklung bei der vorgegebenen Fließgeschwindigkeit von Q = 1 mL/h (entspricht einer mittleren anfänglichen Fluidströmungsgeschwindigkeit von 0,96 mm/s) und einer Porengröße von d = 300 μm für die Versuchszeitpunkte t = 5 h, t = 10 h, t = 15 h und t = 20 h . Die Hellfeldbilder wurden zusammengefügt und der Hintergrund entfernt. (B) Die Binarisierung dieser Bilder und die Quantifizierung der vom Biofilm eingenommenen Fläche (dunkle Pixel) führten zur Quantifizierung der Oberflächenbedeckung in Abbildung 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
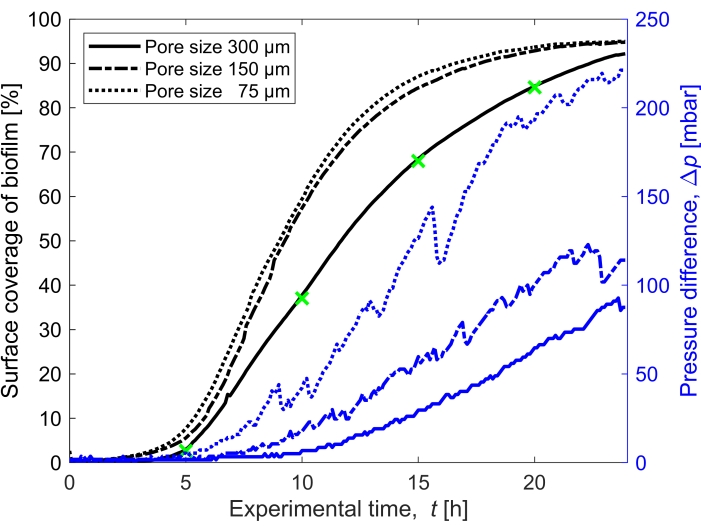
Abbildung 3: Zeitliche Entwicklung der Biofilmbedeckung und Einfluss auf den Druck. Biofilmabdeckung mit gleichzeitiger Druckmessung für die drei Porengrößen (300 μm, 150 μm und 75 μm) unter den gleichen experimentellen Bedingungen wie in Abbildung 2. Die Druckdifferenz, die durch den Biofilm im mikrofluidischen Kanal des porösen Mediums, Δp, (blaue Linien) auf der rechten y-Achse verursacht wird, nimmt mit zunehmender Oberflächenbedeckung des Biofilms zu (schwarze Linien). Die grünen Markierungen entsprechen den Datenpunkten der in Abbildung 2 gezeigten Bilder. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Mikrofluidische poröse Medienanaloga in Verbindung mit Drucksensoren bieten ein geeignetes Werkzeug, um die Entwicklung von Biofilmen in porösen Medien zu untersuchen. Die Vielseitigkeit bei der Gestaltung des mikrofluidischen porösen Mediums, insbesondere die Anordnung der Säulen, einschließlich Durchmesser, unregelmäßige Formen und Porengröße, ermöglicht die Untersuchung vieler Geometrien. Diese Geometrien reichen von einzelnen Poren bis hin zu hochkomplexen, unregelmäßig angeordneten Hindernissen, die verschiedene natürliche (z. B. Böden) und industrielle (z. B. Membranen und Filter) poröse Medien nachahmen. In der vorliegenden mikrofluidischen Plattform wurden drei poröse Mediengeometrien mit regelmäßig angeordneten zylindrischen Säulen (Porengrößen: 75 μm, 150 μm und 300 μm) erzeugt, wobei die Fluiddurchflussrate pro Experiment gewählt werden konnte. Die vorgestellte Plattform kann leicht angepasst werden, um Bioverstopfung mit einer festen Druckhöhe anstelle einer auferlegten Flüssigkeitsdurchflussrate zu untersuchen. In diesem Fall sollte die Durchflussregelvorrichtung ein Druckregler mit einem Nährmediumbehälter anstelle einer Spritzenpumpe sein. Die daraus resultierenden Änderungen der Durchflussrate aufgrund von Bioverstopfung konnten durch Messung des Abflusses über die Zeit mit einem Durchflusssensor überwacht werden.
Mehrere kritische Punkte müssen berücksichtigt werden, um ein erfolgreiches mikrofluidisches Experiment mit Biofilmwachstum durchzuführen. Um die Bildung von Luftblasen im mikrofluidischen Kanal während des Experiments zu vermeiden, wurden der mikrofluidische Kanal und das Kulturmedium entgast (Schritt 4.3). Als nächstes muss die Befüllung des mikrofluidischen Kanals mit dem entgasten Kulturmedium schnell, aber vorsichtig durchgeführt werden, um einen vollständig gesättigten Kanal ohne Luftblasen zu erhalten. Wenn Luftblasen im porösen Medium eingeschlossen sind, können die Blasen durch Spülen des Mikrofluidikkanals mit einer höheren Durchflussrate nach kurzer Zeit entfernt werden. Der zweite entscheidende Schritt besteht darin, eine Umgebung mit konstanter Temperatur zu gewährleisten, um das Wachstum des Biofilms konsistent zu reproduzieren. Das Wachstum von Mikroorganismen variiert mit der Temperatur25, was zu nicht reproduzierbaren Ergebnissen führen kann, wenn die Temperatur während des Experiments (in diesem Fall 24 h) nicht stabil gehalten wird. Für die vorliegende Plattform wurde ein Box-Inkubator um das Mikroskop herum verwendet, obwohl wahrscheinlich auch ein kleineres temperaturstabiles Gehäuse für die mikrofluidische Vorrichtung ausreichen würde. Schließlich sollten während der Bildaufnahme die Positionen der einzelnen Bilder mit einer Überlappung von mindestens 15 % gewählt werden, um eine ausreichende Überlappung für den Stitching-Algorithmus24 zu erhalten.
Die vorliegende mikrofluidische Plattform ist auf die zweidimensionale Beobachtung beschränkt, während poröse Medienanwendungen wie Erde oder Membranen eine dreidimensionale Struktur aufweisen. Vorteile der quasi-2D-Mikrofluidik-Plattform im Vergleich zu 3D-Plattformen für poröse Medien zur Untersuchung von Bioverstopfung sind jedoch der vollständige optische Zugang und die hohe Zeitauflösung, da 3D-Plattformen in der Regel eine Endpunktbildgebung durchführen 26,27. Darüber hinaus wird erwartet, dass der Bioverstopfungsprozess (d.h. die zeitliche Entwicklung der Oberflächenbedeckung) in 3D-Systemen 26,27 fortbesteht, wie er auch für die Clustergrößenverteilung einer nicht mischbaren Phase innerhalb poröser Medien28 auftritt, die in2D- und 3D-Systemen die gleiche Skalierung aufweist.
Diese Methode ermöglicht es, die Druckreaktion auf das Wachstum von Biofilmen in porösen Medien zu messen und gleichzeitig ihre räumlich-zeitliche Entwicklung bei hoher zeitlicher und räumlicher Auflösung und unterschiedlichen Porengrößen zu untersuchen. Die aus solchen Messungen gewonnenen Datensätze geben Aufschluss über die Korrelation der porenskaligen Biofilmentwicklung mit den Druckreaktionen des biofilmporösen Mediumsystems und können einen Maßstab für die numerische Modellierung von Biofilmen liefern. Diese Modellierungsbemühungen sind besonders relevant, um den Bereich der Bedingungen (z. B. Porengrößen, Strömungsgeschwindigkeiten und Biofilmeigenschaften für andere Spezies oder Multispezies-Biofilme) zu erweitern, die die experimentellen Kapazitäten übersteigen. Letzteres ist von großer Bedeutung für das Verständnis der Mechanismen der Bioverstopfung in der Nähe von Bohrlöchern, Bioremediationsanwendungen und Biomineralisation 29,30,31. Insgesamt könnte diese Methode leicht angepasst werden, um die Biomineralisation zu untersuchen oder die Biotransformation von Verunreinigungen durch Biofilme in porösen Medien zu verfolgen.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Die Autoren bedanken sich für die Unterstützung durch SNSF PRIMA Grant 179834 (an E.S.), die diskretionäre Finanzierung durch die ETH (an R.S.), den ETH Zürich Research Grant (an R.S. und J.J.M.) und die diskretionäre Finanzierung durch die Eawag (an J.J.M.). Die Autoren danken Roberto Pioli für die Veranschaulichung des Versuchsaufbaus in Abbildung 1B und Ela Burmeister für die Siliziumwafer-Präparation.
Materialien
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
Referenzen
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221(2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197(2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107(2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116(2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316(2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536(2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten