Method Article
פלטפורמה מיקרופלואידית לחקר סתימה ביולוגית במדיה נקבובית
In This Article
Summary
הפרוטוקול הנוכחי מתאר פלטפורמה מיקרופלואידית לחקר התפתחות ביופילם במדיה נקבובית כמו-דו-ממדית על ידי שילוב של דימות מיקרוסקופיה ברזולוציה גבוהה עם מדידות הפרשי לחצים בו זמנית. הפלטפורמה מכמתת את ההשפעה של גודל הנקבוביות וקצב זרימת הנוזלים במדיה נקבובית על סתימה ביולוגית.
Abstract
ביופילמים חיידקיים נמצאים במספר מדיות נקבוביות סביבתיות ותעשייתיות, כולל קרקעות וקרומי סינון. ביופילמים גדלים בתנאי זרימה מסוימים ויכולים לסתום נקבוביות, ובכך לכוון מחדש את זרימת הנוזל המקומית. היכולת של ביופילמים לסתום נקבוביות, מה שמכונה ביו-סתימה, יכולה להיות בעלת השפעה עצומה על החדירות המקומית של התווך הנקבובי, ליצור הצטברות לחץ במערכת ולהשפיע על זרימת המסה דרכו. כדי להבין את יחסי הגומלין בין צמיחת ביופילם וזרימת נוזלים בתנאים פיזיקליים שונים (למשל, במהירויות זרימה שונות ובגדלים שונים של נקבוביות), במחקר הנוכחי פותחה פלטפורמה מיקרופלואידית כדי להמחיש התפתחות ביופילם באמצעות מיקרוסקופ בתנאים פיזיקליים חיצוניים ומבוקרים. ניתן למדוד את הצטברות הלחץ הנגרמת על ידי ביופילם בתווך הנקבובי בו זמנית באמצעות חיישני לחץ, ומאוחר יותר, בקורלציה עם כיסוי פני השטח של הביופילם. הפלטפורמה המוצגת מספקת בסיס לגישה שיטתית לחקר סתימות ביולוגיות הנגרמות על ידי ביופילמים במדיה נקבובית בתנאי זרימה, וניתן להתאים אותה לחקר מבודדים סביבתיים או ביופילמים מרובי מינים.
Introduction
ביופילמים - מושבות חיידקים המשובצות במטריצה מפרישה עצמית של חומרים חוץ-פולימריים (EPS) - נמצאות בכל מקום במדיה נקבובית טבעית, כגון קרקעות ואקוויפרים1, וביישומים טכניים ורפואיים, כגון טיפול ביולוגי2, סינון מים3 ומכשירים רפואיים4. מטריצת הביופילם מורכבת מרב-סוכרים, סיבי חלבון ודנ"א חוץ-תאי5,6, והיא תלויה מאוד במיקרואורגניזמים, בזמינות חומרי המזון ובתנאי הסביבה7. עם זאת, הפונקציות של המטריצה הן אוניברסליות; הוא מהווה את הפיגום של מבנה הביופילם, מגן על קהילת החיידקים מפני לחצים מכניים וכימיים, ואחראי במידה רבה לתכונות הריאולוגיות של הביופילמים5.
במדיה נקבובית, הצמיחה של ביופילמים יכולה לסתום נקבוביות, מה שגורם למה שנקרא bioclogging. התפתחות הביופילם נשלטת על ידי זרימת הנוזל וגודל הנקבוביות, המוגדר כמרחק המפריד בין שני עמודים, של התווך הנקבובי 8,9,10. הן גודל הנקבוביות והן זרימת הנוזלים שולטים בהובלת החומרים המזינים ובכוחות הגזירה המקומיים. בתורו, הביופילם הגדל סותם נקבוביות, ומשפיע על התפלגות המהירות של הנוזל 11,12,13, על הסעת ההמונים ועל המוליכות ההידראולית של התווך הנקבובי 14,15. השינויים במוליכות הידראולית משתקפים באמצעות לחץ מוגבר במערכות סגורות16,17,18,19. מחקרים מיקרופלואידים עכשוויים בפיתוח ביופילם וסתימה ביולוגית מתמקדים בחקר ההשפעה של מהירויות זרימה בגיאומטריות הומוגניות16,20 (כלומר, עם גודל נקבוביות יחיד) או מדיה נקבובית הטרוגנית12,21,22. עם זאת, כדי להתיר את ההשפעות של קצבי הזרימה וגודל הנקבוביות על התפתחות הביופילם ושינויי הלחץ הנובעים מכך בתווך הנקבובי הסתום, נדרשת פלטפורמה ניסיונית רב-תכליתית וניתנת לשליטה המאפשרת לחקור גיאומטריות מדיה נקבוביות שונות ותנאי סביבה במקביל.
המחקר הנוכחי מציג פלטפורמה מיקרופלואידית המשלבת מדידות לחץ עם הדמיה סימולטנית של הביופילם המתפתח בתווך הנקבובי. בשל חדירות הגז, התאימות הביולוגית והגמישות שלו בתכנון גיאומטריית התעלה, התקן מיקרופלואידי העשוי מפולידימתילסילוקסאן (PDMS) הוא כלי מתאים לחקר התפתחות ביופילם במדיה נקבובית. מיקרופלואידיקה מאפשרת בקרה של תנאים פיזיקליים וכימיים (למשל, זרימת נוזלים וריכוז חומרי מזון) בדיוק גבוה כדי לחקות את הסביבה של בתי גידול מיקרוביאליים23. יתר על כן, התקנים מיקרופלואידים ניתן בקלות לצלם עם רזולוציה מיקרומטרית באמצעות מיקרוסקופ אופטי בשילוב עם מדידות מקוונות (למשל, הלחץ המקומי).
בעבודה זו, הניסויים מתמקדים בחקר ההשפעה של גודל הנקבוביות בתווך נקבובי הומוגני אנלוגי בתנאי זרימה כפויים מבוקרים. זרימת מדיום תרבית מוטלת באמצעות משאבת מזרק, והפרש הלחצים דרך התעלה המיקרופלואידית נמדד בו זמנית באמצעות חיישני לחץ. פיתוח ביופילם מתחיל על ידי זריעת תרבית פלנקטונית של Bacillus subtilis בתעלה המיקרופלואידית. הדמיה סדירה של הביופילם המתפתח וניתוח התמונה מאפשרת לקבל מידע מפוענח בקנה מידה נקבובי על כיסוי פני השטח בתנאי ניסוי שונים. המידע המתואם של שינוי הלחץ והיקף הסתימה הביולוגית מספק קלט חיוני להערכות חדירות של מדיה נקבובית סתומה ביולוגית.
Protocol
1. הכנת פרוסות סיליקון
- עצבו את הגיאומטריות של התעלה המיקרופלואידית בתוכנת תכנון בעזרת מחשב (CAD; ראו טבלת חומרים) והדפיסו אותה על סרט צילום שקוף כדי ליצור את מסיכת הפוטו (איור 1A).
- ייצרו את תבנית האב על ידי ליתוגרפיה רכה (בתנאי חדר נקי) לפי השלבים הבאים.
- אופים את רקיק הסיליקון בטמפרטורה של 200°C למשך שעתיים.
- הניחו את רקיק הפרוסות במרכז ציפוי מסתובב ושפכו את ה-photoresist SU8 3050 (ראו טבלת חומרים) על הפרוסה. מעיל מסתובב ב-1,700 סל"ד למשך 40 שניות עם זמן רמפה של 10 שניות ל-100 סל"ד.
הערה: פרמטרי ציפוי הספין הוגדרו להשגת עובי יעד של 100 מיקרומטר עבור SU8 3050. - לאחר תהליך הציפוי המסתובב, אפו ברך את רקיק הסיליקון בטמפרטורה של 65°C למשך 600 שניות ו-95°C במשך 2,700 שניות. תנו לרקיק להתקרר בטמפרטורת החדר למשך הלילה.
הערה: קירור הלילה משפר את ההיצמדות של SU8 לרקיק. - הניחו את מסיכת הפוטו (שלב 1.1) על הפרוסת וחשפו אותה לאור UV, עם אנרגיית חשיפה של 250 mJ/cm2 ובאורך גל של 350 ננומטר.
- לאחר החשיפה, אופים את המצע החשוף ב 65 ° C במשך 60 s ו 95 ° C במשך 300 שניות.
- פתח את פרוסת הסיליקון כדי להשיג את תבנית האב על ידי טבילתה בכוס מלאה במפתח mrDev600 (ראה טבלת חומרים). נערו בעדינות את הכד במשך 1,800 שניות כדי לשטוף את ההתנגדות הלא פולימרית. לאחר מכן, יש להתיז כביסה על ידי ריסוס איזופרופנול על פרוסת הסיליקון ולייבש באוויר.
- אפו בחוזקה את רקיק הסיליקון בטמפרטורה של 200°C במשך 1,800 שניות.
- סילניזציה של תבנית האב באמצעות שקיעת אדים של 20 μL של סילאן Trichloro (1H, 1H, 2H, 2H-perfluorooctyl) (ראה טבלת חומרים) שהונחה על מגלשת זכוכית ליד התבנית למשך 40 דקות במייבש ואקום, ויצרה לחץ מד של 100 mbar.
2. ייצור המכשיר המיקרופלואידי
הערה: הליך הייצור המתואר כאן הוא עבור התקן מיקרופלואידי עם תעלה מיקרופלואידית אחת. עם זאת, אותה שיטה יכולה להיות מיושמת כדי לייצר מכשיר microfluidic עם תעלות microfluidic מרובים במקביל.
- ערבבו את האלסטומר עם הקרוסלינקר שלו ביחס של 10:1 (ראו טבלת חומרים) להכנת תערובת PDMS. מערבבים את התערובת עד שהיא מתערבבת באופן אחיד והופכת אטומה בגלל בועות האוויר הסגורות.
- משחררים את התערובת במייבש ואקום, ויוצרים לחץ מד של 100 mbar עד להסרת בועות האוויר הכלואות והיא נראית שקופה. הזמן הדרוש לפירוק גזים הוא בדרך כלל 30 דקות.
- מניחים את תבנית האב (שלב 1) בכלי תרבית תאים (ראו טבלת חומרים). יוצקים 20 גרם של תערובת PDMS על תבנית האב כדי לייצר תעלות עם עובי סופי של 5 מ"מ.
- אופים את תבנית המאסטר ב 70 מעלות צלזיוס במשך 2 שעות.
- חתכו את ה-PDMS שנרפא סביב התעלה המיקרופלואידית (במרחק של כ-3 מ"מ) באמצעות להב, ולאחר מכן קלפו את התעלה המיקרופלואידית PDMS מהתבנית הראשית.
- כדי ליצור את הכניסה והמוצא של התעלות המיקרופלואידיות, ניקבו חורים בעזרת ניקוב ביופסיה (קוטר של 1.5 מ"מ) בגפיים (החלק העליון של המשולשים, ראו איור 1A). נקב חור אחד נוסף במרכז משולש הכניסה כדי להתקין את חיישן הלחץ מאוחר יותר.
- שטפו מגלשת זכוכית ואת התעלה המיקרופלואידית בתמיסת דטרגנט 1% הזמינה מסחרית (ראו טבלת חומרים) למשך 5 דקות, ולאחר מכן שטפו אותם במים נטולי יונים. לאחר מכן, שטפו את התעלה המיקרופלואידית PDMS ואת מגלשת הזכוכית עם איזופרופנול. לאחר מכן, שטפו אותם שוב במים נטולי יונים. יבש את התעלה המיקרופלואידית PDMS ואת מגלשת הזכוכית עם אוויר דחוס בבר אחד למשך דקה אחת.
הערה: המבנה הנקבובי של PDMS חייב להיות יבש לחלוטין כדי שההדבקה תהיה יעילה. - הניחו את מגלשת הזכוכית ואת התעלה המיקרופלואידית בחומר ניקוי פלזמה (ראו טבלת חומרים) וודאו שהמשטחים שיש לחבר פונים כלפי מעלה. הפעל את שואב הפלזמה וטפל בתעלה המיקרופלואידית ובמגלשת הזכוכית עם פלסמת אוויר בזרימת אוויר של 1 SL/h (ליטר סטנדרטי לשעה) למשך דקה אחת. חברו את התעלה המיקרופלואידית למגלשת הזכוכית מיד לאחר הוצאתם מהמנקה על ידי הצבתם במגע זה עם זה.
הערה: הקפד לא לגעת במשטחים המטופלים, מכיוון שהדבר עלול להשפיע על ההדבקה. בעת ייצור מכשיר מיקרופלואידי עם תעלות מיקרופלואידיות מרובות, חשוף את התעלות המיקרופלואידיות בו זמנית וקשר אותן בשלב אחד. - הניחו את המכשיר המיקרופלואידי המלוכד על פלטה חמה של 80°C למשך 15 דקות לפחות.
- אחסנו את המכשיר המיקרופלואידי בצלחת תרבית תאים נקייה עד לתחילת הניסוי.
3. הכנת ההשעיה החיידקית
- גידול אוכלוסייה של Bacillus subtilis NCIB 3610 20 שעות לפני תחילת הניסוי על ידי חיסון ישיר של 3 מ"ל של מרק מזין מס '3 מדיום תרבית (ראה טבלת חומרים) ממלאי גליצרול קפוא בצינור תרבית של 15 מ"ל. דוגרים באינקובטור רועד ב-30 מעלות צלזיוס וב-200 סל"ד למשך הלילה (למשך 16 שעות).
- צור תת-תרבית מתרבית הלילה 4 שעות לפני תחילת הניסוי על ידי הוספת 3 מיקרוליטר של תרבית הלילה ב-3 מ"ל של מדיום תרבית טרי (דילול של 1:1,000) בצינור תרבית של 15 מ"ל. לדגור על תת-התרבות באינקובטור רועד ב-30°C ב-200 סל"ד למשך 3.5-4 שעות כדי לקבל צפיפות אופטית ב-600 ננומטר (OD600) של 0.1.
4. ניסוי גידול ביופילם
- הפעל את אינקובטור התיבה של המיקרוסקופ 3 שעות לפני הניסוי כדי להבטיח טמפרטורה יציבה של 25 מעלות צלזיוס. הרכיבו את משאבת המזרק ואת חיישני הלחץ (ראו טבלת חומרים).
- חבר את צינורות הכניסה והיציאה להתקן המיקרופלואידי. הכנס ישירות מחט (בקוטר חיצוני של 0.6 מ"מ) לתוך צינור הכניסה כדי לאבטח את החיבור בין הצינור למזרק.
- הניחו את המכשיר המיקרופלואידי, 30 מ"ל מים שעברו דה-יוניזציה ו-30 מ"ל של מדיום תרבית במייבש ואקום ונטרלו אותם למשך שעה אחת לפחות. לאחר מכן, משכו באיטיות את מדיום התרבית ואת המים שעברו דה-יוניזציה לשני מזרקים נפרדים של 30 מ"ל.
הערה: שלב זה חיוני למניעת היווצרות בועות בערוץ תוך כדי שטיפה עם מדיום התרבות. - הרכיבו את המכשיר המיקרופלואידי על המיקרוסקופ והניחו את צינור היציאה במיכל פסולת.
- חברו את המזרק המלא במים שעברו דה-יוניזציה לתעלה המיקרופלואידית דרך הצינור המיקרופלואידי והזריקו את המים באיטיות עד שהם יוצאים ממוצא חיישן הלחץ. מלאו את חיישן הלחץ במים ושטפו את כל הבועות מהצינור המחבר בין התעלה המיקרופלואידית לחיישן הלחץ. סגור את היציאה של חיישן הלחץ עם הברגים הייעודיים לחיישן הלחץ.
הערה: הליך המילוי המתואר מבטיח ששינויי הלחץ בכניסת התעלות המיקרופלואידיות יירשמו במדויק. בעת ביצוע ניסוי עם תעלות מיקרופלואידיות מרובות, חבר כל ערוץ למזרק נפרד כדי להבטיח תנאי זרימה שווים בכל הערוצים.
- חברו את המזרק המלא במים שעברו דה-יוניזציה לתעלה המיקרופלואידית דרך הצינור המיקרופלואידי והזריקו את המים באיטיות עד שהם יוצאים ממוצא חיישן הלחץ. מלאו את חיישן הלחץ במים ושטפו את כל הבועות מהצינור המחבר בין התעלה המיקרופלואידית לחיישן הלחץ. סגור את היציאה של חיישן הלחץ עם הברגים הייעודיים לחיישן הלחץ.
- מלאו את שאר התעלה המיקרופלואידית במים שעברו דה-יוניזציה.
- הניחו מסנן של 1.2 מיקרומטר (ראו טבלת חומרים) על מזרק המדיה לתרבית. לאחר מכן, הסר את מזרק המים וחבר בזהירות את מזרק המדיה התרבית לצינור המיקרופלואידי הנכנס. הרכיבו את המזרק על משאבת המזרק ושטפו את התעלה בתווך התרבית בקצב זרימה של 2 מ"ל/שעה למשך שעה.
הערה: המסנן מונע מתאי חיידקים להיכנס למזרק במהלך ההעמסה. שטיפת התעלה המיקרופלואידית עם אמצעי התרבית תסיר את הבועות הנותרות במבנה הנקבובי. - כוונו את משאבת המזרק בקצב הזרימה הרצוי (כאן 1 מ"ל/שעה) במהלך הניסוי וכוונו את קריאת הלחץ של חיישני הלחץ לאפס.
הערה: על ידי הגדרת קריאת הלחץ הראשונית לאפס, רק הפרש הלחצים שנגרם על ידי התפתחות ביופילם במהלך הניסוי יימדד. - פיפטה 1 מ"ל של תרבית חיידקים ב OD600 של 0.1 בבקבוקון צנטריפוגה 1.5 מ"ל. טען את תרבית החיידקים לתוך התעלה המיקרופלואידית על ידי הכנסת צינור היציאה לתוך בקבוקון הצנטריפוגה. לאחר המתנה של 5 דקות להסרת בועות אוויר פוטנציאליות ממוצא הצינורות, משכו 150 מיקרוליטר של תמיסה חיידקית בקצב זרימה של 1 מ"ל/שעה, עד שהתעלה המיקרופלואידית תתמלא בתרבית החיידקים.
- הסירו בזהירות את מסנן מזרק המדיה התרבית והכניסו את השקע למיכל האשפה. השאירו את תאי החיידק בתנאי זרימה אפסית בתעלה המיקרופלואידית למשך 3 שעות כדי לאפשר את חיבור פני השטח שלהם בתווך הנקבובי.
הערה: השארת תאי החיידק בתנאי זרימה אפסית למשך 3 שעות הייתה אופטימלית לחיבור הזן החיידקי המשמש תוך הבטחת תרבית חיידקים מחומצנת היטב. זני חיידקים אחרים עשויים לדרוש פחות או יותר זמן. - כדי להתחיל את הניסוי, התחל את הזרימה על ידי הגדרת משאבת המזרק לקצב הזרימה הרצוי (כאן 1 מ"ל / שעה) והתחל את קריאת הלחץ על 1 הרץ.
- קבל תמונות של הביופילם הגדל במרווח הזמן הרצוי, תצורה אופטית והגדלה.
הערה: במחקר הנוכחי, תמונות בהגדלה פי 4 במצב שדה בהיר ב-18 מיקומים המשתרעים על פני כל תחום התווך הנקבובי נרכשו כל 6 דקות למשך 24 שעות.
5. ניתוח תמונות
- שחזר את כל המדיום הנקבובי מתוך רצפי התמונות שצולמו על ידי תפירת התמונות מ-18 המיקומים באמצעות תוכנת ניתוח תמונות (ראה טבלת חומרים) ואלגוריתם תפירה24.
- שמרו את רצפי התמונות התפורים כרצף של תמונות בודדות.
הערה: אם הקבצים גדולים מדי, בשלב זה, ניתן לשנות את גודל התמונות ולאגד אותן לגודל סביר לצורך עיבוד נוסף. - צור מסכה של עמודי התווך הנקבובי כדי להסיר אותם מהניתוח.
- הסירו את הרקע של התמונות על-ידי חלוקתן לפי הרקע שלהן עם התמונה שצולמה ב-t = 0 שעות (איור 2A) ובצעו בינאריזציה של התמונות בסף המתאים לפלח את הביופילם (איור 2B).
- חשבו את הרוויה של הביופילם על-ידי חישוב השטח המכוסה על-ידי הביופילם (מספר הפיקסלים המיוחסים לביופילם) בהשוואה לאזור הריק של התחום הנקבובי (איור 3).
תוצאות
במחקר הנוכחי נעשה שימוש במכשיר מיקרופלואידי עם שלוש תעלות מיקרופלואידיות מקבילות עם גדלי נקבוביות שונים (איור 1) כדי לחקור באופן שיטתי היווצרות ביופילם במדיה נקבובית. תהליך היווצרות הביופילם הודגם באמצעות מיקרוסקופ שדה בהיר. תאי החיידקים והביופילם הופיעו בתמונות כפיקסלים כהים יותר (איור 2). בנוסף, נצפה תהליך סתימה הדרגתי; במהלך ניסוי של 24 שעות, הביופילם שגדל בתחילה באופן אקראי התיישב כמעט בכל התווך הנקבובי.
כיסוי פני השטח של הביופילם בזמן שגדל בקצב זרימה של Q = 1 מ"ל/שעה, המתאים למהירות זרימת נוזל התחלתית ממוצעת של 0.96 מ"מ לשנייה, כומת עבור שלושה גדלים שונים של נקבוביות (75 מיקרומטר, 150 מיקרומטר ו-300 מיקרומטר) (איור 3, קווים שחורים). נמצא כי כיסוי פני השטח, ששימש כפרוקסי לדרגת הסתימה הביולוגית, התרחש 10% מהר יותר בגודל הנקבוביות הקטן ביותר של 75 מיקרומטר מאשר בגודל הנקבוביות הגדול ביותר (300 מיקרומטר) כאשר השוו את כיסוי פני השטח ב- t = 20 שעות. לאחר מכן, כיסוי פני השטח היה מתואם עם הצטברות הלחץ שנגרמה על-ידי הביופילם (איור 3, קווים כחולים). הסתימה בתעלה המיקרופלואידית בגודל הנקבוביות הקטנה יותר הובילה להפרש לחצים גבוה יותר בין הכניסה לשקע מאשר בתעלות מיקרופלואידיות בגודל נקבוביות גדולות יותר, מה שמצביע על כך שמדיה נקבובית בגודל קטן יותר תפתח הצטברות לחץ גבוהה יותר כאשר היא נתונה לסתימה ביולוגית.
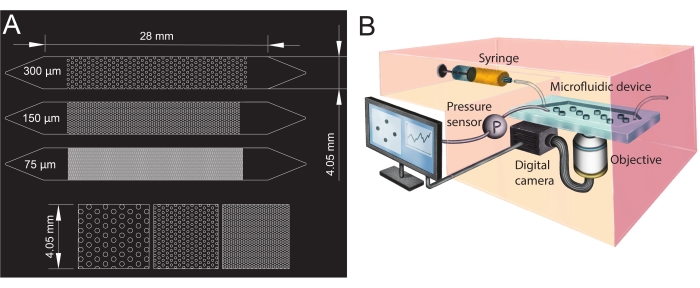
איור 1: תכנון תעלות מיקרופלואידיות ומערך ניסויי. (A) מסיכת פוטו של התעלות המיקרופלואידיות בגדלים שונים של נקבוביות (75 מיקרומטר, 150 מיקרומטר ו-300 מיקרומטר) המשמשות כאנלוגים של מדיה נקבובית ותצוגה מוגדלת של סידור העמודים (שורה תחתונה). העיגולים מראים את מיקום העמודים (מכשולים בלתי חדירים), המייצגים את השלב המוצק של המדיה הנקבובית. (B) סכמה של מערך הניסוי המראה את המזרק, חיישן הלחץ, המכשיר המיקרופלואידי (עם ערוץ מיקרופלואידי יחיד), ומערך המצלמה הדיגיטלית עם המטרה (כלומר, המיקרוסקופ). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: ויזואליזציה וכימות של התפתחות ביופילם בתווך הנקבובי. (A) רצף תמונה מייצג של התפתחות הביופילם בקצב זרימה כפוי של Q = 1 מ"ל/שעה (מתאים למהירות זרימת נוזל התחלתית ממוצעת של 0.96 מ"מ לשנייה) וגודל נקבוביות של d = 300 מיקרומטר המוצג עבור נקודות הזמן הניסיוניות t = 5 שעות, t = 10 שעות, t = 15 שעות, ו- t = 20 שעות. תמונות השדה הבהיר נתפרו, והרקע הוסר. (B) הבינאריות של התמונות האלה והכימות של השטח שנכבש על-ידי ביופילם (פיקסלים כהים) הובילו לכימות כיסוי פני השטח באיור 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
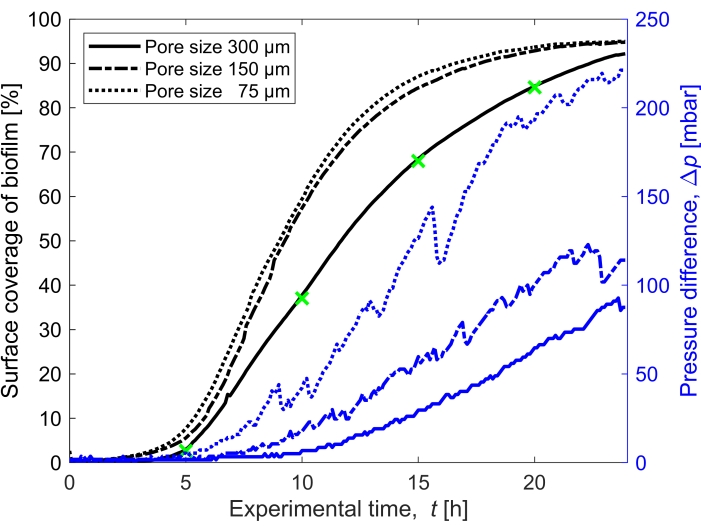
איור 3: התפתחות זמנית של כיסוי ביופילם והשפעה על לחץ. כיסוי ביופילם עם קריאת לחץ סימולטנית עבור שלושת גדלי הנקבוביות (300 מיקרומטר, 150 מיקרומטר ו-75 מיקרומטר) באותם תנאי ניסוי כמו איור 2. הפרש הלחצים שנגרם על-ידי הביופילם בתעלה המיקרופלואידית התוומית הנקבובית, Δp, (קווים כחולים) המוצגים על ציר y הימני, גדל ככל שכיסוי פני השטח של הביופילם (קווים שחורים) גדל עם הגדלת כיסוי פני השטח של הביופילם (קווים שחורים). הסמנים הירוקים תואמים לנקודות הנתונים של התמונות המוצגות באיור 2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
אנלוגים של מדיה נקבובית מיקרופלואידית בשילוב עם חיישני לחץ מספקים כלי מתאים לחקר התפתחות ביופילם במדיה נקבובית. הרבגוניות בעיצוב התווך הנקבובי המיקרופלואידי, במיוחד סידור העמודים, כולל קוטר, צורות לא סדירות וגודל נקבוביות, מאפשרת חקירה של גיאומטריות רבות. גיאומטריות אלה נעות בין נקבוביות בודדות למכשולים מורכבים מאוד, מסודרים באופן לא סדיר, המחקים מדיה נקבובית טבעית שונה (למשל, קרקעות) ותעשייתית (למשל, ממברנות ומסננים). בפלטפורמה המיקרופלואידית הנוכחית נוצרו שלוש גאומטריות מדיה נקבוביות עם עמודים גליליים מסודרים באופן קבוע (גודל נקבוביות: 75 מיקרומטר, 150 מיקרומטר ו-300 מיקרומטר), שבהם ניתן היה לבחור את קצב זרימת הנוזל בכל ניסוי. ניתן להתאים בקלות את הפלטפורמה המוצגת לחקר סתימה ביולוגית עם ראש לחץ קבוע במקום קצב זרימת נוזל כפוי. במקרה זה, מכשיר בקרת הזרימה צריך להיות בקר לחץ עם מאגר בינוני תרבות במקום משאבת מזרק. ניתן לנטר את השינויים בקצב הזרימה כתוצאה מסתימה ביולוגית על ידי מדידת הזרימה לאורך זמן באמצעות חיישן קצב זרימה.
יש לקחת בחשבון מספר נקודות קריטיות כדי לבצע ניסוי מיקרופלואידי מוצלח עם גידול ביופילם. כדי למנוע היווצרות בועות אוויר בתעלה המיקרופלואידית במהלך הניסוי, התעלה המיקרופלואידית ותווך התרבית פורקו מהגז (שלב 4.3). לאחר מכן, מילוי התעלה המיקרופלואידית בתווך התרבית נטול הגז חייב להתבצע במהירות אך בזהירות כדי להשיג תעלה רוויה לחלוטין ללא בועות אוויר. במקרה שבועות אוויר לכודות בתווך הנקבובי, שטיפת התעלה המיקרופלואידית בקצב זרימה גבוה יותר יכולה להסיר את הבועות לאחר זמן קצר. הצעד המכריע השני הוא להבטיח סביבת טמפרטורה קבועה כדי לשחזר את צמיחת הביופילם באופן עקבי. גדילת המיקרואורגניזמים משתנה עם טמפרטורה 25, מה שעלול להוביל לתוצאות שאינן ניתנות לשחזור כאשר לא שומרים על טמפרטורה יציבה במהלך הניסוי (במקרה זה,24 שעות). עבור הפלטפורמה הנוכחית, נעשה שימוש באינקובטור קופסה סביב המיקרוסקופ, אם כי מארז יציב טמפרטורה קטן יותר עבור המכשיר המיקרופלואידי יספיק גם כן. לבסוף, במהלך רכישת התמונה, יש לבחור את המיקומים של התמונות הבודדות עם חפיפה של לפחות 15% כדי לקבל חפיפה מספקת עבור אלגוריתם התפירה24.
הפלטפורמה המיקרופלואידית הנוכחית מוגבלת לתצפית דו-ממדית, בעוד שליישומי מדיה נקבוביים כמו אדמה או ממברנות יש מבנה תלת-ממדי. עם זאת, היתרונות של פלטפורמה מיקרופלואידית כמו-דו-ממדית בהשוואה לפלטפורמות מדיה נקבוביות תלת-ממדיות לחקר ביו-סתימה הם הגישה האופטית המלאה ורזולוציית הזמן הגבוהה, שכן פלטפורמות תלת-ממדיות מבצעות בדרך כלל הדמיה של נקודות קצה26,27. בנוסף, צפוי כי תהליך הביו-סתימה (כלומר, התפתחות הזמן של כיסוי פני השטח) נמשך במערכות תלת-ממדיות26,27, כפי שהוא מתרחש גם עבור התפלגות גודל הצביר של פאזה בלתי ניתנת להפרדה בתוך מדיה נקבובית28, המציגה את אותו קנה מידה במערכות דו-ממדיות ותלת-ממדיות.
שיטה זו מאפשרת למדוד את תגובת הלחץ לצמיחת ביופילם במדיה נקבובית תוך לימוד התפתחותו המרחבית-טמפורלית ברזולוציה טמפורלית ומרחבית גבוהה ובגדלים שונים של נקבוביות. מערכי הנתונים המתקבלים ממדידות כאלה מביאים תובנה לגבי המתאם בין התפתחות ביופילם בקנה מידה נקבובי לבין תגובות לחץ של מערכת המדיום הנקבובי-ביופילם, ויכולים לספק אמת מידה למידול מספרי של ביופילמים. מאמצי מידול אלה רלוונטיים במיוחד להרחבת טווח התנאים (למשל, גודל נקבוביות, מהירויות זרימה ותכונות ביופילם עבור מינים אחרים או ביופילמים מרובי מינים) החורגים מיכולות הניסוי. האחרון רלוונטי מאוד להבנת המנגנונים של סתימה ביולוגית בקרבת בארות, יישומי ביו-תיקון וביומינרליזציה 29,30,31. בסך הכל, שיטה זו יכולה בקלות להיות מותאמת לחקר ביומינרליזציה או לעקוב אחר ביוטרנספורמציה של מזהמים על ידי ביופילמים במדיה נקבובית.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
המחברים מודים על תמיכה מ-SNSF PRIMA grant 179834 (ל-E.S.), מימון לפי שיקול דעת מ-ETH (ל-R.S.), ETH Zurich Research Grant (ל-R.S. ו-J.J.M.), ומימון לפי שיקול דעת מ-Eawag (ל-J.J.M). המחברים רוצים להודות לרוברטו פיולי על הדגמת מערך הניסוי באיור 1B ולאלה בורמייסטר על הכנת פרוסות הסיליקון.
Materials
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
References
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221(2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197(2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107(2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116(2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316(2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536(2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.