Method Article
Una plataforma microfluídica para estudiar la bioobstrucción en medios porosos
En este artículo
Resumen
El presente protocolo describe una plataforma microfluídica para estudiar el desarrollo de biopelículas en medios porosos cuasi-2D mediante la combinación de imágenes de microscopía de alta resolución con mediciones simultáneas de diferencia de presión. La plataforma cuantifica la influencia del tamaño de poro y las tasas de flujo de fluidos en medios porosos en la bioobstrucción.
Resumen
Las biopelículas bacterianas se encuentran en varios medios porosos ambientales e industriales, incluidos los suelos y las membranas de filtración. Las biopelículas crecen bajo ciertas condiciones de flujo y pueden obstruir los poros, redirigiendo así el flujo de fluido local. La capacidad de las biopelículas para obstruir los poros, la llamada bioobstrucción, puede tener un efecto tremendo en la permeabilidad local del medio poroso, creando una acumulación de presión en el sistema e impactando el flujo másico a través de él. Para comprender la interacción entre el crecimiento de la biopelícula y el flujo de fluidos en diferentes condiciones físicas (por ejemplo, a diferentes velocidades de flujo y tamaños de poro), en el presente estudio, se desarrolla una plataforma microfluídica para visualizar el desarrollo de la biopelícula utilizando un microscopio bajo condiciones físicas controladas e impuestas externamente. La acumulación de presión inducida por la biopelícula en el medio poroso se puede medir simultáneamente utilizando sensores de presión y, más tarde, correlacionarse con la cobertura superficial de la biopelícula. La plataforma presentada proporciona una línea de base para un enfoque sistemático para investigar la bioobstrucción causada por biopelículas en medios porosos en condiciones de flujo y se puede adaptar para estudiar aislados ambientales o biopelículas multiespecies.
Introducción
Las biopelículas (colonias bacterianas incrustadas en una matriz autosecretada de sustancias extrapoliméricas (EPS), son ubicuas en medios porosos naturales, como suelos y acuíferos1, y aplicaciones técnicas y médicas, como biorremediación2, filtración de agua3 y dispositivos médicos4. La matriz de biofilm está compuesta por polisacáridos, fibras proteicas y ADN extracelular5,6, y depende fuertemente de los microorganismos, la disponibilidad de nutrientes, así como las condiciones ambientales7. Sin embargo, las funciones de la matriz son universales; Forma el andamio de la estructura del biofilm, protege a la comunidad microbiana de tensiones mecánicas y químicas, y es en gran parte responsable de las propiedades reológicas de los biofilms5.
En medios porosos, el crecimiento de biopelículas puede obstruir los poros, causando la llamada bioobstrucción. El desarrollo del biofilm está controlado por el flujo de fluido y el tamaño de poro, definido como la distancia que separa dos pilares, del medio poroso 8,9,10. Tanto el tamaño de poro como el flujo de fluido controlan el transporte de nutrientes y las fuerzas de cizallamiento locales. A su vez, el biofilm creciente obstruye los poros, afectando la distribución de la velocidad del fluido 11,12,13, el transporte de masa y la conductividad hidráulica del medio poroso 14,15. Los cambios en la conductividad hidráulica se reflejan a través del aumento de la presión en sistemas confinados16,17,18,19. Los estudios microfluídicos actuales en el desarrollo de biopelículas y la bioobstrucción se centran en estudiar el impacto de las velocidades de flujo en geometrías homogéneas16,20 (es decir, con un tamaño de poro singular) o medios porosos heterogéneos12,21,22. Sin embargo, para desentrañar los efectos de las tasas de flujo y el tamaño de poro en el desarrollo de biopelículas y los cambios de presión resultantes en el medio poroso bioobstruido, se requiere una plataforma experimental altamente controlable y versátil que permita el estudio de diferentes geometrías de medios porosos y condiciones ambientales en paralelo.
El presente estudio introduce una plataforma microfluídica que combina mediciones de presión con imágenes simultáneas de la biopelícula en evolución dentro del medio poroso. Debido a su permeabilidad al gas, biocompatibilidad y flexibilidad en el diseño de la geometría del canal, un dispositivo microfluídico hecho de polidimetilsiloxano (PDMS) es una herramienta adecuada para estudiar el desarrollo de biopelículas en medios porosos. La microfluídica permite el control de las condiciones físicas y químicas (por ejemplo, flujo de fluidos y concentración de nutrientes) con alta precisión para imitar el ambiente de los hábitats microbianos23. Además, los dispositivos microfluídicos se pueden visualizar fácilmente con resolución micrométrica utilizando un microscopio óptico y junto con mediciones en línea (por ejemplo, la presión local).
En este trabajo, los experimentos se centran en estudiar el impacto del tamaño de poro en un análogo de medio poroso homogéneo bajo condiciones de flujo impuesto controladas. El flujo de un medio de cultivo se impone utilizando una bomba de jeringa, y la diferencia de presión a través del canal microfluídico se mide simultáneamente con sensores de presión. El desarrollo del biofilm se inicia mediante la siembra de un cultivo planctónico de Bacillus subtilis en el canal microfluídico. Las imágenes regulares de la biopelícula en evolución y el análisis de imágenes permiten obtener información resuelta a escala de poros en la cobertura de la superficie bajo diversas condiciones experimentales. La información correlacionada del cambio de presión y el grado de bioobstrucción proporciona información crucial para las estimaciones de permeabilidad de medios porosos bioobstruidos.
Protocolo
1. Preparación de obleas de silicio
- Diseñe las geometrías del canal microfluídico en el software de diseño asistido por computadora (CAD; consulte la Tabla de materiales) e imprímalo en una película transparente para crear la fotomáscara (Figura 1A).
- Fabrice el molde maestro mediante litografía suave (en condiciones de sala limpia) siguiendo los pasos a continuación.
- Hornear la oblea de silicio a 200 °C durante 2 h.
- Coloque la oblea en el centro de una centrifugadora y vierta SU8 3050 fotorresistente (consulte la Tabla de materiales) en la oblea. Capa de centrifugado a 1.700 rpm durante 40 s con un tiempo de rampa de 10 s/100 rpm.
NOTA: Los parámetros de centrifugado se ajustaron para obtener un espesor objetivo de 100 μm para el SU8 3050. - Después del proceso de centrifugado, hornee suavemente la oblea de silicio a 65 °C durante 600 s y 95 °C durante 2.700 s. Deje que la oblea se enfríe a temperatura ambiente durante la noche.
NOTA: El enfriamiento nocturno mejora la adhesión del SU8 a la oblea. - Coloque la fotomáscara (paso 1.1) sobre la oblea y exponerla a la luz UV, con una energía de exposición de 250 mJ/cm2 y a una longitud de onda de 350 nm.
- Después de la exposición, hornear el sustrato expuesto a 65 °C durante 60 s y 95 °C durante 300 s.
- Desarrolle la oblea de silicio para obtener el molde maestro sumergiéndolo en un vaso de precipitados lleno de revelador mrDev600 (consulte la Tabla de materiales). Agite suavemente el vaso de precipitados durante 1.800 s para lavar la resistencia no polimerizada. Luego, lave por salpicaduras rociando isopropanol sobre la oblea de silicio y seque al aire.
- Hornear la oblea de silicio a 200 °C durante 1.800 s.
- Silanizar el molde maestro a través de la deposición de vapor de 20 μL de silano Tricloro (1H, 1H, 2H, 2H-perfluorooctil) (ver Tabla de materiales) colocado en un portaobjetos de vidrio junto al molde durante 40 minutos en un desecador de vacío, creando una presión manométrica de 100 mbar.
2. Fabricación del dispositivo microfluídico
NOTA: El procedimiento de fabricación descrito aquí es para un dispositivo microfluídico con un canal microfluídico. Sin embargo, el mismo método se puede aplicar para fabricar un dispositivo microfluídico con múltiples canales microfluídicos en paralelo.
- Mezcle el elastómero con su reticulante en una proporción de 10:1 (consulte la Tabla de materiales) para preparar una mezcla de PDMS. Revuelva la mezcla hasta que se mezcle uniformemente y se vuelva opaca debido a las burbujas de aire cerradas.
- Desgasifica la mezcla en un desecador al vacío, creando una presión manométrica de 100 mbar hasta que se eliminen las burbujas de aire atrapadas y se vea transparente. El tiempo requerido para la desgasificación suele ser de 30 minutos.
- Coloque el molde maestro (paso 1) en una placa de cultivo celular (consulte la Tabla de materiales). Verter 20 g de la mezcla PDMS en el molde maestro para producir canales con un espesor final de 5 mm.
- Hornear el molde maestro a 70 °C durante 2 h.
- Corte el PDMS curado alrededor del canal microfluídico (a una distancia de aproximadamente 3 mm) con una cuchilla y luego retire el canal microfluídico PDMS del molde maestro.
- Para crear la entrada y salida de los canales microfluídicos, perfore los orificios con un punzón de biopsia (diámetro de 1,5 mm) en sus extremidades (parte superior de los triángulos, véase la figura 1A). Perfore un orificio adicional en el centro del triángulo de entrada para instalar el sensor de presión más adelante.
- Lave un portaobjetos de vidrio y el canal microfluídico con una solución detergente al 1% disponible comercialmente (consulte la Tabla de materiales) durante 5 minutos, luego enjuáguelos con agua desionizada. Posteriormente, lave el canal microfluídico PDMS y el portaobjetos de vidrio con isopropanol. Luego, enjuáguelos nuevamente con agua desionizada. Seque el canal microfluídico PDMS y el portaobjetos de vidrio con aire comprimido a 1 bar durante 1 min.
NOTA: La estructura porosa del PDMS debe estar completamente seca para que la unión sea efectiva. - Coloque el portaobjetos de vidrio y el canal microfluídico en un limpiador de plasma (consulte la Tabla de materiales) y asegúrese de que las superficies a unir estén hacia arriba. Encienda el limpiador de plasma y trate el canal microfluídico y el portaobjetos de vidrio con plasma de aire a un flujo de aire de 1 SL / h (litro estándar por hora) durante 1 minuto. Conecte el canal microfluídico al portaobjetos de vidrio inmediatamente después de sacarlos del limpiador poniéndolos en contacto entre sí.
NOTA: Asegúrese de no tocar las superficies tratadas, ya que esto podría afectar la unión. Al fabricar un dispositivo microfluídico con múltiples canales microfluídicos, exponga los canales microfluídicos simultáneamente y únalos en un solo paso. - Coloque el dispositivo microfluídico unido en una placa caliente a 80 °C durante al menos 15 minutos.
- Almacene el dispositivo microfluídico en una placa de cultivo celular limpio hasta que comience el experimento.
3. Preparación de la suspensión bacteriana
- Cultivar una población de Bacillus subtilis NCIB 3610 20 h antes del inicio del experimento inoculando directamente 3 ml de medio de cultivo de caldo nutriente nº 3 (ver Tabla de materiales) de un stock de glicerol congelado en un tubo de cultivo de 15 ml. Incubar en una incubadora agitadora a 30 °C y 200 rpm durante la noche (durante 16 h).
- Hacer un subcultivo a partir del cultivo nocturno 4 h antes del inicio del experimento añadiendo 3 μL del cultivo nocturno en 3 ml de medio de cultivo fresco (dilución 1:1.000) en un tubo de cultivo de 15 ml. Incubar el subcultivo en una incubadora de agitación a 30 °C a 200 rpm durante 3,5-4 h para obtener una densidad óptica a 600 nm (OD600) de 0,1.
4. Experimento de crecimiento de biofilm
- Encienda la incubadora de cajas del microscopio 3 h antes del experimento para garantizar una temperatura estable de 25 °C. Monte la bomba de jeringa y los sensores de presión (consulte la Tabla de materiales).
- Conecte el tubo de entrada y salida al dispositivo microfluídico. Inserte directamente una aguja (con un diámetro exterior de 0,6 mm) en el tubo de entrada para asegurar la conexión entre el tubo y la jeringa.
- Coloque el dispositivo microfluídico, 30 ml de agua desionizada y 30 ml de medio de cultivo en un desecador al vacío y desgasifique durante al menos 1 h. Luego, tire lentamente del medio de cultivo y del agua desionizada en dos jeringas separadas de 30 ml.
NOTA: Este paso es crucial para evitar la formación de burbujas en el canal mientras se lava con el medio de cultivo. - Monte el dispositivo microfluídico en el microscopio y coloque el tubo de salida en un contenedor de residuos.
- Conecte la jeringa llena de agua desionizada al canal microfluídico a través del tubo microfluídico e inyecte lentamente el agua hasta que salga de la salida del sensor de presión. Llene el sensor de presión con agua y enjuague todas las burbujas del tubo que conecta el canal microfluídico y el sensor de presión. Cierre la salida del sensor de presión con los tornillos dedicados al sensor de presión.
NOTA: El procedimiento de llenado descrito garantiza que los cambios de presión en la entrada de los canales microfluídicos se registrarán con precisión. Cuando ejecute un experimento con múltiples canales microfluídicos, conecte cada canal a una jeringa separada para garantizar condiciones de flujo iguales en todos los canales.
- Conecte la jeringa llena de agua desionizada al canal microfluídico a través del tubo microfluídico e inyecte lentamente el agua hasta que salga de la salida del sensor de presión. Llene el sensor de presión con agua y enjuague todas las burbujas del tubo que conecta el canal microfluídico y el sensor de presión. Cierre la salida del sensor de presión con los tornillos dedicados al sensor de presión.
- Llene el resto del canal microfluídico con el agua desionizada.
- Coloque un filtro de 1,2 μm (consulte la Tabla de materiales) en la jeringa de los medios de cultivo. Luego, retire la jeringa de agua y conecte cuidadosamente la jeringa de medios de cultivo al tubo microfluídico de entrada. Monte la jeringa en la bomba de la jeringa y enjuague el canal con el medio de cultivo a un caudal de 2 ml/h durante 1 h.
NOTA: El filtro evita que las células bacterianas entren en la jeringa durante la carga. El lavado del canal microfluídico con los medios de cultivo eliminará las burbujas restantes en la estructura porosa. - Ajuste la bomba de jeringa al caudal deseado (aquí 1 ml / h) durante el experimento y ajuste la lectura de presión de los sensores de presión a cero.
NOTA: Al establecer la lectura de presión inicial en cero, solo se medirá la diferencia de presión causada por el desarrollo de biopelículas durante el experimento. - Pipetear 1 ml del cultivo bacteriano a un OD600 de 0,1 en un vial de centrífuga de 1,5 ml. Cargue el cultivo bacteriano en el canal microfluídico colocando el tubo de salida en el vial de la centrífuga. Después de esperar 5 minutos para eliminar cualquier burbuja de aire potencial de la salida de los tubos, retire 150 μL de solución bacteriana a una velocidad de flujo de 1 ml / h, hasta que el canal microfluídico se llene con el cultivo bacteriano.
- Retire con cuidado el filtro de la jeringa del medio de cultivo y coloque la salida en el contenedor de residuos. Dejar las células bacterianas en condiciones de flujo cero en el canal microfluídico durante 3 h para permitir su fijación superficial en el medio poroso.
NOTA: Se optimizó la eliminación de las células bacterianas en condiciones de flujo cero durante 3 h para la unión de la cepa bacteriana utilizada y se aseguró un cultivo bacteriano bien oxigenado. Otras cepas bacterianas pueden requerir más o menos tiempo. - Para comenzar el experimento, inicie el flujo ajustando la bomba de jeringa al caudal deseado (aquí 1 ml / h) y comience la lectura de presión a 1 Hz.
- Adquiera imágenes de la biopelícula en crecimiento en el intervalo de tiempo, la configuración óptica y el aumento deseados.
NOTA: En el presente estudio, las imágenes con un aumento de 4x en el modo de campo claro en 18 posiciones que abarcan todo el dominio del medio poroso se adquirieron cada 6 minutos durante 24 h.
5. Análisis de imágenes
- Reconstruir todo el medio poroso a partir de las secuencias de imágenes grabadas mediante la unión de las imágenes de las 18 posiciones utilizando un software de análisis de imágenes (ver Tabla de materiales) y un algoritmo de costura24.
- Guarde las secuencias de imágenes unidas como una secuencia de imágenes singulares.
NOTA: Si los archivos son demasiado grandes, en este punto, las imágenes se pueden reescalar y agrupar a un tamaño razonable para su posterior procesamiento. - Crea una máscara de los pilares del medio poroso para eliminarlos del análisis.
- Eliminar el fondo de las imágenes dividiéndolas por su fondo con la imagen tomada a t = 0 h (Figura 2A) y binarizar las imágenes en un umbral adecuado para segmentar el biofilm (Figura 2B).
- Calcule la saturación de la biopelícula calculando el área cubierta por la biopelícula (número de píxeles atribuidos a la biopelícula) en comparación con el área vacía del dominio poroso (Figura 3).
Resultados
Para el presente estudio, se utilizó un dispositivo microfluídico con tres canales microfluídicos paralelos con diferentes tamaños de poro (Figura 1) para estudiar sistemáticamente la formación de biopelículas en medios porosos. El proceso de formación de biopelículas se visualizó utilizando microscopía de campo claro. Las células bacterianas y la biopelícula aparecieron en las imágenes como píxeles más oscuros (Figura 2). Además, se observó un proceso gradual de obstrucción; Durante un experimento de 24 h, la biopelícula inicialmente cultivada al azar colonizó casi todo el medio poroso.
La cobertura superficial de la biopelícula en el tiempo cultivado a un caudal de Q = 1 mL/h, que corresponde a una velocidad media inicial del flujo de fluido de 0,96 mm/s, se cuantificó para tres tamaños de poro diferentes (75 μm, 150 μm y 300 μm) (Figura 3, líneas negras). Se encontró que la cobertura superficial, que se utilizó como un proxy para el grado de bioobstrucción, ocurrió un 10% más rápido en el tamaño de poro más pequeño de 75 μm que en el tamaño de poro más grande (300 μm) al comparar la cobertura superficial en t = 20 h. Luego, la cobertura superficial se correlacionó con la acumulación de presión causada por la biopelícula (Figura 3, líneas azules). La obstrucción en el canal microfluídico de tamaño de poro más pequeño condujo a una mayor diferencia de presión entre la entrada y la salida que en los canales microfluídicos de mayor tamaño de poro, lo que indica que los medios porosos de menor tamaño desarrollarán una mayor acumulación de presión cuando se sometan a bioobstrucción.
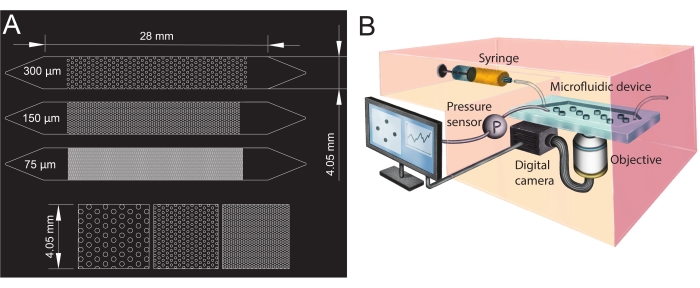
Figura 1: Diseño de canales microfluídicos y configuración experimental. (A) Fotomáscara de los canales microfluídicos con diferentes tamaños de poro (75 μm, 150 μm y 300 μm) utilizados como análogos de medios porosos y una vista ampliada de la disposición de los pilares (fila inferior). Los círculos muestran la ubicación de los pilares (obstáculos impermeables), representando la fase sólida del medio poroso. (B) Esquema de la configuración experimental que muestra la jeringa, el sensor de presión, el dispositivo microfluídico (con un solo canal microfluídico) y la configuración de la cámara digital con el objetivo (es decir, el microscopio). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Visualización y cuantificación del desarrollo del biofilm en el medio poroso. (A) Secuencia de imagen representativa del desarrollo del biofilm al caudal impuesto de Q = 1 mL/h (corresponde a una velocidad media inicial del flujo de fluido de 0,96 mm/s) y un tamaño de poro de d = 300 μm mostrado para los puntos de tiempo experimentales t = 5 h, t = 10 h, t = 15 h y t = 20 h . Las imágenes de campo brillante fueron cosidas y el fondo fue eliminado. (B) La binarización de estas imágenes y la cuantificación del área ocupada por la biopelícula (píxeles oscuros) condujo a la cuantificación de la cobertura superficial en la Figura 3. Haga clic aquí para ver una versión más grande de esta figura.
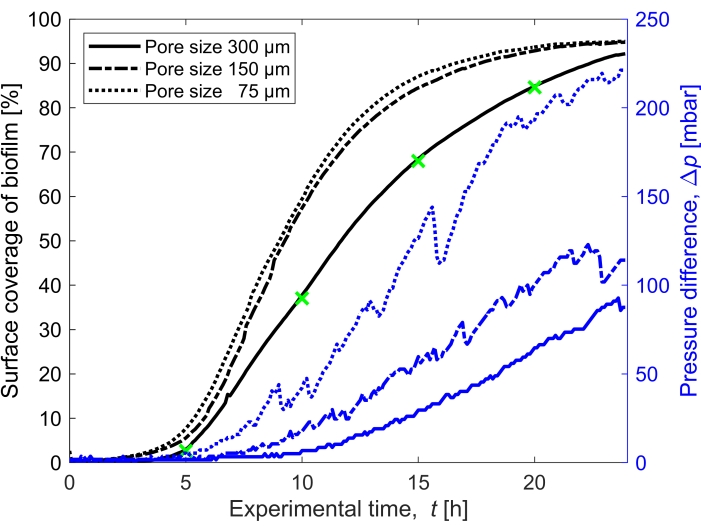
Figura 3: Evolución temporal de la cobertura de biofilm e impacto sobre la presión. Cobertura de biofilm con lectura simultánea de presión para los tres tamaños de poro (300 μm, 150 μm y 75 μm) en las mismas condiciones experimentales que la Figura 2. La diferencia de presión causada por la biopelícula en el canal microfluídico del medio poroso, Δp, (líneas azules) que se muestra en el eje y derecho, aumenta con una mayor cobertura superficial de la biopelícula (líneas negras). Los marcadores verdes corresponden a los puntos de datos de las imágenes que se muestran en la Figura 2. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los análogos de medios porosos microfluídicos junto con sensores de presión proporcionan una herramienta adecuada para estudiar el desarrollo de biopelículas en medios porosos. La versatilidad en el diseño del medio poroso microfluídico, específicamente la disposición de los pilares, incluido el diámetro, las formas irregulares y el tamaño de poro, permite la investigación de muchas geometrías. Estas geometrías van desde poros individuales hasta obstáculos altamente complejos y dispuestos irregularmente que imitan diferentes medios porosos naturales (por ejemplo, suelos) e industriales (por ejemplo, membranas y filtros). En la plataforma microfluídica actual, se crearon tres geometrías de medios porosos con pilares cilíndricos dispuestos regularmente (tamaños de poro: 75 μm, 150 μm y 300 μm), donde se podía elegir el caudal de fluido por experimento. La plataforma presentada se puede adaptar fácilmente para estudiar la bioobstrucción con un cabezal de presión fijo en lugar de un caudal de fluido impuesto. En este caso, el dispositivo de control de flujo debe ser un controlador de presión con un depósito de medio de cultivo en lugar de una bomba de jeringa. Los cambios resultantes en el caudal debido a la bioobstrucción podrían controlarse midiendo el flujo de salida a lo largo del tiempo utilizando un sensor de caudal.
Se deben considerar varios puntos críticos para ejecutar un experimento microfluídico exitoso con el crecimiento de biopelículas. Para evitar la formación de burbujas de aire en el canal microfluídico durante el experimento, el canal microfluídico y el medio de cultivo se desgasificaron (paso 4.3). A continuación, el llenado del canal microfluídico con el medio de cultivo desgasificado debe realizarse de forma rápida pero cuidadosa para obtener un canal completamente saturado sin burbujas de aire. En caso de que las burbujas de aire queden atrapadas en el medio poroso, el lavado del canal microfluídico a un caudal más alto puede eliminar las burbujas después de un corto tiempo. El segundo paso crucial es garantizar un entorno de temperatura constante para reproducir el crecimiento de la biopelícula de manera consistente. El crecimiento de microorganismos varía con la temperatura25, lo que podría conducir a resultados no reproducibles cuando no se mantiene la temperatura estable durante el experimento (en este caso, 24 h). Para la plataforma actual, se utilizó una incubadora de caja alrededor del microscopio, aunque una carcasa más pequeña estable a la temperatura para el dispositivo microfluídico probablemente también sería suficiente. Finalmente, durante la adquisición de la imagen, las posiciones de las imágenes individuales deben elegirse con una superposición de al menos el 15% para obtener suficiente superposición para el algoritmo de costura24.
La plataforma microfluídica actual se limita a la observación bidimensional, mientras que las aplicaciones de medios porosos como el suelo o las membranas tienen una estructura tridimensional. Sin embargo, las ventajas de la plataforma microfluídica cuasi-2D en comparación con las plataformas de medios porosos 3D para estudiar la bioobstrucción son el acceso óptico completo y la alta resolución temporal, ya que las plataformas 3D suelen realizar imágenes de punto final26,27. Además, se espera que el proceso de bioobstrucción (es decir, la evolución temporal de la cobertura superficial) persista en los sistemas3D 26,27, como ocurre también para la distribución del tamaño del clúster de una fase inmiscible dentro de medios porosos28, que presenta la misma escala en sistemas 2D y 3D.
Este método permite medir la respuesta de presión al crecimiento de biofilm en medios porosos mientras se estudia su desarrollo espacio-temporal a alta resolución temporal y espacial y diferentes tamaños de poro. Los conjuntos de datos obtenidos de tales mediciones aportan información sobre la correlación del desarrollo de biopelículas a escala de poros con las respuestas de presión del sistema de medio poroso de biopelícula, y pueden proporcionar un punto de referencia para el modelado numérico de biopelículas. Estos esfuerzos de modelado son especialmente relevantes para ampliar el rango de condiciones (por ejemplo, tamaños de poro, velocidades de flujo y propiedades de biopelícula para otras especies o biopelículas multiespecies) que exceden las capacidades experimentales. Este último es altamente relevante para comprender los mecanismos de bioobstrucción en las cercanías de pozos, aplicaciones de biorremediación y biomineralización 29,30,31. En general, este método podría adaptarse fácilmente para estudiar la biomineralización o rastrear la biotransformación de contaminantes por biopelículas en medios porosos.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores reconocen el apoyo de la subvención SNSF PRIMA 179834 (a E.S.), la financiación discrecional de ETH (a R.S.), ETH Zurich Research Grant (a R.S. y J.J.M.) y la financiación discrecional de Eawag (a J.J.M.). Los autores desean agradecer a Roberto Pioli por ilustrar la configuración experimental en la Figura 1B y a Ela Burmeister por la preparación de la oblea de silicio.
Materiales
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
Referencias
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221(2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197(2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107(2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116(2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316(2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536(2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.