Method Article
Una piattaforma microfluidica per studiare il bioclogging in mezzi porosi
In questo articolo
Riepilogo
Il presente protocollo descrive una piattaforma microfluidica per studiare lo sviluppo di biofilm in mezzi porosi quasi-2D combinando l'imaging al microscopio ad alta risoluzione con misurazioni simultanee della differenza di pressione. La piattaforma quantifica l'influenza della dimensione dei pori e delle portate del fluido nei mezzi porosi sul biointasamento.
Abstract
I biofilm batterici si trovano in diversi mezzi porosi ambientali e industriali, compresi i terreni e le membrane di filtrazione. I biofilm crescono in determinate condizioni di flusso e possono ostruire i pori, reindirizzando così il flusso locale del fluido. La capacità dei biofilm di ostruire i pori, il cosiddetto biointasamento, può avere un enorme effetto sulla permeabilità locale del mezzo poroso, creando un accumulo di pressione nel sistema e influenzando il flusso di massa attraverso di esso. Per comprendere l'interazione tra la crescita del biofilm e il flusso del fluido in diverse condizioni fisiche (ad esempio, a diverse velocità di flusso e dimensioni dei pori), nel presente studio, viene sviluppata una piattaforma microfluidica per visualizzare lo sviluppo del biofilm utilizzando un microscopio in condizioni fisiche controllate imposte dall'esterno. L'accumulo di pressione indotto dal biofilm nel mezzo poroso può essere misurato simultaneamente utilizzando sensori di pressione e, successivamente, correlato con la copertura superficiale del biofilm. La piattaforma presentata fornisce una base per un approccio sistematico per studiare il bioclogging causato da biofilm in mezzi porosi in condizioni di flusso e può essere adattata allo studio di isolati ambientali o biofilm multispecie.
Introduzione
I biofilm - colonie batteriche incorporate in una matrice auto-secreta di sostanze extrapolimeriche (EPS) - sono onnipresenti nei mezzi porosi naturali, come terreni e falde acquifere1, e nelle applicazioni tecniche e mediche, come il biorisanamento2, la filtrazione dell'acqua3 e i dispositivi medici4. La matrice del biofilm è composta da polisaccaridi, fibre proteiche e DNA extracellulare5,6 e dipende fortemente dai microrganismi, dalla disponibilità di nutrienti e dalle condizioni ambientali7. Tuttavia, le funzioni della matrice sono universali; Costituisce l'impalcatura della struttura del biofilm, protegge la comunità microbica dalle sollecitazioni meccaniche e chimiche ed è in gran parte responsabile delle proprietà reologiche dei biofilm5.
Nei mezzi porosi, la crescita dei biofilm può ostruire i pori, causando il cosiddetto biointasamento. Lo sviluppo del biofilm è controllato dal flusso del fluido e dalla dimensione dei pori, definita come la distanza che separa due pilastri, del mezzo poroso 8,9,10. Sia la dimensione dei pori che il flusso del fluido controllano il trasporto dei nutrienti e le forze di taglio locali. A sua volta, il biofilm in crescita ostruisce i pori, influenzando la distribuzione della velocità del fluido 11,12,13, il trasporto di massa e la conduttività idraulica del mezzo poroso 14,15. Le variazioni della conducibilità idraulica si riflettono attraverso l'aumento della pressione nei sistemi confinati 16,17,18,19. Gli attuali studi microfluidici nello sviluppo di biofilm e bioclogging si concentrano sullo studio dell'impatto delle velocità di flusso in geometrie omogenee16,20 (cioè con una dimensione dei pori singolare) o mezzi porosi eterogenei12,21,22. Tuttavia, per districare gli effetti delle portate e della dimensione dei pori sullo sviluppo del biofilm e le conseguenti variazioni di pressione nel mezzo poroso biointasato, è necessaria una piattaforma sperimentale altamente controllabile e versatile che consenta lo studio di diverse geometrie porose e condizioni ambientali in parallelo.
Il presente studio introduce una piattaforma microfluidica che combina misurazioni della pressione con l'imaging simultaneo del biofilm in evoluzione all'interno del mezzo poroso. Grazie alla sua permeabilità ai gas, alla biocompatibilità e alla flessibilità nella progettazione della geometria del canale, un dispositivo microfluidico in polidimetilsilossano (PDMS) è uno strumento adatto per studiare lo sviluppo di biofilm in mezzi porosi. La microfluidica consente il controllo delle condizioni fisiche e chimiche (ad esempio, flusso di fluidi e concentrazione di nutrienti) con elevata precisione per imitare l'ambiente degli habitat microbici23. Inoltre, i dispositivi microfluidici possono essere facilmente ripresi con risoluzione micrometrica utilizzando un microscopio ottico e accoppiati con misurazioni online (ad esempio, la pressione locale).
In questo lavoro, gli esperimenti si concentrano sullo studio dell'impatto della dimensione dei pori in un analogo poroso omogeneo in condizioni di flusso imposte controllate. Il flusso di un terreno di coltura viene imposto utilizzando una pompa a siringa e la differenza di pressione attraverso il canale microfluidico viene misurata simultaneamente con sensori di pressione. Lo sviluppo del biofilm è iniziato seminando una coltura planctonica di Bacillus subtilis nel canale microfluidico. L'imaging regolare del biofilm in evoluzione e l'analisi delle immagini consentono di ottenere informazioni risolte in scala di pori sulla copertura superficiale in varie condizioni sperimentali. Le informazioni correlate del cambiamento di pressione e l'estensione del bioclogging forniscono input cruciali per le stime della permeabilità dei mezzi porosi biointasati.
Protocollo
1. Preparazione del wafer di silicio
- Progettare le geometrie del canale microfluidico in software di progettazione assistita da computer (CAD; vedi Table of Materials) e stamparlo su una pellicola trasparente per creare la fotomaschera (Figura 1A).
- Fabbricare lo stampo principale mediante litografia morbida (in condizioni di camera bianca) seguendo i passaggi seguenti.
- Cuocere il wafer di silicio a 200 °C per 2 ore.
- Posizionare il wafer al centro di uno spin-coater e versare SU8 3050 photoresist (vedi Tabella dei materiali) sul wafer. Spin coat a 1.700 giri/min per 40 s con un tempo di rampa di 10 s/100 giri/min.
NOTA: I parametri di spin-coating sono stati impostati per ottenere uno spessore target di 100 μm per l'SU8 3050. - Dopo il processo di spin-coating, cuocere morbidamente il wafer di silicio a 65 °C per 600 s e 95 °C per 2.700 s. Lasciare raffreddare il wafer a temperatura ambiente durante la notte.
NOTA: Il raffreddamento notturno migliora l'adesione dell'SU8 al wafer. - Posizionare la fotomaschera (punto 1.1) sul wafer ed esporla alla luce UV, con un'energia di esposizione di 250 mJ/cm2 e ad una lunghezza d'onda di 350 nm.
- Dopo l'esposizione, cuocere il substrato esposto a 65 °C per 60 s e 95 °C per 300 s.
- Sviluppare il wafer di silicio per ottenere lo stampo principale immergendolo in un becher riempito con lo sviluppatore mrDev600 (vedere Tabella dei materiali). Agitare delicatamente il becher per 1.800 s per lavare la resistenza non polimerizzata. Quindi, lavare spruzzando isopropanolo sul wafer di silicio e asciugare all'aria.
- Cuocere duramente il wafer di silicio a 200 °C per 1.800 s.
- Silanizzare lo stampo principale attraverso la deposizione di vapore di 20 μL di tricloro (1H, 1H, 2H, 2H-perfluoroottil) silano (vedi Tabella dei materiali) posto su un vetrino accanto allo stampo per 40 minuti in un essiccatore sottovuoto, creando una pressione manometrica di 100 mbar.
2. Fabbricazione del dispositivo microfluidico
NOTA: La procedura di fabbricazione qui descritta è per un dispositivo microfluidico con un canale microfluidico. Tuttavia, lo stesso metodo può essere applicato per fabbricare un dispositivo microfluidico con più canali microfluidici in parallelo.
- Mescolare l'elastomero con il suo reticolante in un rapporto di 10:1 (vedere Tabella dei materiali) per preparare una miscela PDMS. Mescolare il composto fino a quando non diventa uniformemente miscelato e diventa opaco a causa delle bolle d'aria chiuse.
- Degasare la miscela in un essiccatore sottovuoto, creando una pressione manometrica di 100 mbar fino a quando le bolle d'aria intrappolate vengono rimosse e appare trasparente. Il tempo necessario per il degasaggio è in genere di 30 minuti.
- Posizionare lo stampo principale (fase 1) in un piatto di coltura cellulare (vedere Tabella dei materiali). Versare 20 g della miscela PDMS sullo stampo principale per produrre canali con uno spessore finale di 5 mm.
- Cuocere lo stampo principale a 70 °C per 2 ore.
- Tagliare il PDMS polimerizzato attorno al canale microfluidico (a una distanza di circa 3 mm) usando una lama, quindi staccare il canale microfluidico PDMS dallo stampo principale.
- Per creare l'ingresso e l'uscita dei canali microfluidici, praticare fori con un punzone bioptico (diametro di 1,5 mm) alle sue estremità (parte superiore dei triangoli, vedere Figura 1A). Perforare un foro aggiuntivo al centro del triangolo di ingresso per installare il sensore di pressione in un secondo momento.
- Lavare un vetrino e il canale microfluidico con una soluzione detergente all'1% disponibile in commercio (vedi Tabella dei materiali) per 5 minuti, quindi sciacquarli con acqua deionizzata. Successivamente, lavare il canale microfluidico PDMS e il vetrino con isopropanolo. Quindi, sciacquarli nuovamente con acqua deionizzata. Asciugare il canale microfluidico PDMS e il vetrino con aria compressa a 1 bar per 1 min.
NOTA: La struttura porosa del PDMS deve essere completamente asciutta affinché l'incollaggio sia efficace. - Posizionare il vetrino e il canale microfluidico in un pulitore al plasma (vedere Tabella dei materiali) e assicurarsi che le superfici da incollare siano rivolte verso l'alto. Accendere il pulitore al plasma e trattare il canale microfluidico e il vetrino con plasma d'aria ad un flusso d'aria di 1 SL/h (litro standard all'ora) per 1 minuto. Incollare il canale microfluidico al vetrino immediatamente dopo averli estratti dal pulitore mettendoli in contatto tra loro.
NOTA: Assicurarsi di non toccare le superfici trattate, poiché ciò potrebbe influire sull'incollaggio. Quando si fabbrica un dispositivo microfluidico con più canali microfluidici, esporre i canali microfluidici contemporaneamente e legarli in un unico passaggio. - Posizionare il dispositivo microfluidico incollato su una piastra riscaldante a 80 °C per almeno 15 minuti.
- Conservare il dispositivo microfluidico in un piatto di coltura cellulare pulita fino all'inizio dell'esperimento.
3. Preparazione della sospensione batterica
- Far crescere una popolazione di Bacillus subtilis NCIB 3610 20 ore prima dell'inizio dell'esperimento inoculando direttamente 3 ml di brodo nutritivo n. 3 terreno di coltura (vedi Tabella dei materiali) da uno stock di glicerolo congelato in una provetta da 15 ml. Incubare in un incubatore agitatore a 30 °C e 200 giri/min durante la notte (per 16 ore).
- Fare una sottocoltura dalla coltura notturna 4 ore prima dell'inizio dell'esperimento aggiungendo 3 μL della coltura notturna in 3 ml di terreno di coltura fresco (diluizione 1:1.000) in una provetta da 15 ml. Incubare la sottocoltura in un incubatore di scuotimento a 30 °C a 200 rpm per 3,5-4 h per ottenere una densità ottica a 600 nm (OD600) di 0,1.
4. Esperimento di crescita del biofilm
- Accendere l'incubatore box del microscopio 3 ore prima dell'esperimento per garantire una temperatura stabile di 25 °C. Montare la pompa a siringa e i sensori di pressione (vedere Tabella dei materiali).
- Collegare i tubi di ingresso e uscita al dispositivo microfluidico. Inserire direttamente un ago (con un diametro esterno di 0,6 mm) nel tubo di ingresso per fissare il collegamento tra il tubo e la siringa.
- Porre il dispositivo microfluidico, 30 ml di acqua deionizzata e 30 ml di terreno di coltura in un essiccatore sottovuoto e degasarli per almeno 1 ora. Quindi, tirare lentamente il terreno di coltura e l'acqua deionizzata in due siringhe separate da 30 ml.
NOTA: questo passaggio è fondamentale per prevenire la formazione di bolle nel canale durante il lavaggio con il terreno di coltura. - Montare il dispositivo microfluidico sul microscopio e posizionare il tubo di uscita in un contenitore per i rifiuti.
- Collegare la siringa riempita con acqua deionizzata al canale microfluidico attraverso il tubo microfluidico e iniettare lentamente l'acqua fino a quando non esce dall'uscita del sensore di pressione. Riempire il sensore di pressione con acqua e lavare tutte le bolle dal tubo che collega il canale microfluidico e il sensore di pressione. Chiudere l'uscita del sensore di pressione con le viti dedicate al sensore di pressione.
NOTA: La procedura di riempimento descritta garantisce che le variazioni di pressione all'ingresso dei canali microfluidici vengano registrate con precisione. Quando si esegue un esperimento con più canali microfluidici, collegare ciascun canale a una siringa separata per garantire condizioni di flusso uguali in tutti i canali.
- Collegare la siringa riempita con acqua deionizzata al canale microfluidico attraverso il tubo microfluidico e iniettare lentamente l'acqua fino a quando non esce dall'uscita del sensore di pressione. Riempire il sensore di pressione con acqua e lavare tutte le bolle dal tubo che collega il canale microfluidico e il sensore di pressione. Chiudere l'uscita del sensore di pressione con le viti dedicate al sensore di pressione.
- Riempire il resto del canale microfluidico con l'acqua deionizzata.
- Posizionare un filtro da 1,2 μm (vedere Tabella dei materiali) sulla siringa del terreno di coltura. Quindi, rimuovere la siringa ad acqua e collegare con attenzione la siringa del terreno di coltura al tubo microfluidico di ingresso. Montare la siringa sulla pompa a siringa e lavare il canale con il terreno di coltura ad una portata di 2 ml/h per 1 ora.
NOTA: Il filtro impedisce alle cellule batteriche di entrare nella siringa durante il carico. Il lavaggio del canale microfluidico con i terreni di coltura rimuoverà le bolle rimanenti nella struttura porosa. - Impostare la pompa a siringa alla portata desiderata (qui 1 mL/h) durante l'esperimento e impostare la lettura della pressione dei sensori di pressione a zero.
NOTA: Impostando la lettura della pressione iniziale su zero, verrà misurata solo la differenza di pressione causata dallo sviluppo del biofilm durante l'esperimento. - Pipettare 1 mL di coltura batterica a un OD600 di 0,1 in un flaconcino di centrifuga da 1,5 mL. Caricare la coltura batterica nel canale microfluidico inserendo il tubo di uscita nel flaconcino della centrifuga. Dopo aver atteso 5 minuti per rimuovere eventuali bolle d'aria dall'uscita delle provette, prelevare 150 μL di soluzione batterica ad una portata di 1 mL/h, fino a riempire il canale microfluidico con la coltura batterica.
- Rimuovere con cautela il filtro della siringa dei terreni di coltura e posizionare l'uscita nel contenitore dei rifiuti. Lasciare le cellule batteriche in condizioni di flusso zero nel canale microfluidico per 3 ore per consentire il loro attacco superficiale nel mezzo poroso.
NOTA: Lasciare le cellule batteriche in condizioni di flusso zero per 3 ore è stato ottimizzato per l'attacco del ceppo batterico utilizzato garantendo al contempo una coltura batterica ben ossigenata. Altri ceppi batterici potrebbero richiedere più o meno tempo. - Per avviare l'esperimento, avviare il flusso impostando la pompa a siringa sulla portata desiderata (qui 1 mL/h) e avviare la lettura della pressione a 1 Hz.
- Acquisisci immagini del biofilm in crescita nell'intervallo di tempo, nella configurazione ottica e nell'ingrandimento desiderati.
NOTA: Nel presente studio, le immagini con ingrandimento 4x in modalità campo chiaro in 18 posizioni che coprono l'intero dominio del mezzo poroso sono state acquisite ogni 6 minuti per 24 ore.
5. Analisi delle immagini
- Ricostruire l'intero mezzo poroso dalle sequenze di immagini registrate cucendo le immagini dalle 18 posizioni utilizzando un software di analisi delle immagini (vedi Tabella dei materiali) e un algoritmo di cucitura24.
- Salvate le sequenze di immagini cucite come sequenza di immagini singolari.
NOTA: se i file sono troppo grandi, a questo punto, le immagini possono essere ridimensionate e associate a una dimensione ragionevole per ulteriori elaborazioni. - Create una maschera dei pilastri del mezzo poroso per rimuoverli dall'analisi.
- Rimuovere lo sfondo delle immagini dividendole per il loro sfondo con l'immagine scattata a t = 0 h (Figura 2A) e binarizzare le immagini ad una soglia adatta a segmentare il biofilm (Figura 2B).
- Calcolare la saturazione del biofilm calcolando l'area coperta dal biofilm (numero di pixel attribuiti al biofilm) rispetto all'area vuota del dominio poroso (Figura 3).
Risultati
Per il presente studio, è stato utilizzato un dispositivo microfluidico con tre canali microfluidici paralleli con diverse dimensioni dei pori (Figura 1) per studiare sistematicamente la formazione di biofilm in mezzi porosi. Il processo di formazione del biofilm è stato visualizzato utilizzando la microscopia a campo chiaro. Le cellule batteriche e il biofilm sono apparsi nelle immagini come pixel più scuri (Figura 2). Inoltre, è stato osservato un graduale processo di intasamento; Durante un esperimento di 24 ore, il biofilm inizialmente cresciuto in modo casuale ha colonizzato quasi l'intero mezzo poroso.
La copertura superficiale del biofilm nel tempo cresciuto ad una portata di Q = 1 mL/h, che corrisponde a una velocità media iniziale del flusso del fluido di 0,96 mm/s, è stata quantificata per tre diverse dimensioni dei pori (75 μm, 150 μm e 300 μm) (Figura 3, linee nere). È stato riscontrato che la copertura superficiale, che è stata utilizzata come proxy per il grado di biointasamento, si è verificata il 10% più velocemente alla dimensione dei pori più piccola di 75 μm rispetto alla dimensione dei pori più grande (300 μm) quando si confronta la copertura superficiale a t = 20 h. Quindi, la copertura superficiale è stata correlata all'accumulo di pressione causato dal biofilm (Figura 3, linee blu). L'intasamento nel canale microfluidico di dimensioni dei pori più piccole ha portato a una maggiore differenza di pressione tra l'ingresso e l'uscita rispetto ai canali microfluidici di dimensioni dei pori più grandi, indicando che i mezzi porosi di dimensioni più piccole svilupperanno un accumulo di pressione più elevato quando sottoposti a biointasamento.
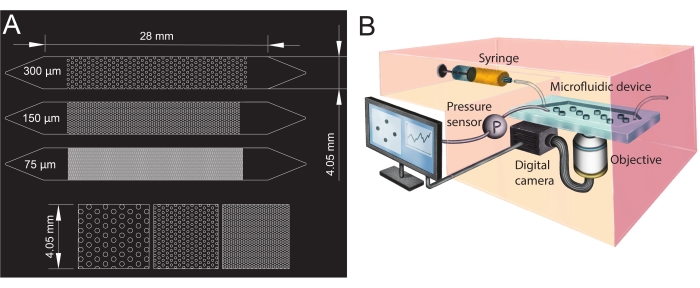
Figura 1: Progettazione di canali microfluidici e configurazione sperimentale. (A) Fotomaschera dei canali microfluidici con diverse dimensioni dei pori (75 μm, 150 μm e 300 μm) utilizzati come analoghi dei media porosi e una vista ingrandita della disposizione dei pilastri (riga inferiore). I cerchi mostrano la posizione dei pilastri (ostacoli impermeabili), che rappresentano la fase solida del mezzo poroso. (B) Schema della configurazione sperimentale che mostra la siringa, il sensore di pressione, il dispositivo microfluidico (con un singolo canale microfluidico) e la configurazione della fotocamera digitale con l'obiettivo (cioè il microscopio). Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Visualizzazione e quantificazione dello sviluppo del biofilm nel mezzo poroso. (A) Sequenza di immagini rappresentative dello sviluppo del biofilm alla portata imposta di Q = 1 mL/h (corrisponde ad una velocità media iniziale del flusso del fluido di 0,96 mm/s) e una dimensione dei pori di d = 300 μm indicata per i punti temporali sperimentali t = 5 h, t = 10 h, t = 15 h e t = 20 h . Le immagini a campo chiaro sono state cucite e lo sfondo è stato rimosso. (B) La binarizzazione di queste immagini e la quantificazione dell'area occupata dal biofilm (pixel scuri) ha portato alla quantificazione della copertura superficiale nella Figura 3. Fare clic qui per visualizzare una versione ingrandita di questa figura.
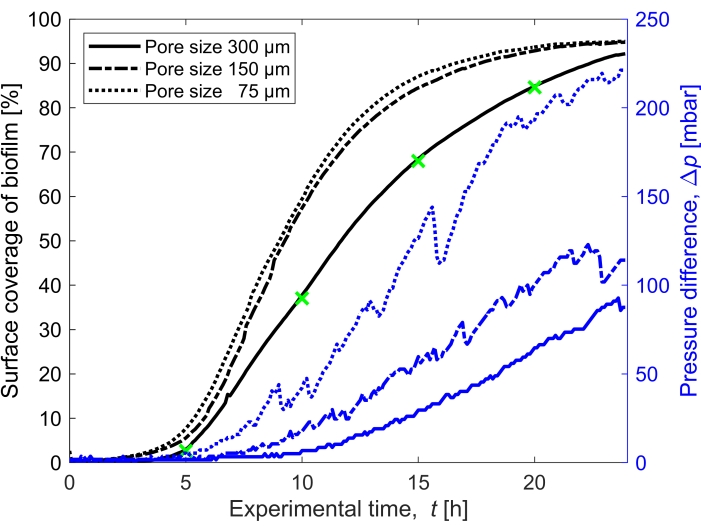
Figura 3: Evoluzione temporale della copertura del biofilm e impatto sulla pressione. Copertura del biofilm con lettura simultanea della pressione per le tre dimensioni dei pori (300 μm, 150 μm e 75 μm) nelle stesse condizioni sperimentali della Figura 2. La differenza di pressione causata dal biofilm nel canale microfluidico poroso medio, Δp, (linee blu) mostrate sull'asse y destro, aumenta con una maggiore copertura superficiale del biofilm (linee nere). Gli indicatori verdi corrispondono ai punti dati delle immagini mostrate nella Figura 2. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Gli analoghi dei fluidi porosi microfluidici accoppiati con sensori di pressione forniscono uno strumento adatto per studiare lo sviluppo di biofilm in mezzi porosi. La versatilità nella progettazione del mezzo poroso microfluidico, in particolare la disposizione dei pilastri, compreso il diametro, le forme irregolari e la dimensione dei pori, consente l'indagine di molte geometrie. Queste geometrie vanno da singoli pori a ostacoli altamente complessi e disposti in modo irregolare che imitano diversi mezzi porosi naturali (ad esempio, terreni) e industriali (ad esempio, membrane e filtri). Nell'attuale piattaforma microfluidica, sono state create tre geometrie porose dei mezzi con pilastri cilindrici disposti regolarmente (dimensioni dei pori: 75 μm, 150 μm e 300 μm), dove la portata del fluido potrebbe essere scelta per esperimento. La piattaforma presentata può essere facilmente adattata per studiare il bioclogging con una testa di pressione fissa piuttosto che una portata di fluido imposta. In questo caso, il dispositivo di controllo del flusso deve essere un regolatore di pressione con un serbatoio di terreno di coltura anziché una pompa a siringa. I conseguenti cambiamenti di portata dovuti al bioclogging potrebbero essere monitorati misurando il deflusso nel tempo utilizzando un sensore di portata.
Diversi punti critici devono essere considerati per eseguire un esperimento microfluidico di successo con la crescita del biofilm. Per evitare la formazione di bolle d'aria nel canale microfluidico durante l'esperimento, il canale microfluidico e il terreno di coltura sono stati degassati (fase 4.3). Successivamente, il riempimento del canale microfluidico con il terreno di coltura degassato deve essere condotto rapidamente ma con attenzione per ottenere un canale completamente saturo senza bolle d'aria. Nel caso in cui le bolle d'aria siano intrappolate nel mezzo poroso, il lavaggio del canale microfluidico a una portata più elevata può rimuovere le bolle dopo un breve periodo di tempo. Il secondo passo cruciale è garantire un ambiente a temperatura costante per riprodurre la crescita del biofilm in modo coerente. La crescita dei microrganismi varia con la temperatura25, il che potrebbe portare a risultati non riproducibili quando non si mantiene stabile la temperatura durante l'esperimento (in questo caso, 24 ore). Per la piattaforma attuale, è stato utilizzato un incubatore a scatola attorno al microscopio, anche se un involucro più piccolo e stabile alla temperatura per il dispositivo microfluidico sarebbe probabilmente sufficiente. Infine, durante l'acquisizione dell'immagine, le posizioni delle singole immagini dovrebbero essere scelte con una sovrapposizione di almeno il 15% per ottenere una sovrapposizione sufficiente per l'algoritmo di cucitura24.
L'attuale piattaforma microfluidica è limitata all'osservazione bidimensionale, mentre le applicazioni di mezzi porosi come il suolo o le membrane hanno una struttura tridimensionale. Tuttavia, i vantaggi della piattaforma microfluidica quasi-2D rispetto alle piattaforme multimediali porose 3D per studiare il bioclogging sono l'accesso ottico completo e l'alta risoluzione temporale, poiché le piattaforme 3D di solito eseguono l'imaging finale26,27. Inoltre, ci si aspetta che il processo di bioclogging (cioè l'evoluzione temporale della copertura superficiale) persista nei sistemi 3D 26,27, come avviene anche per la distribuzione delle dimensioni del cluster di una fase immiscibile all'interno di mezzi porosi28, che presenta lo stesso ridimensionamento nei sistemi2D e 3D.
Questo metodo consente di misurare la risposta della pressione alla crescita del biofilm in mezzi porosi mentre studia il suo sviluppo spazio-temporale ad alta risoluzione temporale e spaziale e diverse dimensioni dei pori. I set di dati ottenuti da tali misurazioni forniscono informazioni sulla correlazione dello sviluppo del biofilm su scala dei pori con le risposte alla pressione del sistema biofilm-mezzo poroso e possono fornire un punto di riferimento per la modellazione numerica dei biofilm. Questi sforzi di modellazione sono particolarmente rilevanti per estendere la gamma di condizioni (ad esempio, dimensioni dei pori, velocità di flusso e proprietà del biofilm per altre specie o biofilm multispecie) che superano le capacità sperimentali. Quest'ultimo è molto rilevante per comprendere i meccanismi di bioclogging in prossimità di pozzi, applicazioni di biorisanamento e biomineralizzazione 29,30,31. Nel complesso, questo metodo potrebbe essere facilmente adattato per studiare la biomineralizzazione o tracciare la biotrasformazione dei contaminanti da biofilm in mezzi porosi.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Gli autori riconoscono il sostegno della sovvenzione SNSF PRIMA 179834 (a E.S.), il finanziamento discrezionale da ETH (a R.S.), ETH Zurich Research Grant (a R.S. e J.J.M.) e finanziamenti discrezionali da Eawag (a J.J.M.). Gli autori ringraziano Roberto Pioli per aver illustrato la configurazione sperimentale in Figura 1B e Ela Burmeister per la preparazione del wafer di silicio.
Materiali
| Name | Company | Catalog Number | Comments |
| Acrodisc 25 mm Syringe Filter, 1.2 µm Versapor Membrane | Pall Corporation | PN4190 | 1.2 µm filters |
| BD 10 mL Syringe (Luer-Lock) | BD | 300912 | used to fill the channel with deionised water |
| Box Incubator | Life Imaging Services | used to have a stable temperature during the biofilm growth experiment | |
| Cell density meter CO8000 | WPA biowave | OD meter | |
| Centrifuge vial | Eppendorf | 30120086 | 1.5 mL |
| CETONI Base 120 | CETONI GmbH | syringe pump | |
| CorelCAD | CorelDRAW | software used to design the microfluidic channel geometries | |
| Culture tubes (14 mL, sterile) | greiner bio-one | Culture tubes | |
| Drying oven, VENTI-Line | VWR | Oven to cure the PDMS | |
| Handy | Migros | Detergent solution | |
| Hot plate with temperature control | VRW | to cure the PDMS-glass bonding after plasma treatment | |
| ImageJ | FIJI | Image analysis software | |
| Innova 42 Inc Shaker (New Brunswick) | Eppendorf | Incubator | |
| Isopropanol (> 99.8%) | Sigma Aldrich | 67-63-0 | |
| Masterflex transfer tubing | Masterflex | HV-06419-05 | 0.020'' ID, 0.06'' OD |
| Micro Slides, Plain, 75 x 60 mm | Corning | 2947-75X50 | Glass slides |
| Microfluidic pressure sensor (1 bar) | Elveflow | Pressure sensors | |
| Miltex Biopsy puncher, diameter 1.5 mm | Integra | Puncher to make the inlet and outlet holes of the microfluidic channel | |
| mrDev600 developer | Microresist | ||
| Nikon Eclipse Ti2 | Nikon Instruments | Microscope | |
| Nutrient broth n°3 | Sigma Aldrich | ||
| Omnifix Syringe with Luer-Lock | B.Braun | syringes of different volume | |
| Plasma chamber Zepto | Diener Electronic | ZEPTO-1 | used to plasma bond the PDMS and the glass slide |
| Precision wipes (Kimtech Science) | Kimberly Clark | KCP-7552 | to dry the glass slide |
| Scale | VWR-CH | 611-2605 | used to weigh the elastomer to crosslinking agent ratio |
| Silicon wafer (10 cm) | Silicon Materials Inc. | N//Phos <100> 1-10 Ω cm | |
| Spincoater, Spin module SM150 | Sawatec | ||
| SU8 3050 Photoresist | Kayakuam | ||
| Süss MA6 Mask aligner | SUSS MicroTec Group | used to align the chrome-glass mask | |
| Sylgard 184 | Dow Corning | silicone elastomer kit; curing agent | |
| Techni Etch Cr01 | Technic | Technic | |
| Tissue culture dish 150 | TPP | 93150 | |
| Trichloro (1H, 1H, 2H, 2H perfluorooctyl) silane | Sigma Aldrich | Sigma Aldrich | used to silanize the silicane wafer |
| Veeco Dektak 6 M | Veeco | Profilometer |
Riferimenti
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nature Reviews Microbiology. 17 (4), 247-260 (2019).
- Cunningham, A. B., Sharp, R. R., Hiebert, R., James, G. Subsurface biofilm barriers for the containment and remediation of contaminated groundwater. Bioremediation Journal. 7 (3-4), 151-164 (2003).
- Pronk, W., et al. Gravity-driven membrane filtration for water and wastewater treatment: A review. Water Research. 149, 553-565 (2019).
- Caldara, M., Belgiovine, C., Secchi, E., Rusconi, R. Environmental, microbiological, and immunological features of bacterial biofilms associated with implanted medical devices. Clinical Microbiology and Infection. 35 (2), 00221(2022).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8 (9), 623-633 (2010).
- Davey, M. E., O'Toole, G. A. Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews. 64 (4), 847-867 (2000).
- Stoodley, P., Dodds, I., Boyle, J. D., Lappin-Scott, H. M. Influence of hydrodynamics and nutrients on biofilm structure. Journal of Applied Microbiology. 85 (1), 19-28 (1998).
- Thomen, P., et al. Bacterial biofilm under flow: First a physical struggle to stay, then a matter of breathing. PLoS ONE. 12 (4), 0175197(2017).
- Horn, H., Reiff, H., Morgenroth, E. Simulation of growth and detachment in biofilm systems under defined hydrodynamic conditions. Biotechnology and Bioengineering. 81 (5), 607-617 (2003).
- Thullner, M., Mauclaire, L., Schroth, M. H., Kinzelbach, W., Zeyer, J. Interaction between water flow and spatial distribution of microbial growth in a two-dimensional flow field in saturated porous media. Journal of Contaminant Hydrology. 58 (3-4), 169-189 (2002).
- Bottero, S., et al. Biofilm development and the dynamics of preferential flow paths in porous media. Biofouling. 29 (9), 1069-1086 (2013).
- Durham, W. M., Tranzer, O., Leombruni, A., Stocker, R. Division by fluid incision: Biofilm patch development in porous media. Physics of Fluids. 24 (9), 091107(2012).
- Coyte, K. Z., Tabuteau, H., Gaffney, E. A., Foster, K. R., Durham, W. M. Microbial competition in porous environments can select against rapid biofilm growth. Proceedings of the National Academy of Sciences. 114 (2), 161-170 (2017).
- Taylor, S. W., Jaffé, P. R. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation. Water Resources Research. 26 (9), 2153-2159 (1990).
- Cunningham, A. B., Characklls, W. G., Abedeen, F., Crawford, D. Influence of biofilm accumulation on porous media hydrodynamics. Environmental Science and Technology. 25 (7), 1305-1311 (1991).
- Valiei, A., Kumar, A., Mukherjee, P. P., Liu, Y., Thundat, T. A web of streamers: Biofilm formation in a porous microfluidic device. Lab on a Chip. 12 (24), 5133-5137 (2012).
- Biswas, I., Sadrzadeh, M., Kumar, A. Impact of bacterial streamers on biofouling of microfluidic filtration systems. Biomicrofluidics. 12 (4), 044116(2018).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Stewart, T. L., Scott Fogler, H. Pore-scale investigation of biomass plug development and propagation in porous media. Biotechnology and Bioengineering. 77 (5), 577-588 (2002).
- Hassanpourfard, M., Ghosh, R., Thundat, T., Kumar, A. Dynamics of bacterial streamers induced clogging in microfluidic devices. Lab on a Chip. 16 (21), 4091-4096 (2016).
- Aufrecht, J. A., et al. Pore-scale hydrodynamics influence the spatial evolution of bacterial biofilms in a microfluidic porous network. PLoS ONE. 14 (6), 0218316(2019).
- Karimifard, S., Li, X., Elowsky, C., Li, Y. Modeling the impact of evolving biofilms on flow in porous media inside a microfluidic channel. Water Research. 188, 116536(2021).
- Yawata, Y., Nguyen, J., Stocker, R., Rusconi, R. Microfluidic studies of biofilm formation in dynamic environments. Journal of Bacteriology. 198 (19), 2589-2595 (2016).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Ratkowsky, D. A., Olley, J., McMeekin, T. A., Ball, A. Relationship between temperature and growth rate of bacterial cultures. Journal of Bacteriology. 149 (1), 1-5 (1982).
- Ostvar, S., et al. Investigating the influence of flow rate on biofilm growth in three dimensions using microimaging. Advances in Water Resources. 117, 1-13 (2018).
- Carrel, M., et al. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development. Water Research. 134, 280-291 (2018).
- Iglauer, S., Favretto, S., Spinelli, G., Schena, G., Blunt, M. J. X-ray tomography measurements of power-law cluster size distributions for the nonwetting phase in sandstones. Physical Review E. 82 (5), 10-12 (2010).
- Wu, C., Chu, J., Wu, S., Cheng, L., van Paassen, L. A. Microbially induced calcite precipitation along a circular flow channel under a constant flow condition. Acta Geotechnica. 14 (3), 673-683 (2019).
- Nassar, M. K., et al. Large-scale experiments in microbially induced calcite precipitation (MICP): reactive transport model development and prediction. Water Resources Research. 54 (1), 480-500 (2018).
- Jimenez-Martinez, J., Nguyen, J., Or, D. Controlling pore-scale processes to tame subsurface biomineralization. Reviews in Environmental Science and Biotechnology. 21 (1), 27-52 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon