Method Article
Amniyotik membrandan Lumikan ekstraksiyonu ve depolama sıcaklığının belirlenmesi
Bu Makalede
Özet
Mevcut protokol, lumikanın amniyotik membrandan () ekstraksiyonunu ve depolama koşullarını, proteinlerini ve lumikan konsantrasyonunu ölçmek için -20 ° C, 4 ° C'de ekstraktı (AME) ve 6, 12, 20 ve 32 gün boyunca oda sıcaklığında (RT) olarak tanımlamaktadır.
Özet
Lumikan, insan amniyotik membranında () kornea epitelizasyonunu ve kollajen liflerinin organizasyonunu teşvik eden, kornea saydamlığını koruyan küçük bir lösin bakımından zengin proteoglikandır. Bu çalışmada, lumikan elde etmek için'den protein ekstraksiyonu için bir yöntem önerilmiştir. Ek olarak, farklı sıcaklık ve zaman periyotlarında depolanan ekstraktındaki (AME) lumikanın stabilitesi değerlendirilir. 100 mg çözüldü ve mekanik olarak epitelden arındırıldı. Deepitelize edilmiş, proteaz inhibitörleri ile 2.5 mL salin tamponu ile çözündürülen ve protein ekstraksiyonu için santrifüj edilen ince bir toz elde edilene kadar donduruldu ve ezildi. Süpernatant toplandı ve 6, 12, 20 ve 32 gün boyunca -20 ° C, 4 ° C ve oda sıcaklığında (RT) saklandı. Daha sonra, lumican her AME'de nicelleştirildi. Bu teknik,'den lumikan ekstraksiyonu için erişilebilir ve edinilebilir bir protokol sağlar. Lumikan konsantrasyonu depolama süresi ve sıcaklık koşullarından etkilendi. -20 ° C ve 4 ° C'de depolanan 12 günlük AME'deki Lumikan, diğer AME'lerden önemli ölçüde daha yüksekti. Bu lumican ekstraksiyonu, tedaviler ve farmasötik çözeltiler geliştirmek için yararlı olabilir. AME lumikan'ın reepitelizasyon ve yara iyileşme sürecindeki kullanımlarını belirlemek için daha ileri çalışmalara ihtiyaç vardır.
Giriş
Kornea etkileri için en çok kullanılan tedavilerden biri amniyotik membran transplantasyonudur; ancak son yıllarda amniyotik dokunun çeşitli bileşenlerinin alternatif ve adjuvan tedaviler olarak kullanılması için yeni öneriler ortaya çıkmıştır. 'nin en çok çalışılan bileşenleri arasında ekstraktından (AME) elde edilenler 1,2,3,4,5,6,7'dir. , antianjiyojenik proteinler, interlökinler (IL), metalloproteinazların doku inhibitörleri (TIMP'ler), nötrofil hücre dışı tuzaklarını inhibe eden TSG-6'nın aracılık ettiği anti-enflamatuar proteinler, büyüme faktörleri: epidermal büyüme faktörü (EGF), dönüştürücü büyüme faktörü (TGF) (alfa ve beta), keratinosit büyüme faktörü (KGF), hepatosit büyüme faktörü (HGF) ve kollajen fibrillogenezidüzenleyerek kornea saydamlığını koruyan lumikan gibi çoklu çözünür faktörler içerir 1, 2,3,4,5,6,7,8,9.
Lumikan, kornea stroma matriksindeki interstisyel kollajenazın ana hücre dışı bileşenlerinden biri olan, kollajen liflerinin organize edilmesinden ve kornea saydamlığının korunmasından sorumlu olan küçük lösin bakımından zengin bir proteoglikan (SLRP) 4,10,11'dir. Proteoglikanlar, hücre dışı matriksteki (ECM) moleküllerdir ve hücre içi sinyalizasyonun gerçekleştirilmesinde ve hücre içi homeostazın korunmasında ana moleküllerdir12. ECM proteinlerinin yara iyileşmesi sırasında proliferasyon, farklılaşma ve göçün hücresel süreçlerini yönlendirdiği bildirilmiştir11.
Kanıtlar, lumikanın kornea reepitelizasyonu sürecine olası katılımını göstermektedir. Saika ve ark., bir çalışmada, kornea yaralanmasından sonra, kornea keratositlerinde lumikanın ilk 8 saat ile yaralanmadan sonraki 3 gün arasında tespit edilebileceğini göstermiştir. İkinci ve üçüncü günde en yüksek lumikan konsantrasyonunu sunan bu proteoglikan daha sonra yedinci gün13'te tespit edilemez. Bu veriler, lumikanın kornea reepitelizasyon sürecinin aktivasyonuna katılımını göstermektedir. Öte yandan, başka bir çalışmada, lumikan yokluğunun yeniden epitelizasyonu geciktirdiği; İlginçtir ki, lumikan eklenmesi yeniden epitelizasyon sürecini hızlandırabilir 4,11,13. Benzer şekilde, yakın tarihli bir çalışma, lumikanın kornea limbus fibroblastlarının14'ünün enflamatuar fonksiyonlarını modüle edebildiğini bildirmiştir, bu da lumikanın enflamatuar, antifibrotik ve yeniden epitelleştirici yanıtın bir modülatörü olarak rol oynadığını düşündürmektedir. Benzer şekilde, lumikan, Fas-FasL gibi sinyal molekülleriyle etkileşime girerek kornea tepkisini modüle edebilir. Ayrıca, nakavt bir Lum-/- fare modelinde lumikanın bulunmaması, lumikan sinyalinin eksikliğinin yeterli kornea onarımını engellediğini göstermiştir15.
Öncelikle, bu yöntem lumikanı'den çıkarmanın uygulanabilir ve ulaşılabilir bir yolunu göstermeyi amaçlamaktadır. Bu avantajlı lumikan ekstraksiyonu yöntemiyle, benzer konsantrasyonlarda protein elde etmek, işlem süresini azaltmak ve önceki çalışmalara kıyasla araştırmacılar için daha uygun hale getirmek mümkündür16. Ayrıca, bu AME lumikanı kornea onarımı ve yeniden epitelizasyon işlemleri için bir adjuvan olarak kullanılabilir.
Protokol
Tüm deneysel prosedürler Kurumsal Gözden Geçirme Kurulu tarafından onaylanmıştır (Proje No. CEI-2020/06/04). , Chavez-García ve ark.17 tarafından tanımlandığı gibi hazırlanan Instituto de Oftalmologia Conde de Valenciana amniyon bankasından (tanımlanmamış insan deneklerden) elde edilmiştir.
1. Amniyotik membran ekstraktının hazırlanması
- Amniyon bankasından 100 mg alın.
NOT: Önceki bir rapora göre, 50 mg toplam 10 ng / mL lumican14 salgılar. Daha yüksek bir lumikan konsantrasyonu elde etmek için, toplam 32cm2'lik bir alana eşdeğer 100 mg kullanın. - donmuşsa, oda sıcaklığında çözün.
NOT: Laminer davlumbaz sınıf II B altında aşağıdaki prosedürleri uygulayın. - 'yi 10 mL steril dengeli tuz çözeltisi (BSS, Malzeme Tablosuna bakınız) ile bir Petri kabında 2 dakika boyunca yıkayın.
- BSS'yi bir beherin içine dökün.
- 3. adımı tekrarlayın ve Petri kabı BSS'de gliserol ortamının bulunmadığını görsel olarak onaylayın.
NOT: 3. adımı yineleyin. Petri kabı BSS'de gliserol ortamı bulunmayana kadar gerektiği gibi.
- 'yi 37 °C'de 10 mL dispase II (1.7 IU / mL, bakınız Malzeme Tablosu) ile inkübe edin, 30 dakika boyunca% 5 CO2 .
NOT: Dispase II, epitel hücreleri üzerinde nazik aktiviteye sahip nötr bir proteazdır. Bu enzim, sağlam epidermisi dermisten etkili bir şekilde ayırır ve sağlam epitel tabakalarını izole eder18. - Dispase inkübasyonundan sonra, bir lastik polis memuru ile mekanik bir deepitelizasyon14 gerçekleştirin (bkz. Mikroskopi görselleştirme ile deepitelizasyonu onaylayın.
NOT: Epitelizasyonun giderilmesi işlemi, 4x ve 20x hedefleri kullanılarak ters çevrilmiş bir mikroskopta doğrulanır. Herhangi bir hücresel tabakanın varlığını dışlamak için dokuyu görselleştirin. - 'yi 2 dakika boyunca 10 mL BSS içeren bir Petri kabında yıkayın. BSS'yi bir beherin içine dökün.
- Epitelize edilmiş'yi (dAM) 2 mL'lik bir mikrosantrifüj tüpüne yerleştirin. dAM'yi 40 dakika boyunca sıvı azot içine batırın.
- Dondurulmuş dAM'yi, ince bir toz elde edilene kadar -85 ° C'de önceden soğutulmuş bir harçta 2-3 dakika boyunca manuel olarak topraklayın.
- Harçta, dAM tozunu 2.5 mL proteaz inhibitörü çözeltisi (proteaz inhibitörleri ile BSS) ile çözün.
NOT: Her proteaz inhibitörü tableti aşağıdaki enzim karışımından oluşur: pankreas ekstresi (0.02 mg / mL), termolizin (metalloproteaz) (0.0005 mg / mL), kimotripsin (0.002 mg / mL), tripsin (0.02 mg / mL) ve papain (0.33 mg / mL) (bkz. - Karışımı bir mikropipetle toplayın ve harç duvarlarını bir neşter bıçağı yardımıyla temizleyin. Karışımı 5 mL'lik bir tüpe yerleştirin.
- 30 s boyunca vorteks ile iyice karıştırın.
- Doku karışımını 4 °C'de 20 dakika boyunca 34 x g'de santrifüj yaparak homojenize edin ve 4 °C'de 20 dakika boyunca 3360 x g'de hemen santrifüj yapın.
- Toplanan süpernatant AME'dir (Şekil 1). Her bir AME'nin 0,7 mL'sini farklı 2 mL mikrosantrifüj tüplerinde 6, 12, 20 ve 33 gün boyunca -20 °C, 4 °C ve oda sıcaklığındaki (RT) farklı sıcaklık koşullarında saklayın.
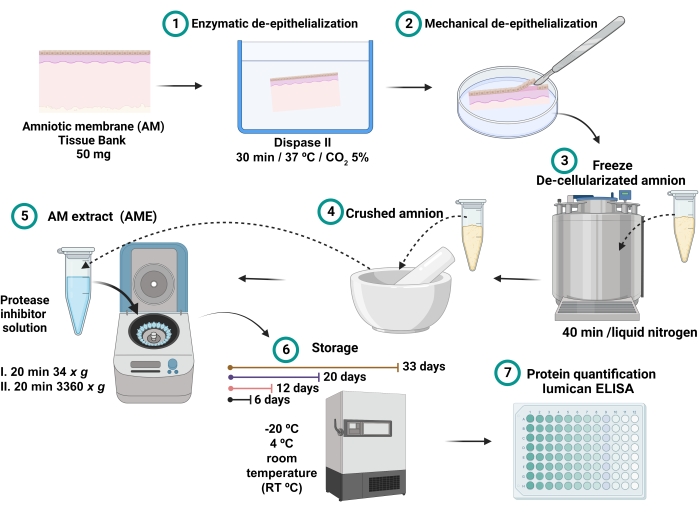
Şekil 1: AME hazırlama ve lumikan konsantrasyonu ölçümü işlemi . 100 mg, 30 dakika boyunca 37 ° C'de dispase II ile inkübe edildi ve mekanik olarak epitelden arındırıldı. Epitelden arındırılmış yıkandı ve 40 dakika boyunca sıvı azota batırıldı ve daha sonra proteaz inhibitörleri ile 2.5 mL salin tamponu ile çözündürülen ve santrifüj edilen ince bir toz elde edilene kadar ezildi. Süpernatant, toplam protein ve lumikan kantitasyonuna kadar 6, 12, 20 ve 32 gün boyunca -20 ° C, 4 ° C ve RT'de toplandı ve saklandı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. AME protein niceliği
NOT: AME'deki toplam proteinin miktarı, obtensiyondan hemen sonra yapılmalıdır. Lowry protein tahlili kullanarak proteinleri ölçün ve üreticinin talimatlarını izleyin (bkz. Tüm standartların ve numunelerin üçlü olarak test edilmesi önerilir.
- Her bir AME örneğinin 40 μL'sini 96 delikli bir mikro plakaya pipetleyin.
- 0-1.500 μg/mL'lik (0, 1, 5, 25, 125, 250, 500, 750, 1.000 ve 1.500 μg/mL) nihai BSA konsantrasyonu için sığır serum albümini (BSA) standardını kullanarak aynı mikroplakaya standart bir eğri hazırlayın.
- Her bir kuyucuğa modifiye edilmiş Lowry reaktifinin 200 μL'lik pipeti. Hemen 30 s boyunca bir plaka karıştırıcı üzerinde karıştırın.
- Mikro plakayı alüminyum folyo ile örtün ve RT'de 10 dakika boyunca inkübe edin.
- Her bir kuyucuğa 20 μL 1x Folin-Ciocalteu reaktifi pipeti. Hemen 30 s boyunca bir plaka karıştırıcı üzerinde karıştırın.
NOT: 1x Folin-Ciocalteu reaktifi hazırlamak için, 2x (2N) reaktif 1:1'i ultra saf su ile seyreltin. Seyreltilmiş reaktif kararsız olduğu için aynı kullanım gününde 1x Folin-Ciocalteu reaktifi hazırlayın. - Mikro plakayı ışıktan alüminyum folyo ile örtün ve RT'de 30 dakika boyunca inkübe edin.
- Bir ELISA plaka spektrometresinde 660 nm'de numunelerin emilimini ölçün (bkz.
NOT: Renk, 650 nm ile 750 nm arasındaki dalga boylarında ölçülebilir. - Standart boş numunelerin 660 nm absorbans değerinin ortalamasını alın ve standart ve bilinmeyen numunelerin diğer 660 nm değerlerinden çıkarın.
- Absorbansı, 10 saniye boyunca düşük sarsıntıya sahip bir uç nokta modunda bir ELISA plaka spektrometresi ile ölçün.
- Bilinmeyen her numunenin protein konsantrasyonunu belirlemek için standart eğriyi kullanın.
- Proteinin hesaplanması için, her standart BSA eğrisinin X eksenindeki mg / mL cinsinden konsantrasyonlara karşı Y eksenindeki absorbans değerlerini kullanarak doğrusal bir regresyon grafiğinden konsantrasyonu belirleyin.
- Protein konsantrasyonunu hesaplamak için doğrusal regresyon ve r değeri denklemini elde edin.
NOT: Sonuçlar, toplam proteinin mg AM'ye (μg / mL protein / mg AM dokusu) göre normalleştirilmiş bağıl konsantrasyon değerleri olarak ifade edilir.
- Protein konsantrasyonunu hesaplamak için doğrusal regresyon ve r değeri denklemini elde edin.
3. AME'de Lumikan'ın nicelleştirilmesi
NOT: Lumikan konsantrasyonu, farklı depolama koşullarında ve zaman periyotlarında depolanan AME'de ölçülmelidir. Sandviç ELISA kullanarak lumikanı ölçün ve üreticinin talimatlarını izleyin. Tüm standartların ve numunelerin mükerrer olarak test edilmesi önerilir.
- İnsan lumikanı yakalama antikorunu (bakınız Malzeme Tablosu) fosfat tamponlu salin (PBS) içindeki kullanılan konsantrasyona göre seyreltin.
NOT: Yakalama antikoru şişesi 120 μg antikor içerir. 0.5 mL PBS ile sulandırıldıktan sonra, yakalama antikorunu 2 μg / mL'lik bir çalışma çözeltisinde seyreltin.- Seyreltilmiş yakalama antikorunun kuyucuğu başına anında 100 μL'yi 96 delikli bir mikro plakaya pipetleyin. Plakayı kapatın ve RT'de gece boyunca inkübe edin.
- Her bir kuyucuğu aspire edin ve 300 μL yıkama tamponu ile pipetleyerek yıkayın: PBS'de% 0.05 polioksietilen sorbitan monolaurat 20, pH 7.2-7.4 (bkz. Üç kez tekrarlayın.
NOT: Son yıkamadan sonra, kalan yıkama tamponunu plakayı her zaman sabitleyerek çıkarın ve kağıt havlulara hafifçe dokunun. - 300 μL reaktif seyreltici ekleyerek plakaları bloke edin: PBS'de% 1 BSA, pH 7.2-7.4, 0.2 μm filtrelenmiş (bkz. RT'de 1 saat boyunca inkübe edin.
- 2. adımı yineleyin.
- 125, 250, 500, 1.000, 2.000, 4.000 ve 8.000 pg/mL'lik nihai konsantrasyonlar için 0-8.000 pg/mL'den iki kat seri seyreltme kullanarak 96 delikli bir mikro plakaya standart bir eğri hazırlayın. ELISA lumican kiti, 75 ng'lik bir rekombinant lumikan standardı içerir (bkz.
- 100 μL numune ve yakalama antikoru kaplı 96 delikli mikroplakaya standart eğri ekleyin.
- Mikro plakayı örtün ve hızı 2-3 rpm arasında tutan kompakt bir rocker'da düşük ajitasyonla RT'de 2 saat boyunca inkübe edin.
- 2. adımı yineleyin.
- Her bir oyuğa 100 μL biyotinillenmiş tespit antikoru ekleyin (bakınız Malzeme Tablosu). Işıktan koruyun ve RT'de 2 saat inkübe edin ve hızı 2-3 rpm arasında tutan kompakt bir rocker'da düşük ajitasyonla inkübe edin.
NOT: Biyotinile tespit edilen antikor şişesi 24 μg antikor içerir. 1.0 mL reaktif seyreltici ile sulandırıldıktan sonra, biyotinile tespit antikorunu 400 ng / mL'lik bir çalışma çözeltisinde seyreltin. - 2. adımı yineleyin.
- Her bir kuyucuğa streptavidin-yaban turpu peroksidazının (HRP, Malzeme Tablosuna bakınız) çalışma seyreltmesinin 100 μL'sini ekleyin. Mikro plakayı ışıktan örtün ve RT'de 20 dakika boyunca inkübe edin.
NOT: Reaktif streptavidin-HRP 40 kat konsantreydi. 1x streptavidin-HRP iş çözeltisi reaktif seyreltici ile yapıldı.
NOT: Plakayı doğrudan ışığa yerleştirmekten kaçının. - 2. adımı yineleyin.
- Son olarak, her bir kuyucuğa 100 μL substrat tetrametilbenzidin (TMB, bakınız Malzeme Tablosu) çözeltisi ekleyin.
NOT: TMB çözeltisini, kit içinde sağlanan eşit hacimli stabilize hidrojen peroksit% 30 çözeltisi ile hazırlayın.
NOT: Çözeltiyi kullanmadan hemen önce hazırlayın ve oda sıcaklığında tutun. - RT'de karanlık bir yerde 30 dakika boyunca kuluçkaya yatın.
NOT: Plakayı doğrudan ışığa yerleştirmekten kaçının. Daha fazla yıkamaya gerek olmadığı için TMB solüsyonunu aspire etmeyin. - Kolorimetrik reaksiyonu durdurmak için 50 μL 1NH2SO4 durdurma çözeltisi ekleyin. Tam karıştırmayı sağlamak için plakaya hafifçe dokunun.
- Bir ELISA plaka spektrometresinde 450 nm'ye ayarlanmış bir mikroplaka okuyucu kullanarak her bir kuyucuğun emiciliğini hemen belirleyin.
- Absorbansı, 10 saniye boyunca düşük sarsıntıya sahip bir uç nokta modunda bir ELISA plaka spektrometresi ile ölçün.
- Standart boş numunelerin 450 nm absorbans değerinin ortalamasını alın ve standart ve bilinmeyen numunelerin diğer 450 nm değerlerinden çıkarın.
- Bilinmeyen her numunenin lumikan konsantrasyonunu belirlemek için standart eğriyi kullanın.
- Lumikan konsantrasyonunun hesaplanması için, her standart lumikan eğrisinin X eksenindeki pg/mL cinsinden konsantrasyonlara karşı Y eksenindeki absorbans değerlerini kullanarak doğrusal bir regresyon grafiği oluşturun.
- Lumikan konsantrasyonunu hesaplamak için doğrusal regresyon ve r değeri denklemini elde edin.
NOT: Lumikan konsantrasyonu, ekstrakte edilen doku mg'ına göre normalleştirildi. Sonuçlar, lumikanın mg'ye (ng/mL lumikan/mg dokusu) normalize edilmiş bağıl konsantrasyon değerleri olarak ifade edilir.
- Lumikan konsantrasyonunu hesaplamak için doğrusal regresyon ve r değeri denklemini elde edin.
Sonuçlar
Sonuçlar standart sapmanın (SD) ortalama değeri ± olarak raporlanır. Öğrencinin t-testleri ve varyans analizi (ANOVA) yapıldı. 0.05 < P değerleri istatistiksel olarak anlamlı kabul edildi. İstatistiksel analiz, istatistik yazılımı kullanılarak gerçekleştirilmiştir (bakınız Malzeme Tablosu).
AME'deki toplam protein miktarı zaman ve depolama koşullarından etkilenmiştir. Bazal protein konsantrasyonu tüm AME arasında benzerdi; toplam protein aralığı, değerlendirilen örnekler arasında anlamlı bir fark olmaksızın 2.7 ± 0.3 μg / mL idi. Bununla birlikte, numuneler 12, 20 ve 32 gün boyunca saklandığında, bazal konsantrasyona göre protein konsantrasyonunda değişkenlik gözlenmiştir. İlginç bir şekilde, protein konsantrasyonu, AME'de 4 ° C'de ve -20 ° C'de, tüm depolama zamanlarında RT'ye göre artmıştır.
Benzer şekilde, protein konsantrasyonu depolama süreleri arasında karşılaştırıldığında, 12, 20 ve 32 gün sonra değişti. RT durumuna kıyasla 4 °C ve -20 °C'de 32 ve 20 günlük AME'de anlamlı bir fark (p < 0.05) bulunmuştur (Şekil 2), elde edilen farklı AME'lerde sıcaklığın protein korunumu için önemli olduğunu düşündürmektedir.

Şekil 2: AME'deki toplam protein konsantrasyonu zaman ve depolama sıcaklığından etkilenir. AME üzerindeki protein ekstraksiyonunun konsantrasyonu, sıcaklık ve zaman depolama koşullarından önce ve sonra ölçülmüştür. Değerlendirilen depolama süresi, üç farklı sıcaklık koşuluna (RT °C, 4 °C ve -20 °C) kıyasla 6 gün (siyah üçgenler), 12 gün (pembe üçgenler), 20 gün (mor kare) ve 32 gün (kahverengi daireler) idi. Bazal protein konsantrasyonu tüm AME arasında benzerdi. Farklı sıcaklık koşullarında bazal protein konsantrasyonuna göre 20 ve 32 günlük AME'de protein konsantrasyonunda anlamlı bir fark vardı. Her koşulda n = 3. Veriler, 0.05 ± SE * p < μg / mL protein medyanı olarak ifade edilir (S1 32 güne karşı S1 20, 12 ve 6 gün 4 ° C'de); (-20 °C'de S1 20, 12 ve 6 güne karşı S1 32 gün). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Lumikan konsantrasyonu depolama süresi ve sıcaklık koşullarından etkilendi. AME'de 6, 20 ve 32 gün boyunca saklanan 12 günlük depolamaya kıyasla daha az lumikan konsantrasyonu bulundu. Önemli bir şekilde, 12 günlük AME, 20 ve 32 günlük depolamadan daha yüksek bir lumikan konsantrasyonuna sahipti (p < 0.05).
AME'deki lumikan konsantrasyonu depolama sıcaklıkları arasında karşılaştırıldığında, 12 gün boyunca -20 ° C ve 4 ° C'de saklanırsa daha yüksek bir lumikan konsantrasyonu bulunmuştur (Şekil 3). İlginç bir şekilde, 4 ° C'ye kıyasla -20 ° C'de saklanırsa, 12 günlük AME'de daha yüksek (p < 0.05) lumikan konsantrasyonu bile bulunmuştur.
Bu, lumikan konsantrasyonunun sıcaklık koşullarından ve depolama süresinden etkilendiğini ve en yüksek lumikan konsantrasyonunu elde etmek için uygun depolama süresinin ve sıcaklığının -20 ° C'de 12 gün olduğunu düşündürmektedir.
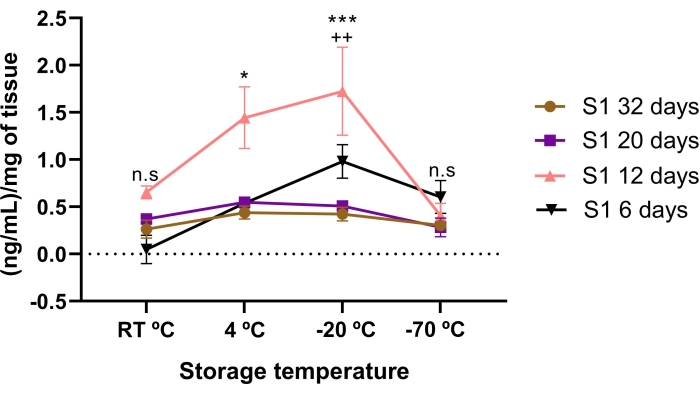
Şekil 3: AME'deki toplam lumikan konsantrasyonu zaman ve depolama sıcaklığından etkilenir. Lumikan konsantrasyonu depolama süresi ve sıcaklık koşullarından etkilendi. AME'deki lumikan konsantrasyonu, sıcaklık ve zaman depolama koşullarından önce ve sonra ölçülmüştür. Değerlendirilen depolama süresi, üç farklı sıcaklık koşuluna (RT °C, 4 °C ve -20 °C) kıyasla 6 gün (siyah üçgenler), 12 gün (pembe üçgenler), 20 gün (mor kare) ve 32 gün (kahverengi daireler) idi. 12 günlük AME'deki Lumikan, -20 °C ve 4 °C sıcaklık koşullarında 32, 20 ve 6 günlük AME'ye kıyasla anlamlı derecede yüksekti. *p < 0.05 (S1 12 gün vs S1 32, 20 ve 6 gün 4 °C'de); p < 0,001 (-20°C'de S1 12 gün ile S1 32, 20 ve 6 gün). AME'deki en yüksek lumikan konsantrasyonu 12 günde -20 ° C'de depolandı. ++p < 0.01 (S1 12 gün 4 ° C'ye karşı S1 12 gün -20 ° C). 32 ve 20 günlük AME'deki lumikan arasında, depolama sıcaklığı koşullarına (n.s.) kıyasla anlamlı bir fark yoktu. Her koşulda (n = 3), veriler proteinin ng / mL'sinin medyanı olarak ifade edilir. Veriler istatistiksel anlamlılık açısından değil, mg doku ± SE. (n.s.) ile normalleştirildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışmada, AME'de lumikanın varlığı ve farklı depolama koşulları altındaki stabilitesi ile doğrudan ilişkisi analiz edilmiştir. İlginç bir şekilde, AME'deki toplam protein konsantrasyonu ölçüldüğünde, protein konsantrasyonu depolamadan sonra artmıştır. Kanıtlar, dondurulmuş depodaki protein konsantrasyonunu değiştirebilecek üç mekanizma önermektedir: soğuk denatürasyon, çözünenlerin dondurulmuş konsantrasyonu ve protein yapısının buzla indüklenen kısmi açılması19. Dondurma işlemi, numunedeki sıvı fazın kristalleşmesi nedeniyle depolama numuneleri üzerindeki protein konsantrasyonunu etkileyebilir. Sonuçlar, bunun, dondurucudaki depolama süresinden etkilenen konsantrasyonun dondurulması işlemi olarak gerçekleşmiş olabileceğini düşündürmektedir. Daha uzun depolama zamanlarında (32 ve 20 gün) ve en düşük sıcaklıklarda (4 ° C ve -20 ° C) daha yüksek bir protein konsantrasyonu gözlenmiştir. Bununla birlikte, en yüksek protein konsantrasyonuna sahip dönem, en yüksek lumikan konsantrasyonuna sahip değildi; bu, lumikanın donmuş sıcaklıklardan ve zaman koşullarından etkilenebileceğini düşündürmektedir.
Sonuçlara göre, lumikan konsantrasyonu 4 ° C ve -20 ° C'de 12 günlük depolamada daha yüksek ve daha kararlıydı. Bununla birlikte, 6 günde 12 güne kıyasla daha az lumikan konsantrasyonu bulundu. Bazı raporlar, dondurulmuş depolama koşullarından sonra protein konsantrasyonunun değişebileceğini düşündürmektedir20. Sonuçlar, numunelerin dondurulması sırasında meydana gelen protein yapısının buz kaynaklı kısmi açılması adı verilen termodinamik bir mekanizmadan kaynaklanabilir. Sulu çözeltilerdeki proteinlerin su ile etkileşimi, diğer moleküllerle etkileşimlerini azaltır. Donmuş koşullar altında suyun kristalleşme süreci, proteinlerin ve bazı fonksiyonel bölgelerin diğer moleküllerle etkileşime girmesine izin verir19. Yukarıda belirtilenlerle, sulu bir çözelti içinde lumikanın 12 gün dondurulmasından sonra, daha yüksek bir konsantrasyonla sonuçlanmak için ELISA nicelleştirme kitinde bulunan antikorlarla etkileşime girebilir. Öte yandan, muhtemelen altıncı günde, lumikan sulu çözeltide tenha olabilirdi.
İlerleyen yeniliklerde, kullanımı, etiyolojiden bağımsız olarak kornea reepitelizasyonu için son teknoloji tedavidir. Daha önce de belirtildiği gibi,'nin faydaları çok geniştir 21,22,23,24,25,26. Birçok yazar, AME'de lumikanın faydalarını göstermiş ve özellikle gelişmekte olan ülkeler için uygun fiyatlı bir alternatif haline getirmiştir 1,2,3,4,5,6,7,8,9. Şu anda, AME'de lumikanın birçok faydası vardır; tedavi olarak kullanımı kornea yeniden epitelizasyonunu destekler ve kornea ülserlerinin prognozunu iyileştirir 4,5,6,7,8,9,10,11,12,13,14,15. transplantasyonu (AMT) çeşitli kornea hastalıklarının iyileştirilmesinde büyük yararı olan bir tedavi haline gelmiştir24,25. Bununla birlikte, kornea dokusunun kalıcı epitel defektleri (PED) ve limbal kök hücre eksiklikleri (LESCD) gibi kornea onarımına yardımcı olan biyolojik faktörlerin varlığının sürekli tedavi ve bakımını gerektiren bazı kronik etkileri vardır21,24. Günümüzde AMT'nin kornea yüzeyinde salgıladığı faktörlerin uzun süreli bakımını sağlayan adjuvan tedaviler bulunmamaktadır. Bununla birlikte, hasta güvenliği için AMT'nin sürekli değiştirilmesi önerilememiştir26. Bu nedenle, AMT'nin işlevlerinin, lumikan gibi kornea dokusunda tarafından salınan faktörlerin varlığını daha uzun süre sürdürmeye yardımcı olmasına ve korunmasına yardımcı olan, korneanın kalıcı sorunlarının tedavisini desteklemeyi amaçlayan alternatifler geliştirmek gerekir27.
Lumikan,'de anti-enflamatuar ve antifibrotik fonksiyonları olan faktörlerden biridir ve kornea onarım sürecinde fonksiyonlara sahip olduğu bildirilmiştir 6,7,8,9,10,11,12,13,14,15 . Bu nedenle lumican, kornea duygularının tedavisinde yardımcı olmak için iyi bir aday olmayı önerir; Bununla birlikte, kornea yeniden epitelizasyonunu sağlamak için AME'de lumikanın etkinliğini belirlemek için ek araştırmalara ihtiyaç vardır.
Lumikan, hücre dışı matriks bileşiklerinin kollajen olarak salgılanmasını düzenlediği gösterilen bir proteoglikandır; Ayrıca, fibroblast aktivasyonu ve inflamatuar hücrelerin modülasyonunda ve anjiyogenez sürecinde rol oynar ve yara iyileşmesinde önemli bir rol oynar. Sonuçlara göre, lumikan dokusundan çıkarılabilir. Lumikan'ın terapötik uygulamaları çoktur; AME'de lumikan kullanımı, oküler bozukluklar için ulaşılabilir bir terapötik seçenek sağlar 4,13. AME kullanmanın birincil avantajı, sulu bileşimi göz önüne alındığında, oküler yüzey için topikal bir tedavi olarak kolay bir uygulama sağlamasıdır. Benzer şekilde, anti-enflamatuar ve immünoregülatör özelliklere sahip diğer proteinler, dokusundan ekstrakte edilen bileşenlerde bulunabilir ve bu da gözdeki epitelizasyon problemlerinin tedavisinde daha büyük bir fayda sağlayabilir. Örneğin, ve hücresel bileşenlerde bulunan TSG-6 gibi diğer anti-enflamatuar faktörlerin daha önce immünoregülatör özelliklere sahip olduğu bildirilmiştir8. Bu nedenle, AME'de bulunan lumikan ve diğer hücre dışı matriks bileşiklerinin ve immünomodülatör moleküllerin kombine bir tedavisi, yeniden epitelizasyon ve yara iyileşme sürecinde yararlı olabilir.
Bu yöntem, bol miktarda protein ve faktörlerin gözlenmesi için yararlı olan protein ekstraksiyonu için basit bir teknik göstermeyi amaçlamaktadır. Bu yöntem için kritik hususlardan biri, proteaz inhibitörlerinin kullanılmasıdır, çünkü, protein bozulmasını önlemek için enzimatik bileşiklerin yüklerine sahip bir doku olduğu için başarılı protein ekstraksiyonu için temeldir27. Kanıtlar, protein inhibitörlerinin sulu bir çözelti ile birlikte kullanılmasının, doku26'da HGF gibi diğer faktörlerin ekstraksiyonunu arttırdığını bildirmiştir. 'nin dondurulmasından ve topraklanmasından sonra ince bir tozun tıkanması, AME'nin optimal obtensiyonu için gereklidir, çünkü bu işlem sitozolik ve diğer nükleer bileşiklerin ekstraksiyonu için gerekli yapıların doku ve hücresel bozulması için uygundur28,29.
Bu ekstraksiyon yönteminin birkaç sınırlaması, kullanılan miktarının yüksek ölçekli bir ekstraksiyona izin verememesidir. Bu protokol, sınırlı miktarda dokudan protein ekstraksiyonuna izin verir; çünkü bu yöntemin daha büyük bir doku alanından daha fazla miktarda protein elde edilmesine izin verdiğine dair bir kanıt yoktur. Diğer ekstraksiyon yöntemlerine kıyasla göz önünde bulundurulması gereken sorun giderme, fazla enzimler proteinlerietkileyebileceğinden 30 ve tekniğin etkinliğini azaltabileceğinden, uygun bir proteaz inhibitörü konsantrasyonu ve inkübasyon süresi kullanmaktır.
Bu tekniğin bir kısmı, santrifüjleme ve ekstraksiyon işleminin tekrarlanmasının protein ekstraksiyonunu arttırdığını açıklayan Mahbod ve ark.16 tarafından bildirilenlerden modifiye edilmiştir. Mahbod'un aksine, sonuçlar üç döngü santrifüjlemeden sonra protein konsantrasyonunu bildirmedi. Toplam protein konsantrasyonu belirlendiğinde, ikinci bir ekstraksiyonda% 80 ve üçüncü bir ekstraksiyonda% 97'ye kadar azalmıştır. Sadece bir ekstraksiyon yapmak işlem süresini azaltır ve toplam protein miktarını azaltmaz. Öncekilerle birlikte, burada bildirilen ekstraksiyon yöntemi, olumlu sonuçlara sahip yalnızca bir santrifüjleme adımı gerektirir.
Bu teknik,'de bulunan diğer faktörleri ve proteinleri çıkarmak ve ayrıca hayvanlar veya sebzeler gibi diğer kaynaklardan faktörler elde etmek için kullanılabilir. Ayrıca, temel araştırmaları yürütmek veya hatta formülasyonların ve tedavilerin geliştirilmesini sağlamak için proteinlerin elde edilmesi için bir uygulamaya da sahip olabilir.
Bu sonuçlar, lumikanın'den çıkarılabileceğini ve hem -20 ° C hem de 4 ° C sıcaklık koşullarında AME olarak 12 gün boyunca saklanabileceğini göstermektedir. Lumikan'ın AME olarak terapötik etkilerini elde etmek için yarı ömrünü dikkate almak önemlidir. AME lumikanının kornea epitel hücrelerindeki rolünü belirlemek ve kornea reepitelizasyonu için ideal lumikan dozunu belirlemek için daha ileri çalışmalara ihtiyaç vardır.
Sonuç olarak, sonuçlar AME'de lumikan gibi faktörlerin elde edilmesinin mümkün olduğunu göstermektedir. Benzer şekilde, sıcaklık ve depolama süresi koşulları AME'de bulunan lumikan konsantrasyonunu etkiler.
Açıklamalar
Çalışma, Universidad Nacional Autonoma de Mexico Araştırma ve Teknolojik İnovasyon Projeleri Destek Programı (Hibe No. PAPIIT IN203821) ve Eğitim, Bilim, Teknoloji ve İnovasyon Bakanlığı (Hibe No. SECTEI 250/2019) tarafından finanse edilmiştir.
Teşekkürler
Yazarların rekabet eden finansal çıkarları yoktur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
Referanslar
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır