Method Article
استخلاص اللوميكان من الغشاء الأمنيوسي وتحديد درجة حرارة تخزينه
In This Article
Summary
يصف البروتوكول الحالي استخراج اللوميكان من الغشاء الأمنيوسي (AM) وظروف تخزينه كمستخلص AM (AME) عند -20 درجة مئوية و 4 درجات مئوية ودرجة حرارة الغرفة (RT) لمدة 6 و 12 و 20 و 32 يوما لتحديد بروتيناته وتركيز اللوميكان.
Abstract
Lumican هو بروتيوغليكان صغير غني بالليوسين في الغشاء الأمنيوسي البشري (AM) الذي يعزز ظهارة القرنية وتنظيم ألياف الكولاجين ، والحفاظ على شفافية القرنية. في العمل الحالي ، تم اقتراح طريقة لاستخراج البروتين من AM للحصول على lumican. بالإضافة إلى ذلك ، يتم تقييم استقرار lumican في مستخلص AM (AME) المخزن في درجات حرارة وفترات زمنية مختلفة. تم إذابة 100 ملغ من AM وإزالة الظهارة الميكانيكية. تم تجميد AM المنزوع الظهارة وسحقه حتى يتم الحصول على مسحوق ناعم ، والذي تم إذابته ب 2.5 مل من المحلول الملحي مع مثبطات الأنزيم البروتيني والطرد المركزي لاستخراج البروتين. تم جمع المادة الطافية وتخزينها في -20 درجة مئوية و 4 درجات مئوية ودرجة حرارة الغرفة (RT) لمدة 6 و 12 و 20 و 32 يوما. بعد ذلك ، تم تحديد كمية lumican في كل AME. تسمح هذه التقنية ببروتوكول يمكن الوصول إليه واكتسابه لاستخراج اللوميكان من AM. تأثر تركيز اللوميكان بوقت التخزين وظروف درجة الحرارة. كان Lumican في AME لمدة 12 يوما مخزنا عند -20 درجة مئوية و 4 درجات مئوية أعلى بكثير من AME الأخرى. يمكن أن يكون استخراج اللوميكان هذا مفيدا لتطوير العلاجات والحلول الصيدلانية. هناك حاجة إلى مزيد من الدراسات لتحديد استخدامات AME lumican في عملية إعادة الاندمال وشفاء الجروح.
Introduction
واحدة من العلاجات الأكثر استخداما لأمراض القرنية هو زرع الغشاء الأمنيوسي. ومع ذلك ، في السنوات الأخيرة ، ظهرت مقترحات جديدة لاستخدام مكونات مختلفة من الأنسجة الأمنيوسية كعلاجات بديلة ومساعدة. من بين المكونات الأكثر دراسة من AM هي تلك التي تم الحصول عليها من استخراج AM (AME)1،2،3،4،5،6،7. يحتوي AM على العديد من العوامل القابلة للذوبان مثل البروتينات المضادة لتولد الأوعية ، والإنترلوكينات (IL) ، ومثبطات الأنسجة للبروتينات المعدنية (TIMPs) ، والبروتينات المضادة للالتهابات بوساطة TSG-6 التي تمنع مصائد العدلات خارج الخلية ، وعوامل النمو: عامل نمو البشرة (EGF) ، عامل النمو المحول (TGF) (ألفا وبيتا) ، عامل نمو الخلايا الكيراتينية (KGF) ، عامل نمو خلايا الكبد (HGF) ، ولوميكان ، الذي يحافظ على شفافية القرنية من خلال تنظيم تكوين ألياف الكولاجين1 ، 2،3،4،5،6،7،8،9.
Lumican هو بروتيوغليكان صغير غني بالليوسين (SLRP) ، وهو أحد المكونات الرئيسية خارج الخلية للكولاجيناز الخلالي في مصفوفة سدى القرنية ، وهو مسؤول عن تنظيم ألياف الكولاجين والحفاظ على شفافية القرنية4،10،11. البروتيوغليكان هي جزيئات في المصفوفة خارج الخلية (ECM) ، وهي الجزيئات الرئيسية في تنفيذ إشارات الخلية والحفاظ على التوازن داخل الخلايا12. تم الإبلاغ عن بروتينات ECM لدفع العمليات الخلوية للانتشار والتمايز والهجرة أثناء التئام الجروح11.
تشير الأدلة إلى احتمال مشاركة اللوميكان في عملية إعادة الظهارة القرنية. أظهر Saika et al. ، في دراسة ، أنه بعد إصابة القرنية ، يمكن اكتشاف lumican في خلايا القرنية القرنية بين أول 8 ساعات وحتى 3 أيام بعد الإصابة. تقديم أعلى تركيز من lumican في اليوم الثاني والثالث ، وهذا البروتيوغليكان لا يمكن اكتشافه في اليوم السابع13. تشير هذه البيانات إلى مشاركة اللوميكان في تنشيط عملية إعادة الاندمال الظهاري للقرنية. من ناحية أخرى ، في دراسة أخرى ، أفيد أن عدم وجود lumican يؤخر إعادة الاندمال الظهاري. ومن المثير للاهتمام ، أن إضافة Lumican يمكن أن يسرع عملية إعادة الاندمال الظهاري4،11،13. وبالمثل ، أفادت دراسة حديثة أن اللوميكان يمكن أن يعدل الوظائف الالتهابية للخلايا الليفية القرنية14 ، مما يشير إلى دور اللوميكان كمغير للاستجابة الالتهابية والمضادة للتليف وإعادة الاندمال. وبالمثل ، يمكن لوميكان تعديل استجابة القرنية من خلال التفاعل مع جزيئات الإشارة مثل Fas-FasL. أيضا ، أظهر غياب lumican في نموذج Lum-/- mouse بالضربة القاضية أن عدم وجود إشارات lumican يمنع إصلاح القرنية الكافي15.
في المقام الأول ، تهدف هذه الطريقة إلى إظهار طريقة مجدية وسهلة لاستخراج اللوميكان من AM. باستخدام هذه الطريقة المفيدة لاستخراج اللوميكان ، من الممكن الحصول على تركيزات مماثلة من البروتينات ، مما يقلل من وقت المعالجة ويجعلها أكثر ملاءمة للمحققين مقارنة بالدراسات السابقة16. علاوة على ذلك ، يمكن استخدام AME lumican كمساعد لإصلاح القرنية وعمليات إعادة الاندمال الظهاري.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية من قبل مجلس المراجعة المؤسسية (رقم المشروع. CEI-2020/06/04). تم الحصول على AM من Instituto de Oftalmologia Conde de Valenciana amnion bank (من أشخاص مجهولي الهوية) ، والذي تم إعداده كما وصفه شافيز غارسيا وآخرون 17.
1. إعداد مستخلص الغشاء الأمنيوسي
- الحصول على 100 ملغ من AM من بنك السلى.
ملاحظة: وفقا لتقرير سابق ، يفرز 50 مجم من AM ما مجموعه 10 نانوغرام / مل من اللوميكان14. للحصول على تركيز أعلى من lumican ، استخدم 100 ملغ من AM ، أي ما يعادل مساحة إجمالية قدرها 32 سم2. - إذا تم تجميد AM ، قم بإذابته في درجة حرارة الغرفة.
ملاحظة: نفذ الإجراءات التالية تحت غطاء التدفق الصفحي من الفئة II B. - اغسل AM في طبق بتري مع 10 مل من محلول الملح المتوازن المعقم (BSS ، انظر جدول المواد) لمدة 2 دقيقة.
- صب BSS في دورق.
- كرر الخطوة 3 وتأكد بصريا من أن وسيط الجلسرين غير موجود في طبق بتري BSS.
ملاحظة: كرر الخطوة 3. حسب الحاجة حتى لا يكون وسط الجلسرين موجودا في طبق بتري BSS.
- احتضان AM مع 10 مل من dispase II (1.7 وحدة دولية / مل ، انظر جدول المواد) عند 37 درجة مئوية ، 5٪ CO2 لمدة 30 دقيقة.
ملاحظة: Dispase II هو بروتياز محايد مع نشاط لطيف على الخلايا الظهارية. يفصل هذا الإنزيم بشكل فعال البشرة السليمة عن الأدمة ويعزل الأوراق الظهارية السليمة18. - بعد الحضانة dispase ، قم بإجراء إزالة الظهارة الميكانيكية14 مع شرطي مطاطي (انظر جدول المواد). تأكيد إزالة الظهارة عن طريق التصور المجهري.
ملاحظة: يتم تأكيد عملية إزالة الظهارة في مجهر مقلوب باستخدام أهداف 4x و 20x. تصور الأنسجة لاستبعاد وجود أي طبقة خلوية. - اغسل AM في طبق بتري مع 10 مل من BSS لمدة 2 دقيقة. صب BSS في دورق.
- ضع AM (dAM) غير الظهاري في أنبوب طرد مركزي دقيق سعة 2 مل. اغمر dAM في النيتروجين السائل لمدة 40 دقيقة.
- قم بتأريض dAM المجمد يدويا لمدة 2-3 دقائق في ملاط مبرد مسبقا عند -85 درجة مئوية حتى يتم الحصول على مسحوق ناعم.
- في الهاون ، قم بإذابة مسحوق dAM ب 2.5 مل من محلول مثبطات الأنزيم البروتيني (BSS مع مثبطات الأنزيم البروتيني).
ملاحظة: يتكون كل قرص من مثبطات الأنزيم البروتيني من الخليط التالي من الإنزيمات: مستخلص البنكرياس (0.02 مجم / مل) ، ثيرموليزين (ميتالوبروتيز) (0.0005 مجم / مل) ، كيموتريبسين (0.002 مجم / مل) ، تربسين (0.02 مجم / مل) ، وغراء (0.33 مجم / مل) (انظر جدول المواد). - جمع الخليط مع micropipette ، وتنظيف جدران هاون بمساعدة سكين مشرط. ضع الخليط في أنبوب سعة 5 مل.
- تخلط جيدا مع دوامة لمدة 30 ثانية.
- تجانس خليط الأنسجة عن طريق الطرد المركزي عند 34 × جم لمدة 20 دقيقة عند 4 درجات مئوية والطرد المركزي على الفور عند 3360 × جم لمدة 20 دقيقة عند 4 درجات مئوية.
- الطافت الذي تم جمعه هو AME (الشكل 1). قم بتخزين 0.7 مل من كل AME في أنابيب طرد مركزي دقيقة مختلفة سعة 2 مل لمدة 6 و 12 و 20 و 33 يوما في ظروف درجات حرارة مختلفة تبلغ -20 درجة مئوية و 4 درجات مئوية ودرجة حرارة الغرفة (RT).
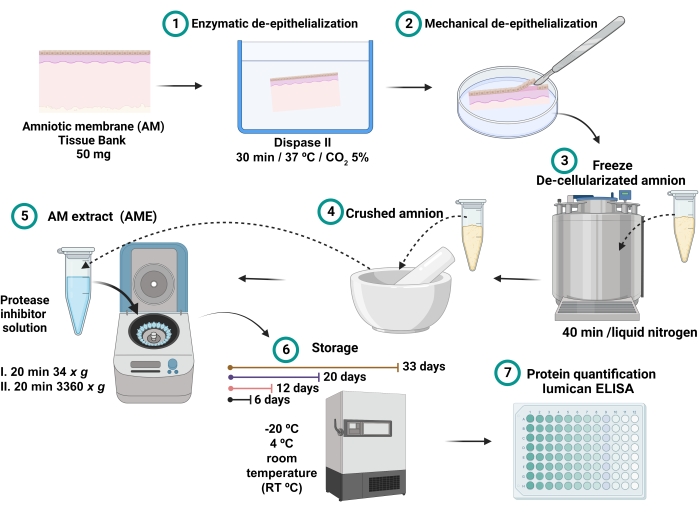
الشكل 1: عملية تحضير AME وقياس تركيز اللوميكان . تم تحضين 100 ملغ من AM مع dispase II عند 37 درجة مئوية لمدة 30 دقيقة وإزالة الظهارة ميكانيكيا. تم غسل AM غير الظهاري وغمره في النيتروجين السائل لمدة 40 دقيقة ، ثم سحقه حتى يتم الحصول على مسحوق ناعم ، والذي تم إذابته ب 2.5 مل من محلول ملحي مع مثبطات الأنزيم البروتيني والطرد المركزي. تم جمع المادة الطافية وتخزينها في -20 درجة مئوية و 4 درجات مئوية و RT لمدة 6 و 12 و 20 و 32 يوما حتى يتم تحديد كمية البروتين واللوميكان الكلي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
2. تحديد كمية البروتين AME
ملاحظة: يجب إجراء القياس الكمي للبروتين الكلي في AME مباشرة بعد الالتزام. حدد كمية البروتينات باستخدام مقايسة بروتين لوري واتبع تعليمات الشركة المصنعة (انظر جدول المواد). يوصى بفحص جميع المعايير والعينات في ثلاث نسخ.
- ماصة 40 ميكرولتر من كل عينة من AME في صفيحة مجهرية 96 بئر.
- قم بإعداد منحنى قياسي في نفس الصفيحة الدقيقة باستخدام معيار ألبومين مصل البقر (BSA) لتركيز BSA النهائي من 0-1500 ميكروغرام / مل (0 ، 1 ، 5 ، 25 ، 125 ، 250 ، 500 ، 750 ، 1000 و 1500 ميكروغرام / مل).
- ماصة 200 ميكرولتر من كاشف لوري المعدل لكل بئر. امزجه على الفور على خلاط لوحة لمدة 30 ثانية.
- قم بتغطية الصفيحة الدقيقة بورق الألمنيوم واحتضانها في RT لمدة 10 دقائق.
- ماصة 20 ميكرولتر من كاشف 1x Folin-Ciocalteu لكل بئر. امزجه على الفور على خلاط لوحة لمدة 30 ثانية.
ملاحظة: لتحضير كاشف Folin-Ciocalteu 1x ، قم بتخفيف كاشف 2x (2N) 1: 1 بماء فائق النقاء. تحضير 1x كاشف Folin-Ciocalteu في نفس يوم الاستخدام لأن الكاشف المخفف غير مستقر. - قم بتغطية الصفيحة الدقيقة من الضوء بورق الألمنيوم واحتضانها في RT لمدة 30 دقيقة.
- قم بقياس امتصاص العينات عند 660 نانومتر في مطياف لوحة ELISA (انظر جدول المواد).
ملاحظة: يمكن قياس اللون بأطوال موجية تتراوح بين 650 نانومتر و 750 نانومتر. - متوسط قيمة الامتصاص 660 نانومتر للعينات الفارغة القياسية وطرحها من قيم 660 نانومتر الأخرى للعينات القياسية وغير المعروفة.
- قم بقياس الامتصاص باستخدام مطياف لوحة ELISA في وضع نقطة النهاية مع اهتزاز منخفض لمدة 10 ثوان.
- استخدم المنحنى القياسي لتحديد تركيز البروتين لكل عينة مجهولة.
- لحساب البروتين ، حدد التركيز من الرسم البياني للانحدار الخطي باستخدام قيم الامتصاص على المحور Y مقابل التركيزات في mg / mL على المحور X لكل منحنى BSA قياسي.
- الحصول على معادلة الانحدار الخطي وقيمة r لحساب تركيز البروتين.
ملاحظة: يتم التعبير عن النتائج كقيم تركيز نسبي طبيعية للبروتين الكلي بالنسبة إلى ملغ من AM (ميكروغرام / مل بروتين / ملغ من أنسجة AM).
- الحصول على معادلة الانحدار الخطي وقيمة r لحساب تركيز البروتين.
3. القياس الكمي للوميكان في AME
ملاحظة: يجب قياس تركيز اللوميكان في AME المخزن في ظروف تخزين وفترات زمنية مختلفة. حدد لوميكان باستخدام ساندويتش ELISA واتبع تعليمات الشركة المصنعة. يوصى بفحص جميع المعايير والعينات من نسختين.
- قم بتخفيف الجسم المضاد لالتقاط اللوميكان البشري (انظر جدول المواد) إلى التركيز المستخدم في محلول ملحي مخزن بالفوسفات (PBS).
ملاحظة: تحتوي قارورة الأجسام المضادة الملتقطة على 120 ميكروغرام من الأجسام المضادة. بعد إعادة التكوين باستخدام 0.5 مل من PBS ، قم بتخفيف الجسم المضاد للالتقاط في محلول عملي يبلغ 2 ميكروغرام / مل.- ماصة على الفور 100 ميكرولتر لكل بئر من الجسم المضاد المخفف للالتقاط إلى صفيحة مجهرية 96 بئرا. أرفق اللوحة واحتضنها طوال الليل في RT.
- نضح كل بئر وغسله عن طريق سحب 300 ميكرولتر من محلول الغسيل: 0.05٪ بولي أوكسي إيثيلين سوربيتان مونولورات 20 في PBS ، درجة الحموضة 7.2-7.4 (انظر جدول المواد) باستخدام ماصة متعددة القنوات. كرر ثلاث مرات.
ملاحظة: بعد آخر غسلة ، قم بإزالة أي مخزن مؤقت متبقي للغسيل عن طريق وضع الطبق واضغط برفق على المناشف الورقية. - لوحات كتلة عن طريق إضافة 300 ميكرولتر من مخفف الكاشف: 1 ٪ BSA في PBS ، درجة الحموضة 7.2-7.4 ، 0.2 ميكرومتر المصفاة (انظر جدول المواد) لكل بئر. احتضان في RT لمدة 1 ساعة.
- كرر الخطوة 2.
- قم بإعداد منحنى قياسي في صفيحة دقيقة ذات 96 بئرا باستخدام تخفيفات تسلسلية ثنائية من 0-8000 بيكوغرام / مل للتركيزات النهائية من 125 و 250 و 500 و 1000 و 2000 و 4000 و 8000 بيكوغرام / مل. تحتوي مجموعة ELISA lumican على معيار lumican المؤتلف من 75 نانوغرام (انظر جدول المواد).
- أضف 100 ميكرولتر من العينات والمنحنى القياسي في الصفيحة الدقيقة 96 المطلية بالأجسام المضادة بالتقاط.
- قم بتغطية الصفيحة الدقيقة واحتضانها لمدة 2 ساعة عند RT مع تحريك منخفض في هزاز مضغوط يحافظ على السرعة بين 2-3 دورة في الدقيقة.
- كرر الخطوة 2.
- أضف 100 ميكرولتر من الجسم المضاد للكشف عن البيوتينيل (انظر جدول المواد) إلى كل بئر. غطيها من الضوء واحتضنها لمدة 2 ساعة عند RT مع تحريض منخفض في هزاز مضغوط يحافظ على السرعة بين 2-3 دورة في الدقيقة.
ملاحظة: تحتوي قارورة الجسم المضاد للكشف عن البيوتينيل على 24 ميكروغرام من الجسم المضاد. بعد إعادة التكوين باستخدام 1.0 مل من مخفف الكاشف ، قم بتخفيف الجسم المضاد للكشف عن البيوتينيل في محلول عمل يبلغ 400 نانوغرام / مل. - كرر الخطوة 2.
- أضف 100 ميكرولتر من التخفيف العامل لبيروكسيديز الستربتافيدين - الفجل (HRP ، انظر جدول المواد) إلى كل بئر. غطي الصفيحة الدقيقة من الضوء واحتضنها لمدة 20 دقيقة في RT.
ملاحظة: كان الستربتافيدين التفاعلي HRP مركزا بمقدار 40 ضعفا. تم إجراء حل العمل 1x من streptavidin- HRP مع مخفف الكاشف.
ملاحظة: تجنب وضع اللوحة في الضوء المباشر. - كرر الخطوة 2.
- أخيرا ، أضف 100 ميكرولتر من محلول رباعي ميثيل بنزيدين الركيزة (TMB ، انظر جدول المواد) إلى كل بئر.
ملاحظة: قم بإعداد محلول TMB بحجم متساو من محلول بيروكسيد الهيدروجين المستقر 30٪ المقدم في المجموعة.
ملاحظة: قم بإعداد المحلول مباشرة قبل الاستخدام واحتفظ به في درجة حرارة الغرفة. - احتضان لمدة 30 دقيقة في RT في مكان مظلم.
ملاحظة: تجنب وضع اللوحة في الضوء المباشر. لا تستنشق محلول TMB حيث لا حاجة إلى مزيد من الغسيل. - أضف 50 ميكرولتر من محلول التوقف 1N H2SO4 لإيقاف التفاعل اللوني. اضغط برفق على اللوحة لضمان الخلط الشامل.
- حدد على الفور امتصاص كل بئر باستخدام قارئ صفيحة دقيقة مضبوط على 450 نانومتر في مطياف لوحة ELISA.
- قم بقياس الامتصاص باستخدام مطياف لوحة ELISA في وضع نقطة النهاية مع اهتزاز منخفض لمدة 10 ثوان.
- متوسط قيمة الامتصاص 450 نانومتر للعينات الفارغة القياسية وطرحها من قيم 450 نانومتر الأخرى للعينات القياسية وغير المعروفة.
- استخدم المنحنى القياسي لتحديد تركيز اللوميكان لكل عينة مجهولة.
- لحساب تركيز اللوميكان ، قم بعمل رسم بياني للانحدار الخطي باستخدام قيم الامتصاص على المحور Y مقابل التركيزات في pg / mL على المحور X لكل منحنى لوميكان قياسي.
- احصل على معادلة الانحدار الخطي وقيمة r لحساب تركيز اللوميكان.
ملاحظة: تم تطبيع تركيز اللوميكان فيما يتعلق بملغ من الأنسجة المستخرجة. يتم التعبير عن النتائج كقيم تركيز نسبي طبيعية من lumican إلى mg AM (ng / mL lumican / mg AM الأنسجة).
- احصل على معادلة الانحدار الخطي وقيمة r لحساب تركيز اللوميكان.
النتائج
يتم الإبلاغ عن النتائج كقيمة متوسطة ± الانحراف المعياري (SD). تم إجراء اختبارات t للطالب وتحليل التباين (ANOVA). اعتبرت قيم P < 0.05 ذات دلالة إحصائية. تم إجراء التحليل الإحصائي باستخدام برنامج إحصائي (انظر جدول المواد).
تأثرت كمية البروتين الإجمالية في AME بالوقت وظروف التخزين. كان تركيز البروتين القاعدي مشابها بين جميع AME. كان نطاق البروتين الكلي 2.7 ± 0.3 ميكروغرام / مل دون فرق كبير بين العينات التي تم تقييمها. ومع ذلك ، عندما تم تخزين العينات لمدة 12 و 20 و 32 يوما ، لوحظ تباين في تركيز البروتين فيما يتعلق بالتركيز القاعدي. ومن المثير للاهتمام ، أن تركيز البروتين زاد في AME عند 4 درجات مئوية و -20 درجة مئوية فيما يتعلق ب RT في جميع أوقات التخزين.
وبالمثل ، عند مقارنة تركيز البروتين بين أوقات التخزين ، تغير بعد 12 و 20 و 32 يوما. تم العثور على فرق كبير (p < 0.05) في AME لمدة 32 و 20 يوما عند 4 درجات مئوية و -20 درجة مئوية مقارنة بحالة RT (الشكل 2) ، مما يشير إلى أن درجة الحرارة مهمة لحفظ البروتين في AME المختلفة التي تم الحصول عليها.

الشكل 2: يتأثر تركيز البروتين الكلي في AME بالوقت ودرجة حرارة التخزين. تم تحديد تركيز استخلاص البروتين على AME قبل وبعد ظروف تخزين درجة الحرارة والوقت. كان وقت التخزين الذي تم تقييمه 6 أيام (مثلثات سوداء) و 12 يوما (مثلثات وردية) و 20 يوما (مربع أرجواني) و 32 يوما (دوائر بنية) مقارنة بثلاثة ظروف درجة حرارة مختلفة (RT °C و 4 °C و -20 °C). كان تركيز البروتين القاعدي مشابها بين جميع AME. كان هناك اختلاف كبير في تركيز البروتين في AME لمدة 20 و 32 يوما فيما يتعلق بتركيز البروتين القاعدي في ظروف درجات الحرارة المختلفة. في كل حالة ن = 3. يتم التعبير عن البيانات كوسيط ميكروغرام / مل من البروتين ± SE * p < 0.05 (S1 32 يوما مقابل S1 20 و 12 و 6 أيام عند 4 درجات مئوية) ؛ (S1 32 يوما مقابل S1 20 و 12 و 6 أيام عند -20 درجة مئوية). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
تأثر تركيز اللوميكان بوقت التخزين وظروف درجة الحرارة. تم العثور على تركيز أقل من اللوميكان في AME المخزنة لمدة 6 و 20 و 32 يوما ، مقارنة ب 12 يوما من التخزين. بشكل ملحوظ ، كان AME لمدة 12 يوما يحتوي على تركيز أعلى من اللوميكان من 20 و 32 يوما من التخزين (p < 0.05).
عندما تمت مقارنة تركيز اللوميكان في AME بين درجات حرارة التخزين ، تم العثور على تركيز أعلى من lumican إذا تم تخزينه في -20 درجة مئوية و 4 °C لمدة 12 يوما (الشكل 3). ومن المثير للاهتمام ، أنه تم العثور على تركيز أعلى (p < 0.05) من lumican في 12 يوما AME إذا تم تخزينه في -20 درجة مئوية مقارنة ب 4 درجات مئوية.
يشير هذا إلى أن تركيز اللوميكان يتأثر بظروف درجة الحرارة ووقت التخزين ، مما يشير إلى أن وقت التخزين ودرجة الحرارة المناسبين لتحقيق أعلى تركيز للوميكان هو 12 يوما عند -20 درجة مئوية.
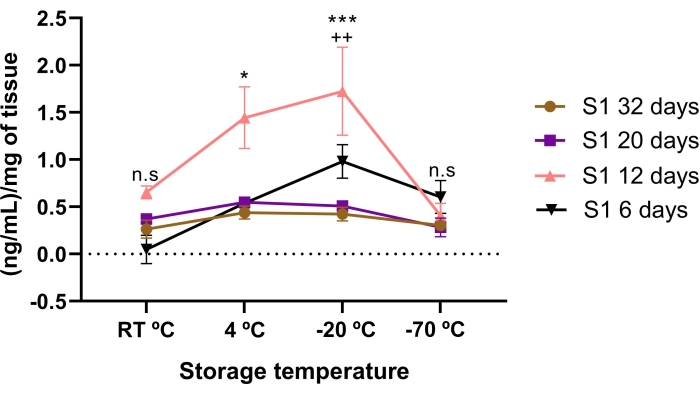
الشكل 3: تأثر إجمالي تركيز اللوميكان في AME بالوقت ودرجة حرارة التخزين. تأثر تركيز اللوميكان بوقت التخزين وظروف درجة الحرارة. تم تحديد تركيز اللوميكان في AME قبل وبعد ظروف درجة الحرارة وتخزين الوقت. كان وقت التخزين الذي تم تقييمه 6 أيام (مثلثات سوداء) و 12 يوما (مثلثات وردية) و 20 يوما (مربع أرجواني) و 32 يوما (دوائر بنية) مقارنة بثلاثة ظروف درجة حرارة مختلفة (RT °C و 4 °C و -20 °C). كان Lumican في AME لمدة 12 يوما أعلى بكثير مقارنة ب AME في 32 و 20 و 6 أيام ، في ظروف درجات حرارة -20 درجة مئوية و 4 درجات مئوية. * p < 0.05 (S1 12 يوما مقابل S1 32 و 20 و 6 أيام عند 4 درجات مئوية) ؛ p < 0.001 (S1 12 يوما مقابل S1 32 و 20 و 6 أيام عند -20 درجة مئوية). كان أعلى تركيز للوميكان في AME عند 12 يوما مخزنة عند -20 درجة مئوية. ++ p < 0.01 (S1 12 يوما 4 درجات مئوية مقابل S1 12 يوما -20 درجة مئوية). لم يكن هناك فرق كبير بين lumican في AME من 32 و 20 يوما مقارنة بظروف درجة حرارة التخزين (n.s). في كل حالة (ن = 3) ، يتم التعبير عن البيانات كوسيط نانوغرام / مل من البروتين. تم تطبيع البيانات فيما يتعلق ب mg من الأنسجة ± SE. (n.s.) وليس الدلالة الإحصائية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
في هذه الدراسة ، تم تحليل وجود lumican في AME وعلاقته المباشرة مع ثباته في ظل ظروف التخزين المختلفة. ومن المثير للاهتمام ، عندما تم تحديد تركيز البروتين الكلي في AME ، زاد تركيز البروتين بعد التخزين. تشير الدلائل إلى ثلاث آليات يمكن أن تغير تركيز البروتين في التخزين المجمد: التمسخ البارد ، والتركيز المجمد للمواد المذابة ، والتكشف الجزئي الناجم عن الجليد لبنية البروتين19. يمكن أن تؤثر عملية التجميد على تركيز البروتين في عينات التخزين بسبب تبلور الطور السائل في العينة. تشير النتائج إلى أن هذا يمكن أن يكون قد حدث كعملية تجميد التركيز ، متأثرة بوقت التخزين في الفريزر. لوحظ تركيز أعلى للبروتينات في أوقات تخزين أطول (32 و 20 يوما) وفي أبرد درجات الحرارة (4 درجات مئوية و -20 درجة مئوية). ومع ذلك ، فإن الفترة التي تحتوي على أعلى تركيز للبروتين لم يكن لديها أعلى تركيز للوميكان. هذا يشير إلى أن Lumican يمكن أن يتأثر بدرجات الحرارة المتجمدة والظروف الزمنية.
وفقا للنتائج ، كان تركيز اللوميكان أعلى وأكثر استقرارا عند 12 يوما من التخزين عند 4 درجات مئوية و -20 درجة مئوية. ومع ذلك ، تم العثور على تركيز أقل من اللوميكان في 6 أيام مقارنة ب 12 يوما. تشير بعض التقارير إلى أن تركيز البروتين يمكن أن يتغير بعد ظروف التخزين المجمدة20. يمكن أن تكون النتائج ناتجة عن آلية ديناميكية حرارية تسمى الكشف الجزئي الناجم عن الجليد لبنية البروتين ، والتي تحدث أثناء تجميد العينات. تفاعل البروتينات مع الماء في المحاليل المائية يقلل من تفاعلاتها مع الجزيئات الأخرى. تسمح عملية تبلور الماء في ظل ظروف متجمدة للبروتينات وبعض المناطق الوظيفية بالتفاعل مع جزيئات أخرى19. بحلول ما سبق ، بعد 12 يوما من تجميد اللوميكان في محلول مائي ، يمكن أن يكون قادرا على التفاعل مع الأجسام المضادة الموجودة في مجموعة القياس الكمي ELISA للحصول على تركيز أعلى. من ناحية أخرى ، ربما في اليوم السادس ، كان من الممكن عزل اللوميكان في المحلول المائي.
في تطوير الابتكارات ، فإن استخدام AM هو العلاج المتطور لإعادة اندمال القرنية بغض النظر عن المسببات. كما ذكرنا سابقا ، فإن فوائد AM واسعة21،22،23،24،25،26. أظهر العديد من المؤلفين فوائد اللوميكان في AME ، مما يجعله بديلا ميسور التكلفة خصيصا للبلدان النامية1،2،3،4،5،6،7،8،9. حاليا ، هناك العديد من فوائد lumican في AME. استخدامه كعلاج يفضل إعادة الظهارة القرنية ويحسن تشخيص قرحة القرنية4،5،6،7،8،9،10،11،12،13،14،15. أصبح زرع AM (AMT) علاجا له فوائد كبيرة لتحسين اضطرابات القرنية المختلفة24,25. ومع ذلك ، هناك بعض التأثيرات المزمنة لأنسجة القرنية ، مثل العيوب الظهارية المستمرة (PED) ونقص الخلايا الجذعية الداكنة (LESCD) ، والتي تتطلب علاجا مستمرا والحفاظ على وجود العوامل البيولوجية التي تساعد على إصلاح القرنية21,24. حاليا ، لا توجد علاجات مساعدة تسمح بالصيانة طويلة الأجل للعوامل التي تطلقها AMT على سطح القرنية. ومع ذلك ، لا يمكن التوصية بالاستبدال المستمر ل AMT لسلامة المرضى26. لهذا السبب ، من الضروري تطوير بدائل تسمح لوظائف AMT بالمساعدة وتساعد في الحفاظ على وجود العوامل التي تطلقها AM في أنسجة القرنية مثل lumican لفترة أطول ، بهدف تفضيل علاج المشاكل المستمرة للقرنية27.
Lumican هو أحد العوامل الموجودة في AM مع وظائف مضادة للالتهابات ومضادة للتليف ، والتي تم الإبلاغ عن أن لها وظائف في عملية إصلاح القرنية6،7،8،9،10،11،12،13،14،15 . هذا هو السبب في أن lumican يقترح أن يكون مرشحا جيدا للمساعدة في علاج أمراض القرنية. ومع ذلك ، هناك حاجة إلى مزيد من البحث لتحديد فعالية lumican في AME لتحقيق إعادة الاندمال الظهاري للقرنية.
Lumican هو بروتيوغليكان ثبت أنه ينظم إفراز مركبات المصفوفة خارج الخلية مثل الكولاجين. أيضا ، يشارك في تنشيط الخلايا الليفية وتعديل الخلايا الالتهابية وعملية تكوين الأوعية الدموية ، ولها دور مهم في التئام الجروح. وفقا للنتائج ، يمكن استخراج lumican من الأنسجة AM. التطبيقات العلاجية للوميكان عديدة. يسمح استخدام lumican في AME بخيار علاجي يمكن تحقيقه لاضطرابات العين 4,13. الميزة الأساسية لاستخدام AME هي أنه يوفر تطبيقا سهلا كعلاج موضعي لسطح العين ، نظرا لتكوينه المائي. وبالمثل ، يمكن العثور على بروتينات أخرى ذات خصائص مضادة للالتهابات ومناعية داخل المكونات المستخرجة من أنسجة AM ، والتي يمكن أن تقدم فائدة أكبر في علاج مشاكل إزالة الظهارة في العين. على سبيل المثال ، تم الإبلاغ سابقا عن عوامل أخرى مضادة للالتهابات مثل TSG-6 الموجودة في AM والمكونات الخلوية لها خصائص مناعية8. بموجب هذا ، يمكن أن يكون العلاج المشترك للوميكان ومركبات المصفوفة خارج الخلية الأخرى والجزيئات المناعية الموجودة في AME مفيدا في عملية إعادة الاندمال والتئام الجروح.
تهدف هذه الطريقة إلى إظهار تقنية مباشرة لاستخراج البروتين ، مفيدة لامتصاص البروتينات والعوامل الوفيرة. أحد الاعتبارات الحاسمة لهذه الطريقة هو استخدام مثبطات الأنزيم البروتيني ، حيث أنه أساسي لاستخراج البروتين بنجاح لأن AM عبارة عن نسيج يحتوي على كميات من المركبات الأنزيمية لمنع تدهور البروتين27. أفادت الأدلة أن استخدام مثبطات البروتين مع محلول مائي يزيد من استخراج عوامل أخرى ، مثل HGF ، في أنسجة AM26. يعد انبعاث مسحوق ناعم بعد تجميد وتأريض AM ضروريا للامتصاص الأمثل ل AME ، لأن هذه العملية مناسبة لتعطيل الأنسجة والخلايا للهياكل اللازمة لاستخراج المركبات الخلوية والمركبات النووية الأخرى28,29.
بعض القيود على طريقة الاستخراج هذه هي أن كمية AM المستخدمة لا يمكن أن تسمح باستخراج واسع النطاق. يسمح هذا البروتوكول باستخراج البروتين من كمية محدودة من الأنسجة. نظرا لعدم وجود دليل على أن هذه الطريقة تسمح بالحصول على كمية أكبر من البروتين من منطقة أنسجة أكبر. استكشاف الأخطاء وإصلاحها التي يجب مراعاتها بالمقارنة مع طرق الاستخراج الأخرى هو استخدام تركيز مناسب من مثبطات الأنزيم البروتيني ووقت الحضانة ، حيث يمكن أن تؤثر الإنزيمات الزائدة على البروتينات30 وتقلل من فعالية التقنية.
تم تعديل جزء من هذه التقنية من تلك التي أبلغ عنها Mahbod et al.16 ، والتي تصف أن تكرار عملية الطرد المركزي والاستخراج يزيد من استخراج البروتين. على عكس محبوب ، لم تبلغ النتائج عن تركيز البروتين بعد ثلاث دورات من الطرد المركزي. عندما تم تحديد تركيز البروتين الكلي ، انخفض بنسبة 80٪ في الاستخراج الثاني وما يصل إلى 97٪ في الاستخراج الثالث. يؤدي إجراء استخراج واحد فقط إلى تقليل وقت المعالجة ولا يقلل من كمية البروتين الكلي. مع ما سبق ، تتطلب طريقة الاستخراج المذكورة هنا خطوة طرد مركزي واحدة فقط مع نتائج إيجابية.
يمكن استخدام هذه التقنية لاستخراج العوامل والبروتينات الأخرى الموجودة في AM وأكثر من ذلك ، للحصول على عوامل من مصادر أخرى مثل الحيوانات أو الخضروات. يمكن أن يكون لها أيضا تطبيق للحصول على البروتينات لإجراء البحوث الأساسية أو حتى تطوير التركيبات والعلاجات.
تشير هذه النتائج إلى أنه يمكن استخراج اللوميكان من AM وتخزينه لمدة 12 يوما على شكل AME تحت ظروف درجة حرارة -20 درجة مئوية و 4 درجات مئوية. من المهم النظر في عمر النصف لتحقيق الآثار العلاجية للوميكان مثل AME. هناك حاجة إلى مزيد من الدراسات لتحديد دور AME lumican في الخلايا الظهارية القرنية وتحديد الجرعة المثالية من lumican لإعادة الاندمال الظهاري للقرنية.
في الختام ، تشير النتائج إلى إمكانية الحصول على عوامل مثل lumican في AME. وبالمثل ، تؤثر ظروف درجة الحرارة ووقت التخزين على تركيز اللوميكان الموجود في AME.
Disclosures
تم تمويل الدراسة من قبل برنامج دعم مشاريع البحث والابتكار التكنولوجي التابع للجامعة الوطنية المستقلة في المكسيك (رقم المنحة. PAPIIT IN203821) ، ووزارة التعليم والعلوم والتكنولوجيا والابتكار (رقم المنحة. SECTEI 250/2019).
Acknowledgements
ليس للمؤلفين مصالح مالية متنافسة.
Materials
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
References
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved