Method Article
מיצוי לומיקן מממברנת מי השפיר וקביעת טמפרטורת האחסון שלו
In This Article
Summary
הפרוטוקול הנוכחי מתאר את מיצוי הלומיקאן מממברנת מי השפיר (AM) ואת תנאי האחסון שלהם כתמצית AM (AME) בטמפרטורה של -20 מעלות צלזיוס, 4 מעלות צלזיוס וטמפרטורת החדר (RT) במשך 6, 12, 20 ו-32 ימים כדי לכמת את החלבונים ואת ריכוז הלומיקאן.
Abstract
Lumican הוא פרוטאוגליקן קטן עשיר בלאוצין בקרום מי השפיר האנושי (AM) המקדם אפיתל הקרנית וארגון סיבי קולגן, תוך שמירה על שקיפות הקרנית. בעבודה הנוכחית, שיטה למיצוי חלבון מ AM כדי להשיג lumican הוא הציע. בנוסף, מעריכה את יציבות הלומיקאן בתמצית AM (AME) המאוחסנת בטמפרטורות ובתקופות זמן שונות. 100 מ"ג של AM הופשרו ועברו דה-אפיתל מכני. ה- AM שעבר דה-אפיתל הוקפא ונמחץ עד שהתקבלה אבקה דקה, אשר סולובילציה עם 2.5 מ"ל של חיץ מלוחים עם מעכבי פרוטאז וצנטריפוגה למיצוי חלבונים. הסופר-נאטנט נאסף ואוחסן בטמפרטורה של -20 מעלות צלזיוס, 4 מעלות צלזיוס ובטמפרטורת החדר (RT) למשך 6, 12, 20 ו-32 ימים. לאחר מכן, לומיקן כומת בכל AME. טכניקה זו מאפשרת פרוטוקול נגיש וניתן לרכישה למיצוי לומיקן מ- AM. ריכוז לומיקן הושפע מזמן האחסון ומתנאי הטמפרטורה. Lumican ב AME של 12 ימים מאוחסנים ב -20 °C ו 4 °C היה גבוה משמעותית מאשר AME אחרים. מיצוי לומיקן זה יכול להיות שימושי לפיתוח טיפולים ופתרונות תרופתיים. מחקרים נוספים נדרשים כדי לקבוע את השימושים של AME lumican באפיתל מחדש ותהליך ריפוי פצעים.
Introduction
אחד הטיפולים הנפוצים ביותר עבור רגשות הקרנית הוא השתלת קרום מי השפיר; עם זאת, בשנים האחרונות עלו הצעות חדשות לשימוש במרכיבים שונים של רקמת מי השפיר כטיפולים אלטרנטיביים ואדג'ובנטיים. בין המרכיבים הנחקרים ביותר של AM הם אלה המתקבלים תמצית AM (AME)1,2,3,4,5,6,7. AM מכיל גורמים מסיסים מרובים כגון חלבונים אנטי-אנגיוגניים, אינטרלוקינים (IL), מעכבי רקמות של מטאלופרוטאינאזות (TIMPs), חלבונים אנטי דלקתיים בתיווך TSG-6 המעכבים מלכודות נויטרופילים חוץ-תאיות, גורמי גדילה: גורם גדילה אפידרמלי (EGF), גורם גדילה מתמיר (TGF) (אלפא ובטא), גורם גדילה קרטינוציטים (KGF), גורם גדילה הפטוציטים (HGF) ולומיקן, השומר על שקיפות הקרנית על ידי ויסות פיברילוגנזה של קולגן1, 2,3,4,5,6,7,8,9.
Lumican הוא פרוטאוגליקן קטן עשיר בלאוצין (SLRP), אחד המרכיבים החוץ-תאיים העיקריים של קולגן בין-תאי במטריצת הסטרומה של הקרנית, האחראי על ארגון סיבי הקולגן ושמירה על שקיפות הקרנית 4,10,11. פרוטאוגליקנים הם מולקולות במטריצה החוץ-תאית (ECM), שהן העיקריות שבהן בביצוע איתות תאי ובשמירה על הומאוסטזיס תוך-תאי12. דווח כי חלבוני ECM מניעים את התהליכים התאיים של התפשטות, התמיינות ונדידה במהלך ריפוי פצעים11.
ראיות מצביעות על השתתפות אפשרית של lumican בתהליך של אפיתל מחדש הקרנית. Saika et al., במחקר, הראו כי לאחר פגיעה בקרנית, ניתן לזהות לומיקן בקרטוציטים של הקרנית בין 8 השעות הראשונות ועד 3 ימים לאחר הפציעה. הצגת הריכוז הגבוה ביותר של lumican ביום השני והשלישי, פרוטאוגליקן זה הוא לאחר מכן בלתי ניתן לגילוי ביום השביעי13. נתונים אלה מצביעים על השתתפות של lumican בהפעלת תהליך אפיתל מחדש של הקרנית. מאידך גיסא, במחקר אחר, דווח כי היעדר לומיקן מעכב אפיתל מחדש; באופן מעניין, הוספת לומיקן יכולה להאיץ את תהליך האפיתל מחדש 4,11,13. כמו כן, מחקר שנערך לאחרונה דיווח כי lumican יכול לווסת את הפונקציות הדלקתיות של פיברובלסטים לימבוס הקרנית14, אשר מציע תפקיד עבור lumican כמו מודולטור של התגובה דלקתית, antifibrotic ו אפיתל מחדש. באופן דומה, לומיקן יכול לווסת את תגובת הקרנית על ידי אינטראקציה עם מולקולות איתות כגון Fas-FasL. כמו כן, היעדר לומיקן במודל עכבר נוקאאוט Lum-/- הוכיח כי היעדר איתות לומיקן מונע תיקון קרנית הולם15.
בראש ובראשונה, שיטה זו נועדה להדגים דרך אפשרית ונגישה לחלץ לומיקן מ- AM. בשיטה מועילה זו של מיצוי לומיקן, ניתן להשיג ריכוזים דומים של חלבונים, מה שמקטין את זמן העיבוד והופך אותו לנוח יותר לחוקרים בהשוואה למחקרים הקודמים16. יתר על כן, לומיקן AME זה יכול לשמש כאדג'ובנט לתיקון הקרנית ולתהליכי אפיתל מחדש.
Protocol
כל הליכי הניסוי אושרו על ידי המועצה לביקורת מוסדית (פרויקט מס' CEI-2020/06/04). ה- AM הושג מבנק האמניון של מכון אופטלמולוגיה קונדה דה ולנסיה (מנבדקים אנושיים לא מזוהים), שהוכן כפי שתואר על ידי Chávez-García et al.17.
1. הכנת תמצית קרום מי השפיר
- להשיג 100 מ"ג של AM מבנק אמניון.
הערה: על פי דו"ח קודם, 50 מ"ג של AM מפריש בסך הכל 10 ננוגרם/מ"ל של לומיקן14. כדי להשיג ריכוז גבוה יותר של lumican, להשתמש 100 מ"ג של AM, שווה ערך לשטח הכולל של 32 ס"מ2. - אם ה-AM קפוא, הפשירו אותו בטמפרטורת החדר.
הערה: בצע את ההליכים הבאים תחת מכסה מנוע זרימה למינרית Class II B. - שטפו את ה-AM בצלחת פטרי עם 10 מ"ל של תמיסת מלח סטרילית מאוזנת (BSS, ראו טבלת חומרים) למשך 2 דקות.
- יוצקים את ה- BSS לתוך.
- חזור על שלב 3 ואשר חזותית כי מדיום גליצרול אינו קיים בצלחת פטרי BSS.
הערה: חזור על שלב 3. לפי הצורך עד שמדיום גליצרול אינו קיים בצלחת פטרי BSS.
- דגירה של AM עם 10 מ"ל של dispase II (1.7 IU/mL, ראה טבלת חומרים) ב 37 °C, 5% CO2 במשך 30 דקות.
הערה: Dispase II הוא פרוטאז נייטרלי עם פעילות עדינה על תאי אפיתל. אנזים זה מפריד ביעילות את האפידרמיס השלם מהדרמיס ומבודד יריעות אפיתל שלמות18. - לאחר הדגירה השונה, בצע דה-אפיתל מכני14 עם שוטר גומי (ראה טבלת חומרים). אשר דה-אפיתל על ידי הדמיה מיקרוסקופית.
הערה: תהליך הדה-אפיתל מאומת במיקרוסקופ הפוך באמצעות מטרות 4x ו-20x. דמיינו את הרקמה כדי למנוע נוכחות של כל שכבה תאית. - לשטוף את AM בצלחת פטרי עם 10 מ"ל של BSS במשך 2 דקות. יוצקים את ה- BSS לתוך.
- מקם את ה-AM שעבר דה-אפיתל (dAM) בצינור מיקרוצנטריפוגה בגודל 2 מ"ל. יש לטבול את ה-dAM בחנקן נוזלי למשך 40 דקות.
- טחנו ידנית את ה-dAM הקפוא למשך 2-3 דקות בחומר מליטה מקורר מראש בטמפרטורה של -85°C עד לקבלת אבקה דקה.
- בחומר המליטה, יש לבודד את אבקת ה-dAM עם תמיסת מעכבי פרוטאז של 2.5 מ"ל (BSS עם מעכבי פרוטאז).
הערה: כל טבליה של מעכב פרוטאז מורכבת מתערובת האנזימים הבאה: תמצית לבלב (0.02 מ"ג/מ"ל), תרמוליזין (מטאלופרוטאז) (0.0005 מ"ג/מ"ל), כימוטריפסין (0.002 מ"ג/מ"ל), טריפסין (0.02 מ"ג/מ"ל) ופפאין (0.33 מ"ג/מ"ל) (ראו טבלת חומרים). - לאסוף את התערובת עם micropipette, ולנקות את קירות טיט בעזרת סכין אזמל. מניחים את התערובת בצינור של 5 מ"ל.
- מערבבים היטב עם המערבולת במשך 30 שניות.
- הומוגניות של תערובת הרקמות על ידי צנטריפוגה ב 34 x g במשך 20 דקות ב 4 °C ומיד צנטריפוגה ב 3360 x g במשך 20 דקות ב 4 °C (60 °F).
- הסופר-נטנט שנאסף הוא ה-AME (איור 1). אחסן 0.7 מ"ל מכל AME בצינורות מיקרוצנטריפוגה שונים של 2 מ"ל למשך 6, 12, 20 ו-33 ימים בתנאי הטמפרטורה השונים של -20 °C, 4 °C וטמפרטורת החדר (RT).
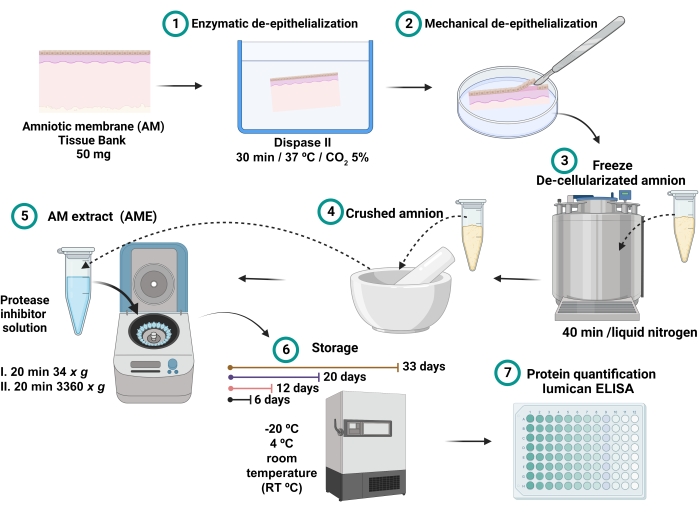
איור 1: תהליך הכנת AME ומדידת ריכוז לומיקן . 100 מ"ג של AM היו דגירה עם dispase II ב 37 מעלות צלזיוס במשך 30 דקות ו דה-אפיתל מכנית. AM דה-אפיתל נשטף ושקע בחנקן נוזלי במשך 40 דקות, ולאחר מכן מרוסק עד שהתקבלה אבקה דקה, אשר היה solubilized עם 2.5 מ"ל של חיץ מלוחים עם מעכבי פרוטאז צנטריפוגה. הסופר-נאטנט נאסף ואוחסן בטמפרטורה של -20 מעלות צלזיוס, 4 מעלות צלזיוס ו-RT במשך 6, 12, 20 ו-32 ימים עד לכמות החלבון והלומיקן הכוללת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
2. כימות חלבון AME
הערה: כימות החלבון הכולל ב- AME חייב להתבצע מיד לאחר ההסתייגות. כמת חלבונים באמצעות בדיקת חלבון Lowry ופעל בהתאם להוראות היצרן (ראה טבלת חומרים). מומלץ לבחון את כל התקנים והדגימות במשולש.
- פיפטה 40 μL של כל דגימה של AME לתוך microplate 96 באר.
- הכינו עקומה סטנדרטית לאותה לוחית מיקרו באמצעות תקן אלבומין בסרום בקר (BSA) לריכוז BSA סופי של 0-1,500 מיקרוגרם/מ"ל (0, 1, 5, 25, 125, 250, 500, 750, 1,000 ו-1,500 מיקרוגרם/מ"ל).
- פיפטה 200 μL של מגיב לורי שונה לכל באר. מיד מערבבים אותו על מערבל צלחת במשך 30 שניות.
- מכסים את המיקרו-פלטה ברדיד אלומיניום ודוגרים אותה ב-RT למשך 10 דקות.
- פיפטה 20 μL של מגיב 1x Folin-Ciocalteu לכל באר. מיד מערבבים אותו על מערבל צלחת במשך 30 שניות.
הערה: כדי להכין ריאגנט אחד מסוג Folin-Ciocalteu, יש לדלל ריאגנט 2x (2N) ביחס של 1:1 עם מים טהורים במיוחד. יש להכין ריאגנט Folin-Ciocalteu אחד באותו יום של שימוש, שכן המגיב המדולל אינו יציב. - מכסים את המיקרו-פלטה מאור ברדיד אלומיניום ודוגרים אותה ב-RT למשך 30 דקות.
- מדוד את ספיגת הדגימות ב-660 ננומטר בספקטרומטר צלחות ELISA (ראו טבלת חומרים).
הערה: ניתן למדוד צבע באורכי גל שבין 650 ננומטר ל-750 ננומטר. - ממוצע ערך הספיגה של 660 ננומטר של הדגימות הריקות הסטנדרטיות וחיסור אותו מערכים אחרים של 660 ננומטר של דגימות סטנדרטיות ולא ידועות.
- מדוד את הספיגה באמצעות ספקטרומטר צלחת ELISA במצב נקודת קצה עם רעידות נמוכות במשך 10 שניות.
- השתמש בעקומה הסטנדרטית כדי לקבוע את ריכוז החלבון של כל דגימה לא ידועה.
- לצורך חישוב החלבון, קבע את הריכוז מגרף רגרסיה קווית באמצעות ערכי הספיגה על ציר Y כנגד הריכוזים ב- mg/mL על ציר X של כל עקומת BSA סטנדרטית.
- קבל את המשוואה של רגרסיה ליניארית וערך r כדי לחשב את ריכוז החלבון.
הערה: התוצאות מבוטאות כערכי ריכוז יחסיים מנורמלים של סך החלבון ביחס למ"ג של AM (מיקרוגרם/מ"ל חלבון/מ"ג רקמת AM).
- קבל את המשוואה של רגרסיה ליניארית וערך r כדי לחשב את ריכוז החלבון.
3. כימות של לומיקן ב- AME
הערה: יש למדוד את ריכוז הלומיקאן ב-AME המאוחסן בתנאי אחסון שונים ובתקופות זמן שונות. כימות לומיקן באמצעות כריך ELISA ופעל לפי הוראות היצרן. מומלץ לבדוק את כל התקנים והדגימות בכפילות.
- לדלל את נוגדן לכידת הלומיקאן האנושי (ראו טבלת חומרים) לריכוז המועסק בתמיסת מלח עם מאגרי פוספטים (PBS).
הערה: בקבוקון נוגדני הלכידה מכיל 120 מיקרוגרם נוגדן. לאחר שחזור עם 0.5 מ"ל של PBS, יש לדלל את נוגדן הלכידה בתמיסה עובדת של 2 מיקרוגרם/מ"ל.- פיפטה מיידית 100 μL לכל באר של נוגדן לכידה מדולל למיקרו-פלטה של 96 באר. הקיפו את הצלחת ודגרו אותה למשך הלילה ב-RT.
- שאפו כל באר ושטפו אותה על ידי פיפטינג עם 300 μL של מאגר כביסה: 0.05% פוליאוקסיאתילן סורביטן מונולאורט 20 ב- PBS, pH 7.2-7.4 (ראה טבלת חומרים) באמצעות פיפטור רב ערוצי. חזרו על הפעולה שלוש פעמים.
הערה: לאחר הכביסה האחרונה, הסר את כל מאגר הכביסה שנותר על ידי אוורור הצלחת והקש בעדינות על מגבות נייר. - חסום לוחות על ידי הוספת 300 μL של דילול ריאגנט: 1% BSA ב- PBS, pH 7.2-7.4, 0.2 מיקרומטר מסונן (ראה טבלת חומרים) לכל באר. דגירה ב-RT למשך שעה אחת.
- חזור על שלב 2.
- הכן עקומה סטנדרטית לתוך לוח מיקרו של 96 בארות באמצעות דילולים סדרתיים כפולים מ-0-8,000 pg/mL לריכוזים סופיים של 125, 250, 500, 1,000, 2,000, 4,000 ו-8,000 pg/mL. ערכת הלומיקאן ELISA מכילה תקן לומיקן רקומביננטי של 75 ננוגרם (ראו טבלת חומרים).
- הוסף 100 μL של דגימות ואת העקומה הסטנדרטית במיקרופלט 96-well מצופה נוגדנים לכידה.
- מכסים את המיקרו-פלטה ודוגרים במשך שעתיים ב-RT עם תסיסה נמוכה בנדנדה קומפקטית השומרת על המהירות שבין 2-3 סל"ד.
- חזור על שלב 2.
- הוסף 100 μL של הנוגדן לזיהוי ביוטינילציה (ראו טבלת חומרים) לכל באר. מכסים מאור ודוגרים שעתיים ב-RT עם תסיסה נמוכה בנדנדה קומפקטית השומרת על המהירות שבין 2-3 סל"ד.
הערה: בקבוקון הנוגדנים לזיהוי ביוטינילטים מכיל 24 מיקרוגרם נוגדן. לאחר שחזור עם 1.0 מ"ל של דילול מגיב, יש לדלל את הנוגדן לזיהוי ביוטינילציה בתמיסה עובדת של 400 ננוגרם/מ"ל. - חזור על שלב 2.
- הוסף 100 μL של דילול עבודה של streptavidin-חזרת peroxidase (HRP, ראה טבלת חומרים) לכל באר. מכסים את המיקרו-פלטה מאור ודוגרים במשך 20 דקות ב-RT.
הערה: הסטרפטאבידין-HRP הריאקטיבי היה מרוכז פי 40. פתרון העבודה 1x של streptavidin- HRP נעשה עם דילול מגיב.
הערה: יש להימנע מהנחת הצלחת בתאורה ישירה. - חזור על שלב 2.
- לבסוף, הוסף 100 μL של מצע טטרה-מתיל-בנזידין (TMB, ראה טבלת חומרים) פתרון לכל באר.
הערה: הכן תמיסת TMB עם נפח שווה של תמיסת מי חמצן מיוצבת 30% המסופקת בערכה.
הערה: יש להכין את התמיסה מיד לפני השימוש ולשמור עליה בטמפרטורת החדר. - דגירה במשך 30 דקות ב- RT במקום חשוך.
הערה: יש להימנע מהנחת הצלחת בתאורה ישירה. אל תשאף את תמיסת ה- TMB מכיוון שאין צורך בכביסה נוספת. - הוסף 50 μL של 1N H2SO4 תמיסת עצירה כדי לעצור את התגובה הצבעונית. טפחו בעדינות על הצלחת כדי להבטיח ערבוב יסודי.
- קבע מיד את הספיגה של כל באר באמצעות קורא microplate מוגדר ל 450 ננומטר בספקטרומטר צלחת ELISA.
- מדוד את הספיגה באמצעות ספקטרומטר צלחת ELISA במצב נקודת קצה עם רעידות נמוכות במשך 10 שניות.
- ממוצע ערך הספיגה של 450 ננומטר של הדגימות הריקות הסטנדרטיות והפחתתו מערכים אחרים של 450 ננומטר של דגימות סטנדרטיות ולא ידועות.
- השתמש בעקומה הרגילה כדי לקבוע את הריכוז הלומיקאן של כל דגימה לא ידועה.
- לצורך חישוב הריכוז הלומיקני, ערכו גרף רגרסיה קווית באמצעות ערכי הספיגה על ציר Y כנגד הריכוזים ב-pg/mL בציר X של כל עקומת לומיקן סטנדרטית.
- קבל את המשוואה של רגרסיה ליניארית וערך r כדי לחשב את הריכוז הלומיקני.
הערה: ריכוז הלומיקן היה מנורמל ביחס למ"ג הרקמה שחולצה. התוצאות מבוטאות כערכי ריכוז יחסיים מנורמלים של לומיקן למ"ג AM (ng/mL lumican/mg AM tissue).
- קבל את המשוואה של רגרסיה ליניארית וערך r כדי לחשב את הריכוז הלומיקני.
תוצאות
התוצאות מדווחות כערך הממוצע ± סטיית תקן (SD). בוצעו מבחני t של התלמידים וניתוח השונות (ANOVA). ערכי P < 0.05 נחשבו מובהקים סטטיסטית. הניתוח הסטטיסטי בוצע באמצעות תוכנת סטטיסטיקה (ראו טבלת חומרים).
כמות החלבון הכוללת ב-AME הושפעה מתנאי הזמן והאחסון. ריכוז החלבון הבסיסי היה דומה בקרב כל AME; טווח החלבון הכולל היה 2.7 ± 0.3 מיקרוגרם למ"ל ללא הבדל משמעותי בין הדגימות שנבדקו. עם זאת, כאשר הדגימות אוחסנו במשך 12, 20 ו -32 ימים, נצפתה שונות בריכוז החלבון ביחס לריכוז הבסיסי. מעניין, ריכוז החלבון עלה ב- AME ב- 4 °C ו- -20 °C ביחס ל- RT בכל עת של אחסון.
באופן דומה, כאשר הושווה ריכוז החלבון בין זמני האחסון, הוא השתנה לאחר 12, 20 ו-32 יום. הבדל משמעותי (p < 0.05) נמצא ב-AME של 32 ו-20 ימים ב-4 מעלות צלזיוס ו-20 מעלות צלזיוס בהשוואה למצב RT (איור 2), מה שמצביע על כך שהטמפרטורה חשובה לשימור חלבונים ב-AME השונים שהתקבלו.

איור 2: ריכוז החלבון הכולל ב-AME מושפע מטמפרטורת הזמן והאחסון. ריכוז מיצוי החלבון ב-AME כומת לפני ואחרי תנאי אחסון הטמפרטורה והזמן. זמן האחסון שהוערך היה 6 ימים (משולשים שחורים), 12 ימים (משולשים ורודים), 20 ימים (ריבוע סגול) ו -32 ימים (עיגולים חומים) בהשוואה לשלושה תנאי טמפרטורה שונים (RT °C, 4 °C ו- -20 °C (20 °F)). ריכוז החלבון הבסיסי היה דומה בקרב כל AME. היה הבדל משמעותי בריכוז החלבון ב-AME של 20 ו-32 יום ביחס לריכוז החלבון הבסיסי בתנאי טמפרטורה שונים. בכל תנאי n = 3. הנתונים מבוטאים כחציון של מיקרוגרם/מ"ל של חלבון ± SE *p < 0.05 (S1 32 ימים לעומת S1 20, 12 ו-6 ימים ב-4 מעלות צלזיוס); (S1 32 ימים לעומת S1 20, 12 ו-6 ימים ב-20°C-). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
ריכוז לומיקן הושפע מזמן האחסון ומתנאי הטמפרטורה. ריכוז נמוך יותר של לומיקן נמצא ב-AME שאוחסן במשך 6, 20 ו-32 ימים, בהשוואה ל-12 ימי אחסון. באופן משמעותי, AME של 12 ימים היה ריכוז גבוה יותר של lumican מאשר 20 ו 32 ימים של אחסון (p < 0.05).
כאשר הושווה ריכוז הלומיקני ב-AME בין טמפרטורות האחסון, נמצא ריכוז גבוה יותר של לומיקן אם הוא מאוחסן ב-20°C- וב-4 °C במשך 12 ימים (איור 3). מעניין, אפילו ריכוז גבוה יותר (p < 0.05) של lumican נמצא ב 12 ימים AME אם מאוחסן ב -20 °C (70 °F) בהשוואה 4 °C (64 °F).
זה מצביע על כך שריכוז הלומיקאן מושפע מתנאי הטמפרטורה וזמן האחסון, מה שמרמז על כך שזמן האחסון והטמפרטורה המתאימים להשגת הריכוז הגבוה ביותר של לומיקן הוא 12 ימים ב -20 מעלות צלזיוס.
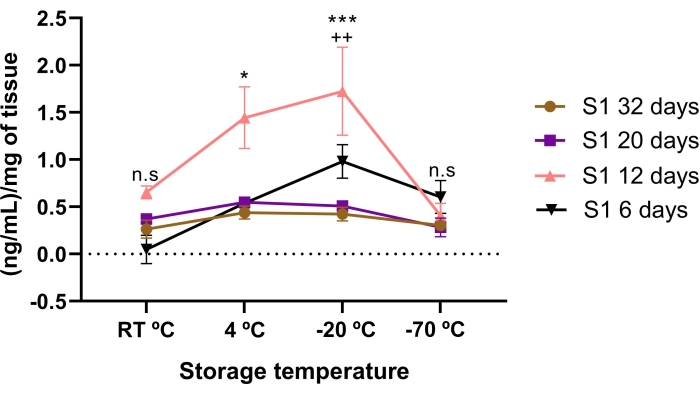
איור 3: ריכוז לומיקן כולל ב-AME המושפע מטמפרטורת הזמן והאחסון. ריכוז לומיקן הושפע מזמן האחסון ומתנאי הטמפרטורה. ריכוז הלומיקאן ב-AME כומת לפני ואחרי תנאי אחסון הטמפרטורה והזמן. זמן האחסון שהוערך היה 6 ימים (משולשים שחורים), 12 ימים (משולשים ורודים), 20 ימים (ריבוע סגול) ו -32 ימים (עיגולים חומים) בהשוואה לשלושה תנאי טמפרטורה שונים (RT °C, 4 °C ו- -20 °C (20 °F)). Lumican ב- AME של 12 ימים היה גבוה משמעותית בהשוואה ל- AME של 32, 20 ו - 6 ימים, בתנאי טמפרטורה של -20 °C (75 °F) ו- 4 °C. * p < 0.05 (S1 12 ימים לעומת S1 32, 20, ו 6 ימים ב 4 °C (6 °F); p < 0.001 (S1 12 ימים לעומת S1 32, 20 ו-6 ימים ב-20°C-). הריכוז הגבוה ביותר של לומיקן ב- AME היה ב -12 ימים מאוחסנים ב -20 מעלות צלזיוס. ++p < 0.01 (S1 12 ימים 4 °C לעומת S1 12 ימים -20 °C (70 °F)). לא היה הבדל משמעותי בין לומיקן ב-AME של 32 ו-20 יום בהשוואה לתנאי טמפרטורת האחסון (n.s). בכל תנאי (n = 3), הנתונים מבוטאים כחציון של ng/mL של חלבון. הנתונים נורמלו ביחס למ"ג של רקמה ± SE. (n.s.) ולא למובהקות סטטיסטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
במחקר זה, נוכחות של lumican נותח ב AME ואת המתאם הישיר שלה עם יציבותו בתנאי אחסון שונים. באופן מעניין, כאשר כימתו את ריכוז החלבון הכולל ב-AME, ריכוז החלבון עלה לאחר האחסון. הראיות מצביעות על שלושה מנגנונים שיכולים לשנות את ריכוז החלבון באחסון קפוא: דנטורציה קרה, ריכוז המומסים הקפואים והתגלגלות חלקית של מבנה החלבון19 המושרה על ידי קרח. תהליך ההקפאה עשוי להשפיע על ריכוז החלבון בדגימות אחסון עקב התגבשות השלב הנוזלי בדגימה. התוצאות מצביעות על כך שזה יכול היה להתרחש כתהליך של הקפאת הריכוז, המושפע מזמן האחסון במקפיא. ריכוז גבוה יותר של חלבונים נצפה בזמני אחסון ארוכים יותר (32 ו -20 ימים) ובטמפרטורות הקרות ביותר (4 °C (74 °F) ו -20 °C (75 °F). עם זאת, בתקופה עם הריכוז הגבוה ביותר של חלבון לא היה הריכוז הגבוה ביותר של lumican; זה מצביע על כך שלומיקן יכול להיות מושפע מטמפרטורות קפואות ותנאי זמן.
על פי התוצאות, ריכוז הלומיקאן היה גבוה ויציב יותר ב -12 ימי אחסון ב -4 מעלות צלזיוס ו -20 מעלות צלזיוס. עם זאת, ריכוז נמוך יותר של לומיקן נמצא ב-6 ימים לעומת 12 ימים. חלק מהדיווחים מצביעים על כך שריכוז החלבון עשוי להשתנות לאחר תנאי אחסוןקפואים 20. התוצאות יכולות להיגרם על ידי מנגנון תרמודינמי בשם התגלגלות חלקית המושרה על ידי קרח של מבנה החלבון, המתרחשת במהלך הקפאת דגימות. האינטראקציה של חלבונים עם מים בתמיסות המימיות מפחיתה את האינטראקציות שלהם עם מולקולות אחרות. תהליך ההתגבשות של מים בתנאים קפואים מאפשר לחלבונים ולאזורים פונקציונליים מסוימים לקיים אינטראקציה עם מולקולות אחרות19. על פי האמור לעיל, לאחר 12 ימים של הקפאת לומיקן בתמיסה מימית, הוא יכול להיות מסוגל לתקשר עם הנוגדנים הקיימים בערכת הכימות של ELISA כדי לגרום לריכוז גבוה יותר. מצד שני, כנראה ביום השישי, הלומיקן יכול היה להיות מבודד בתמיסה מימית.
בקידום חידושים, השימוש ב- AM הוא הטיפול החדשני ביותר לאפיתל מחדש של הקרנית ללא קשר לאטיולוגיה. כאמור, היתרונות של AM הם עצומים 21,22,23,24,25,26. מחברים רבים הדגימו את היתרונות של lumican ב- AME, מה שהופך אותו חלופה סבירה במיוחד עבור מדינות מתפתחות 1,2,3,4,5,6,7,8,9. נכון לעכשיו, ישנם יתרונות רבים של lumican ב AME; השימוש בו כטיפול מעדיף אפיתל מחדש של הקרנית ומשפר את הפרוגנוזה של כיבים בקרנית 4,5,6,7,8,9,10,11,12,13,14,15. השתלת AM (AMT) הפכה לטיפול עם יתרונות גדולים לשיפור הפרעות קרנית שונות24,25. עם זאת, ישנם כמה רגשות כרוניים של רקמת הקרנית, כגון פגמים מתמשכים באפיתל (PED) וחסרים בתאי גזע לימבליים (LESCD), הדורשים טיפול מתמיד ותחזוקה של נוכחות של גורמים ביולוגיים המסייעים לתיקוןהקרנית 21,24. נכון לעכשיו, אין טיפולים אדג'ובנטיים המאפשרים תחזוקה ארוכת טווח של הגורמים המשתחררים על ידי AMT על פני הקרנית. עם זאת, החלפה מתמדת של AMT לא יכול להיות מומלץ לבטיחות המטופל26. מסיבה זו, יש צורך לפתח חלופות המאפשרות את הפונקציות של AMT כדי לסייע ומסייע לשמור על נוכחותם של גורמים שפורסמו על ידי AM ברקמת הקרנית כגון lumican במשך זמן רב יותר, מתוך כוונה להעדיף את הטיפול בבעיות מתמשכות של הקרנית27.
Lumican הוא אחד הגורמים הקיימים AM עם פונקציות אנטי דלקתיות ואנטי פיברוטיות, אשר דווח כי יש פונקציות בתהליך תיקון הקרנית 6,7,8,9,10,11,12,13,14,15 . לכן lumican מציע להיות מועמד טוב כדי לסייע בטיפול ברגשות הקרנית; עם זאת, מחקר נוסף נדרש כדי לקבוע את היעילות של lumican ב- AME כדי להשיג אפיתל מחדש של הקרנית.
Lumican הוא פרוטאוגליקן שהוכח כמווסת את הפרשת תרכובות המטריצה החוץ-תאית כקולגן; כמו כן, הוא מעורב בהפעלת פיברובלסטים וויסות של תאים דלקתיים ותהליך אנגיוגנזה, בעל תפקיד חשוב בריפוי פצעים. על פי התוצאות, lumican ניתן לחלץ מרקמת AM. יישומים טיפוליים של lumican הם רבים; השימוש בלומיקאן ב- AME מאפשר אפשרות טיפולית ברת השגה להפרעות עיניים 4,13. היתרון העיקרי של השימוש ב- AME הוא שהוא מספק יישום קל כטיפול מקומי למשטח העין, בהתחשב בהרכבו המיימי. כמו כן, חלבונים אחרים עם מאפיינים אנטי דלקתיים וחיסוניים ניתן למצוא בתוך הרכיבים המופקים מרקמת AM, אשר יכול להציג יתרון גדול יותר בטיפול בבעיות דה-אפיתל בעין. לדוגמה, גורמים אנטי דלקתיים אחרים כגון TSG-6 הנמצאים ב- AM ורכיבים תאיים דווחו בעבר כבעלי תכונות ויסות חיסוני8. בזאת, טיפול משולב של תרכובות לומיקן ותרכובות מטריקס חוץ-תאיות אחרות ומולקולות אימונומודולטוריות הנמצאות ב- AME יכול להיות שימושי בתהליך אפיתל מחדש וריפוי פצעים.
שיטה זו נועדה להדגים טכניקה פשוטה למיצוי חלבונים, שימושית עבור obtention של חלבונים שופעים וגורמים. אחד השיקולים הקריטיים לשיטה זו הוא השימוש במעכבי פרוטאזות, שכן הוא חיוני למיצוי חלבון מוצלח שכן AM היא רקמה עם המון תרכובות אנזימטיות למניעת פירוק חלבונים27. עדויות דיווחו כי שימוש במעכבי חלבון יחד עם תמיסה מימית מגביר את מיצוי של גורמים אחרים, כגון HGF, ברקמת AM26. ההסתרה של אבקה עדינה לאחר הקפאה והארקה של AM נחוצה להעלאה אופטימלית של AME, שכן תהליך זה מתאים לשיבוש רקמות ותאים של מבנים הדרושים להפקת ציטוזוליק ותרכובות גרעיניות אחרות28,29.
כמה מגבלות של שיטת מיצוי זו הן שכמות AM שבה נעשה שימוש לא יכלה לאפשר מיצוי בקנה מידה גבוה. פרוטוקול זה מאפשר מיצוי חלבון מכמות מוגבלת של רקמה; שכן אין ראיות לכך ששיטה זו מאפשרת להשיג כמות גדולה יותר של חלבון מאזור רקמה גדול יותר. פתרון בעיות שיש לשקול בהשוואה לשיטות מיצוי אחרות הוא להשתמש בריכוז מתאים של מעכב פרוטאז וזמן הדגירה, שכן עודף האנזימים עלול להשפיע על חלבונים30 ולהפחית את יעילות הטכניקה.
חלק מטכניקה זו שונה מזו שדווחה על ידי Mahbod et al.16, המתארת כי חזרה על תהליך הצנטריפוגה והמיצוי מגבירה את מיצוי החלבון. בניגוד למהבוד, התוצאות לא דיווחו על ריכוז חלבונים לאחר שלושה מחזורים של צנטריפוגה. כאשר נקבע ריכוז החלבון הכולל, הוא ירד ב-80% במיצוי שני ועד 97% במיצוי שלישי. ביצוע מיצוי אחד בלבד מקצר את זמן העיבוד ואינו מקטין את כמות החלבון הכוללת. עם הקודם, שיטת החילוץ המדווחת כאן דורשת רק שלב צנטריפוגה אחד עם תוצאות חיוביות.
טכניקה זו יכולה לשמש כדי לחלץ גורמים וחלבונים אחרים הנמצאים בבוקר ועוד, כדי לקבל גורמים ממקורות אחרים כגון בעלי חיים או ירקות. זה יכול להיות גם יישום להשגת חלבונים לביצוע מחקר בסיסי או אפילו פיתוח של ניסוחים וטיפולים.
תוצאות אלה מצביעות על כך שניתן לחלץ לומיקן מ- AM ולאחסן אותו במשך 12 יום כ- AME בתנאי טמפרטורה של -20 °C ו- 4 °C. חשוב לשקול את מחצית החיים שלה כדי להשיג את ההשפעות הטיפוליות של lumican כמו AME. מחקרים נוספים נדרשים כדי לקבוע את התפקיד של AME lumican בתאי אפיתל הקרנית ולקבוע את המינון האידיאלי של lumican עבור אפיתל מחדש של הקרנית.
לסיכום, התוצאות מצביעות על כך שהשגת גורמים כגון לומיקן ב- AME אפשרית. כמו כן, הטמפרטורה ותנאי זמן האחסון משפיעים על ריכוז הלומיקאן הקיים ב- AME.
Disclosures
המחקר מומן על ידי תוכנית התמיכה בפרויקטים של מחקר וחדשנות טכנולוגית של האוניברסיטה הלאומית האוטונומית של מקסיקו (מענק מס' PAPIIT IN203821), ומשרד החינוך, המדע, הטכנולוגיה והחדשנות (מענק מס' SECTEI 250/2019).
Acknowledgements
למחברים אין אינטרסים כלכליים מתחרים.
Materials
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
References
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved