Method Article
Извлечение люмикана из амниотической мембраны и определение температуры ее хранения
В этой статье
Резюме
Настоящий протокол описывает извлечение люмиканов из амниотической мембраны (AM) и условия их хранения в виде экстракта AM (AME) при -20 °C, 4 °C и комнатной температуре (RT) в течение 6, 12, 20 и 32 дней для количественной оценки его белков и концентрации люмиканов.
Аннотация
Люмикан представляет собой небольшой богатый лейцином протеогликан в амниотической мембране человека (АМ), который способствует эпителизации роговицы и организации коллагеновых волокон, поддерживая прозрачность роговицы. В настоящей работе предложен способ экстракции белка из АМ для получения люмикана. Кроме того, оценивается стабильность люмикана в экстракте AM (AME), хранящемся при различных температурах и периодах времени. 100 мг АМ размораживали и механически деэпителизировали. Деэпителиализованный АМ замораживали и измельчали до получения мелкого порошка, который солюбилизировали 2,5 мл физиологического буфера с ингибиторами протеазы и центрифугировали для экстракции белка. Супернатант собирали и хранили при -20 °C, 4 °C и комнатной температуре (RT) в течение 6, 12, 20 и 32 дней. После этого люмикан был количественно определен в каждом AME. Этот метод позволяет создать доступный и доступный протокол для извлечения люмиканов из AM. На концентрацию люмикана влияли время хранения и температурные условия. Люмикан в АМЕ 12 дней хранился при -20 °C и 4 °C был значительно выше, чем в других AME. Эта экстракт люмикана может быть полезна для разработки методов лечения и фармацевтических решений. Необходимы дальнейшие исследования для определения использования люмикана AME в процессе реэпителизации и заживления ран.
Введение
Одним из наиболее часто используемых методов лечения поражений роговицы является трансплантация амниотической мембраны; однако в последние годы появились новые предложения по использованию различных компонентов амниотической ткани в качестве альтернативных и адъювантных методов лечения. К числу наиболее изученных компонентов АМ относятся те, которые получены из экстракта АМ (АМЕ)1,2,3,4,5,6,7. AM содержит множество растворимых факторов, таких как антиангиогенные белки, интерлейкины (IL), тканевые ингибиторы металлопротеиназ (TIMPs), противовоспалительные белки, опосредованные TSG-6, которые ингибируют внеклеточные ловушки нейтрофилов, факторы роста: эпидермальный фактор роста (EGF), трансформирующий фактор роста (TGF) (альфа и бета), фактор роста кератиноцитов (KGF), фактор роста гепатоцитов (HGF) и люмикан, который поддерживает прозрачность роговицы путем регулирования фибрилтогенеза коллагена1, 2,3,4,5,6,7,8,9.
Люмикан представляет собой небольшой богатый лейцином протеогликан (SLRP), один из основных внеклеточных компонентов интерстициальной коллагеназы в матрице стромы роговицы, отвечающий за организацию коллагеновых волокон и поддержание прозрачности роговицы 4,10,11. Протеогликаны представляют собой молекулы во внеклеточном матриксе (ECM), которые являются основными в проведении клеточной сигнализации и поддержании внутриклеточного гомеостаза12. Сообщалось, что белки ECM управляют клеточными процессами пролиферации, дифференцировки и миграции во время заживления ран11.
Данные свидетельствуют о возможном участии люмикана в процессе реэпителизации роговицы. Saika et al. в исследовании показали, что после травмы роговицы люмикан может быть обнаружен в кератоцитах роговицы между первыми 8 ч и до 3 дней после травмы. Представляя самую высокую концентрацию люмикана на второй и третий день, этот протеогликан впоследствии не обнаруживается на седьмой день13. Эти данные свидетельствуют об участии люмикана в активации процесса реэпителизации роговицы. С другой стороны, в другом исследовании сообщалось, что отсутствие люмиканов задерживает реэпителизацию; Интересно, что добавление люмикана может ускорить процесс реэпителизации 4,11,13. Аналогичным образом, недавнее исследование показало, что люмикан может модулировать воспалительные функции фибробластов роговицылимбуса 14, что предполагает роль люмикана в качестве модулятора воспалительного, антифиброзивного и реэпителиализирующего ответа. Аналогичным образом, люмикан может модулировать реакцию роговицы, взаимодействуя с сигнальными молекулами, такими как Fas-FasL. Кроме того, отсутствие люмикана в нокаутной модели Lum-/- мыши продемонстрировало, что отсутствие люмиканной сигнализации препятствует адекватному восстановлению роговицы15.
В первую очередь, этот метод направлен на демонстрацию осуществимого и доступного способа извлечения люмикана из AM. С помощью этого предпочтительного метода экстракции люмиканов можно получить аналогичные концентрации белков, уменьшая время обработки и делая его более удобным для исследователей по сравнению с предыдущими исследованиями16. Кроме того, этот люмикан AME может быть использован в качестве адъюванта для процессов восстановления и реэпителизации роговицы.
протокол
Все экспериментальные процедуры были одобрены Институциональным наблюдательным советом (проект No CEI-2020/06/04). AM был получен из Банка АМТа Офтальмологии Валенсии (из деидентифицированных людей), который подготовлен, как описано Чавесом-Гарсией и др.17.
1. Приготовление экстракта амниотической мембраны
- Получают 100 мг АМ из амнионного банка.
ПРИМЕЧАНИЕ: Согласно предыдущему отчету, 50 мг АМ секретирует в общей сложности 10 нг/мл люмикана14. Для получения более высокой концентрации люмикана используют 100 мг АМ, что эквивалентно общей площади 32см2. - Если AM заморожен, разморозьте его при комнатной температуре.
ПРИМЕЧАНИЕ: Выполните следующие процедуры под ламинарной проточной вытяжкой класса II B. - Промыть АМ в чашке Петри 10 мл стерильного сбалансированного раствора соли (BSS, см. Таблицу материалов) в течение 2 мин.
- Налейте BSS в стакан.
- Повторите шаг 3 и визуально подтвердите, что глицериновая среда отсутствует в чашке Петри BSS.
ПРИМЕЧАНИЕ: Повторите шаг 3. по мере необходимости до тех пор, пока глицериновая среда не присутствует в чашке Петри BSS.
- Инкубируют AM с 10 мл диспаза II (1,7 МЕ/мл, см. Таблицу материалов) при 37 °C, 5% CO2 в течение 30 мин.
ПРИМЕЧАНИЕ: Dispase II является нейтральной протеазой с мягкой активностью над эпителиальными клетками. Этот фермент эффективно отделяет интактный эпидермис от дермы и изолирует интактные эпителиальные листы18. - После инкубации диспазы выполняют механическую деэпителизацию14 с резиновым полицейским (см. Таблицу материалов). Подтвердите деэпителизацию с помощью микроскопической визуализации.
ПРИМЕЧАНИЕ: Процесс деэпителизации подтверждается в перевернутом микроскопе с использованием 4x и 20x объективов. Визуализируйте ткань, чтобы исключить наличие какого-либо клеточного слоя. - Вымойте АМ в чашке Петри с 10 мл BSS в течение 2 мин. Налейте BSS в стакан.
- Поместите деэпителиализованный AM (dAM) в микроцентрифужную трубку объемом 2 мл. Погрузите дАМ в жидкий азот на 40 мин.
- Вручную измельчают замороженный dAM в течение 2-3 мин в предварительно охлаждаемом растворе при -85 °C до получения мелкодисперсного порошка.
- В растворе солюбилизируют порошок dAM 2,5 мл раствора ингибитора протеазы (BSS с ингибиторами протеазы).
ПРИМЕЧАНИЕ: Каждая таблетка ингибитора протеазы состоит из следующей смеси ферментов: экстракт поджелудочной железы (0,02 мг/мл), термолизин (металлопротеаза) (0,0005 мг/мл), химотрипсин (0,002 мг/мл), трипсин (0,02 мг/мл) и папаин (0,33 мг/мл) (см. Таблицу материалов). - Соберите смесь с помощью микропипетки, и очистите стенки раствора с помощью скальпельного ножа. Поместите смесь в пробирку объемом 5 мл.
- Хорошо перемешать с вихрем в течение 30 с.
- Гомогенизировать тканевую смесь центрифугированием при 34 х г в течение 20 мин при 4 °С и немедленно центрифугировать при 3360 х г в течение 20 мин при 4 °С.
- Собранным супернатантом является AME (рисунок 1). Хранить 0,7 мл каждого AME в разных микроцентрифужных трубках по 2 мл в течение 6, 12, 20 и 33 дней при различных температурных условиях -20 °C, 4 °C и комнатной температуре (RT).
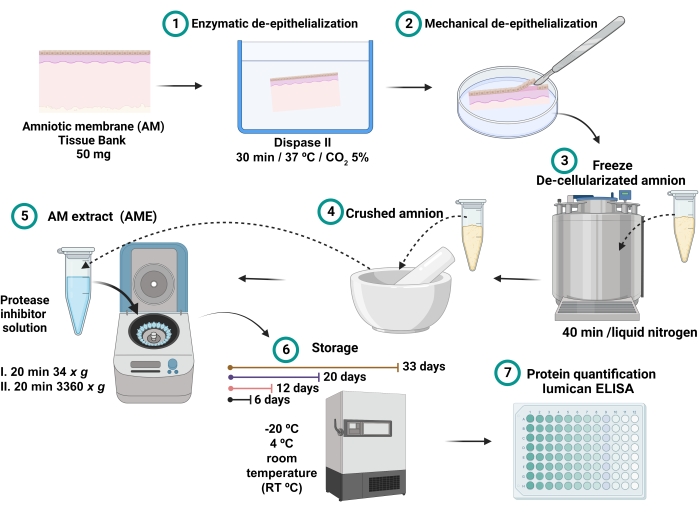
Рисунок 1: Процесс получения АМЕ и измерения концентрации люмиканов. 100 мг АМ инкубировали с диспазой II при 37 °С в течение 30 мин и механически деэпителиализировали. Деэпителиализованный АМ промывали и погружали в жидкий азот на 40 мин, а затем измельчали до получения мелкого порошка, который солюбилизировали 2,5 мл физиологического буфера с ингибиторами протеазы и центрифугировали. Супернатант собирали и хранили при -20 °C, 4 °C и RT в течение 6, 12, 20 и 32 дней до полного количественного определения белка и люмикана. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Количественная оценка белка AME
ПРИМЕЧАНИЕ: Количественная оценка общего белка в АМЕ должна проводиться сразу после получения. Количественно оценивайте белки с помощью анализа белка Lowry и следуйте инструкциям производителя (см. Таблицу материалов). Рекомендуется, чтобы все стандарты и образцы анализировались в трех экземплярах.
- Пипетка 40 мкл каждого образца AME в 96-луночную микропластину.
- Подготовьте стандартную кривую в ту же микропластину с использованием стандарта сывороточного альбумина крупного рогатого скота (BSA) для конечной концентрации BSA 0-1 500 мкг/мл (0, 1, 5, 25, 125, 250, 500, 750, 1000 и 1 500 мкг/мл).
- Пипетка 200 мкл модифицированного реагента Лоури в каждую скважину. Сразу же перемешайте его на пластинчатом миксере в течение 30 с.
- Накройте микропластин алюминиевой фольгой и инкубируйте ее на RT в течение 10 мин.
- Пипетка 20 мкл 1x реагента Folin-Ciocalteu в каждую лунку. Сразу же перемешайте его на пластинчатом миксере в течение 30 с.
ПРИМЕЧАНИЕ: Чтобы приготовить 1x реагента Folin-Ciocalteu, разбавьте 2x (2N) реагента 1:1 сверхчистой водой. Приготовьте 1x реагент Folin-Ciocalteu в тот же день использования, так как разбавленный реагент нестабилен. - Накройте микропластинку от света алюминиевой фольгой и высиживайте ее на RT в течение 30 мин.
- Измерьте поглощение образцов при 660 нм в пластинчатом спектрометре ИФА (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Цвет может быть измерен на длинах волн от 650 нм до 750 нм. - Усредните значение поглощения 660 нм стандартных пустых образцов и вычтите его из других значений 660 нм стандартных и неизвестных образцов.
- Измерьте поглощение с помощью пластинчатого спектрометра ИФА в режиме конечной точки с низким встряхиванием в течение 10 с.
- Используйте стандартную кривую для определения концентрации белка в каждом неизвестном образце.
- Для расчета белка определите концентрацию на графике линейной регрессии, используя значения поглощения по оси Y по отношению к концентрациям в мг/мл на оси X каждой стандартной кривой BSA.
- Получение уравнения линейной регрессии и значения r для расчета концентрации белка.
ПРИМЕЧАНИЕ: Результаты выражаются в виде нормализованных относительных значений концентрации общего белка относительно мг АМ (мкг/мл белка/мг ткани АМ).
- Получение уравнения линейной регрессии и значения r для расчета концентрации белка.
3. Количественная оценка Lumican в AME
ПРИМЕЧАНИЕ: Концентрация люмикана должна быть измерена в АМЕ, хранящемся в различных условиях хранения и периодах времени. Количественно оцените люмикан с помощью сэндвич-ИФА и следуйте инструкциям производителя. Рекомендуется, чтобы все стандарты и образцы анализировались в двух экземплярах.
- Разбавить человеческое люмиканное захватное антитело (см. Таблицу материалов) до используемой концентрации в фосфатно-буферном физиологическом растворе (PBS).
ПРИМЕЧАНИЕ: Флакон с захватным антителом содержит 120 мкг антитела. После восстановления 0,5 мл ПБС разводят захватным антителом в рабочем растворе 2 мкг/мл.- Мгновенно пипетку 100 мкл на лунку разбавленного захвата антитела к 96-луночной микропластине. Заключите пластину в оболочку и высиживайте ее на ночь в RT.
- Аспирировать каждую скважину и промыть ее пипеткой с 300 мкл промывочного буфера: 0,05% монолаурат полиоксиэтиленсорбитана 20 в PBS, рН 7,2-7,4 (см. Таблицу материалов) с использованием многоканального пипеттера. Повторите три раза.
ПРИМЕЧАНИЕ: После последней стирки удалите оставшийся буфер для стирки, покрыв тарелку, и осторожно прижмите ее к бумажным полотенцам. - Блокируют пластины добавлением 300 мкл разбавителя реагента: 1% BSA в PBS, рН 7,2-7,4, 0,2 мкм фильтруют (см. Таблицу материалов) в каждую скважину. Инкубировать на РТ в течение 1 ч.
- Повторите шаг 2.
- Подготовьте стандартную кривую в 96-луночную микропластину с использованием двукратного последовательного разбавления от 0 до 8000 пг/мл для конечных концентраций 125, 250, 500, 1000, 2000, 4000 и 8000 пг/мл. Комплект люмиканов ELISA содержит рекомбинантный люмикан стандарта 75 нг (см. Таблицу материалов).
- Добавьте 100 мкл образцов и стандартную кривую в 96-луночную микропластину, покрытую антителами.
- Накройте микропластинкой и инкубируйте в течение 2 ч при РТ с низким перемешиванием в компактном коромысле, поддерживающем скорость между 2-3 об/мин.
- Повторите шаг 2.
- Добавьте 100 мкл антитела к биотинилированному детектированию (см. Таблицу материалов) в каждую лунку. Накрыть от света и инкубировать 2 ч на РТ с низким перемешиванием в компактном коромысле, поддерживающем скорость между 2-3 об/мин.
ПРИМЕЧАНИЕ: Флакон с биотинилированным антителом содержит 24 мкг антитела. После восстановления 1,0 мл разбавителя реагента разводят антитело к биотинилированному детектированию в рабочем растворе 400 нг/мл. - Повторите шаг 2.
- Добавляют в каждую лунку 100 мкл рабочего разбавления стрептавидин-пероксидазы хрена (HRP, см. Таблицу материалов). Накройте микропластинку от света и инкубируйте в течение 20 минут на RT.
ПРИМЕЧАНИЕ: Реактивный стрептавидин-HRP был 40-кратно концентрированным. Рабочий раствор 1х стрептавидина-HRP изготавливали с разбавителем реагента.
ПРИМЕЧАНИЕ: Избегайте размещения пластины при прямом освещении. - Повторите шаг 2.
- Наконец, добавьте 100 мкл раствора субстрата тетраметилбензидина (TMB, см. Таблицу материалов) в каждую лунку.
ПРИМЕЧАНИЕ: Готовят раствор ТМБ с равным объемом стабилизированного 30% раствора перекиси водорода, предусмотренного в комплекте.
ПРИМЕЧАНИЕ: Подготовьте раствор непосредственно перед использованием и выдерживайте его при комнатной температуре. - Инкубировать в течение 30 мин при РТ в темном месте.
ПРИМЕЧАНИЕ: Избегайте размещения пластины при прямом освещении. Не аспирируйте раствор TMB, так как дальнейшая промывка не требуется. - Добавляют 50 мкл 1NH2SO4 стоп-раствора, чтобы остановить колориметрическую реакцию. Осторожно постучите по тарелке, чтобы обеспечить тщательное перемешивание.
- Немедленно определите поглощение каждой скважины с помощью микропластичного считывателя, установленного на 450 нм в пластинчатом спектрометре ИФА.
- Измерьте поглощение с помощью пластинчатого спектрометра ИФА в режиме конечной точки с низким встряхиванием в течение 10 с.
- Усредните значение поглощения 450 нм стандартных пустых образцов и вычтите его из других значений 450 нм стандартных и неизвестных образцов.
- Используйте стандартную кривую для определения концентрации люмиканов в каждом неизвестном образце.
- Для расчета концентрации люмиканов составьте линейный график регрессии, используя значения поглощения по оси Y по отношению к концентрациям в пг/мл на оси X каждой стандартной люмиканской кривой.
- Получение уравнения линейной регрессии и значения r для вычисления концентрации люмикана.
ПРИМЕЧАНИЕ: Концентрацию люмикана нормализовали по отношению к мг экстрагированной ткани. Результаты выражаются в виде нормализованных относительных значений концентрации люмикана к мг АМ (нг/мл люмикан/мг АМ ткани).
- Получение уравнения линейной регрессии и значения r для вычисления концентрации люмикана.
Результаты
Результаты сообщаются как среднее значение ± стандартного отклонения (SD). Были проведены студенческие т-тесты и анализ дисперсии (ANOVA). P-значения < 0,05 были признаны статистически значимыми. Статистический анализ проводился с использованием статистического программного обеспечения (см. Таблицу материалов).
Общее количество белка в АМЕ зависело от времени и условий хранения. Концентрация базального белка была одинаковой среди всех АМЕ; диапазон общего белка составлял 2,7 ± 0,3 мкг/мл без существенной разницы между оцениваемыми образцами. Однако, когда образцы хранились в течение 12, 20 и 32 дней, наблюдалась изменчивость концентрации белка по отношению к базальной концентрации. Интересно, что концентрация белка увеличивалась в АМЕ при 4 °C и -20 °C по отношению к RT во все время хранения.
Аналогичным образом, когда концентрацию белка сравнивали между временами хранения, она изменялась через 12, 20 и 32 дня. Существенная разница (p < 0,05) была обнаружена в AME 32 и 20 дней при 4 °C и -20 °C по сравнению с состоянием RT (рисунок 2), предполагая, что температура важна для сохранения белка в различных полученных AME.

Рисунок 2: Общая концентрация белка в АМЕ зависит от времени и температуры хранения. Концентрация экстракции белка на AME была количественно определена до и после температуры и временных условий хранения. Оценивалось время хранения 6 дней (черные треугольники), 12 дней (розовые треугольники), 20 дней (фиолетовый квадрат) и 32 дня (коричневые круги) по сравнению с тремя различными температурными условиями (RT °C, 4 °C и -20 °C). Концентрация базального белка была одинаковой среди всех АМЕ. Наблюдалась значительная разница в концентрации белка в АМЕ в течение 20 и 32 дней относительно концентрации базального белка при различных температурных условиях. В каждом условии n = 3. Данные выражаются в виде медианы мкг/мл белка ± SE*p < 0,05 (S1 32 дня против S1 20, 12 и 6 дней при 4 °C); (S1 32 дня против S1 20, 12 и 6 дней при -20 °C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На концентрацию люмикана влияли время хранения и температурные условия. Меньшая концентрация люмикана была обнаружена в AME, хранящемся в течение 6, 20 и 32 дней, по сравнению с 12 днями хранения. Примечательно, что AME 12 дней имел более высокую концентрацию люмикана, чем 20 и 32 дня хранения (p < 0,05).
Когда концентрацию люмикана в АМЕ сравнивали между температурами хранения, была обнаружена более высокая концентрация люмикана при хранении при -20 °C и 4 °C в течение 12 дней (рисунок 3). Интересно, что даже более высокая (p < 0,05) концентрация люмикана была обнаружена в течение 12 дней AME при хранении при -20 °C по сравнению с 4 °C.
Это говорит о том, что концентрация люмикана зависит от температурных условий и времени хранения, предполагая, что соответствующее время хранения и температура для достижения наибольшей концентрации люмикана составляет 12 дней при -20 °C.
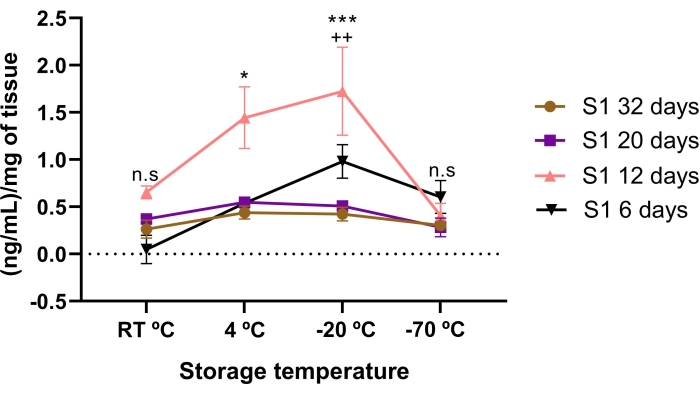
Рисунок 3: Общая концентрация люмикана в АМЕ зависит от времени и температуры хранения. На концентрацию люмикана влияли время хранения и температурные условия. Концентрация люмикана в АМЕ была количественно определена до и после температурных и временных условий хранения. Оценивалось время хранения 6 дней (черные треугольники), 12 дней (розовые треугольники), 20 дней (фиолетовый квадрат) и 32 дня (коричневые круги) по сравнению с тремя различными температурными условиями (RT °C, 4 °C и -20 °C). Люмикан в АМЕ 12 дней был достоверно выше по сравнению с АМЭ 32, 20 и 6 дней, при температурных условиях -20 °C и 4 °C. *p < 0,05 (S1 12 дней против S1 32, 20 и 6 дней при 4 °C); p < 0,001 (S1 12 дней против S1 32, 20 и 6 дней при -20°C). Самая высокая концентрация люмикана в АМЕ была через 12 дней при хранении при -20 °C. ++p < 0,01 (S1 12 дней 4 °C против S1 12 дней -20 °C). Не было выявлено существенной разницы между люмиканами в АМЕ в 32 и 20 дней по сравнению с температурными условиями хранения (н.с.). В каждом состоянии (n = 3) данные выражаются в виде медианы нг/мл белка. Данные были нормализованы в отношении мг тканевых ± SE. (n.s.), а не статистическую значимость. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В данном исследовании анализировалось наличие люмикана в АМЕ и его прямая корреляция с его стабильностью при различных условиях хранения. Интересно, что когда общая концентрация белка в АМЕ была количественно определена, концентрация белка увеличивалась после хранения. Данные свидетельствуют о трех механизмах, которые могут изменить концентрацию белка в замороженном хранилище: холодная денатурация, замороженная концентрация растворенных веществ и частичное развертывание структуры белка19, вызванное льдом. Процесс замораживания может повлиять на концентрацию белка на хранимых образцах из-за кристаллизации жидкой фазы в образце. Результаты показывают, что это могло произойти как процесс замораживания концентрации, на который влияет время хранения в морозильной камере. Более высокая концентрация белков наблюдалась при более длительном времени хранения (32 и 20 дней) и при самых низких температурах (4 °C и -20 °C). Однако период с самой высокой концентрацией белка не имел самой высокой концентрации люмикана; это говорит о том, что на люмикан могут влиять замерзшие температуры и временные условия.
Согласно результатам, концентрация люмиканов была выше и стабильнее через 12 дней хранения при 4 °C и -20 °C. Тем не менее, меньшая концентрация люмикана была обнаружена через 6 дней по сравнению с 12 днями. Некоторые сообщения предполагают, что концентрация белка может измениться после замороженных условий хранения20. Результаты могут быть вызваны термодинамическим механизмом, называемым искусственным льдом, частичным развертыванием структуры белка, которое происходит во время замораживания образцов. Взаимодействие белков с водой в водных растворах снижает их взаимодействие с другими молекулами. Процесс кристаллизации воды в замороженных условиях позволяет белкам и некоторым функциональным областям взаимодействовать с другими молекулами19. Согласно вышесказанному, после 12 дней замораживания люмикана в водном растворе он может взаимодействовать с антителами, присутствующими в наборе количественной оценки ИФА, что приводит к более высокой концентрации. С другой стороны, вероятно, на шестой день люмикан мог быть изолирован в водном растворе.
В продвижении инноваций использование АМ является самым современным методом лечения реэпителизации роговицы независимо от этиологии. Как уже упоминалось выше, преимущества AM огромны 21,22,23,24,25,26. Многие авторы продемонстрировали преимущества люмикана в АМЕ, сделав его доступной альтернативой специально для развивающихся стран 1,2,3,4,5,6,7,8,9. В настоящее время существует много преимуществ люмикана в AME; его применение в качестве лечения способствует реэпителизации роговицы и улучшает прогноз язв роговицы 4,5,6,7,8,9,10,11,12,13,14,15. Трансплантация АМ (АМТ) стала лечением с большими преимуществами для улучшения различных заболеваний роговицы24,25. Тем не менее, существуют некоторые хронические поражения ткани роговицы, такие как стойкие дефекты эпителия (PED) и дефицит лимбальных стволовых клеток (LESCD), которые требуют постоянного лечения и поддержания присутствия биологических факторов, которые помогают восстанавливать роговицу21,24. В настоящее время не существует адъювантных обработок, которые позволяют длительно поддерживать факторы, высвобождаемые АМТ на поверхности роговицы. Однако постоянная замена АМТ не может быть рекомендована для безопасности пациентов26. По этой причине необходимо разработать альтернативы, которые позволяют функциям АМТ помогать и помогают поддерживать присутствие факторов, высвобождаемых АМ в ткани роговицы, таких как люмикан, в течение более длительного времени, намереваясь способствовать лечению постоянных проблем роговицы27.
Люмикан является одним из факторов, присутствующих в АМ с противовоспалительными и антифибротическими функциями, который, как сообщается, имеет функции в процессе восстановления роговицы 6,7,8,9,10,11,12,13,14,15 . Вот почему люмикан предлагает быть хорошим кандидатом, чтобы помочь в лечении поражений роговицы; однако необходимы дополнительные исследования для определения эффективности люмикана в АМЕ для достижения реэпителизации роговицы.
Люмикан представляет собой протеогликан, который, как было показано, регулирует секрецию соединений внеклеточного матрикса в виде коллагена; кроме того, он участвует в активации фибробластов и модуляции воспалительных клеток и процессе ангиогенеза, играя важную роль в заживлении ран. Согласно результатам, люмикан может быть извлечен из ткани AM. Терапевтические применения люмикана многочисленны; использование люмикана в АМЕ позволяет достижимый терапевтический вариант при глазных расстройствах 4,13. Основным преимуществом использования AME является то, что он обеспечивает легкое применение в качестве местного лечения поверхности глаза, учитывая его водный состав. Аналогичным образом, другие белки с противовоспалительными и иммунорегуляторными характеристиками могут быть найдены в компонентах, извлеченных из ткани AM, что может принести большую пользу при лечении проблем деэпителиализации в глазу. Например, ранее сообщалось, что другие противовоспалительные факторы, такие как TSG-6, присутствующие в AM и клеточных компонентах, обладают иммунорегуляторными свойствами8. Таким образом, комбинированная терапия люмиканами и другими соединениями внеклеточного матрикса и иммуномодулирующими молекулами, присутствующими в АМЕ, может быть полезна в процессе реэпителизации и заживления ран.
Этот метод направлен на демонстрацию простой техники экстракции белка, полезной для получения обильных белков и факторов. Одним из критических соображений для этого метода является использование ингибиторов протеазы, поскольку он имеет основополагающее значение для успешной экстракции белка, поскольку AM представляет собой ткань с множеством ферментативных соединений для предотвращения деградации белка27. В фактических данных сообщалось, что использование ингибиторов белка вместе с водным раствором увеличивает экстракцию других факторов, таких как HGF, в ткани AM26. Затухание мелкодисперсного порошка после замораживания и заземления АМ необходимо для оптимального всасывания АМЕ, так как этот процесс подходит для тканевого и клеточного разрушения структур, необходимых для экстракции цитозольных и других ядерных соединений28,29.
Некоторые ограничения этого метода экстракции заключаются в том, что используемое количество AM не может позволить крупномасштабную экстракцию. Этот протокол позволяет экстрагировать белок из ограниченного количества ткани; поскольку нет доказательств того, что этот метод позволяет получить большее количество белка из большей площади ткани. Устранение неисправностей, которое следует рассматривать в сравнении с другими методами экстракции, заключается в использовании подходящей концентрации ингибитора протеазы и времени инкубации, поскольку избыток ферментов может влиять на белки30 и снижать эффективность метода.
Часть этого метода была модифицирована по сравнению с тем, о котором сообщили Mahbod et al.16, в котором описывается, что повторение процесса центрифугирования и экстракции увеличивает экстракцию белка. В отличие от Махбода, результаты не сообщали о концентрации белка после трех циклов центрифугирования. Когда определяли общую концентрацию белка, она уменьшалась на 80% при второй экстракции и до 97% при третьей экстракции. Выполнение только одной экстракции сокращает время обработки и не уменьшает количество общего белка. С учетом вышесказанного, метод экстракции, описанный здесь, требует только одной стадии центрифугирования с благоприятными результатами.
Этот метод может быть использован для извлечения других факторов и белков, присутствующих в AM, и далее, для получения факторов из других источников, таких как животные или овощи. Он также может иметь применение для получения белков для проведения фундаментальных исследований или даже разработки составов и методов лечения.
Эти результаты свидетельствуют о том, что люмикан может быть извлечен из AM и храниться в течение 12 дней в качестве AME при температурных условиях -20 °C и 4 °C. Важно учитывать его период полувыведения для достижения терапевтических эффектов люмикана в виде АМЕ. Необходимы дальнейшие исследования для определения роли люмикана АМЕ в эпителиальных клетках роговицы и определения идеальной дозы люмикана для реэпителизации роговицы.
В заключение, результаты показывают, что получение таких факторов, как люмикан в AME возможно. Аналогичным образом, температура и условия хранения влияют на концентрацию люмикана, присутствующего в AME.
Раскрытие информации
Исследование финансировалось Программой поддержки научно-исследовательских и технологических инновационных проектов Национального автономного университета Мексики (грант No PAPIIT IN203821) и Министерства образования, науки, технологий и инноваций (грант No SECTEI 250/2019).
Благодарности
У авторов нет конкурирующих финансовых интересов.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
Ссылки
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены