Method Article
Estrazione Lumican dalla membrana amniotica e determinazione della sua temperatura di conservazione
In questo articolo
Riepilogo
Il presente protocollo descrive l'estrazione di lumican dalla membrana amniotica (AM) e le loro condizioni di conservazione come estratto AM (AME) a -20 °C, 4 °C e temperatura ambiente (RT) per 6, 12, 20 e 32 giorni per quantificare le sue proteine e la concentrazione di lumican.
Abstract
Lumican è un piccolo proteoglicano ricco di leucina nella membrana amniotica umana (AM) che promuove l'epitelizzazione corneale e l'organizzazione delle fibre di collagene, mantenendo la trasparenza corneale. Nel presente lavoro, viene proposto un metodo per l'estrazione di proteine da AM per ottenere lumican. Inoltre, viene valutata la stabilità del lumican nell'estratto AM (AME) conservato a diverse temperature e periodi di tempo. 100 mg di AM sono stati scongelati e deepitelizzati meccanicamente. L'AM deepitelizzato è stato congelato e frantumato fino ad ottenere una polvere fine, che è stata solubilizzata con 2,5 ml di tampone salino con inibitori della proteasi e centrifugata per l'estrazione delle proteine. Il surnatante è stato raccolto e conservato a -20 °C, 4 °C e temperatura ambiente (RT) per 6, 12, 20 e 32 giorni. Successivamente, il lumican è stato quantificato in ogni AME. Questa tecnica consente un protocollo accessibile e acquisibile per l'estrazione lumican da AM. La concentrazione di lumican è stata influenzata dal tempo di conservazione e dalle condizioni di temperatura. Lumican nell'AME di 12 giorni conservato a -20 °C e 4 °C era significativamente più alto rispetto ad altri AME. Questa estrazione lumicana potrebbe essere utile per lo sviluppo di trattamenti e soluzioni farmaceutiche. Sono necessari ulteriori studi per determinare gli usi di AME lumican nella riepitelizzazione e nel processo di guarigione delle ferite.
Introduzione
Uno dei trattamenti più utilizzati per le affezioni corneali è il trapianto di membrana amniotica; Tuttavia, negli ultimi anni, sono emerse nuove proposte per l'utilizzo di vari componenti del tessuto amniotico come trattamenti alternativi e adiuvanti. Tra i componenti più studiati dell'AM ci sono quelli ottenuti dall'estratto di AM (AME)1,2,3,4,5,6,7. AM contiene molteplici fattori solubili come proteine antiangiogeniche, interleuchine (IL), inibitori tissutali delle metalloproteinasi (TIMP), proteine antinfiammatorie mediate da TSG-6 che inibiscono le trappole extracellulari dei neutrofili, fattori di crescita: fattore di crescita epidermico (EGF), fattore di crescita trasformante (TGF) (alfa e beta), fattore di crescita dei cheratinociti (KGF), fattore di crescita degli epatociti (HGF) e lumican, che mantiene la trasparenza corneale regolando la fibrillogenesi del collagene1, 2,3,4,5,6,7,8,9.
Lumican è un piccolo proteoglicano ricco di leucina (SLRP), uno dei principali componenti extracellulari della collagenasi interstiziale nella matrice dello stroma corneale, responsabile dell'organizzazione delle fibre di collagene e del mantenimento della trasparenza corneale 4,10,11. I proteoglicani sono molecole della matrice extracellulare (ECM), che sono le principali nello svolgimento della segnalazione cellulare e nel mantenimento dell'omeostasi intracellulare12. È stato riportato che le proteine ECM guidano i processi cellulari di proliferazione, differenziazione e migrazione durante la guarigione delle ferite11.
L'evidenza indica la possibile partecipazione di lumican nel processo di riepitelizzazione corneale. Saika et al., in uno studio, hanno dimostrato che dopo una lesione corneale, il lumican potrebbe essere rilevato nei cheratociti corneali tra le prime 8 ore e fino a 3 giorni dopo l'infortunio. Presentando la più alta concentrazione di lumican il secondo e il terzo giorno, questo proteoglicano è successivamente non rilevabile il settimo giorno13. Questi dati suggeriscono la partecipazione di lumican all'attivazione del processo di riepitelizzazione corneale. D'altra parte, in un altro studio, è stato riportato che l'assenza di lumican ritarda la riepitelizzazione; È interessante notare che l'aggiunta di Lumican potrebbe accelerare il processo di riepitelizzazione 4,11,13. Allo stesso modo, uno studio recente ha riportato che il lumican può modulare le funzioni infiammatorie dei fibroblasti del limbus corneale14, il che suggerisce un ruolo per il lumican come modulatore della risposta infiammatoria, antifibrotica e riepitelizzante. Allo stesso modo, il lumican può modulare la risposta corneale interagendo con molecole di segnalazione come Fas-FasL. Inoltre, l'assenza di lumican in un modello murino Lum-/- knockout ha dimostrato che la mancanza di segnalazione lumican impedisce un'adeguata riparazione corneale15.
In primo luogo, questo metodo mira a dimostrare un modo fattibile e accessibile per estrarre lumican da AM. Con questo vantaggioso metodo di estrazione lumican, è possibile ottenere concentrazioni simili di proteine, diminuendo il tempo di elaborazione e rendendolo più conveniente per gli sperimentatori rispetto agli studi precedenti16. Inoltre, questo AME lumican potrebbe essere utilizzato come coadiuvante per i processi di riparazione e riepitelizzazione corneale.
Protocollo
Tutte le procedure sperimentali sono state approvate dall'Institutional Review Board (Progetto n. CEI-2020/06/04). L'AM è stato ottenuto dall'Instituto de Oftalmologia Conde de Valenciana amnion bank (da soggetti umani non identificati), che è preparato come descritto da Chávez-García et al.17.
1. Preparazione dell'estratto della membrana amniotica
- Ottenere 100 mg di AM dalla banca amnion.
NOTA: Secondo un rapporto precedente, 50 mg di AM secernono un totale di 10 ng / mL di lumican14. Per ottenere una maggiore concentrazione di lumican, utilizzare 100 mg di AM, equivalenti ad una superficie totale di 32 cm2. - Se l'AM è congelato, scongelarlo a temperatura ambiente.
NOTA: eseguire le seguenti procedure in una cappa a flusso laminare di classe II B. - Lavare l'AM in una capsula di Petri con 10 ml di soluzione salina bilanciata sterile (BSS, vedere Tabella dei materiali) per 2 minuti.
- Versare il BSS in un becher.
- Ripetere il passaggio 3 e confermare visivamente che il mezzo glicerolo non è presente nella BSS della capsula di Petri.
Nota : ripetere il passaggio 3. se necessario fino a quando il mezzo glicerolo non è presente nella piastra di Petri BSS.
- Incubare l'AM con 10 mL di dispasi II (1,7 UI/mL, vedi Tabella dei materiali) a 37 °C, 5% CO2 per 30 min.
NOTA: Dispase II è una proteasi neutra con attività delicata sulle cellule epiteliali. Questo enzima separa efficacemente l'epidermide intatta dal derma e isola i fogli epiteliali intatti18. - Dopo l'incubazione dispase, eseguire una deepitelizzazione meccanica14 con un poliziotto di gomma (vedi Tabella dei materiali). Confermare la deepitelizzazione mediante visualizzazione al microscopio.
NOTA: Il processo di deepitelizzazione è corroborato in un microscopio invertito utilizzando obiettivi 4x e 20x. Visualizza il tessuto per escludere la presenza di qualsiasi strato cellulare. - Lavare l'AM in una capsula di Petri con 10 ml di BSS per 2 minuti. Versare il BSS in un becher.
- Posizionare l'AM (dAM) deepitelializzato in una provetta da microcentrifuga da 2 ml. Immergere il dAM in azoto liquido per 40 minuti.
- Macinare manualmente il dAM congelato per 2-3 minuti in una malta preraffreddata a -85 °C fino ad ottenere una polvere fine.
- Nella malta, solubilizzare la polvere dAM con 2,5 mL di soluzione inibitrice della proteasi (BSS con inibitori della proteasi).
NOTA: Ogni compressa di inibitore della proteasi è costituita dalla seguente miscela di enzimi: estratto di pancreas (0,02 mg/ml), termolisina (metalloproteasi) (0,0005 mg/ml), chimotripsina (0,002 mg/ml), tripsina (0,02 mg/ml) e papaina (0,33 mg/ml) (vedere Tabella dei materiali). - Raccogliere la miscela con una micropipetta e pulire le pareti della malta con l'aiuto di un coltello da bisturi. Mettere la miscela in un tubo da 5 ml.
- Mescolare bene con il vortice per 30 s.
- Omogeneizzare la miscela di tessuto centrifugando a 34 x g per 20 minuti a 4 °C e centrifugare immediatamente a 3360 x g per 20 minuti a 4 °C.
- Il surnatante raccolto è l'AME (Figura 1). Conservare 0,7 ml di ciascun AME in diverse provette da microcentrifuga da 2 ml per 6, 12, 20 e 33 giorni alle diverse condizioni di temperatura di -20 °C, 4 °C e temperatura ambiente (RT).
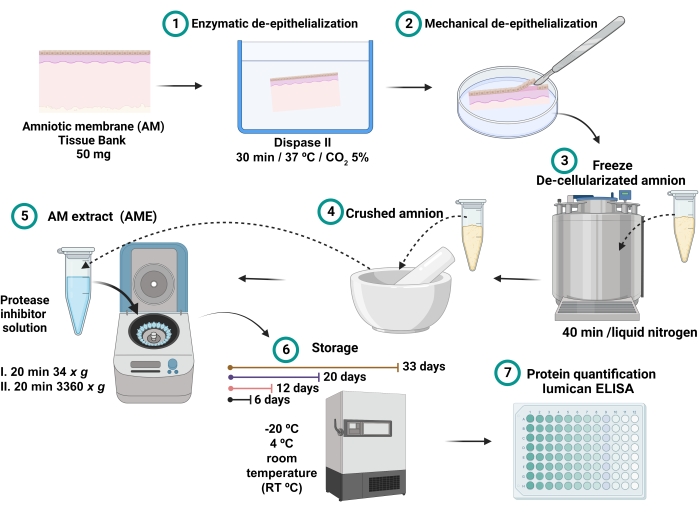
Figura 1: Processo di preparazione dell'AME e misurazione della concentrazione di lumicani . 100 mg di AM sono stati incubati con dispasi II a 37 °C per 30 minuti e deepitelizzati meccanicamente. L'AM deepitelializzato è stato lavato e immerso in azoto liquido per 40 minuti, quindi frantumato fino ad ottenere una polvere fine, che è stata solubilizzata con 2,5 ml di tampone salino con inibitori della proteasi e centrifugata. Il surnatante è stato raccolto e conservato a -20 °C, 4 °C e RT per 6, 12, 20 e 32 giorni fino alla quantificazione totale delle proteine e dei lumicani. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Quantificazione della proteina AME
NOTA: La quantificazione delle proteine totali nell'AME deve essere effettuata immediatamente dopo l'ottenzione. Quantificare le proteine utilizzando il saggio delle proteine di Lowry e seguire le istruzioni del produttore (vedere la tabella dei materiali). Si raccomanda che tutti gli standard e i campioni siano analizzati in triplice copia.
- Pipettare 40 μL di ciascun campione di AME in una micropiastra da 96 pozzetti.
- Preparare una curva standard nella stessa micropiastra utilizzando l'albumina sierica bovina (BSA) standard per una concentrazione finale di BSA di 0-1.500 μg/ml (0, 1, 5, 25, 125, 250, 500, 750, 1.000 e 1.500 μg/ml).
- Pipettare 200 μL del reagente di Lowry modificato in ciascun pozzetto. Mescolare immediatamente su un mixer a piastre per 30 s.
- Coprire la micropiastra con un foglio di alluminio e incubarla a RT per 10 minuti.
- Pipettare 20 μL di 1x reagente Folin-Ciocalteu in ciascun pozzetto. Mescolare immediatamente su un mixer a piastre per 30 s.
NOTA: Per preparare 1x reagente Folin-Ciocalteu, diluire 2x (2N) reagente 1:1 con acqua ultrapura. Preparare 1x reagente Folin-Ciocalteu lo stesso giorno di utilizzo poiché il reagente diluito è instabile. - Coprire la micropiastra dalla luce con un foglio di alluminio e incubarla a RT per 30 minuti.
- Misurare l'assorbanza dei campioni a 660 nm in uno spettrometro a piastre ELISA (vedere Tabella dei materiali).
NOTA: Il colore può essere misurato a lunghezze d'onda comprese tra 650 nm e 750 nm. - Calcolare la media del valore di assorbanza di 660 nm dei campioni bianchi standard e sottrarlo dagli altri valori di 660 nm dei campioni standard e sconosciuti.
- Misurare l'assorbanza con uno spettrometro a piastre ELISA in modalità endpoint con basso scuotimento per 10 s.
- Utilizzare la curva standard per determinare la concentrazione proteica di ciascun campione sconosciuto.
- Per il calcolo delle proteine, determinare la concentrazione da un grafico di regressione lineare utilizzando i valori di assorbanza sull'asse Y rispetto alle concentrazioni in mg/ml sull'asse X di ciascuna curva BSA standard.
- Ottenere l'equazione della regressione lineare e del valore r per calcolare la concentrazione proteica.
NOTA: I risultati sono espressi come valori di concentrazione relativa normalizzati della proteina totale rispetto a mg di AM (μg/mL proteina/mg di tessuto AM).
- Ottenere l'equazione della regressione lineare e del valore r per calcolare la concentrazione proteica.
3. Quantificazione del Lumican nell'AME
NOTA: La concentrazione di lumican deve essere misurata nell'AME immagazzinato in diverse condizioni di conservazione e periodi di tempo. Quantificare il lumican utilizzando sandwich ELISA e seguire le istruzioni del produttore. Si raccomanda di saggiare tutti gli standard e i campioni in duplice copia.
- Diluire l'anticorpo umano di cattura lumican (vedere Tabella dei materiali) alla concentrazione impiegata nella soluzione salina tamponata fosfato (PBS).
NOTA: Il flaconcino dell'anticorpo di cattura contiene 120 μg di anticorpo. Dopo ricostituzione con 0,5 mL di PBS, diluire l'anticorpo di cattura ad una soluzione di lavoro di 2 μg/mL.- Pipettare istantaneamente 100 μL per pozzetto dell'anticorpo di cattura diluito su una micropiastra a 96 pozzetti. Racchiudere la piastra e incubarla durante la notte a RT.
- Aspirare ogni pozzetto e lavarlo mediante pipettaggio con 300 μL di tampone di lavaggio: 0,05% poliossietilene sorbitano monolaurato 20 in PBS, pH 7,2-7,4 (vedere Tabella dei materiali) utilizzando un pipettatore multicanale. Ripeti tre volte.
NOTA: Dopo l'ultimo lavaggio, rimuovere qualsiasi tampone di lavaggio rimanente estromettendo la piastra e picchiettandola delicatamente contro gli asciugamani di carta. - Bloccare le piastre aggiungendo 300 μL di diluente reagente: 1% BSA in PBS, pH 7,2-7,4, 0,2 μm filtrato (vedi Tabella dei materiali) a ciascun pozzetto. Incubare a RT per 1 ora.
- Ripetere il passaggio 2.
- Preparare una curva standard in una micropiastra da 96 pozzetti utilizzando diluizioni seriali doppie da 0-8.000 pg/mL per concentrazioni finali di 125, 250, 500, 1.000, 2.000, 4.000 e 8.000 pg/mL. Il kit ELISA lumican contiene uno standard lumican ricombinante di 75 ng (vedi Tabella dei materiali).
- Aggiungere 100 μL di campioni e la curva standard nella micropiastra a 96 pozzetti rivestita di anticorpi di cattura.
- Coprire la micropiastra e incubare per 2 ore a RT con bassa agitazione in un bilanciere compatto mantenendo la velocità tra 2-3 giri / min.
- Ripetere il passaggio 2.
- Aggiungere 100 μL dell'anticorpo di rilevazione biotinilata (vedere Tabella dei materiali) a ciascun pozzetto. Coprire dalla luce e incubare 2 h a RT con bassa agitazione in un bilanciere compatto mantenendo la velocità tra 2-3 rpm.
NOTA: Il flaconcino di anticorpi per il rilevamento di biotinilati contiene 24 μg di anticorpo. Dopo ricostituzione con 1,0 mL di diluente reattivo, diluire l'anticorpo di rilevazione biotinilata ad una soluzione di lavoro di 400 ng/mL. - Ripetere il passaggio 2.
- Aggiungere 100 μL della diluizione di lavoro della streptavidina-perossidasi di rafano (HRP; vedere Tabella dei materiali) a ciascun pozzetto. Coprire la micropiastra dalla luce e incubare per 20 minuti a RT.
NOTA: La streptavidina-HRP reattiva era concentrata di 40 volte. La soluzione di lavoro 1x di streptavidina-HRP è stata realizzata con diluente reagente.
NOTA: Evitare di posizionare la lastra alla luce diretta. - Ripetere il passaggio 2.
- Infine, aggiungere 100 μL di soluzione di substrato tetrametilbenzidina (TMB, vedi Tabella dei materiali) a ciascun pozzetto.
NOTA: Preparare la soluzione TMB con un volume uguale di soluzione stabilizzata di perossido di idrogeno al 30% fornita nel kit.
NOTA: Preparare la soluzione immediatamente prima dell'uso e mantenerla a temperatura ambiente. - Incubare per 30 minuti a RT in un luogo buio.
NOTA: Evitare di posizionare la lastra alla luce diretta. Non aspirare la soluzione TMB poiché non è necessario alcun ulteriore lavaggio. - Aggiungere 50 μL di soluzione 1N H2SO4 stop per arrestare la reazione colorimetrica. Picchiettare delicatamente la piastra per garantire una miscelazione accurata.
- Determinare immediatamente l'assorbanza di ciascun pozzetto utilizzando un lettore di micropiastre impostato a 450 nm in uno spettrometro a piastre ELISA.
- Misurare l'assorbanza con uno spettrometro a piastre ELISA in modalità endpoint con basso scuotimento per 10 s.
- Calcolare la media del valore di assorbanza di 450 nm dei campioni bianchi standard e sottrarlo dagli altri valori di 450 nm dei campioni standard e sconosciuti.
- Utilizzare la curva standard per determinare la concentrazione lumicana di ciascun campione sconosciuto.
- Per il calcolo della concentrazione di lumicani, fare un grafico di regressione lineare usando i valori di assorbanza sull'asse Y rispetto alle concentrazioni in pg/mL sull'asse X di ciascuna curva lumican standard.
- Ottenere l'equazione di regressione lineare e il valore r per calcolare la concentrazione lumican.
NOTA: La concentrazione di lumican è stata normalizzata rispetto al mg di tessuto estratto. I risultati sono espressi come valori di concentrazione relativa normalizzati di lumican a mg AM (ng/mL lumican/mg AM tessuto).
- Ottenere l'equazione di regressione lineare e il valore r per calcolare la concentrazione lumican.
Risultati
I risultati sono riportati come valore medio ± deviazione standard (SD). Sono stati eseguiti i test t dello studente e l'analisi della varianza (ANOVA). Valori P < 0,05 sono stati considerati statisticamente significativi. L'analisi statistica è stata eseguita utilizzando software di statistica (vedi Tabella dei materiali).
La quantità totale di proteine nell'AME è stata influenzata dal tempo e dalle condizioni di conservazione. La concentrazione proteica basale era simile tra tutte le AME; l'intervallo di proteine totali era 2,7 ± 0,3 μg / ml senza una differenza significativa tra i campioni valutati. Tuttavia, quando i campioni sono stati conservati per 12, 20 e 32 giorni, è stata osservata variabilità nella concentrazione proteica rispetto alla concentrazione basale. È interessante notare che la concentrazione proteica è aumentata nell'AME a 4 ° C e -20 ° C rispetto all'RT in ogni momento di conservazione.
Allo stesso modo, quando la concentrazione proteica è stata confrontata tra i tempi di conservazione, è cambiata dopo 12, 20 e 32 giorni. Una differenza significativa (p < 0,05) è stata riscontrata nell'AME di 32 e 20 giorni a 4 °C e -20 °C rispetto alla condizione RT (Figura 2), suggerendo che la temperatura è importante per la conservazione delle proteine nei diversi AME ottenuti.

Figura 2: Concentrazione proteica totale nell'AME influenzata dal tempo e dalla temperatura di conservazione. La concentrazione di estrazione proteica sull'AME è stata quantificata prima e dopo le condizioni di conservazione della temperatura e del tempo. Il tempo di conservazione valutato è stato di 6 giorni (triangoli neri), 12 giorni (triangoli rosa), 20 giorni (quadrato viola) e 32 giorni (cerchi marroni) rispetto a tre diverse condizioni di temperatura (RT °C, 4 °C e -20 °C). La concentrazione di proteine basali era simile tra tutte le AME. C'è stata una differenza significativa nella concentrazione proteica nell'AME di 20 e 32 giorni rispetto alla concentrazione proteica basale a diverse condizioni di temperatura. In ogni condizione n = 3. I dati sono espressi come mediana di μg/mL di proteine ± SE *p < 0,05 (S1 32 giorni vs. S1 20, 12 e 6 giorni a 4 °C); (S1 32 giorni vs. S1 20, 12 e 6 giorni a -20 °C). Fare clic qui per visualizzare una versione ingrandita di questa figura.
La concentrazione di lumican è stata influenzata dal tempo di conservazione e dalle condizioni di temperatura. Una minore concentrazione di lumican è stata trovata nell'AME conservato per 6, 20 e 32 giorni, rispetto ai 12 giorni di conservazione. Significativamente, l'AME di 12 giorni aveva una concentrazione di lumican superiore a 20 e 32 giorni di conservazione (p < 0,05).
Quando la concentrazione di lumican nell'AME è stata confrontata tra le temperature di conservazione, è stata trovata una concentrazione più elevata di lumican se conservato a -20 °C e 4 °C per 12 giorni (Figura 3). È interessante notare che anche una concentrazione più elevata (p < 0,05) di lumican è stata trovata nei 12 giorni di AME se conservato a -20 ° C rispetto a 4 ° C.
Ciò suggerisce che la concentrazione di lumican è influenzata dalle condizioni di temperatura e dal tempo di conservazione, suggerendo che il tempo e la temperatura di conservazione appropriati per ottenere la massima concentrazione di lumican sono 12 giorni a -20 °C.
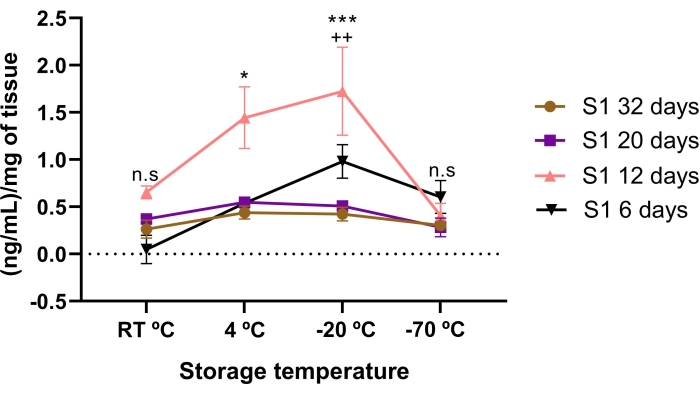
Figura 3: Concentrazione totale di lumican in AME influenzata dal tempo e dalla temperatura di conservazione. La concentrazione di lumican è stata influenzata dal tempo di conservazione e dalle condizioni di temperatura. La concentrazione di lumican nell'AME è stata quantificata prima e dopo le condizioni di temperatura e tempo di conservazione. Il tempo di conservazione valutato è stato di 6 giorni (triangoli neri), 12 giorni (triangoli rosa), 20 giorni (quadrato viola) e 32 giorni (cerchi marroni) rispetto a tre diverse condizioni di temperatura (RT °C, 4 °C e -20 °C). Lumican nell'AME di 12 giorni era significativamente più alto rispetto all'AME di 32, 20 e 6 giorni, a condizioni di temperatura di -20 °C e 4 °C. *p < 0,05 (S1 12 giorni vs. S1 32, 20 e 6 giorni a 4 °C); p < 0,001 (S1 12 giorni vs. S1 32, 20 e 6 giorni a -20°C). La più alta concentrazione di lumican in AME è stata di 12 giorni conservati a -20 °C. ++p < 0,01 (S1 12 giorni 4 °C vs. S1 12 giorni -20 °C). Non vi è stata alcuna differenza significativa tra lumican nell'AME di 32 e 20 giorni rispetto alle condizioni di temperatura di conservazione (n.s). In ogni condizione (n = 3), i dati sono espressi come mediana di ng/mL di proteine. I dati sono stati normalizzati rispetto al mg di tessuto ± SE. (n.s.) non alla significatività statistica. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
In questo studio, la presenza di lumican è stata analizzata nell'AME e la sua correlazione diretta con la sua stabilità in diverse condizioni di conservazione. È interessante notare che, quando è stata quantificata la concentrazione totale di proteine in AME, la concentrazione proteica è aumentata dopo la conservazione. L'evidenza suggerisce tre meccanismi che potrebbero modificare la concentrazione proteica nella conservazione congelata: la denaturazione a freddo, la concentrazione congelata di soluti e lo sviluppo parziale indotto dal ghiaccio della struttura proteica19. Il processo di congelamento potrebbe influire sulla concentrazione di proteine sui campioni di conservazione a causa della cristallizzazione della fase liquida nel campione. I risultati suggeriscono che ciò potrebbe essersi verificato come un processo di congelamento della concentrazione, influenzato dal tempo di conservazione nel congelatore. Una maggiore concentrazione di proteine è stata osservata in tempi di conservazione più lunghi (32 e 20 giorni) e alle temperature più fredde (4 °C e -20 °C). Tuttavia, il periodo con la più alta concentrazione di proteine non aveva la più alta concentrazione di lumican; Ciò suggerisce che Lumican potrebbe essere influenzato dalle temperature e dalle condizioni temporali congelate.
Secondo i risultati, la concentrazione di lumican era più alta e più stabile a 12 giorni di conservazione a 4 ° C e -20 ° C. Tuttavia, una concentrazione minore di lumican è stata trovata a 6 giorni rispetto a 12 giorni. Alcuni rapporti suggeriscono che la concentrazione di proteine potrebbe cambiare dopo le condizioni di conservazione congelate20. I risultati potrebbero essere causati da un meccanismo termodinamico chiamato dispiegamento parziale indotto dal ghiaccio della struttura proteica, che avviene durante il congelamento dei campioni. L'interazione delle proteine con l'acqua nelle soluzioni acquose riduce le loro interazioni con altre molecole. Il processo di cristallizzazione dell'acqua in condizioni di congelamento consente alle proteine e ad alcune regioni funzionali di interagire con altre molecole19. Secondo quanto sopra, dopo 12 giorni di congelamento del lumican in una soluzione acquosa, potrebbe essere in grado di interagire con gli anticorpi presenti nel kit di quantificazione ELISA per ottenere una concentrazione più elevata. D'altra parte, probabilmente il sesto giorno, il lumican potrebbe essere stato isolato nella soluzione acquosa.
Nel promuovere le innovazioni, l'uso dell'AM è il trattamento all'avanguardia per la riepitelizzazione corneale indipendentemente dall'eziologia. Come accennato in precedenza, i benefici di AM sono vasti 21,22,23,24,25,26. Molti autori hanno dimostrato i benefici del lumican in AME, rendendolo un'alternativa economica specifica per i paesi in via di sviluppo 1,2,3,4,5,6,7,8,9. Attualmente, ci sono molti vantaggi di lumican in AME; Il suo utilizzo come trattamento favorisce la riepitelizzazione corneale e migliora la prognosi delle ulcere corneali 4,5,6,7,8,9,10,11,12,13,14,15. Il trapianto AM (AMT) è diventato un trattamento con grandi benefici per migliorare vari disturbi corneali24,25. Tuttavia, ci sono alcune affezioni croniche del tessuto corneale, come i difetti epiteliali persistenti (PED) e le carenze di cellule staminali limbari (LESCD), che richiedono un trattamento costante e il mantenimento della presenza di fattori biologici che aiutano la riparazione corneale21,24. Attualmente non esistono trattamenti adiuvanti che permettano il mantenimento a lungo termine dei fattori rilasciati dall'AMT sulla superficie corneale. Tuttavia, una sostituzione costante dell'AMT non può essere raccomandata per la sicurezza del paziente26. Per questo motivo, è necessario sviluppare alternative che consentano alle funzioni dell'AMT di assistere e aiutare a mantenere la presenza di fattori rilasciati dall'AM nel tessuto corneale come il lumican per un tempo più lungo, intendendo favorire il trattamento dei problemi persistenti della cornea27.
Lumican è uno dei fattori presenti nell'AM con funzioni antinfiammatorie e antifibrotiche, che è stato segnalato per avere funzioni nel processo di riparazione corneale 6,7,8,9,10,11,12,13,14,15 . Ecco perché lumican suggerisce di essere un buon candidato per aiutare nel trattamento delle affezioni corneali; tuttavia, sono necessarie ulteriori ricerche per determinare l'efficacia di lumican nell'AME per ottenere la riepitelizzazione corneale.
Lumican è un proteoglicano che ha dimostrato di regolare la secrezione di composti della matrice extracellulare come il collagene; Inoltre, è coinvolto nell'attivazione dei fibroblasti e nella modulazione delle cellule infiammatorie e nel processo di angiogenesi, avendo un ruolo importante nella guarigione delle ferite. Secondo i risultati, il lumican può essere estratto dal tessuto AM. Le applicazioni terapeutiche del lumican sono numerose; l'uso di lumican nell'AME consente un'opzione terapeutica raggiungibile per i disturbi oculari 4,13. Il vantaggio principale dell'utilizzo di AME è che fornisce una facile applicazione come trattamento topico per la superficie oculare, data la sua composizione acquosa. Allo stesso modo, altre proteine con caratteristiche antinfiammatorie e immunoregolatorie possono essere trovate all'interno dei componenti estratti dal tessuto AM, che potrebbero presentare un maggiore beneficio nel trattamento dei problemi deepitelizzanti nell'occhio. Ad esempio, altri fattori antinfiammatori come TSG-6 presenti nell'AM e componenti cellulari sono stati precedentemente segnalati per avere proprietà immunoregolatorie8. In questo modo, una terapia combinata di lumican e altri composti della matrice extracellulare e molecole immunomodulanti presenti nell'AME potrebbe essere utile nel processo di riepitelizzazione e guarigione delle ferite.
Questo metodo mira a dimostrare una tecnica semplice per l'estrazione di proteine, utile per l'ottenimento di proteine e fattori abbondanti. Una delle considerazioni critiche per questo metodo è l'uso di inibitori della proteasi, in quanto è fondamentale per il successo dell'estrazione proteica in quanto l'AM è un tessuto con carichi di composti enzimatici per prevenire la degradazione delle proteine27. L'evidenza ha riportato che l'uso di inibitori proteici insieme a una soluzione acquosa aumenta l'estrazione di altri fattori, come HGF, nel tessuto AM26. L'ottenimento di una polvere fine dopo il congelamento e la messa a terra dell'AM è necessario per l'ottenimento ottimale dell'AME, poiché questo processo è adatto per la distruzione tissutale e cellulare delle strutture necessarie per l'estrazione di composti citosolici e di altri composti nucleari28,29.
Alcune limitazioni di questo metodo di estrazione sono che la quantità AM utilizzata non potrebbe consentire un'estrazione su larga scala. Questo protocollo consente l'estrazione di proteine da una quantità limitata di tessuto; poiché non ci sono prove che questo metodo consenta di ottenere una maggiore quantità di proteine da un'area tissutale più ampia. La risoluzione da considerare rispetto ad altri metodi di estrazione consiste nell'utilizzare un'adeguata concentrazione di inibitore della proteasi e il tempo di incubazione, poiché gli enzimi in eccesso potrebbero influenzare le proteine30 e ridurre l'efficacia della tecnica.
Parte di questa tecnica è stata modificata da quella riportata da Mahbod et al.16, che descrive che ripetere il processo di centrifugazione ed estrazione aumenta l'estrazione delle proteine. Contrariamente a Mahbod, i risultati non hanno riportato la concentrazione proteica dopo tre cicli di centrifugazione. Quando è stata determinata la concentrazione proteica totale, è diminuita dell'80% in una seconda estrazione e fino al 97% in una terza estrazione. L'esecuzione di una sola estrazione riduce il tempo di lavorazione e non diminuisce la quantità di proteine totali. Con quanto precede, il metodo di estrazione qui riportato richiede solo una fase di centrifugazione con risultati favorevoli.
Questa tecnica potrebbe essere utilizzata per estrarre altri fattori e proteine presenti nell'AM e, inoltre, per ottenere fattori da altre fonti come animali o verdure. Potrebbe anche avere un'applicazione per ottenere proteine per svolgere ricerche di base o addirittura lo sviluppo di formulazioni e trattamenti.
Questi risultati suggeriscono che il lumican può essere estratto dall'AM e conservato per 12 giorni come AME sia in condizioni di temperatura di -20 °C che di 4 °C. È importante considerare la sua emivita per ottenere gli effetti terapeutici di lumican come AME. Sono necessari ulteriori studi per determinare il ruolo di AME lumican nelle cellule epiteliali corneali e per determinare la dose ideale di lumican per la riepitelizzazione corneale.
In conclusione, i risultati suggeriscono che è possibile ottenere fattori come il lumican nell'AME. Allo stesso modo, le condizioni di temperatura e tempo di conservazione influenzano la concentrazione di lumican presente nell'AME.
Divulgazioni
Lo studio è stato finanziato dal Programma di sostegno per progetti di ricerca e innovazione tecnologica dell'Universidad Nacional Autonoma de Mexico (Grant No. PAPIIT IN203821) e dal Ministero dell'Istruzione, della Scienza, della Tecnologia e dell'Innovazione (Grant No. SECTEI 250/2019).
Riconoscimenti
Gli autori non hanno interessi finanziari concorrenti.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
Riferimenti
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon