Method Article
Lumican-Extraktion aus Amnionmembran und Bestimmung ihrer Lagertemperatur
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Extraktion von Lumican aus der Amnionmembran (AM) und deren Lagerbedingungen als AM-Extrakt (AME) bei -20 °C, 4 °C und Raumtemperatur (RT) für 6, 12, 20 und 32 Tage, um seine Proteine und Lumican-Konzentration zu quantifizieren.
Zusammenfassung
Lumican ist ein kleines leucinreiches Proteoglykan in der menschlichen Amnionmembran (AM), das die Hornhautepithelisierung und die Organisation von Kollagenfasern fördert und die Transparenz der Hornhaut aufrechterhält. In der vorliegenden Arbeit wird eine Methode zur Proteinextraktion aus AM vorgeschlagen, um Lumican zu erhalten. Zusätzlich wird die Stabilität von Lumican im AM-Extrakt (AME) bewertet, der bei verschiedenen Temperaturen und Zeiträumen gelagert wird. 100 mg AM wurden aufgetaut und mechanisch deepithelialisiert. Das deepithelialisierte AM wurde eingefroren und zerkleinert, bis ein feines Pulver erhalten wurde, das mit 2,5 ml Kochsalzpuffer mit Proteaseinhibitoren gelöst und zur Proteinextraktion zentrifugiert wurde. Der Überstand wurde gesammelt und bei -20 °C, 4 °C und Raumtemperatur (RT) für 6, 12, 20 und 32 Tage gelagert. Danach wurde Lumican in jedem AME quantifiziert. Diese Technik ermöglicht ein zugängliches und erwerbbares Protokoll für die Lumican-Extraktion aus AM. Die Lumican-Konzentration wurde durch die Lagerzeit und die Temperaturbedingungen beeinflusst. Lumican in der AME von 12 Tagen Lagerung bei -20 °C und 4 °C war signifikant höher als andere AME. Diese Lumican-Extraktion könnte für die Entwicklung von Behandlungen und pharmazeutischen Lösungen nützlich sein. Weitere Studien sind erforderlich, um die Verwendung von AME Lumican bei der Reepithelialisierung und Wundheilung zu bestimmen.
Einleitung
Eine der am häufigsten verwendeten Behandlungen für Hornhauterkrankungen ist die Amnionmembrantransplantation; In den letzten Jahren sind jedoch neue Vorschläge für die Verwendung verschiedener Bestandteile des Fruchtwassergewebes als alternative und adjuvante Behandlungen aufgetaucht. Zu den am meisten untersuchten Komponenten von AM gehören diejenigen, die aus dem AM-Extrakt (AME) 1,2,3,4,5,6,7 gewonnen werden. AM enthält mehrere lösliche Faktoren wie antiangiogene Proteine, Interleukine (IL), Gewebeinhibitoren von Metalloproteinasen (TIMPs), entzündungshemmende Proteine, die durch TSG-6 vermittelt werden und neutrophile extrazelluläre Fallen hemmen, Wachstumsfaktoren: epidermaler Wachstumsfaktor (EGF), transformierender Wachstumsfaktor (TGF) (alpha und beta), Keratinozytenwachstumsfaktor (KGF), Hepatozytenwachstumsfaktor (HGF) und Lumican, das die Transparenz der Hornhaut durch Regulierung der Kollagenfibrillogenese aufrechterhält1, 2,3,4,5,6,7,8,9.
Lumican ist ein kleines leucinreiches Proteoglykan (SLRP), eine der wichtigsten extrazellulären Komponenten der interstitiellen Kollagenase in der Hornhautstromamatrix, verantwortlich für die Organisation von Kollagenfasern und die Aufrechterhaltung der Hornhauttransparenz 4,10,11. Proteoglykane sind Moleküle in der extrazellulären Matrix (ECM), die die wichtigsten bei der Durchführung von Zellsignalen und der Aufrechterhaltung der intrazellulären Homöostasesind 12. Es wurde berichtet, dass ECM-Proteine die zellulären Prozesse der Proliferation, Differenzierung und Migration während der Wundheilung antreiben11.
Hinweise auf die mögliche Beteiligung von Lumican am Prozess der Hornhautreepithelisierung. Saika et al. zeigten in einer Studie, dass nach einer Hornhautverletzung Lumican in Hornhautkeratozyten zwischen den ersten 8 h und bis zu 3 Tagen nach der Verletzung nachgewiesen werden konnte. Dieses Proteoglykan weist am zweiten und dritten Tag die höchste Konzentration von Lumican auf und ist anschließend am siebten Tag13 nicht nachweisbar. Diese Daten deuten auf die Beteiligung von Lumican an der Aktivierung des Hornhaut-Reepithelisierungsprozesses hin. Auf der anderen Seite wurde in einer anderen Studie berichtet, dass das Fehlen von Lumican die Reepithelialisierung verzögert; Interessanterweise könnte die Zugabe von Lumican den Reepithelisierungsprozessbeschleunigen 4,11,13. Ebenso hat eine kürzlich durchgeführte Studie berichtet, dass Lumican die entzündlichen Funktionen von Hornhautlimbus-Fibroblastenmodulieren kann 14, was auf eine Rolle von Lumican als Modulator der entzündlichen, antifibrotischen und reepithelialisierenden Reaktion hindeutet. In ähnlicher Weise kann Lumican die Hornhautreaktion modulieren, indem es mit Signalmolekülen wie Fas-FasL interagiert. Auch das Fehlen von Lumican in einem Knockout-Lum-/- Mausmodell zeigte, dass das Fehlen von Lumican-Signalen eine adäquate Hornhautreparatur verhindert15.
In erster Linie zielt diese Methode darauf ab, einen praktikablen und zugänglichen Weg zur Extraktion von Lumican aus AM zu demonstrieren. Mit dieser vorteilhaften Methode der Lumican-Extraktion ist es möglich, ähnliche Konzentrationen von Proteinen zu erhalten, wodurch die Verarbeitungszeit verkürzt und für die Forscher im Vergleich zu den vorherigen Studien bequemer wird16. Darüber hinaus könnte dieses AME-Lumican als Adjuvans für Hornhautreparatur- und Reepithelisierungsprozesse verwendet werden.
Protokoll
Alle experimentellen Verfahren wurden vom Institutional Review Board genehmigt (Projekt Nr. CEI-2020/06/04). Die AM wurde von der Amnionbank Instituto de Oftalmologia Conde de Valenciana (von identifizierten menschlichen Probanden) erhalten, die wie von Chávez-García et al.17 beschrieben hergestellt wird.
1. Herstellung des Amnionmembranextrakts
- Erhalten Sie 100 mg AM von der Amnionbank.
HINWEIS: Laut einem früheren Bericht sezernieren 50 mg AM insgesamt 10 ng / ml Lumican14. Um eine höhere Konzentration von Lumic zu erhalten, verwenden Sie 100 mg AM, was einer Gesamtfläche von 32 cmentspricht 2. - Wenn der AM gefroren ist, tauen Sie ihn bei Raumtemperatur auf.
HINWEIS: Führen Sie die folgenden Verfahren unter einer Laminar-Flow-Haube der Klasse II B durch. - Waschen Sie den AM in einer Petrischale mit 10 ml steriler ausgewogener Salzlösung (BSS, siehe Materialtabelle) für 2 min.
- Gießen Sie das BSS in ein Becherglas.
- Wiederholen Sie Schritt 3 und bestätigen Sie visuell, dass kein Glycerinmedium in der Petrischale BSS vorhanden ist.
HINWEIS: Wiederholen Sie Schritt 3. nach Bedarf, bis Glycerinmedium in Petrischale BSS nicht vorhanden ist.
- Inkubieren Sie den AM mit 10 mL Dispase II (1,7 IE/ml, siehe Materialtabelle) bei 37 °C, 5%CO2 für 30 min.
HINWEIS: Dispase II ist eine neutrale Protease mit sanfter Aktivität über Epithelzellen. Dieses Enzym trennt effektiv die intakte Epidermis von der Dermis und isoliert intakte Epithelblätter18. - Nach der Dispase-Inkubation wird eine mechanische Deepithelialisierung14 mit einem Gummipolizisten durchgeführt (siehe Materialtabelle). Bestätigen Sie die Deepithelialisierung durch Mikroskopie-Visualisierung.
HINWEIS: Der Prozess der Deepithelisierung wird in einem inversen Mikroskop mit 4x- und 20x-Objektiven bestätigt. Visualisieren Sie das Gewebe, um das Vorhandensein einer Zellschicht auszuschließen. - Waschen Sie den AM in einer Petrischale mit 10 ml BSS für 2 min. Gießen Sie das BSS in ein Becherglas.
- Legen Sie den deepithelialisierten AM (dAM) in ein 2-ml-Mikrozentrifugenröhrchen. Tauchen Sie den dAM für 40 min in flüssigen Stickstoff.
- Den gefrorenen dAM für 2-3 min in einem vorgekühlten Mörser bei -85 °C manuell mahlen, bis ein feines Pulver entsteht.
- Im Mörtel das dAM-Pulver mit 2,5 ml Proteaseinhibitorlösung (BSS mit Proteaseinhibitoren) auflösen.
HINWEIS: Jede Tablette Proteasehemmer besteht aus der folgenden Mischung von Enzymen: Pankreasextrakt (0,02 mg / ml), Thermolysin (Metalloprotease) (0,0005 mg / ml), Chymotrypsin (0,002 mg / ml), Trypsin (0,02 mg / ml) und Papain (0,33 mg / ml) (siehe Materialtabelle). - Sammeln Sie die Mischung mit einer Mikropipette und reinigen Sie die Mörtelwände mit Hilfe eines Skalpellmessers. Geben Sie die Mischung in ein 5-ml-Röhrchen.
- 30 s lang gut mit dem Wirbel mischen.
- Die Gewebemischung wird durch Zentrifugieren bei 34 x g für 20 min bei 4 °C homogenisiert und sofort bei 3360 x g für 20 min bei 4 °C zentrifugiert.
- Der gesammelte Überstand ist der AME (Abbildung 1). Lagern Sie 0,7 ml jedes AME in verschiedenen 2-ml-Mikrozentrifugenröhrchen für 6, 12, 20 und 33 Tage bei den unterschiedlichen Temperaturbedingungen von -20 °C, 4 °C und Raumtemperatur (RT).
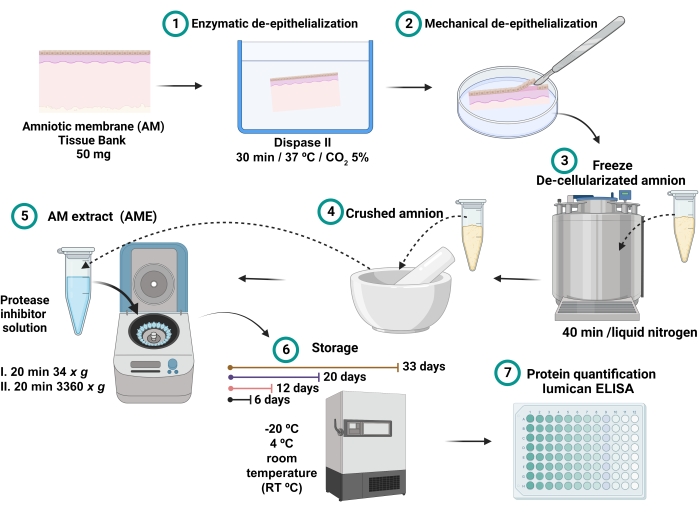
Abbildung 1: Prozess der AME-Präparation und Lumican-Konzentrationsmessung . 100 mg AM wurden mit Dispase II bei 37 °C für 30 min inkubiert und mechanisch deepithelialisiert. Der deepithelialisierte AM wurde gewaschen und 40 min lang in flüssigen Stickstoff getaucht und dann zerkleinert, bis ein feines Pulver erhalten wurde, das mit 2,5 ml Kochsalzpuffer mit Proteaseinhibitoren gelöst und zentrifugiert wurde. Der Überstand wurde gesammelt und bei -20 °C, 4 °C und RT für 6, 12, 20 und 32 Tage bis zur vollständigen Protein- und Lumican-Quantifizierung gelagert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. AME-Protein-Quantifizierung
HINWEIS: Die Quantifizierung des Gesamtproteins in der AME muss unmittelbar nach der Einnahme durchgeführt werden. Quantifizieren Sie Proteine mit dem Lowry-Proteintest und befolgen Sie die Anweisungen des Herstellers (siehe Materialtabelle). Es wird empfohlen, alle Standards und Proben in dreifacher Ausfertigung zu untersuchen.
- Pipettieren Sie 40 μL jeder AME-Probe in eine 96-Well-Mikroplatte.
- Präparation einer Standardkurve in dieselbe Mikroplatte unter Verwendung des BSA-Standards für Rinderserumalbumin (BSA) für eine endgültige BSA-Konzentration von 0-1.500 μg/ml (0, 1, 5, 25, 125, 250, 500, 750, 1.000 und 1.500 μg/ml).
- Pipettieren Sie 200 μL des modifizierten Lowry-Reagenzes in jede Vertiefung. Mischen Sie es sofort auf einem Plattenmischer für 30 s.
- Decken Sie die Mikroplatte mit Aluminiumfolie ab und inkubieren Sie sie bei RT für 10 min.
- 20 μL 1x Folin-Ciocalteu-Reagenz in jede Vertiefung pipettieren. Mischen Sie es sofort auf einem Plattenmischer für 30 s.
HINWEIS: Um 1x Folin-Ciocalteu-Reagenz herzustellen, verdünnen Sie 2x (2N) Reagenz 1:1 mit Reinstwasser. Bereiten Sie 1x Folin-Ciocalteu-Reagenz am selben Tag der Anwendung vor, da das verdünnte Reagenz instabil ist. - Decken Sie die Mikroplatte mit Aluminiumfolie ab und inkubieren Sie sie bei RT für 30 min.
- Messung der Absorption von Proben bei 660 nm in einem ELISA-Plattenspektrometer (siehe Materialtabelle).
HINWEIS: Farbe kann bei Wellenlängen zwischen 650 nm und 750 nm gemessen werden. - Mittelwert des Absorptionswerts von 660 nm der Standard-Blindproben und Subtraktion von anderen 660-nm-Werten von Standard- und unbekannten Proben.
- Messen Sie die Absorption mit einem ELISA-Plattenspektrometer in einem Endpunktmodus mit geringer Erschütterung für 10 s.
- Verwenden Sie die Standardkurve, um die Proteinkonzentration jeder unbekannten Probe zu bestimmen.
- Für die Berechnung des Proteins bestimmen Sie die Konzentration aus einem linearen Regressionsgraphen unter Verwendung der Absorptionswerte auf der Y-Achse gegen die Konzentrationen in mg/ml auf der X-Achse jeder Standard-BSA-Kurve.
- Erhalten Sie die Gleichung der linearen Regression und den r-Wert, um die Proteinkonzentration zu berechnen.
HINWEIS: Die Ergebnisse werden als normalisierte relative Konzentrationswerte des Gesamtproteins relativ zu mg AM (μg / ml Protein / mg AM-Gewebe) ausgedrückt.
- Erhalten Sie die Gleichung der linearen Regression und den r-Wert, um die Proteinkonzentration zu berechnen.
3. Quantifizierung von Lumican bei AME
HINWEIS: Die Konzentration von Lumican muss in der AME gemessen werden, die unter verschiedenen Lagerbedingungen und Zeiträumen gelagert wird. Quantifizieren Sie Lumican mit Sandwich-ELISA und befolgen Sie die Anweisungen des Herstellers. Es wird empfohlen, alle Standards und Proben in zweifacher Ausfertigung zu untersuchen.
- Verdünnen Sie den humanen Lumican-Antikörper (siehe Materialtabelle) auf die verwendete Konzentration in phosphatgepufferter Kochsalzlösung (PBS).
HINWEIS: Die Durchstechflasche mit Capture-Antikörpern enthält 120 μg Antikörper. Nach Rekonstitution mit 0,5 ml PBS wird der Einfangantikörper in einer Arbeitslösung von 2 μg/ml verdünnt.- Pipettieren Sie sofort 100 μl pro Welle des verdünnten Capture-Antikörpers auf eine 96-Well-Mikroplatte. Schließen Sie die Platte ein und inkubieren Sie sie über Nacht bei RT.
- Jede Vertiefung absaugen und durch Pipettieren mit 300 μL Waschpuffer: 0,05% Polyoxyethylensorbitanmonolaurat 20 in PBS, pH 7,2-7,4 (siehe Materialtabelle) mit einem Mehrkanalpipettor absaugen. Wiederholen Sie dies dreimal.
HINWEIS: Entfernen Sie nach dem letzten Waschen den verbleibenden Waschpuffer, indem Sie die Platte abschneiden und vorsichtig gegen Papiertücher klopfen. - Blockplatten durch Zugabe von 300 μL Reagenzverdünnungsmittel: 1% BSA in PBS, pH 7,2-7,4, 0,2 μm gefiltert (siehe Materialtabelle) zu jeder Vertiefung. Inkubieren bei RT für 1 h.
- Wiederholen Sie Schritt 2.
- Präparation einer Standardkurve in eine 96-Well-Mikroplatte unter Verwendung von zweifachen seriellen Verdünnungen von 0-8.000 pg/ml für Endkonzentrationen von 125, 250, 500, 1.000, 2.000, 4.000 und 8.000 pg/ml. Das ELISA-Lumican-Kit enthält einen rekombinanten Lumican-Standard von 75 ng (siehe Materialtabelle).
- Fügen Sie 100 μL Proben und die Standardkurve in die mit Capture-Antikörpern beschichtete 96-Well-Mikroplatte hinzu.
- Die Mikroplatte abdecken und 2 h bei RT mit geringer Bewegung in einer kompakten Wippe inkubieren, wobei die Geschwindigkeit zwischen 2-3 U/min beibehalten wird.
- Wiederholen Sie Schritt 2.
- Geben Sie 100 μL des biotinylierten Antikörpers (siehe Materialtabelle) in jede Vertiefung. Vor Licht schützen und 2 h bei RT mit geringer Bewegung in einer kompakten Wippe inkubieren, wobei die Geschwindigkeit zwischen 2-3 U/min beibehalten wird.
HINWEIS: Die Durchstechflasche mit biotinylierten Antikörpern enthält 24 μg Antikörper. Nach Rekonstitution mit 1,0 ml Reagenzverdünnungsmittel wird der biotinylierte Nachweisantikörper in einer Arbeitslösung von 400 ng/ml verdünnt. - Wiederholen Sie Schritt 2.
- In jede Vertiefung werden 100 μL der Arbeitsverdünnung von Streptavidin-Meerrettichperoxidase (HRP, siehe Materialtabelle) gegeben. Die Mikroplatte mit Licht abdecken und 20 min bei RT inkubieren.
HINWEIS: Das reaktive Streptavidin-HRP war 40-fach konzentriert. Die Arbeitslösung 1x Streptavidin- HRP wurde mit Reagenzverdünnungsmittel hergestellt.
HINWEIS: Vermeiden Sie es, die Platte direktem Licht auszusetzen. - Wiederholen Sie Schritt 2.
- Schließlich werden 100 μL Substrattetramethylbenzidin (TMB, siehe Tabelle der Materialien) zu jeder Vertiefung hinzugefügt.
HINWEIS: Bereiten Sie TMB-Lösung mit einem gleichen Volumen stabilisierter Wasserstoffperoxid-30% iger Lösung vor, die im Kit enthalten ist.
HINWEIS: Bereiten Sie die Lösung unmittelbar vor Gebrauch vor und halten Sie sie bei Raumtemperatur. - Inkubieren Sie für 30 min bei RT an einem dunklen Ort.
HINWEIS: Vermeiden Sie es, die Platte direktem Licht auszusetzen. Saugen Sie die TMB-Lösung nicht ab, da kein weiteres Waschen erforderlich ist. - Fügen Sie 50 μL 1NH2SO4-Stopp-Lösung hinzu, um die kolorimetrische Reaktion zu stoppen. Klopfen Sie vorsichtig auf die Platte, um eine gründliche Mischung zu gewährleisten.
- Bestimmen Sie sofort die Absorption jeder Vertiefung mit einem Mikroplattenleser, der in einem ELISA-Plattenspektrometer auf 450 nm eingestellt ist.
- Messen Sie die Absorption mit einem ELISA-Plattenspektrometer in einem Endpunktmodus mit geringer Erschütterung für 10 s.
- Der Absorptionswert von 450 nm der Standard-Blindproben wird gemittelt und von anderen 450-nm-Werten von Standardproben und unbekannten Proben subtrahiert.
- Verwenden Sie die Standardkurve, um die Lumican-Konzentration jeder unbekannten Probe zu bestimmen.
- Für die Berechnung der Lumican-Konzentration erstellen Sie ein lineares Regressionsdiagramm unter Verwendung der Extinktionswerte auf der Y-Achse gegen die Konzentrationen in pg / ml auf der X-Achse jeder Standard-Lumican-Kurve.
- Rufen Sie die Gleichung der linearen Regression und den r-Wert ab, um die Lumican-Konzentration zu berechnen.
HINWEIS: Die Konzentration von Lumican wurde in Bezug auf die mg des extrahierten Gewebes normalisiert. Die Ergebnisse werden als normalisierte relative Konzentrationswerte von Lumican zu mg AM (ng/ml Lumican/mg AM-Gewebe) ausgedrückt.
- Rufen Sie die Gleichung der linearen Regression und den r-Wert ab, um die Lumican-Konzentration zu berechnen.
Ergebnisse
Die Ergebnisse werden als Mittelwert ± Standardabweichung (SD) angegeben. Es wurden studentische t-Tests und Varianzanalysen (ANOVA) durchgeführt. P-Werte < 0,05 wurden als statistisch signifikant angesehen. Die statistische Auswertung erfolgte mit Hilfe von Statistiksoftware (siehe Materialtabelle).
Die Gesamtproteinmenge in der AME wurde durch Zeit und Lagerbedingungen beeinflusst. Die basale Proteinkonzentration war bei allen AME ähnlich; der Bereich des Gesamtproteins betrug 2,7 ± 0,3 μg/ml ohne signifikanten Unterschied zwischen den ausgewerteten Proben. Wenn die Proben jedoch für 12, 20 und 32 Tage gelagert wurden, wurde eine Variabilität der Proteinkonzentration in Bezug auf die Basalkonzentration beobachtet. Interessanterweise stieg die Proteinkonzentration im AME bei 4 °C und -20 °C in Bezug auf die RT zu allen Zeiten der Lagerung an.
Wenn die Proteinkonzentration zwischen den Lagerzeiten verglichen wurde, änderte sie sich nach 12, 20 und 32 Tagen. Ein signifikanter Unterschied (p < 0,05) wurde in der AME von 32 und 20 Tagen bei 4 °C und -20 °C im Vergleich zur RT-Bedingung gefunden (Abbildung 2), was darauf hindeutet, dass die Temperatur für die Proteinkonservierung in den verschiedenen erhaltenen AME wichtig ist.

Abbildung 2: Gesamtproteinkonzentration in AME beeinflusst von Zeit und Lagertemperatur. Die Konzentration der Proteinextraktion auf AME wurde vor und nach Temperatur und Zeit der Lagerung quantifiziert. Die bewertete Lagerzeit betrug 6 Tage (schwarze Dreiecke), 12 Tage (rosa Dreiecke), 20 Tage (violettes Quadrat) und 32 Tage (braune Kreise) im Vergleich zu drei verschiedenen Temperaturbedingungen (RT °C, 4 °C und -20 °C). Die basale Proteinkonzentration war bei allen AME ähnlich. Es gab einen signifikanten Unterschied in der Proteinkonzentration in der AME von 20 und 32 Tagen in Bezug auf die basale Proteinkonzentration bei verschiedenen Temperaturbedingungen. In jeder Bedingung n = 3. Die Daten werden als Median von μg/ml Protein ± SE *p < 0,05 ausgedrückt (S1 32 Tage vs. S1 20, 12 und 6 Tage bei 4 °C); (S1 32 Tage vs. S1 20, 12 und 6 Tage bei -20 °C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Lumican-Konzentration wurde durch die Lagerzeit und die Temperaturbedingungen beeinflusst. Eine geringere Konzentration von Lumican wurde in der AME gefunden, die für 6, 20 und 32 Tage gelagert wurde, verglichen mit 12 Tagen Lagerung. Signifikanterweise hatte die AME von 12 Tagen eine höhere Konzentration von Lumican als 20 und 32 Tage Lagerung (p < 0,05).
Wenn die Lumican-Konzentration im AME zwischen den Lagertemperaturen verglichen wurde, wurde eine höhere Konzentration von Lumican gefunden, wenn sie 12 Tage lang bei -20 °C und 4 °C gelagert wurde (Abbildung 3). Interessanterweise wurde sogar eine höhere (p < 0,05) Konzentration von Lumican in den 12 Tagen AME gefunden, wenn es bei -20 °C im Vergleich zu 4 °C gelagert wurde.
Dies deutet darauf hin, dass die Konzentration von Lumican durch Temperaturbedingungen und Lagerzeit beeinflusst wird, was darauf hindeutet, dass die geeignete Lagerzeit und Temperatur zum Erreichen der höchsten Konzentration von Lumican 12 Tage bei -20 ° C beträgt.
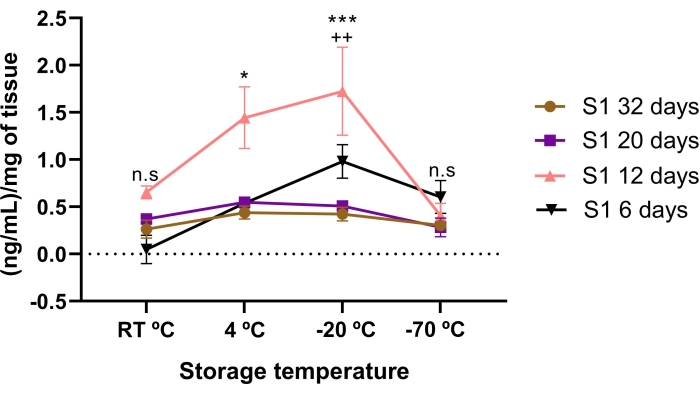
Abbildung 3: Gesamtlumican-Konzentration in AME beeinflusst von Zeit und Lagertemperatur. Die Lumican-Konzentration wurde durch die Lagerzeit und die Temperaturbedingungen beeinflusst. Die Konzentration von Lumican in AME wurde vor und nach Temperatur und Zeit der Lagerung quantifiziert. Die bewertete Lagerzeit betrug 6 Tage (schwarze Dreiecke), 12 Tage (rosa Dreiecke), 20 Tage (violettes Quadrat) und 32 Tage (braune Kreise) im Vergleich zu drei verschiedenen Temperaturbedingungen (RT °C, 4 °C und -20 °C). Lumican in der AME von 12 Tagen war signifikant höher im Vergleich zur AME von 32, 20 und 6 Tagen, bei Temperaturbedingungen von -20 °C und 4 °C. *p < 0,05 (S1 12 Tage vs. S1 32, 20 und 6 Tage bei 4 °C); p < 0,001 (S1 12 Tage vs. S1 32, 20 und 6 Tage bei -20°C). Die höchste Konzentration von Lumican in AME wurde nach 12 Tagen bei -20 °C gelagert. ++p < 0,01 (S1 12 Tage 4 °C vs. S1 12 Tage -20 °C). Es gab keinen signifikanten Unterschied zwischen Lumican in der AME von 32 und 20 Tagen im Vergleich zu Lagertemperaturbedingungen (n.s.). In jeder Bedingung (n = 3) werden die Daten als Median von ng/ml Protein ausgedrückt. Die Daten wurden in Bezug auf mg Gewebe ± SE normalisiert. (n.s.) keine statistische Signifikanz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
In dieser Studie wurde das Vorhandensein von Lumican im AME und seine direkte Korrelation mit seiner Stabilität unter verschiedenen Lagerbedingungen analysiert. Interessanterweise stieg die Proteinkonzentration nach der Lagerung an, wenn die Gesamtproteinkonzentration in AME quantifiziert wurde. Es gibt Hinweise auf drei Mechanismen, die die Proteinkonzentration in gefrorenen Lagern verändern könnten: kalte Denaturierung, die gefrorene Konzentration gelöster Stoffe und eisinduzierte teilweise Entfaltung der Proteinstruktur19. Der Gefrierprozess könnte die Proteinkonzentration auf Lagerproben aufgrund der Kristallisation der flüssigen Phase in der Probe beeinflussen. Die Ergebnisse deuten darauf hin, dass dies als ein Prozess des Einfrierens der Konzentration aufgetreten sein könnte, der von der Lagerzeit im Gefrierschrank beeinflusst wird. Eine höhere Konzentration von Proteinen wurde bei längeren Lagerzeiten (32 und 20 Tage) und bei den kältesten Temperaturen (4 °C und -20 °C) beobachtet. Die Periode mit der höchsten Proteinkonzentration hatte jedoch nicht die höchste Konzentration an Lumican; Dies deutet darauf hin, dass Lumican durch gefrorene Temperaturen und Zeitbedingungen beeinflusst werden könnte.
Den Ergebnissen zufolge war die Lumican-Konzentration nach 12 Tagen Lagerung bei 4 °C und -20 °C höher und stabiler. Dennoch wurde eine geringere Konzentration von Lumican nach 6 Tagen im Vergleich zu 12 Tagen gefunden. Einige Berichte deuten darauf hin, dass sich die Proteinkonzentration nach gefrorenen Lagerbedingungen ändern könnte20. Die Ergebnisse könnten durch einen thermodynamischen Mechanismus verursacht werden, der als eisinduzierte partielle Entfaltung der Proteinstruktur bezeichnet wird und beim Einfrieren von Proben auftritt. Die Wechselwirkung von Proteinen mit Wasser in den wässrigen Lösungen reduziert deren Wechselwirkungen mit anderen Molekülen. Der Kristallisationsprozess von Wasser unter gefrorenen Bedingungen ermöglicht es Proteinen und einigen funktionellen Regionen, mit anderen Molekülen zu interagieren19. Nach 12 Tagen Einfrieren von Lumican in einer wässrigen Lösung könnte es in der Lage sein, mit den im ELISA-Quantifizierungskit vorhandenen Antikörpern zu interagieren, um zu einer höheren Konzentration zu führen. Andererseits, wahrscheinlich am sechsten Tag, könnte der Lumican in der wässrigen Lösung abgeschieden worden sein.
Bei der Weiterentwicklung von Innovationen ist der Einsatz von AM die modernste Behandlung der Hornhaut-Reepithelisierung unabhängig von der Ätiologie. Wie bereits erwähnt, sind die Vorteile von AM enorm 21,22,23,24,25,26. Viele Autoren haben die Vorteile von Lumican bei AME demonstriert, was es zu einer erschwinglichen Alternative speziell für Entwicklungsländermacht 1,2,3,4,5,6,7,8,9. Derzeit gibt es viele Vorteile von Lumican in AME; Seine Verwendung als Behandlung begünstigt die Hornhaut-Reepithelialisierung und verbessert die Prognose von Hornhautgeschwüren 4,5,6,7,8,9,10,11,12,13,14,15. Die AM-Transplantation (AMT) ist zu einer Behandlung mit großem Nutzen für die Verbesserung verschiedener Hornhauterkrankungen geworden24,25. Es gibt jedoch einige chronische Erkrankungen des Hornhautgewebes, wie persistierende Epitheldefekte (PED) und limbale Stammzellmängel (LESCD), die eine ständige Behandlung und Aufrechterhaltung des Vorhandenseins biologischer Faktoren erfordern, die die Hornhautreparatur unterstützen21,24. Derzeit gibt es keine adjuvanten Behandlungen, die eine langfristige Aufrechterhaltung der von AMT freigesetzten Faktoren auf der Hornhautoberfläche ermöglichen. Ein ständiger Austausch der AMT könne jedoch aus Gründen der Patientensicherheit nicht empfohlenwerden 26. Aus diesem Grund ist es notwendig, Alternativen zu entwickeln, die es den Funktionen von AMT ermöglichen, das Vorhandensein von Faktoren, die durch AM im Hornhautgewebe freigesetzt werden, wie Lumican, für eine längere Zeit zu unterstützen und aufrechtzuerhalten, um die Behandlung anhaltender Probleme der Hornhaut zu begünstigen27.
Lumican ist einer der Faktoren bei AM mit entzündungshemmenden und antifibrotischen Funktionen, von denen berichtet wurde, dass sie Funktionen im Hornhautreparaturprozess haben 6,7,8,9,10,11,12,13,14,15 . Deshalb schlägt Lumican vor, ein guter Kandidat für die Behandlung von Hornhauterkrankungen zu sein; Es sind jedoch zusätzliche Untersuchungen erforderlich, um die Wirksamkeit von Lumican bei AME zu bestimmen, um eine Hornhautreepithelisierung zu erreichen.
Lumican ist ein Proteoglykan, von dem gezeigt wurde, dass es die Sekretion von extrazellulären Matrixverbindungen als Kollagen reguliert; Es ist auch an der Aktivierung und Modulation von Fibroblasten von Entzündungszellen und dem Angiogeneseprozess beteiligt und spielt eine wichtige Rolle bei der Wundheilung. Den Ergebnissen zufolge kann Lumican aus AM-Gewebe extrahiert werden. Therapeutische Anwendungen von Lumican sind zahlreich; die Anwendung von Lumican in der AME ermöglicht eine erreichbare therapeutische Option für Augenerkrankungen 4,13. Der Hauptvorteil der Verwendung von AME besteht darin, dass es aufgrund seiner wässrigen Zusammensetzung eine einfache Anwendung als topische Behandlung für die Augenoberfläche bietet. Ebenso können andere Proteine mit entzündungshemmenden und immunregulatorischen Eigenschaften in den aus dem AM-Gewebe extrahierten Komponenten gefunden werden, was einen größeren Nutzen bei der Behandlung von deepithelialisierenden Problemen im Auge darstellen könnte. Zum Beispiel wurde zuvor berichtet, dass andere entzündungshemmende Faktoren wie TSG-6, die in der AM und zellulären Komponenten vorhanden sind, immunregulatorische Eigenschaften haben8. Hierdurch könnte eine kombinierte Therapie von Lumican und anderen extrazellulären Matrixverbindungen und immunmodulatorischen Molekülen, die in der AME vorhanden sind, im Reepithelisierungs- und Wundheilungsprozess nützlich sein.
Diese Methode zielt darauf ab, eine einfache Technik für die Proteinextraktion zu demonstrieren, die für die Bestimmung von reichlich vorhandenen Proteinen und Faktoren nützlich ist. Eine der kritischen Überlegungen für diese Methode ist die Verwendung von Proteaseinhibitoren, da sie für eine erfolgreiche Proteinextraktion von grundlegender Bedeutung ist, da die AM ein Gewebe mit vielen enzymatischen Verbindungen ist, um den Proteinabbau zu verhindern27. Es wurde berichtet, dass die Verwendung von Proteininhibitoren zusammen mit einer wässrigen Lösung die Extraktion anderer Faktoren wie HGF im AM-Gewebeerhöht 26. Die Lagerung eines feinen Pulvers nach dem Einfrieren und Erdung des AM ist für die optimale Obtention von AME notwendig, da dieses Verfahren für den Gewebe- und Zellaufschluss von Strukturen geeignet ist, die für die Extraktion von zytosolischen und anderen Kernverbindungen benötigtwerden 28,29.
Einige Einschränkungen dieser Extraktionsmethode bestehen darin, dass die verwendete AM-Menge keine großflächige Extraktion zulassen könnte. Dieses Protokoll ermöglicht die Proteinextraktion aus einer begrenzten Menge an Gewebe; Da es keine Hinweise darauf gibt, dass diese Methode es ermöglicht, eine größere Menge an Protein aus einem größeren Gewebebereich zu gewinnen. Die Fehlersuche, die im Vergleich zu anderen Extraktionsmethoden in Betracht gezogen werden muss, besteht darin, eine geeignete Konzentration von Proteaseinhibitor und Inkubationszeit zu verwenden, da die überschüssigen Enzyme Proteine30 beeinflussen und die Wirksamkeit der Technik verringern könnten.
Ein Teil dieser Technik wurde von der von Mahbod et al.16 berichteten modifiziert, die beschreibt, dass die Wiederholung des Zentrifugations- und Extraktionsprozesses die Proteinextraktion erhöht. Im Gegensatz zu Mahbod berichteten die Ergebnisse nicht über die Proteinkonzentration nach drei Zentrifugationszyklen. Wenn die Gesamtproteinkonzentration bestimmt wurde, sank sie bei einer zweiten Extraktion um 80% und bei einer dritten Extraktion um bis zu 97%. Die Durchführung von nur einer Extraktion reduziert die Verarbeitungszeit und verringert nicht die Menge an Gesamtprotein. Mit dem vorhergehenden erfordert das hier beschriebene Extraktionsverfahren nur einen Zentrifugationsschritt mit günstigen Ergebnissen.
Diese Technik könnte verwendet werden, um andere Faktoren und Proteine zu extrahieren, die in der AM vorhanden sind, und weiter, um Faktoren aus anderen Quellen wie Tieren oder Gemüse zu erhalten. Es könnte auch eine Anwendung für die Gewinnung von Proteinen haben, um Grundlagenforschung oder sogar die Entwicklung von Formulierungen und Behandlungen durchzuführen.
Diese Ergebnisse deuten darauf hin, dass Lumican aus AM extrahiert und 12 Tage lang als AME unter Temperaturbedingungen von -20 °C und 4 °C gelagert werden kann. Es ist wichtig, seine Halbwertszeit zu berücksichtigen, um die therapeutischen Wirkungen von Lumican als AME zu erzielen. Weitere Studien sind erforderlich, um die Rolle von AME lumican in Hornhautepithelzellen zu bestimmen und die ideale Dosis von Lumican für die Hornhautrepithelisierung zu bestimmen.
Zusammenfassend deuten die Ergebnisse darauf hin, dass es möglich ist, Faktoren wie Lumican in der AME zu erhalten. Ebenso beeinflussen Temperatur- und Lagerzeitbedingungen die Konzentration von Lumican im AME.
Offenlegungen
Die Studie wurde durch das Förderprogramm für Forschungs- und Technologieinnovationsprojekte der Universidad Nacional Autonoma de Mexico (Fördernummer PAPIIT IN203821) und des Ministeriums für Bildung, Wissenschaft, Technologie und Innovation (Fördernummer SECTEI 250/2019) finanziert.
Danksagungen
Die Autoren haben keine konkurrierenden finanziellen Interessen.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
Referenzen
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten