Method Article
Extração de Lumican da Membrana Amniótica e Determinação de sua Temperatura de Armazenamento
Neste Artigo
Resumo
O presente protocolo descreve a extração de lumicano da membrana amniótica (MA) e suas condições de armazenamento como extrato de micorrizas (EMA) a -20 °C, 4 °C e temperatura ambiente (RT) por 6, 12, 20 e 32 dias para quantificar suas proteínas e concentração de lumicano.
Resumo
O lúmicano é um pequeno proteoglicano rico em leucina na membrana amniótica humana (MA) que promove a epitelização da córnea e a organização das fibras colágenas, mantendo a transparência da córnea. No presente trabalho, propõe-se um método de extração proteica de MA para obtenção de lumicano. Além disso, a estabilidade do lumicano no extrato de MA (AME) armazenado em diferentes temperaturas e períodos de tempo é avaliada. 100 mg de MA foram descongelados e desepitelizados mecanicamente. O AM desepitelizado foi congelado e triturado até a obtenção de um pó fino, que foi solubilizado com 2,5 mL de tampão salino com inibidores de protease e centrifugado para extração proteica. O sobrenadante foi coletado e armazenado a -20 °C, 4 °C e temperatura ambiente (TR) por 6, 12, 20 e 32 dias. Posteriormente, o lumicano foi quantificado em cada EMA. Esta técnica permite um protocolo acessível e acessível para a extração de lumicano a partir de AM. A concentração de lúmico foi afetada pelo tempo de armazenamento e pelas condições de temperatura. Lumican no AME de 12 dias armazenado a -20 °C e 4 °C foi significativamente maior do que outros AME. Esta extração de lumicano pode ser útil para o desenvolvimento de tratamentos e soluções farmacêuticas. Mais estudos são necessários para determinar os usos do AME lumican no processo de reepitelização e cicatrização de feridas.
Introdução
Um dos tratamentos mais utilizados para as afecções corneanas é o transplante de membrana amniótica; no entanto, nos últimos anos, novas propostas têm surgido para a utilização de diversos componentes do tecido amniótico como tratamentos alternativos e adjuvantes. Entre os componentes mais estudados da MA estão os obtidos a partir do extrato de MA (EMA)1,2,3,4,5,6,7. A MA contém múltiplos fatores solúveis, como proteínas antiangiogênicas, interleucinas (IL), inibidores teciduais de metaloproteinases (TIMPs), proteínas anti-inflamatórias mediadas pelo TSG-6 que inibem armadilhas extracelulares de neutrófilos, fatores de crescimento: fator de crescimento epidérmico (EGF), fator de crescimento transformador (TGF) (alfa e beta), fator de crescimento de queratinócitos (KGF), fator de crescimento de hepatócitos (HGF) e lumicano, que mantém a transparência da córnea regulando a fibrilogênese do colágeno1, 2,3,4,5,6,7,8,9.
O lúmicano é um pequeno proteoglicano rico em leucina (SLRP), um dos principais componentes extracelulares da colagenase intersticial na matriz do estroma corneano, responsável por organizar as fibras colágenas e manter a transparência corneana 4,10,11. Os proteoglicanos são moléculas da matriz extracelular (MEC), que são as principais na realização da sinalização celular e na manutenção da homeostase intracelular12. Acredita-se que as proteínas ECM impulsionam os processos celulares de proliferação, diferenciação e migração durante a cicatrização de feridas11.
Evidências indicam a possível participação do lumicano no processo de reepitelização corneana. Saika et al., em um estudo, mostraram que, após uma lesão corneana, o lumicano poderia ser detectado em queratócitos corneanos entre as primeiras 8 h e até 3 dias após a lesão. Apresentando a maior concentração de lumicano no segundo e terceiro dia, esse proteoglicano é posteriormente indetectável no sétimo dia13. Esses dados sugerem a participação do lumicano na ativação do processo de reepitelização corneana. Por outro lado, em outro estudo, foi relatado que a ausência de lumicano retarda a reepitelização; curiosamente, a adição de lumicano poderia acelerar o processo de reepitelização 4,11,13. Da mesma forma, um estudo recente relatou que o lumicano pode modular as funções inflamatórias dos fibroblastos do limbo corneano14, o que sugere um papel para o lumicano como modulador da resposta inflamatória, antifibrótica e reepitelizante. Da mesma forma, o lumicano pode modular a resposta da córnea interagindo com moléculas de sinalização, como Fas-FasL. Além disso, a ausência de lumicano em um modelo knockout de camundongo Lum-/- demonstrou que a falta de sinalização lumicana impede o reparo adequado da córnea15.
Primeiramente, este método visa demonstrar uma maneira viável e acessível de extrair lumicano da AM. Com esse método vantajoso de extração de lumicanas, é possível obter concentrações semelhantes de proteínas, diminuindo o tempo de processamento e tornando-o mais conveniente para os pesquisadores em comparação com os estudos anteriores16. Além disso, este lumicano AME poderia ser usado como um adjuvante para os processos de reparo e reepitelização da córnea.
Protocolo
Todos os procedimentos experimentais foram aprovados pelo Comitê de Ética em Pesquisa (Projeto nº CEI-2020/06/04). O AM foi obtido do Banco de Amnion do Instituto de Oftalmologia Conde de Valenciana (de seres humanos não identificados), elaborado conforme descrito por Chávez-García et al.17.
1. Preparação do extracto de membrana amniótica
- Obter 100 mg de AM do banco de amnion.
NOTA: De acordo com um relatório anterior, 50 mg de AM secreta um total de 10 ng/mL de lumicano14. Para obter uma maior concentração de lumicano, utilizar 100 mg de AM, equivalente a uma área total de 32 cm2. - Se o AM estiver congelado, descongele-o à temperatura ambiente.
NOTA: Execute os seguintes procedimentos sob um exaustor de fluxo laminar classe II B. - Lave o AM em uma placa de Petri com 10 mL de solução salina balanceada estéril (BSS, ver Tabela de Materiais) por 2 min.
- Despeje o BSS em um béquer.
- Repita o passo 3 e confirme visualmente que o meio glicerol não está presente na placa de Petri BSS.
Observação : repita a etapa 3. conforme necessário, até que o meio glicerol não esteja presente na placa de Petri BSS.
- Incubar o AM com 10 mL de dispase II (1,7 UI/mL, ver Tabela de Materiais) a 37 °C, CO2 a 5% por 30 min.
NOTA: A dispase II é uma protease neutra com atividade suave sobre as células epiteliais. Essa enzima efetivamente separa a epiderme intacta da derme e isola as folhas epiteliais intactas18. - Após a incubação da dispase, realizar uma desepitelização mecânica14 com um policial de borracha (ver Tabela de Materiais). Confirmar a desepitelização por visualização microscópica.
NOTA: O processo de desepitelização é corroborado em microscópio invertido utilizando objetivas 4x e 20x. Visualize o tecido para excluir a presença de qualquer camada celular. - Lave o AM em uma placa de Petri com 10 mL de BSS por 2 min. Despeje o BSS em um béquer.
- Coloque a MA desepitelizada (dAM) em um tubo de microcentrífuga de 2 mL. Mergulhe o dAM em nitrogênio líquido por 40 min.
- Moer manualmente o dAM congelado durante 2-3 min numa argamassa pré-arrefecida a -85 °C até obter um pó fino.
- Na argamassa, solubilizar o pó de dAM com 2,5 mL de solução inibidora de protease (BSS com inibidores de protease).
NOTA: Cada comprimido de inibidor de protease consiste na seguinte mistura de enzimas: extrato de pâncreas (0,02 mg/mL), termolisina (metalloprotease) (0,0005 mg/mL), quimotripsina (0,002 mg/mL), tripsina (0,02 mg/mL) e papaína (0,33 mg/mL) (ver Tabela de Materiais). - Colete a mistura com uma micropipeta e limpe as paredes de argamassa com a ajuda de uma faca de bisturi. Coloque a mistura em um tubo de 5 mL.
- Misture bem com o vórtice por 30 s.
- Homogeneizar a mistura de tecidos centrifugando a 34 x g durante 20 min a 4 °C e centrifugar imediatamente a 3360 x g durante 20 min a 4 °C.
- O sobrenadante coletado é o AME (Figura 1). Armazenar 0,7 mL de cada AME em diferentes tubos de microcentrífuga de 2 mL por 6, 12, 20 e 33 dias nas diferentes condições de temperatura de -20 °C, 4 °C e temperatura ambiente (RT).
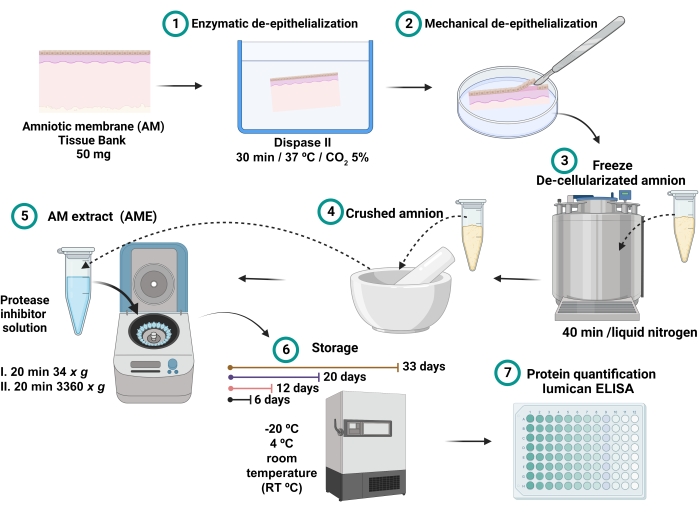
Figura 1: Processo de preparo do AME e medida da concentração de lumican . 100 mg de AM foram incubados com dispase II a 37 °C por 30 min e mecanicamente desepitelizados. O AM desepitelizado foi lavado e imerso em nitrogênio líquido por 40 min, e depois triturado até a obtenção de um pó fino, que foi solubilizado com 2,5 mL de tampão salino com inibidores de protease e centrifugado. O sobrenadante foi coletado e armazenado a -20 °C, 4 °C e RT por 6, 12, 20 e 32 dias até a quantificação da proteína total e do lumicano. Por favor, clique aqui para ver uma versão maior desta figura.
2. Quantificação da proteína AME
NOTA: A quantificação da proteína total no EMA deve ser efectuada imediatamente após a obtenção. Quantifique as proteínas usando o ensaio de proteína de Lowry e siga as instruções do fabricante (consulte Tabela de Materiais). Recomenda-se que todas as normas e amostras sejam ensaiadas em triplicata.
- Pipetar 40 μL de cada amostra de AME para uma microplaca de 96 poços.
- Preparar uma curva padrão na mesma microplaca usando o padrão de albumina sérica bovina (BSA) para uma concentração final de BSA de 0-1.500 μg/mL (0, 1, 5, 25, 125, 250, 500, 750, 1.000 e 1.500 μg/mL).
- Pipeta de 200 μL do reagente de Lowry modificado para cada poço. Misture imediatamente em um misturador de pratos por 30 s.
- Cubra a microplaca com papel alumínio e incube-a em RT por 10 min.
- Pipeta 20 μL de 1x reagente Folin-Ciocalteu para cada poço. Misture imediatamente em um misturador de pratos por 30 s.
NOTA: Para preparar 1x reagente de Folin-Ciocalteu, diluir 2x (2N) reagente 1:1 com água ultrapura. Preparar 1x reagente de Folin-Ciocalteu no mesmo dia de utilização em que o reagente diluído é instável. - Cubra a microplaca da luz com papel alumínio e incube-a em RT por 30 min.
- Medir a absorvância das amostras a 660 nm num espectrómetro de placas ELISA (ver Tabela de Materiais).
NOTA: A cor pode ser medida em comprimentos de onda entre 650 nm e 750 nm. - Calcular em média o valor de absorvância de 660 nm das amostras em branco padrão e subtraí-lo de outros valores de 660 nm de amostras padrão e desconhecidas.
- Meça a absorbância com um espectrômetro de placa ELISA em um modo final com baixa agitação por 10 s.
- Use a curva padrão para determinar a concentração de proteína de cada amostra desconhecida.
- Para o cálculo da proteína, determine a concentração a partir de um gráfico de regressão linear usando os valores de absorbância no eixo Y contra as concentrações em mg/mL no eixo X de cada curva padrão da BSA.
- Obter a equação de regressão linear e valor r para calcular a concentração de proteínas.
NOTA: Os resultados são expressos como valores de concentração relativa normalizados de proteína total em relação a mg de AM (μg/mL de proteína/mg de tecido AM).
- Obter a equação de regressão linear e valor r para calcular a concentração de proteínas.
3. Quantificação de Lumican em AME
NOTA: A concentração de lumicano deve ser medida no AME armazenado em diferentes condições de armazenamento e períodos de tempo. Quantifique o lumicano usando ELISA sanduíche e siga as instruções do fabricante. Recomenda-se que todas as normas e amostras sejam ensaiadas em duplicado.
- Diluir o anticorpo de captura de lumicano humano (ver Tabela de Materiais) para a concentração empregada em solução salina tamponada com fosfato (PBS).
NOTA: O frasco para injetáveis de anticorpos de captura contém 120 μg de anticorpo. Após reconstituição com 0,5 mL de PBS, diluir o anticorpo de captura em uma solução funcional de 2 μg/mL.- Pipetar instantaneamente 100 μL por poço do anticorpo de captura diluído para uma microplaca de 96 poços. Coloque a placa e incube-a durante a noite no RT.
- Aspirar cada poço e lavá-lo pipetando com 300 μL de tampão de lavagem: monolaurato de polioxietileno sorbitano a 0,05% 20 em PBS, pH 7,2-7,4 (ver Tabela de Materiais) usando um pipetador multicanal. Repita três vezes.
NOTA: Após a última lavagem, remova qualquer amortecedor de lavagem restante sempre que a placa e bata suavemente contra toalhas de papel. - Placas de bloco adicionando 300 μL de diluente reagente: 1% de BSA em PBS, pH 7,2-7,4, 0,2 μm filtrado (ver Tabela de Materiais) para cada poço. Incubar no RT por 1 h.
- Repita a etapa 2.
- Prepare uma curva padrão em uma microplaca de 96 poços usando diluições seriadas de duas vezes de 0-8.000 pg/mL para concentrações finais de 125, 250, 500, 1.000, 2.000, 4.000 e 8.000 pg/mL. O kit ELISA lumican contém um padrão lumicano recombinante de 75 ng (ver Tabela de Materiais).
- Adicionar 100 μL de amostras e a curva padrão na microplaca de 96 poços revestida com anticorpos de captura.
- Cubra a microplaca e incube por 2 h a RT com baixa agitação em um balancim compacto mantendo a velocidade entre 2-3 rpm.
- Repita a etapa 2.
- Adicionar 100 μL do anticorpo de detecção biotinilado (ver Tabela de Materiais) a cada alvéolo. Cobrir da luz e incubar 2 h a RT com baixa agitação em balancim compacto mantendo a velocidade entre 2-3 rpm.
NOTA: O frasco para injetáveis de anticorpos de detecção biotinilada contém 24 μg de anticorpo. Após reconstituição com 1,0 mL de diluente reagente, diluir o anticorpo de detecção biotinilada em uma solução de trabalho de 400 ng/mL. - Repita a etapa 2.
- Adicionar 100 μL da diluição de trabalho da peroxidase treptavidina-rábano (HRP, ver Tabela de Materiais) a cada alvéolo. Cubra a microplaca da luz e incube por 20 min no RT.
NOTA: A estreptavidina-HRP reativa foi 40 vezes concentrada. A solução de trabalho 1x de estreptavidina-HRP foi confeccionada com diluente reagente.
NOTA: Evite colocar a placa em luz direta. - Repita a etapa 2.
- Finalmente, adicione 100 μL de substrato tetrametilbenzidina (TMB, ver Tabela de Materiais) solução a cada poço.
NOTA: Prepare a solução TMB com um volume igual de solução estabilizada de peróxido de hidrogênio a 30% fornecida no kit.
NOTA: Preparar a solução imediatamente antes da utilização e mantê-la à temperatura ambiente. - Incubar por 30 min no RT em um local escuro.
NOTA: Evite colocar a placa em luz direta. Não aspirar a solução de TMB, uma vez que não é necessária mais lavagem. - Adicionar 50 μL de solução de parada de 1N H2SO4 para interromper a reação colorimétrica. Bata suavemente na placa para garantir uma mistura completa.
- Determinar imediatamente a absorvância de cada poço usando um leitor de microplacas ajustado para 450 nm em um espectrômetro de placa ELISA.
- Meça a absorbância com um espectrômetro de placa ELISA em um modo final com baixa agitação por 10 s.
- Calcule a média do valor de absorvância de 450 nm das amostras em branco padrão e subtraia-o de outros valores de 450 nm das amostras padrão e desconhecidas.
- Use a curva padrão para determinar a concentração de lumicano de cada amostra desconhecida.
- Para o cálculo da concentração de lumican, faça um gráfico de regressão linear utilizando os valores de absorbância no eixo Y contra as concentrações em pg/mL no eixo X de cada curva lumicana padrão.
- Obter a equação de regressão linear e valor r para calcular a concentração de lumicano.
NOTA: A concentração de lumicano foi normalizada em relação ao mg de tecido extraído. Os resultados são expressos como valores de concentração relativa normalizados de lumicano para mg AM (ng/mL lumican/mg de tecido AM).
- Obter a equação de regressão linear e valor r para calcular a concentração de lumicano.
Resultados
Os resultados são relatados como o valor médio ± desvio padrão (DP). Foram realizados testes t de Student e análise de variância (ANOVA). Os valores de p < 0,05 foram considerados estatisticamente significativos. A análise estatística foi realizada por meio de software estatístico (ver Tabela de Materiais).
A quantidade total de proteína no EMA foi afetada pelo tempo e pelas condições de armazenamento. A concentração de proteína basal foi semelhante entre todos os EMA; a faixa de proteína total foi de 2,7 ± 0,3 μg/mL, sem diferença significativa entre as amostras avaliadas. No entanto, quando as amostras foram armazenadas por 12, 20 e 32 dias, observou-se variabilidade na concentração proteica em relação à concentração basal. Curiosamente, a concentração de proteína aumentou no AME a 4 °C e -20 °C em relação ao RT em todos os momentos de armazenamento.
Da mesma forma, quando a concentração de proteína foi comparada entre os tempos de armazenamento, ela mudou após 12, 20 e 32 dias. Encontrou-se diferença significativa (p < 0,05) no EMA de 32 e 20 dias a 4 °C e -20 °C em relação à condição de TR (Figura 2), sugerindo que a temperatura é importante para a conservação proteica nos diferentes EMA obtidos.

Figura 2: Concentração de proteína total em EMA afetada pelo tempo e temperatura de armazenamento. A concentração de extração proteica em EMA foi quantificada antes e após as condições de temperatura e tempo de armazenamento. O tempo de armazenamento avaliado foi de 6 dias (triângulos pretos), 12 dias (triângulos rosa), 20 dias (quadrado roxo) e 32 dias (círculos marrons) em comparação com três condições de temperatura diferentes (RT °C, 4 °C e -20 °C). A concentração de proteína basal foi semelhante entre todos os AME. Houve diferença significativa na concentração de proteína no EMA de 20 e 32 dias em relação à concentração de proteína basal em diferentes condições de temperatura. Em cada condição n = 3. Os dados são expressos como mediana de μg/mL de proteína ± SE *p < 0,05 (S1 32 dias vs. S1 20, 12 e 6 dias a 4 °C); (S1 32 dias vs. S1 20, 12 e 6 dias a -20 °C). Por favor, clique aqui para ver uma versão maior desta figura.
A concentração de lúmico foi afetada pelo tempo de armazenamento e pelas condições de temperatura. Menos concentração de lumicano foi encontrada no AME armazenado por 6, 20 e 32 dias, em comparação com 12 dias de armazenamento. Significativamente, o AME de 12 dias apresentou maior concentração de lumicano do que 20 e 32 dias de armazenamento (p < 0,05).
Quando a concentração de lumicano no EMA foi comparada entre as temperaturas de armazenamento, encontrou-se maior concentração de lumicano se armazenada a -20 °C e 4 °C por 12 dias (Figura 3). Curiosamente, mesmo uma maior (p < 0,05) concentração de lumicano foi encontrada nos 12 dias de EMA se armazenado a -20 °C em comparação com 4 °C.
Isso sugere que a concentração de lumicano é afetada pelas condições de temperatura e tempo de armazenamento, sugerindo que o tempo e a temperatura de armazenamento apropriados para atingir a maior concentração de lumicano são de 12 dias a -20 °C.
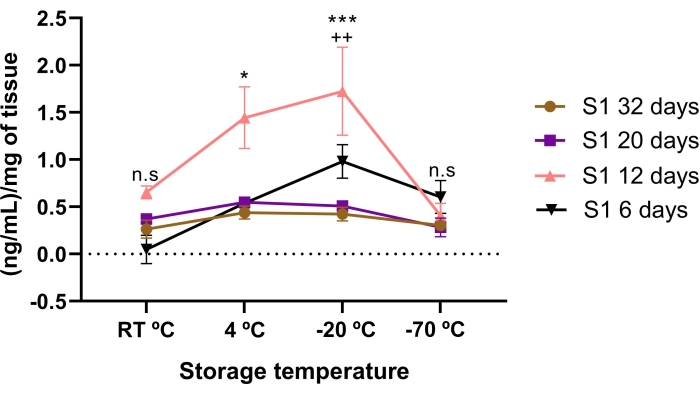
Figura 3: Concentração total de lumicano em EMA afetada pelo tempo e temperatura de armazenamento. A concentração de lúmico foi afetada pelo tempo de armazenamento e pelas condições de temperatura. A concentração de lumicano na EMA foi quantificada antes e após as condições de temperatura e tempo de armazenamento. O tempo de armazenamento avaliado foi de 6 dias (triângulos pretos), 12 dias (triângulos rosa), 20 dias (quadrado roxo) e 32 dias (círculos marrons) em comparação com três condições de temperatura diferentes (RT °C, 4 °C e -20 °C). Lumican no AME de 12 dias foi significativamente maior em comparação com o AME de 32, 20 e 6 dias, em condições de temperatura de -20 °C e 4 °C. *p < 0,05 (S1 12 dias vs. S1 32, 20 e 6 dias a 4 °C); p < 0,001 (S1 12 dias vs. S1 32, 20 e 6 dias a -20°C). A maior concentração de lumicano em EMA foi aos 12 dias armazenada a -20 °C. ++p < 0,01 (S1 12 dias 4 °C vs. S1 12 dias -20 °C). Não houve diferença significativa entre o lumicano no AME de 32 e 20 dias em comparação com as condições de temperatura de armazenamento (n.s). Em cada condição (n = 3), os dados são expressos como a mediana de ng/mL de proteína. Os dados foram normalizados em relação ao mg de tecido ± SE. (n.s.) não significância estatística. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Neste estudo, a presença de lumicano foi analisada no AME e sua correlação direta com sua estabilidade sob diferentes condições de armazenamento. Curiosamente, quando a concentração de proteína total em EMA foi quantificada, a concentração de proteína aumentou após o armazenamento. Evidências sugerem três mecanismos que poderiam alterar a concentração de proteínas no armazenamento congelado: a desnaturação a frio, a concentração congelada de solutos e o desdobramento parcial da estrutura proteica induzido pelo gelo19. O processo de congelamento pode afetar a concentração de proteína em amostras de armazenamento devido à cristalização da fase líquida na amostra. Os resultados sugerem que isso poderia ter ocorrido como um processo de congelamento da concentração, afetado pelo tempo de armazenamento no freezer. Observou-se maior concentração de proteínas em tempos mais longos de armazenamento (32 e 20 dias) e nas temperaturas mais frias (4 °C e -20 °C). No entanto, o período com maior concentração de proteína não apresentou a maior concentração de lumicano; isso sugere que o lumicano pode ser afetado por temperaturas congeladas e condições de tempo.
De acordo com os resultados, a concentração de lumicano foi maior e mais estável aos 12 dias de armazenamento a 4 °C e -20 °C. No entanto, uma menor concentração de lumicano foi encontrada aos 6 dias em comparação com 12 dias. Alguns relatos sugerem que a concentração de proteína pode mudar após condições de armazenamento congelado20. Os resultados podem ser causados por um mecanismo termodinâmico chamado desdobramento parcial induzido por gelo da estrutura da proteína, que acontece durante o congelamento das amostras. A interação de proteínas com água nas soluções aquosas reduz suas interações com outras moléculas. O processo de cristalização da água sob condições congeladas permite que proteínas e algumas regiões funcionais interajam com outras moléculas19. Pelo exposto, após 12 dias de congelamento do lumicano em solução aquosa, ele poderia ser capaz de interagir com os anticorpos presentes no kit de quantificação ELISA para resultar em uma maior concentração. Por outro lado, provavelmente no sexto dia, o lumicano poderia ter sido isolado na solução aquosa.
No avanço das inovações, o uso de MA é o tratamento de última geração para a reepitelização da córnea, independentemente da etiologia. Como mencionado acima, os benefícios da AM são vastos 21,22,23,24,25,26. Muitos autores têm demonstrado os benefícios do lumicano na EMA, tornando-o uma alternativa acessível especificamente para países em desenvolvimento 1,2,3,4,5,6,7,8,9. Atualmente, existem muitos benefícios do lumicano na EMA; seu uso como tratamento favorece a reepitelização corneana e melhora o prognóstico das úlceras de córnea 4,5,6,7,8,9,10,11,12,13,14,15. O transplante de MA (TMA) tornou-se um tratamento com grandes benefícios para a melhora de diversos distúrbios corneanos24,25. No entanto, existem algumas afecções crônicas do tecido corneano, como defeitos epiteliais persistentes (PED) e deficiências de células-tronco límbicas (LESCD), que requerem tratamento constante e manutenção da presença de fatores biológicos que auxiliam no reparo corneano21,24. Atualmente, não existem tratamentos adjuvantes que permitam a manutenção a longo prazo dos fatores liberados pela AMT na superfície da córnea. No entanto, uma substituição constante da TMA não pôde ser recomendada para a segurança do paciente26. Por esse motivo, é necessário desenvolver alternativas que permitam que as funções da AMT auxiliem e ajudem a manter a presença de fatores liberados pela MA no tecido corneano como o lumicano por mais tempo, pretendendo favorecer o tratamento de problemas persistentes da córnea27.
O lúmican é um dos fatores presentes na MA com funções anti-inflamatórias e antifibróticas, que tem sido relatado como tendo funções no processo de reparo corneano 6,7,8,9,10,11,12,13,14,15 . É por isso que o lumicano sugere ser um bom candidato para ajudar no tratamento de afecções da córnea; no entanto, pesquisas adicionais são necessárias para determinar a eficácia do lumicano na EMA para alcançar a reepitelização da córnea.
Lumican é um proteoglicano que demonstrou regular a secreção de compostos da matriz extracelular como colágeno; além disso, está envolvida na ativação e modulação de fibroblastos de células inflamatórias e no processo de angiogênese, tendo um papel importante na cicatrização de feridas. De acordo com os resultados, o lumicano pode ser extraído do tecido AM. As aplicações terapêuticas do lumicano são numerosas; o uso do lumicano no AME permite uma opção terapêutica atingível para distúrbios oculares 4,13. A principal vantagem do uso do AME é que ele proporciona uma fácil aplicação como tratamento tópico para a superfície ocular, dada a sua composição aquosa. Da mesma forma, outras proteínas com características anti-inflamatórias e imunorreguladoras podem ser encontradas nos componentes extraídos do tecido da MA, o que poderia apresentar maior benefício no tratamento de problemas desepitelizantes no olho. Por exemplo, outros fatores anti-inflamatórios, como o TSG-6 presente na MA e componentes celulares, já foram relatados como tendo propriedades imunorreguladoras8. Assim, uma terapia combinada de lumicano e outros compostos da matriz extracelular e moléculas imunomoduladoras presentes no AME poderia ser útil no processo de reepitelização e cicatrização de feridas.
Este método visa demonstrar uma técnica simples para a extração de proteínas, útil para a obtenção de proteínas e fatores abundantes. Uma das considerações críticas para esse método é o uso de inibidores de protease, pois é fundamental para o sucesso da extração proteica, pois o AM é um tecido com cargas de compostos enzimáticos para prevenir a degradação proteica27. Evidências têm relatado que o uso de inibidores proteicos em conjunto com uma solução aquosa aumenta a extração de outros fatores, como o HGF, no tecido MA26. A obtenção de um pó fino após o congelamento e aterramento do AM é necessária para a obtenção ideal de EMA, pois esse processo é adequado para ruptura tecidual e celular de estruturas necessárias para a extração de compostos citosólicos e outros compostos nucleares28,29.
Algumas limitações deste método de extração são que a quantidade de AM utilizada não poderia permitir uma extração em alta escala. Este protocolo permite a extração de proteínas de uma quantidade limitada de tecido; uma vez que não há evidências de que este método permita obter uma maior quantidade de proteína de uma área tecidual maior. A solução de problemas a ser considerada em comparação com outros métodos de extração é usar uma concentração adequada de inibidor de protease e tempo de incubação, pois o excesso de enzimas pode afetar as proteínas30 e reduzir a eficácia da técnica.
Parte dessa técnica foi modificada a partir da relatada por Mahbod et al.16, que descreve que a repetição do processo de centrifugação e extração aumenta a extração de proteínas. Ao contrário de Mahbod, os resultados não relataram concentração de proteína após três ciclos de centrifugação. Quando a concentração de proteína total foi determinada, ela diminuiu em 80% em uma segunda extração e até 97% em uma terceira extração. Realizar apenas uma extração reduz o tempo de processamento e não diminui a quantidade de proteína total. Com o anterior, o método de extração aqui relatado requer apenas uma etapa de centrifugação com resultados favoráveis.
Esta técnica poderia ser usada para extrair outros fatores e proteínas presentes na MA e, além disso, para obter fatores de outras fontes, como animais ou vegetais. Também poderia ter uma aplicação para obtenção de proteínas para realização de pesquisa básica ou mesmo o desenvolvimento de formulações e tratamentos.
Estes resultados sugerem que o lumicano pode ser extraído de AM e armazenado por 12 dias como AME sob condições de temperatura de -20 °C e 4 °C. É importante considerar sua meia-vida para alcançar os efeitos terapêuticos do lumicano como AME. Mais estudos são necessários para determinar o papel do AME lumicano em células epiteliais corneanas e para determinar a dose ideal de lumicano para reepitelização corneana.
Em conclusão, os resultados sugerem que a obtenção de fatores como o lumicano no EMA é possível. Da mesma forma, as condições de temperatura e tempo de armazenamento influenciam a concentração de lumicano presente no EMA.
Divulgações
O estudo foi financiado pelo Programa de Apoio a Projetos de Pesquisa e Inovação Tecnológica da Universidad Nacional Autonoma de Mexico (Grant No. PAPIIT IN203821) e pelo Ministério da Educação, Ciência, Tecnologia e Inovação (Grant No. SECTEI 250/2019).
Agradecimentos
Os autores não têm interesses financeiros concorrentes.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
Referências
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados