Method Article
Extraction de lumican à partir d’une membrane amniotique et détermination de sa température de stockage
Dans cet article
Résumé
Le présent protocole décrit l’extraction du lumican de la membrane amniotique (AM) et leurs conditions de stockage sous forme d’extrait de MA (AME) à -20 °C, 4 °C et à température ambiante (RT) pendant 6, 12, 20 et 32 jours pour quantifier ses protéines et sa concentration en lumicane.
Résumé
Lumican est un petit protéoglycane riche en leucine dans la membrane amniotique humaine (AM) qui favorise l’épithélialisation cornéenne et l’organisation des fibres de collagène, en maintenant la transparence cornéenne. Dans le présent travail, une méthode d’extraction de protéines de la FA pour obtenir du lumican est proposée. De plus, la stabilité du lumican dans l’extrait AM (AME) stocké à différentes températures et périodes est évaluée. 100 mg de MA ont été décongelés et déépithélialisés mécaniquement. La MA désépithélialisée a été congelée et broyée jusqu’à l’obtention d’une poudre fine, qui a été solubilisée avec 2,5 mL de tampon saline avec des inhibiteurs de protéase et centrifugée pour l’extraction des protéines. Le surnageant a été recueilli et conservé à -20 °C, 4 °C et à température ambiante (RT) pendant 6, 12, 20 et 32 jours. Par la suite, le lumican a été quantifié dans chaque TEA. Cette technique permet un protocole accessible et acquis pour l’extraction du lumican à partir de la FA. La concentration de lumican a été affectée par le temps de stockage et les conditions de température. Le Lumican dans le TEA de 12 jours stocké à -20 °C et 4 °C était significativement plus élevé que les autres TEA. Cette extraction de lumican pourrait être utile pour développer des traitements et des solutions pharmaceutiques. D’autres études sont nécessaires pour déterminer les utilisations du lumican AME dans la réépithélialisation et le processus de cicatrisation.
Introduction
L’un des traitements les plus utilisés pour les affections cornéennes est la greffe de membrane amniotique; Cependant, au cours des dernières années, de nouvelles propositions ont émergé pour l’utilisation de divers composants du tissu amniotique comme traitements alternatifs et adjuvants. Parmi les composants les plus étudiés de la FA figurent ceux obtenus à partir de l’extrait d’AM (AME)1,2,3,4,5,6,7. La MA contient de multiples facteurs solubles tels que des protéines antiangiogéniques, des interleukines (IL), des inhibiteurs tissulaires des métalloprotéinases (TIMPs), des protéines anti-inflammatoires médiées par TSG-6 qui inhibent les pièges extracellulaires des neutrophiles, des facteurs de croissance: facteur de croissance épidermique (EGF), facteur de croissance transformant (TGF) (alpha et bêta), facteur de croissance kératinocytaire (KGF), facteur de croissance hépatocytes (HGF) et lumican, qui maintient la transparence cornéenne en régulant la fibrillogenèse du collagène1, 2,3,4,5,6,7,8,9.
Le lumican est un petit protéoglycane riche en leucine (SLRP), l’un des principaux composants extracellulaires de la collagénase interstitielle dans la matrice du stroma cornéen, responsable de l’organisation des fibres de collagène et du maintien de la transparence cornéenne 4,10,11. Les protéoglycanes sont des molécules de la matrice extracellulaire (MEC), qui sont les principales dans la réalisation de la signalisation cellulaire et le maintien de l’homéostasie intracellulaire12. Il a été rapporté que les protéines ECM conduisent les processus cellulaires de prolifération, de différenciation et de migration pendant la cicatrisation des plaies11.
Les preuves indiquent la participation possible du lumican dans le processus de réépithélialisation cornéenne. Saika et al., dans une étude, ont montré qu’après une lésion cornéenne, le lumican pouvait être détecté dans les kératocytes cornéens entre les 8 premières heures et jusqu’à 3 jours après la blessure. Présentant la plus forte concentration de lumican le deuxième et le troisième jour, ce protéoglycane est par la suite indétectable le septième jour13. Ces données suggèrent la participation du lumican dans l’activation du processus de réépithélialisation cornéenne. D’autre part, dans une autre étude, il a été rapporté que l’absence de lumican retarde la réépithélialisation; Fait intéressant, l’ajout de Lumican pourrait accélérer le processus de réépithélialisation 4,11,13. De même, une étude récente a rapporté que le lumican peut moduler les fonctions inflammatoires des fibroblastes du limbe cornéen14, ce qui suggère un rôle pour le lumican en tant que modulateur de la réponse inflammatoire, antifibrotique et ré-épithélialisante. De même, le lumican peut moduler la réponse cornéenne en interagissant avec des molécules de signalisation telles que Fas-FasL. De plus, l’absence de lumican dans un modèle Lum-/- souris knockout a démontré que l’absence de signalisation lumican empêche une réparation cornéenne adéquate15.
Principalement, cette méthode vise à démontrer un moyen réalisable et accessible d’extraire le lumican de la FA. Avec cette méthode avantageuse d’extraction du lumican, il est possible d’obtenir des concentrations similaires de protéines, ce qui diminue le temps de traitement et le rend plus pratique pour les chercheurs par rapport aux études précédentes16. De plus, ce lumican AME pourrait être utilisé comme adjuvant pour les processus de réparation et de réépithélialisation de la cornée.
Protocole
Toutes les procédures expérimentales ont été approuvées par le Comité d’examen institutionnel (projet n° CEI-2020/06/04). La MG a été obtenue auprès de la banque d’amnions de l’Instituto de Oftalmologia Conde de Valenciana (à partir de sujets humains déidentifiés), qui est préparée comme décrit par Chávez-García et al.17.
1. Préparation de l’extrait membranaire amniotique
- Obtenez 100 mg d’AM de la banque d’amnions.
NOTE: Selon un rapport précédent, 50 mg de AM sécrètent un total de 10 ng / mL de lumican14. Pour obtenir une concentration plus élevée de lumicane, utiliser 100 mg d’AM, équivalent à une surface totale de 32cm2. - Si le AM est congelé, décongelez-le à température ambiante.
REMARQUE : Effectuez les procédures suivantes sous une hotte à flux laminaire de classe II B. - Laver le MA dans une boîte de Petri avec 10 ml de solution saline équilibrée stérile (BSS, voir le tableau des matières) pendant 2 min.
- Versez le BSS dans un bécher.
- Répétez l’étape 3 et confirmez visuellement que le milieu glycérol n’est pas présent dans la boîte de Petri BSS.
Remarque : Répétez l’étape 3. au besoin jusqu’à ce que le milieu glycérol ne soit pas présent dans la boîte de Petri BSS.
- Incuber le MA avec 10 mL de dispase II (1,7 UI/mL, voir le tableau des matières) à 37 °C, 5% de CO2 pendant 30 min.
REMARQUE: Dispase II est une protéase neutre avec une activité douce sur les cellules épithéliales. Cette enzyme sépare efficacement l’épiderme intact du derme et isole les feuillets épithéliaux intacts18. - Après l’incubation de la dispase, effectuer une désépithélialisation mécanique14 avec un policier en caoutchouc (voir Tableau des matériaux). Confirmer la désépithélialisation par visualisation microscopique.
NOTE: Le processus de désépithélisation est corroboré dans un microscope inversé utilisant des objectifs 4x et 20x. Visualisez le tissu pour exclure la présence de toute couche cellulaire. - Laver le AM dans une boîte de Petri avec 10 ml de BSS pendant 2 min. Versez le BSS dans un bécher.
- Placez la FA désépithélialisée (dAM) dans un tube microcentrifuge de 2 mL. Plongez le dAM dans de l’azote liquide pendant 40 min.
- Broyer manuellement le dAM congelé pendant 2-3 min dans un mortier prérefroidi à -85 °C jusqu’à obtention d’une poudre fine.
- Dans le mortier, solubiliser la poudre de dAM avec 2,5 mL de solution inhibitrice de protéase (BSS avec inhibiteurs de protéase).
REMARQUE : Chaque comprimé d’inhibiteur de la protéase est constitué du mélange d’enzymes suivant : extrait de pancréas (0,02 mg/mL), thermolysine (métalloprotéase) (0,0005 mg/mL), chymotrypsine (0,002 mg/mL), trypsine (0,02 mg/mL) et papaïne (0,33 mg/mL) (voir le tableau des matières). - Recueillir le mélange avec une micropipette et nettoyer les murs du mortier à l’aide d’un couteau à scalpel. Placer le mélange dans un tube de 5 mL.
- Bien mélanger avec le vortex pendant 30 s.
- Homogénéiser le mélange tissulaire par centrifugation à 34 x g pendant 20 min à 4 °C et centrifuger immédiatement à 3360 x g pendant 20 min à 4 °C.
- Le surnageant recueilli est le TEA (figure 1). Entreposer 0,7 mL de chaque TEA dans différents tubes microcentrifugeuses de 2 mL pendant 6, 12, 20 et 33 jours aux différentes conditions de température de -20 °C, 4 °C et température ambiante (RT).
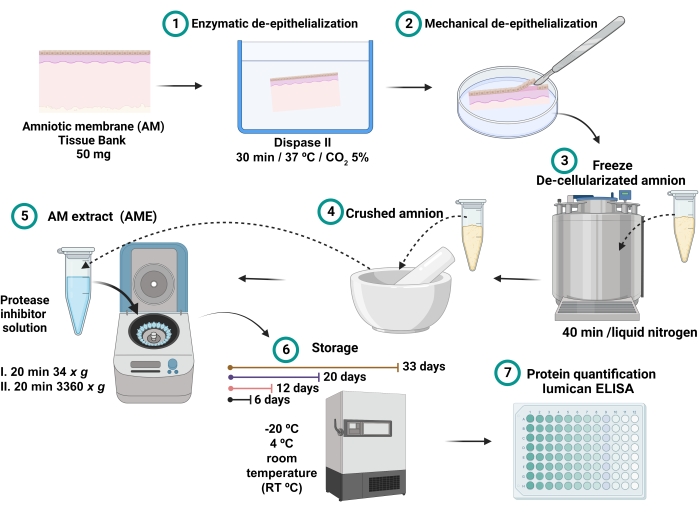
Figure 1 : Processus de préparation de la TEA et mesure de la concentration en lumican. 100 mg de MA ont été incubés avec la dispase II à 37 °C pendant 30 min et désépithélialisés mécaniquement. La FA dé-épithélialisée a été lavée et immergée dans de l’azote liquide pendant 40 minutes, puis broyée jusqu’à obtention d’une poudre fine, qui a été solubilisée avec 2,5 mL de tampon saline avec des inhibiteurs de protéase et centrifugée. Le surnageant a été recueilli et conservé à -20 °C, 4 °C et RT pendant 6, 12, 20 et 32 jours jusqu’à la quantification totale des protéines et du lumican. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Quantification des protéines AME
NOTE: La quantification des protéines totales dans le TEA doit être effectuée immédiatement après l’obtention. Quantifier les protéines à l’aide du dosage des protéines de Lowry et suivre les instructions du fabricant (voir le tableau des matériaux). Il est recommandé que tous les étalons et échantillons soient analysés en trois exemplaires.
- Pipeter 40 μL de chaque échantillon de TEA dans une microplaque de 96 puits.
- Préparer une courbe étalon dans la même microplaque en utilisant l’étalon d’albumine sérique bovine (BSA) pour une concentration finale de BSA de 0 à 1 500 μg/mL (0, 1, 5, 25, 125, 250, 500, 750, 1 000 et 1 500 μg/mL).
- Pipeter 200 μL du réactif Lowry modifié dans chaque puits. Mélangez-le immédiatement sur un batteur à plaques pendant 30 s.
- Couvrir la microplaque de papier d’aluminium et l’incuber à TA pendant 10 min.
- Pipeter 20 μL de 1x réactif Folin-Ciocalteu à chaque puits. Mélangez-le immédiatement sur un batteur à plaques pendant 30 s.
NOTE: Pour préparer 1x réactif Folin-Ciocalteu, diluer 2x (2N) réactif 1:1 avec de l’eau ultrapure. Préparer 1x réactif Folin-Ciocalteu le jour même d’utilisation car le réactif dilué est instable. - Couvrir la microplaque de la lumière avec du papier d’aluminium et l’incuber à TA pendant 30 min.
- Mesurer l’absorbance des échantillons à 660 nm dans un spectromètre à plaques ELISA (voir Tableau des matériaux).
REMARQUE: La couleur peut être mesurée à des longueurs d’onde comprises entre 650 nm et 750 nm. - Faire la moyenne de la valeur d’absorbance de 660 nm des échantillons blancs étalons et la soustraire des autres valeurs de 660 nm des échantillons standard et inconnus.
- Mesurer l’absorbance à l’aide d’un spectromètre à plaques ELISA en mode point final avec une faible secousse pendant 10 s.
- Utilisez la courbe standard pour déterminer la concentration en protéines de chaque échantillon inconnu.
- Pour le calcul de la protéine, déterminer la concentration à partir d’un graphique de régression linéaire en utilisant les valeurs d’absorbance sur l’axe des Y par rapport aux concentrations en mg/mL sur l’axe X de chaque courbe BSA standard.
- Obtenez l’équation de régression linéaire et la valeur r pour calculer la concentration en protéines.
REMARQUE : Les résultats sont exprimés sous forme de valeurs de concentration relative normalisées de protéines totales par rapport à mg d’AM (μg/mL de protéines/mg de tissu AM).
- Obtenez l’équation de régression linéaire et la valeur r pour calculer la concentration en protéines.
3. Quantification du Lumican dans le TEA
NOTA : La concentration de lumican doit être mesurée dans le TEA entreposé dans différentes conditions et périodes d’entreposage. Quantifier le lumican à l’aide d’un test ELISA sandwich et suivre les instructions du fabricant. Il est recommandé que tous les étalons et échantillons soient analysés en double.
- Diluer l’anticorps de capture de lumican humain (voir le tableau des matériaux) à la concentration employée dans une solution saline tamponnée au phosphate (PBS).
REMARQUE : Le flacon d’anticorps de capture contient 120 μg d’anticorps. Après reconstitution avec 0,5 mL de PBS, diluer l’anticorps de capture à une solution de travail de 2 μg/mL.- Pipeter instantanément 100 μL par puits de l’anticorps de capture dilué sur une microplaque de 96 puits. Enfermez l’assiette et incuberez-la pendant la nuit chez RT.
- Aspirer chaque puits et le laver par pipetage avec 300 μL de tampon de lavage : monolaurate de polyoxyéthylène sorbitan à 0,05 % 20 dans du PBS, pH 7,2-7,4 (voir le tableau des matériaux) à l’aide d’un pipeteur multicanal. Répétez trois fois.
REMARQUE: Après le dernier lavage, retirez tout tampon de lavage restant en éversant la plaque et tapotez-la doucement contre les serviettes en papier. - Bloquer les plaques en ajoutant 300 μL de diluant réactif : 1 % de BSA dans PBS, pH 7,2-7,4, 0,2 μm filtré (voir le tableau des matériaux) à chaque puits. Incuber à TA pendant 1 h.
- Répétez l’étape 2.
- Préparer une courbe étalon dans une microplaque à 96 puits en utilisant des dilutions en série doubles de 0 à 8 000 pg/mL pour des concentrations finales de 125, 250, 500, 1 000, 2 000, 4 000 et 8 000 pg/mL. Le kit lumican ELISA contient un lumican recombinant standard de 75 ng (voir le tableau des matériaux).
- Ajouter 100 μL d’échantillons et la courbe standard dans la microplaque à 96 puits revêtue d’anticorps de capture.
- Couvrir la microplaque et incuber pendant 2 h à TA avec une faible agitation dans une bascule compacte en maintenant la vitesse entre 2-3 tr / min.
- Répétez l’étape 2.
- Ajouter 100 μL de l’anticorps de détection biotinylé (voir le tableau des matériaux) à chaque puits. Couvrir de la lumière et incuber 2 h à TA avec une faible agitation dans une bascule compacte en maintenant la vitesse entre 2-3 tr / min.
REMARQUE : Le flacon d’anticorps de détection biotinylée contient 24 μg d’anticorps. Après reconstitution avec 1,0 mL de diluant réactif, diluer l’anticorps de détection biotinylé à une solution de travail de 400 ng/mL. - Répétez l’étape 2.
- Ajouter 100 μL de la dilution de travail de la streptavidine-peroxydase de raifort (HRP, voir le tableau des matières) à chaque puits. Couvrir la microplaque de la lumière et incuber pendant 20 min à TA.
REMARQUE: La streptavidine-HRP réactive était concentrée 40 fois. La solution de travail 1x de streptavidine-HRP a été faite avec un diluant réactif.
REMARQUE: Évitez de placer la plaque à la lumière directe. - Répétez l’étape 2.
- Enfin, ajouter 100 μL de solution de tétraméthylbenzidine (TMB, voir le tableau des matériaux) dans chaque puits.
NOTE: Préparer la solution TMB avec un volume égal de solution de peroxyde d’hydrogène stabilisé à 30% fournie dans le kit.
NOTE: Préparer la solution immédiatement avant utilisation et la maintenir à température ambiante. - Incuber pendant 30 min à RT dans un endroit sombre.
REMARQUE: Évitez de placer la plaque à la lumière directe. N’aspirez pas la solution TMB car aucun lavage supplémentaire n’est nécessaire. - Ajouter 50 μL de solution d’arrêt 1N H2SO4 pour arrêter la réaction colorimétrique. Tapotez doucement la plaque pour assurer un mélange complet.
- Déterminer immédiatement l’absorbance de chaque puits à l’aide d’un lecteur de microplaques réglé à 450 nm dans un spectromètre à plaques ELISA.
- Mesurer l’absorbance à l’aide d’un spectromètre à plaques ELISA en mode point final avec une faible secousse pendant 10 s.
- Faire la moyenne de la valeur d’absorbance de 450 nm des échantillons blancs étalons et la soustraire des autres valeurs de 450 nm des échantillons standard et inconnus.
- Utilisez la courbe étalon pour déterminer la concentration en lumicane de chaque échantillon inconnu.
- Pour le calcul de la concentration de lumicane, faire un graphique de régression linéaire en utilisant les valeurs d’absorbance sur l’axe des Y par rapport aux concentrations en pg/mL sur l’axe X de chaque courbe lumican standard.
- Obtenez l’équation de régression linéaire et la valeur r pour calculer la concentration en lumicane.
REMARQUE : La concentration de lumican a été normalisée par rapport au mg de tissu extrait. Les résultats sont exprimés sous forme de valeurs de concentration relative normalisées de lumican en mg AM (ng/mL de lumican/mg de tissu AM).
- Obtenez l’équation de régression linéaire et la valeur r pour calculer la concentration en lumicane.
Résultats
Les résultats sont présentés sous forme de valeur moyenne ±écart-type (ET). Les tests t de Student et l’analyse de la variance (ANOVA) ont été effectués. Les valeurs de p < 0,05 ont été considérées comme statistiquement significatives. L’analyse statistique a été effectuée à l’aide d’un logiciel de statistiques (voir le tableau des matières).
La quantité totale de protéines dans le TEA a été influencée par le temps et les conditions d’entreposage. La concentration de protéines basales était similaire parmi tous les TEA; la gamme de protéines totales était de 2,7 ± 0,3 μg/mL sans différence significative entre les échantillons évalués. Cependant, lorsque les échantillons ont été stockés pendant 12, 20 et 32 jours, une variabilité de la concentration de protéines par rapport à la concentration basale a été observée. Fait intéressant, la concentration de protéines a augmenté dans le TEA à 4 °C et -20 °C par rapport au RT à tout moment de stockage.
De même, lorsque la concentration en protéines a été comparée entre les temps de stockage, elle a changé après 12, 20 et 32 jours. Une différence significative (p < 0,05) a été observée dans la TEA de 32 et 20 jours à 4 °C et -20 °C par rapport à la condition RT (Figure 2), ce qui suggère que la température est importante pour la conservation des protéines dans les différents TEA obtenus.

Figure 2 : Concentration totale de protéines dans la TEA affectée par le temps et la température d’entreposage. La concentration d’extraction de protéines sur AME a été quantifiée avant et après les conditions de température et de stockage dans le temps. Le temps de stockage évalué était de 6 jours (triangles noirs), 12 jours (triangles roses), 20 jours (carré violet) et 32 jours (cercles bruns) par rapport à trois conditions de température différentes (RT °C, 4 °C et -20 °C). La concentration de protéines basales était similaire parmi tous les TEA. Il y avait une différence significative dans la concentration de protéines dans le TEA de 20 et 32 jours par rapport à la concentration de protéines basales dans différentes conditions de température. Dans chaque condition, n = 3. Les données sont exprimées en médiane de μg/mL de protéines ± SE *p < 0,05 (S1 32 jours vs S1 20, 12 et 6 jours à 4 °C); (S1 32 jours contre S1 20, 12 et 6 jours à -20 °C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
La concentration de lumican a été affectée par le temps de stockage et les conditions de température. Moins de concentration de lumican a été trouvée dans le TEA stocké pendant 6, 20 et 32 jours, comparativement à 12 jours d’entreposage. Fait significatif, la TEA de 12 jours avait une concentration de lumican plus élevée que 20 et 32 jours de stockage (p < 0,05).
Lorsque la concentration de lumican dans le TEA a été comparée entre les températures d’entreposage, une concentration plus élevée de lumican a été trouvée si elle était conservée à -20 °C et à 4 °C pendant 12 jours (figure 3). Fait intéressant, une concentration encore plus élevée (p < 0,05) de lumican a été trouvée dans le TEA de 12 jours s’il était stocké à -20 °C par rapport à 4 °C.
Cela suggère que la concentration de lumican est affectée par les conditions de température et le temps de stockage, ce qui suggère que le temps et la température de stockage appropriés pour atteindre la concentration la plus élevée de lumican sont de 12 jours à -20 ° C.
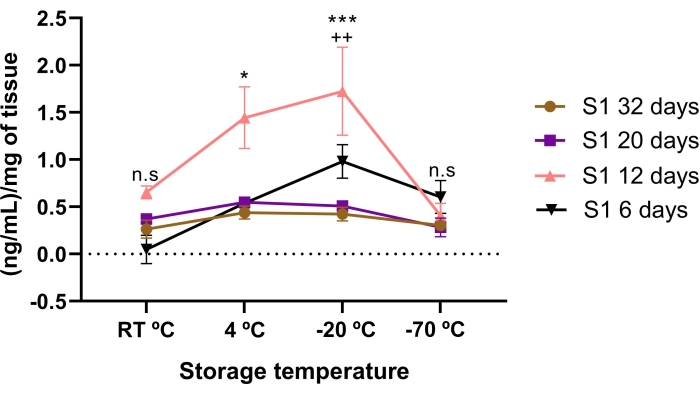
Figure 3 : Concentration totale de lumican dans la TEA affectée par le temps et la température de stockage. La concentration de lumican a été affectée par le temps de stockage et les conditions de température. La concentration de lumican dans le TEA a été quantifiée avant et après les conditions de température et de stockage de temps. Le temps de stockage évalué était de 6 jours (triangles noirs), 12 jours (triangles roses), 20 jours (carré violet) et 32 jours (cercles bruns) par rapport à trois conditions de température différentes (RT °C, 4 °C et -20 °C). Le lumican dans le TEA de 12 jours était significativement plus élevé que le TEA de 32, 20 et 6 jours, à des conditions de température de -20 °C et 4 °C. *p < 0,05 (S1 12 jours vs S1 32, 20 et 6 jours à 4 °C); p < 0,001 (S1 12 jours vs S1 32, 20 et 6 jours à -20°C). La concentration la plus élevée de lumican dans le TEA était stockée à 12 jours à -20 °C. ++p < 0,01 (S1 12 jours 4 °C vs S1 12 jours -20 °C). Il n’y avait pas de différence significative entre le lumican dans le TEA de 32 et 20 jours par rapport aux conditions de température d’entreposage (n.s.). Dans chaque condition (n = 3), les données sont exprimées en tant que médiane de ng/mL de protéines. Les données ont été normalisées en ce qui concerne le mg de tissu ± SE. (n.s.) et non la signification statistique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cette étude, la présence de lumican a été analysée dans le TEA et sa corrélation directe avec sa stabilité dans différentes conditions de stockage. Fait intéressant, lorsque la concentration totale de protéines dans la TEA a été quantifiée, la concentration de protéines a augmenté après le stockage. Les preuves suggèrent trois mécanismes qui pourraient modifier la concentration de protéines dans l’entreposage congelé : la dénaturation à froid, la concentration congelée de solutés et le déploiement partiel de la structure des protéines induit par la glace19. Le processus de congélation pourrait affecter la concentration de protéines sur les échantillons de stockage en raison de la cristallisation de la phase liquide dans l’échantillon. Les résultats suggèrent que cela pourrait s’être produit comme un processus de congélation de la concentration, affecté par le temps de stockage dans le congélateur. Une concentration plus élevée de protéines a été observée à des périodes de stockage plus longues (32 et 20 jours) et aux températures les plus froides (4 °C et -20 °C). Cependant, la période avec la plus forte concentration de protéines n’avait pas la concentration la plus élevée de lumican; Cela suggère que le Lumican pourrait être affecté par les températures et les conditions de temps gelées.
Selon les résultats, la concentration de lumican était plus élevée et plus stable après 12 jours de stockage à 4 °C et -20 °C. Néanmoins, une concentration moindre de lumican a été trouvée à 6 jours par rapport à 12 jours. Certains rapports suggèrent que la concentration en protéines pourrait changer après des conditions d’entreposage congelées20. Les résultats pourraient être causés par un mécanisme thermodynamique appelé dépliage partiel de la structure des protéines induit par la glace, qui se produit lors de la congélation des échantillons. L’interaction des protéines avec l’eau dans les solutions aqueuses réduit leurs interactions avec d’autres molécules. Le processus de cristallisation de l’eau dans des conditions gelées permet aux protéines et à certaines régions fonctionnelles d’interagir avec d’autres molécules19. Par ce qui précède, après 12 jours de congélation du lumican dans une solution aqueuse, il pourrait être capable d’interagir avec les anticorps présents dans le kit de quantification ELISA pour aboutir à une concentration plus élevée. D’autre part, probablement le sixième jour, le lumican aurait pu être isolé dans la solution aqueuse.
Dans l’avancement des innovations, l’utilisation de la FA est le traitement de pointe pour la réépithélialisation cornéenne, quelle que soit son étiologie. Comme mentionné ci-dessus, les avantages de la FA sont vastes 21,22,23,24,25,26. De nombreux auteurs ont démontré les avantages du lumican dans l’AME, ce qui en fait une alternative abordable spécifiquement pour les pays en développement 1,2,3,4,5,6,7,8,9. Actuellement, il existe de nombreux avantages du lumican dans le TEA; Son utilisation comme traitement favorise la réépithélialisation cornéenne et améliore le pronostic des ulcères cornéens 4,5,6,7,8,9,10,11,12,13,14,15. La transplantation AM (AMT) est devenue un traitement avec de grands avantages pour améliorer divers troubles cornéens24,25. Cependant, il existe certaines affections chroniques du tissu cornéen, telles que des défauts épithéliaux persistants (DEP) et des déficiences en cellules souches limbiques (LESCD), qui nécessitent un traitement constant et le maintien de la présence de facteurs biologiques qui aident à la réparation de lacornée21,24. Actuellement, il n’existe aucun traitement adjuvant permettant le maintien à long terme des facteurs libérés par l’AMT sur la surface cornéenne. Cependant, un remplacement constant de l’AMT n’a pas pu être recommandé pour la sécurité des patients26. Pour cette raison, il est nécessaire de développer des alternatives qui permettent aux fonctions de l’AMT d’aider et aident à maintenir la présence de facteurs libérés par la FA dans le tissu cornéen tels que le lumican pendant une période plus longue, dans le but de favoriser le traitement des problèmes persistants de la cornée27.
Le lumican est l’un des facteurs présents dans la MA avec des fonctions anti-inflammatoires et antifibrotiques, qui a été rapporté pour avoir des fonctions dans le processus de réparation de la cornée 6,7,8,9,10,11,12,13,14,15 . C’est pourquoi le lumican suggère d’être un bon candidat pour aider à traiter les affections cornéennes; cependant, des recherches supplémentaires sont nécessaires pour déterminer l’efficacité du lumican dans la TEA pour obtenir une réépithélialisation cornéenne.
Le lumican est un protéoglycane dont il a été démontré qu’il régule la sécrétion de composés de la matrice extracellulaire sous forme de collagène; En outre, il est impliqué dans l’activation des fibroblastes et la modulation des cellules inflammatoires et le processus d’angiogenèse, ayant un rôle important dans la cicatrisation des plaies. Selon les résultats, le lumican peut être extrait du tissu AM. Les applications thérapeutiques du lumican sont nombreuses; l’utilisation du lumican dans la TEA permet une option thérapeutique réalisable pour les troubles oculaires 4,13. Le principal avantage de l’utilisation de l’AME est qu’elle offre une application facile comme traitement topique de la surface oculaire, compte tenu de sa composition aqueuse. De même, d’autres protéines ayant des caractéristiques anti-inflammatoires et immunorégulatrices peuvent être trouvées dans les composants extraits du tissu AM, ce qui pourrait présenter un plus grand avantage dans le traitement des problèmes de désépithélialisation de l’œil. Par exemple, d’autres facteurs anti-inflammatoires tels que le TSG-6 présent dans la FA et les composants cellulaires ont déjà été signalés comme ayant des propriétés immunorégulatrices8. Ainsi, une thérapie combinée de lumican et d’autres composés de la matrice extracellulaire et de molécules immunomodulatrices présentes dans la TEA pourrait être utile dans le processus de réépithélialisation et de cicatrisation.
Cette méthode vise à démontrer une technique simple d’extraction de protéines, utile pour l’obtention de protéines et de facteurs abondants. L’une des considérations critiques pour cette méthode est l’utilisation d’inhibiteurs de protéase, car elle est fondamentale pour une extraction réussie des protéines car la FA est un tissu avec des charges de composés enzymatiques pour empêcher la dégradation des protéines27. Des preuves ont rapporté que l’utilisation d’inhibiteurs de protéines avec une solution aqueuse augmente l’extraction d’autres facteurs, tels que HGF, dans le tissu AM26. L’obtention d’une poudre fine après congélation et mise à la terre de la FA est nécessaire pour l’obtention optimale de l’AME, car ce procédé convient à la perturbation tissulaire et cellulaire des structures nécessaires à l’extraction des composés cytosoliques et autres composés nucléaires28,29.
Quelques limites de cette méthode d’extraction sont que la quantité de FA utilisée ne pouvait pas permettre une extraction à grande échelle. Ce protocole permet l’extraction de protéines à partir d’une quantité limitée de tissu; puisqu’il n’y a aucune preuve que cette méthode permet d’obtenir une plus grande quantité de protéines à partir d’une plus grande zone tissulaire. Le dépannage à envisager par rapport à d’autres méthodes d’extraction consiste à utiliser une concentration appropriée d’inhibiteur de protéase et un temps d’incubation, car l’excès d’enzymes pourrait affecter les protéines30 et réduire l’efficacité de la technique.
Une partie de cette technique a été modifiée par rapport à celle rapportée par Mahbod et al.16, qui décrit que la répétition du processus de centrifugation et d’extraction augmente l’extraction des protéines. Contrairement à Mahbod, les résultats n’ont pas rapporté la concentration de protéines après trois cycles de centrifugation. Lorsque la concentration totale en protéines a été déterminée, elle a diminué de 80% dans une deuxième extraction et jusqu’à 97% dans une troisième extraction. Effectuer une seule extraction réduit le temps de traitement et ne diminue pas la quantité de protéines totales. Avec ce qui précède, la méthode d’extraction décrite ici ne nécessite qu’une seule étape de centrifugation avec des résultats favorables.
Cette technique pourrait être utilisée pour extraire d’autres facteurs et protéines présents dans la MA et en outre, pour obtenir des facteurs d’autres sources telles que des animaux ou des légumes. Il pourrait également avoir une application pour obtenir des protéines pour effectuer de la recherche fondamentale ou même le développement de formulations et de traitements.
Ces résultats suggèrent que le lumican peut être extrait de la FA et stocké pendant 12 jours sous forme de TEA dans des conditions de température de -20 °C et de 4 °C. Il est important de considérer sa demi-vie pour obtenir les effets thérapeutiques du lumican comme AME. D’autres études sont nécessaires pour déterminer le rôle du lumican AME dans les cellules épithéliales cornéennes et pour déterminer la dose idéale de lumican pour la réépithélialisation cornéenne.
En conclusion, les résultats suggèrent qu’il est possible d’obtenir des facteurs tels que le lumican dans le TEA. De même, les conditions de température et de temps de stockage influencent la concentration de lumican présent dans le TEA.
Déclarations de divulgation
L’étude a été financée par le Programme de soutien aux projets de recherche et d’innovation technologique de l’Universidad Nacional Autonoma de Mexico (subvention n° PAPIIT IN203821) et le ministère de l’Éducation, de la Science, de la Technologie et de l’Innovation (subvention n° SECTEI 250/2019).
Remerciements
Les auteurs n’ont pas d’intérêts financiers concurrents.
matériels
| Name | Company | Catalog Number | Comments |
| 1 N H2SO4 stop solution | R&D Systems | DY994 | |
| 100 μL micropipette | Eppendorf | ||
| 1000 μL micropipette | Eppendorf | ||
| 15 mm Petri dish | Symlaboratorios | ||
| 18 G Needle (1.2 mm x 40 mm) | BD Becton Dickinson | 305211 | |
| 2 mL microcentrifuge tube | Eppendorf | Z606340 | |
| 20 mL plastic syringe | BD Becton Dickinson | 302562 | |
| 20 μL micropipette | Eppendorf | ||
| 20-200 μL micropipette | Eppendorf | ||
| 5 mL microcentrifuge tube | Eppendorf | 30119401 | |
| 96-well microplate | SARSTEDT | 821581 | |
| Aluminum foil | N/A | N/A | |
| Amniotic membrane | Instituto de Oftalmologia Conde de Valenciana Amnion Bank | 100 mg | |
| Balanced salt solution | Bausch + Lomb | BSS-403802 | |
| Beaker | N/A | N/A | |
| BioRender | BioRender | figures design | |
| Compact Rocker | BioRad | 970822DD | Mod. 5202SD-BIO |
| complete, EDTA-free, Protease inhibitor cocktail tablets | Roche | 11 873 580 001 | Protease Inhibitor |
| Daiggner vortex Genie 2 | A.Daigger & Co. , INC | 22220A | |
| Dispase II | Gibco | 17105-041 | |
| ELISA plate spectrometer | Thermo Labsystems | 35401106 | Multiscan |
| Freezer | |||
| GraphPad Prism | GraphPad Software, Inc | version 9 | statistical analysis and graphic program |
| Human lumican DuoSet ELISA kit | R&D Systems | DY2846-05 | includes human Lumican capture antibody |
| Incubator | Forma Scientific | 3326 S/N 36481-7002 | |
| Inverted light Microscope | Olympus | 6A13921 | to confirm de-epithelialization Mod.CK2 |
| Laminar flow hood | Forma Scientific | 14753-567 | Mod.1184 |
| Liquid nitrogen | N/A | N/A | |
| Mortar | N/A | N/A | |
| Multi-channel pipettor | Eppendorf | ||
| Nitrogen Tank | Thermo Scientific | Mod. Biocan 20 | |
| Paper towels | N/A | N/A | |
| Phosphate-buffered saline | R&D Systems | DY006 | |
| Pierce Modified Lowry Protein Assay Kit | Thermo Scientific | 23240 | |
| Plate sealers | R&D Systems | DY992 | |
| Reagent diluent | R&D Systems | DY995 | 1% BSA in PBS, pH 7.2-7.4, 0.2 μm filtered |
| Refrigerated centrifuge | centurion scientific Ltd | 15877 | Mod. K2015R |
| Rubber policeman cell scraper | NEST | 710001 | for mechanical de-epithelialization |
| Scalpel knife | Braun | BB521 | No. 10 or 21 |
| Streptavidin-HRP 40-fold concentrated | R&D Systems | part 893975 | |
| Substrate tetramethylbenzidine (TMB) solution | R&D Systems | DY999 | |
| Toothed tweezers | Invent Germany | 6b | inox |
| Ultrapure water | PISA | ||
| Wash buffer | R&D Systems | WA126 | 0.05% Tween 20 in PBS, pH 7.2-7.4 |
Références
- Jirsova, K., Jones, G. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell and Tissue Banking. 18 (2), 193-204 (2017).
- Witherel, C., Yu, T., Concannon, M., Dampier, W., Spiller, K. Immunomodulatory effects of human cryopreserved viable amniotic membrane in a pro-inflammatory environment in vitro. Cellular and Molecular Bioengineering. 10 (5), 451-462 (2017).
- Ruiz-Cañada, C., et al. Amniotic membrane stimulates cell migration by modulating transforming growth factor-β signalling. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 808-820 (2017).
- Yeh, L., et al. Soluble lumican glycoprotein purified from human amniotic membrane promotes corneal epithelial wound healing. Investigative Opthalmology & Visual Science. 46 (2), 479(2005).
- Navas, A., et al. Anti-Inflammatory and anti-fibrotic effects of human amniotic membrane mesenchymal stem cells and their potential in corneal repair. Stem Cells Translational Medicine. 7 (12), 906-917 (2018).
- Magaña-Guerrero, F., Domínguez-López, A., Martínez-Aboytes, P., Buentello-Volante, B., Garfias, Y. Human amniotic membrane mesenchymal stem cells inhibit neutrophil extracellular traps through TSG-6. Scientific Reports. 7, 12426(2017).
- Garfias, Y., Zaga-Clavellina, V., Vadillo-Ortega, F., Osorio, M., Jimenez-Martinez, M. Amniotic membrane is an immunosuppressor of peripheral blood mononuclear cells. Immunological Investigations. 40 (2), 183-196 (2010).
- Koob, T., et al. Biological properties of dehydrated human amnion/chorion composite graft: implications for chronic wound healing. International Wound Journal. 10 (5), 493-500 (2013).
- Miyagi, H., Thomasy, S., Russell, P., Murphy, C. The role of hepatocyte growth factor in corneal wound healing. Experimental Eye Research. 166, 49-55 (2018).
- Chen, S., Mienaltowski, M., Birk, D. Regulation of corneal stroma extracellular matrix assembly. Experimental Eye Research. 133, 69-80 (2015).
- Karamanou, K., Perrot, G., Maquart, F., Brézillon, S. Lumican as a multivalent effector in wound healing. Advanced Drug Delivery Reviews. 129, 344-351 (2018).
- Theocharis, A., et al. Cell-matrix interactions: focus on proteoglycan-proteinase interplay and pharmacological targeting in cancer. FEBS Journal. 281 (22), 5023-5042 (2014).
- Saika, S., et al. Role of lumican in the corneal epithelium during wound healing. Journal of Biological Chemistry. 275 (4), 2607-2612 (2000).
- Domínguez-López, A., et al. Amniotic membrane conditioned medium (AMCM) reduces inflammatory response on human limbal myofibroblast, and the potential role of lumican. Molecular Vision. 27, 370-383 (2021).
- Vij, N., Roberts, L., Joyce, S., Chakravarti, S. Lumican regulates corneal inflammatory responses by modulating Fas-Fas Ligand signaling. Investigative Opthalmology & Visual Science. 46 (1), 88(2005).
- Mahbod, M., et al. Amniotic membrane extract preparation: What is the best method. Journal of Ophthalmic and Vision Research. 9 (3), 314-319 (2014).
- Chávez-García, C., et al. Ophthalmic indications of amniotic membrane transplantation in Mexico: an eight years Amniotic Membrane Bank experience. Cell and Tissue Banking. 17 (2), 261-268 (2015).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Bhatnagar, B. S., Bogner, R. H., Pikal, M. J. Protein stability during freezing: separation of stresses and mechanisms of protein stabilization. Pharmaceutical Development and Technology. 12 (5), 505-523 (2007).
- McClain, A. K., McCarrel, T. M. The effect of four different freezing conditions and time in frozen storage on the concentration of commonly measured growth factors and enzymes in equine platelet-rich plasma over six months. BMC Veterinary Research. 15 (1), 292(2019).
- Tamhane, A., et al. Evaluation of amniotic membrane transplantation as an adjunct to medical therapy as compared with medical therapy alone in acute ocular burns. Ophthalmology. 112 (11), 1963-1969 (2005).
- Shtein, R., et al. Autologous serum-based eye drops for treatment of ocular surface disease. Ophthalmology. 127 (1), 128-133 (2020).
- Shahriari, H., Tokhmehchi, F., Reza, M., Hashemi, N. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model. Cornea. 27 (10), 1148-1150 (2008).
- Schuerch, K., Baeriswyl, A., Frueh, B., Tappeiner, C. Efficacy of amniotic membrane transplantation for the treatment of corneal ulcers. Cornea. 39 (4), 479-483 (2019).
- Chen, H., et al. Amniotic membrane transplantation for persistent corneal ulcers and perforations in acute fungal keratitis. Cornea. 25 (5), 564-572 (2006).
- Guo, Q., et al. A comparison of the effectiveness between amniotic membrane homogenate and transplanted amniotic membrane in healing corneal damage in a rabbit model. Acta Ophthalmologica. 89 (4), 315-319 (2011).
- Sabater, A., Perez, V. Amniotic membrane use for management of corneal limbal stem cell deficiency. Current Opinion in Ophthalmology. 28 (4), 363-369 (2017).
- Ahmad, T., et al. Autolysis of bovine skin, its endogenous proteases, protease inhibitors and their effects on quality characteristics of extracted gelatin. Food Chemistry. 265, 1-8 (2018).
- Mullegama, S. V., et al. Nucleic acid extraction from human biological samples. Methods in Molecular Biology. 1897, 359-383 (2019).
- Skog, M., et al. The effect of enzymatic digestion on cultured epithelial autografts. Cell Transplantation. 28 (5), 638-644 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon