Method Article
3D baskılı damga benzeri bir cihaz aracılığıyla doku sferoidlerinin üretilmesi
Bu Makalede
Özet
Mevcut protokol, 3D baskılı damga benzeri bir cihaz kullanarak uygun maliyetli bir şekilde büyük ölçekte doku sferoidleri üretmek için bir tekniği açıklamaktadır.
Özet
3D hücre kültüründeki ilerlemeler, doku sferoidleri gibi fizyolojik olarak daha ilgili in vitro modeller geliştirmiştir. Sferoid olarak yetiştirilen hücreler, in vivo ortama benzeyen daha gerçekçi biyolojik tepkilere sahiptir. Avantajları nedeniyle, doku sferoidleri, geniş bir biyoteknolojik uygulanabilirlik yelpazesine sahip üstün, daha güvenilir ve daha öngörücü çalışma modellerine doğru yükselen bir eğilimi temsil etmektedir. Bununla birlikte, doku sferoidlerinin büyük ölçekli üretimini sağlayabilen tekrarlanabilir platformlar, potansiyellerini tam olarak keşfetmek ve artırmak için karşılanmamış bir ihtiyaç haline gelmiştir. Burada, homojen doku sferoidlerinin büyük ölçekli üretimi, düşük maliyetli ve zaman açısından etkin bir metodoloji kullanılarak rapor edilmektedir. 6 oyuklu plaka başına 4.716'ya kadar sferoid üretmek için 3D baskılı damga benzeri bir cihaz geliştirilmiştir. Cihaz, fotokürlenebilir bir reçine kullanılarak stereolitografi yöntemiyle üretilir. Son cihaz, 1,3 mm yüksekliğe ve 650 μm genişliğe sahip silindirik mikro pimlerden oluşur. Bu yaklaşım, tek tip şekil ve boyuta ve %>95 hücre canlılığına sahip homojen sferoidlerin ve birlikte kültürlenmiş sferoidlerin hızlı bir şekilde üretilmesine izin verir. Ayrıca, damga benzeri cihaz, farklı boyutlardaki kuyu plakaları ve Petri kapları için ayarlanabilir. Kolayca sterilize edilir ve uzun süre tekrar kullanılabilir. Homojen doku sferoidlerinin verimli ve büyük ölçekli üretimi, doku mühendisliği, ilaç geliştirme, hastalık modelleme ve isteğe bağlı kişiselleştirilmiş tıp gibi birçok endüstri alanı için çevirilerinden yararlanmak için çok önemlidir.
Giriş
Doku sferoidleri, dış kuvvetler olmadan kendi kendine bir araya gelen hücre süspansiyonları tarafından oluşturulan 3 boyutlu mikro dokulardır1. Bu sferoidler, insan fizyolojik sisteminin temel özelliklerine benzerlikleri nedeniyle biyofabrikasyon protokollerinde yaygın olarak kullanılmaktadır 2,3. Doku sferoidleri, geleneksel tek katmanlı hücre kültüründen daha benzer metabolizma, hücre iskeleti dinamikleri, hücre canlılığı ve metabolik ve sekresyon aktivitesi sağlar1. Füzyon yetenekleri nedeniyle, gelişmiş biyolojik alaka düzeyine sahip karmaşık doku mühendisliği yapıları oluşturmak için yapı taşları (örneğin, biyo-baskı protokolleri) olarak da kullanılabilirler 4,5.
Biyolojik ilgileri nedeniyle, doku sferoidleri, doku mühendisliği, ilaç geliştirme, hastalık modelleme ve nanotoksikolojik değerlendirme gibi çeşitli protokoller için biyoteknolojik bir araç olarak kullanılmış, zaman, alan maliyetleri ve hayvan testlerini azaltmıştır 3,6,7,8. Bununla birlikte, doku sferoidlerinin potansiyelini tam olarak keşfetmek ve bunlardan yararlanmak için, büyük ölçekli üretimlerini hedefleyen güvenilir ve tekrarlanabilir yöntemler son derece gereklidir ve bunlar devam eden bir zorluk olmaya devam etmektedir.
Asılı damla, kaplanmış u şeklindeki dip kuyuları, mikroakışkanlar ve polimerik bir matris 9,10 kullanma gibi çeşitli metodolojiler sferoidler üretir. Bu metodolojiler küresel üretim pazarının yolunu açmış olsa da, hala karmaşık, zaman alıcı, emek yoğun veya pahalıdır10.
Mevcut protokol, düşük maliyetli ve zaman etkin bir metodoloji kullanarak homojen doku sferoidlerinin büyük ölçekli üretimini rapor etmektedir. 6 oyuklu plaka başına 4.716'ya kadar sferoid üretmek için 3D baskılı damga benzeri bir cihaz geliştirdik. Ayrıca, damga benzeri cihaz, farklı hücre kültürü plakaları için uygun, kuyu başına daha fazla sferoid üretecek şekilde uyarlanabilir. Kolayca sterilize edilebilir ve uzun süre tekrar kullanılabilir. Homojen doku sferoidlerinin verimli ve büyük ölçekli üretimi, kullanımlarını kliniklere çevirmek ve doku mühendisliği, ilaç geliştirme, hastalık modelleme ve isteğe bağlı kişiselleştirilmiş tıp gibi birçok endüstri alanına katkıda bulunmak için çok önemlidir.
Protokol
Bu çalışma için L929 hücre hattı, fare fibroblastları kullanıldı. Damga benzeri 3D baskılı biyocihaz, ticari bir kaynaktan elde edildi (bkz. Protokol boyunca iyi hücre kültürü uygulamaları ve steril teknikler izlendi. Üretilen cihaz %70'lik alkol ile silinerek ve 15 dakika boyunca UV ışığına maruz bırakılarak sterilize edildi. Hücre kültürü ortamı ve çözeltileri, hücreler veya doku sferoidleri ile temas etmeden önce 37 °C'ye ısıtıldı. Protokolün şematik bir gösterimi Şekil 1'de gösterilmiştir.
1. Damga benzeri cihazdan yapışmayan kalıpların hazırlanması
- Aşağıdaki adımları izleyerek% 2 (a / h) agaroz jeli hazırlayın.
- Agaroz tozunu fosfat tamponlu salin (1x PBS) içinde seyreltin ve elde edilen süspansiyonu dairesel hareketlerle homojenize edin.
NOT: Bu çözelti bir cam şişeye yerleştirilebilir. Bu adımda, agaroz çözeltisi yarı saydam olmayacaktır. - Cam şişeyi mikrodalgaya koyun ve 30 saniye bekletin. Her 5 saniyede bir mikrodalgayı durdurun, cam şişeyi çıkarın ve çözeltiyi dairesel hareketlerle manuel olarak homojenize edin. Isıtma işleminin, çözelti sıvı-berrak bir duruma ulaşana kadar gerçekleştirilmesi gerekir.
NOT: Mikrodalga alternatifi olarak bir sıcak plaka da kullanılabilir. Isıtma işleminden sonra çözelti yarı saydam/berrak olmalıdır. - Deney için planlanan 6 oyuklu bir plakanın her bir oyuğuna 1 mL agaroz çözeltisi ekleyin.
- ~ 15 dakika veya agaroz katılaşana kadar bekleyin.
NOT: Katılaşma süresini azaltmak için bir soğutma plakası kullanılabilir. - 1-2 mL agaroz solüsyonu ekleyin ve cihazı yavaşça sıvı agarozun üzerine yerleştirin.
NOT: Agaroz-cihaz arayüzünde hava kabarcıklarını önlemek için cihazın yerleşimi dikkatli bir şekilde yapılmalıdır. - ~ 30 dakika veya agaroz katılaşana kadar bekleyin.
NOT: Katılaşma süresini azaltmak için bir soğutma plakası kullanılabilir. - Cihazı agarozdan yavaşça çıkarın.
NOT: Kaldırma işlemi çok önemlidir. Agaroz özelliklerini sağlam tutmak için dikkatli bir şekilde çıkarılmalıdır; Aksi takdirde, agaroz bozulabilir. - 2 mL DMEM ortamı ekleyin, 10 dakika bekleyin, ortamı atın ve yeni DMEM ile değiştirin. İyiliği düzgün bir şekilde yıkamak için bunu üç kez tekrarlayın.
- 2 mL DMEM ekleyin ve 6 oyuklu plakayı hücre tohumlanana kadar bir inkübatöre (% 5 CO2 ve% 80 nemde 37 ° C'de) yerleştirin (Şekil 2A-F, Ek Video 1).
- Agaroz tozunu fosfat tamponlu salin (1x PBS) içinde seyreltin ve elde edilen süspansiyonu dairesel hareketlerle homojenize edin.
2. Doku sferoidlerinin oluşumu
NOT: Farklı hücre soyları farklı yapışma özelliklerine sahiptir. Bu nedenle, bu metodolojiyi kullanarak, bazı hücre türleri doku sferoidlerini düzgün bir şekilde oluşturmayabilir.
- Geleneksel tek tabakalı kültürü takiben hücreleri büyütün (yani, hücreleri% 10 fetal sığır serumu (FBS), 100 μg / mL penisilin ve 100 μg / mL streptomisin ile desteklenmiş düşük glikozlu DMEM kullanarak hücre kültürü şişelerinde büyütün) (bkz. Hücreleri %5'lik bir CO2 inkübatöründe 37 ° C'de tutun ve birleşme oranının %80'ine ulaşana kadar izleyin.
- İstenilen birleşmeye ulaştıktan sonra, hücreleri 1x PBS ile yıkayın.
NOT: 25 cm'lik2'lik mataralar için 5 mL, 75 cm'lik2'lik mataralar için 10 mL, 150 cm'lik2'lik mataralar için 15 mL kullanılması tavsiye edilir. - Ayrışma enzimini ekleyin ve hücreleri 37 ° C'de% 5 CO2 ve% 80 nemde 2-5 dakika inkübe edin.
NOT: Bu çalışmada ayrışma enzimi olarak 0.78 mM etilendiamin tetraasetik asit (EDTA) ile %0.125 tripsin kullanılmıştır (bkz. - Hücrelerin hücre kültürü şişelerinden ayrılmasını gözlemleyin ve hücre ayrışma enzimini nötralize etmek için FBS ile desteklenmiş bir büyüme ortamı ekleyin.
NOT: Bu çalışma için, düşük glukozlu DMEM ( Materyal Tablosuna bakınız)% 10 FBS ile desteklenmiş olarak kullanılmıştır. - Hücre süspansiyonunu oda sıcaklığında 5 dakika boyunca 400 x g'da santrifüjleyin. Ardından, hücreleri manuel olarak sayın.
- Tüp başına 50 x 105 hücre alın ve 5 mL 1x PBS ekleyin.
NOT: Ekilen hücre sayısı, nihai doku sferoid çapını etkiler. Bu nedenle, daha büyük çaplı doku sferoidleri oluşturmak için hücre sayısı artırılabilir. - Hücre süspansiyonunu oda sıcaklığında 5 dakika boyunca 400 x g'da santrifüjleyin.
- Bir pipet kullanarak süpernatanı çıkarın, 1 mL hücre kültürü ortamı ekleyin ve çözeltiyi homojenize edin.
NOT: Bu çalışmada, %10 FBS, 100 μg/mL penisilin ve 100 μg/mL streptomisin ile desteklenmiş, düşük glikozlu tam bir DMEM kültür ortamı kullanılmıştır. - 6 oyuklu plakadan (adım 1.1.9) 2 mL ortamı çıkarın ve 3D baskılı biyocihaz tarafından oluşturulan agaroz kalıbının merkezine 1 mL hücre süspansiyonu ekleyin (adım 1.1.7). Mikro rezeksiyonlarda hücreler çökelene kadar bekleyin (~ 20-30 dakika) ve kuyucuğa dikkatlice 1 mL hücre kültürü ortamı ekleyin.
NOT: Bu adımda ekstra dikkatli olmak gerekir. Ortamın nazikçe eklenmesi, pipet ucunun kuyu duvarına yakın yerleştirilmesi ve küçük miktarlarda dağıtılması önerilir. - Doku sferoidlerinin oluşması için 6 oyuklu plakayı inkübatöre (%5 CO2 ve %80 nemde 37 °C'de) yerleştirin (hücre tipine bağlı olarak yaklaşık 24-48 saat) (Şekil 3).
NOT: Farklı hücre tipleri (örneğin, kanser hücreleri, birincil hücreler) farklı kendi kendine montaj kinetiğine sahiptir11.
Sonuçlar
3D baskılı damga benzeri cihaz kullanılarak homojen mikro rezeksiyonların oluşturulması
3D baskılı damga benzeri cihaz, fotokürlenebilir bir reçine kullanılarak stereolitografi yöntemi12 ile başarıyla üretildi (Şekil 2A). Son cihaz, 1.3 mm yüksekliğinde ve 650 μm genişliğinde silindirik mikro pimlerden oluşuyordu (Şekil 2A). Yapışık olmayan mikro rezeksiyonlar üretmek için ana kalıp olarak kullanılması, geometrinin korunmasıyla sağlandı (Şekil 2B-F ve Ek Video 1). Cihazın kullanımı basitti, sterilize edilmesi kolaydı ve uzun vadede tekrar kullanılabilirdi. Ayrıca, farklı boyutlardaki kuyu plakaları (yani 6 kuyu, 12 kuyu, 24 kuyu, 96 kuyu) ve Petri kapları (yani 30 mm, 50 mm, 90 mm, 150 mm) için de ayarlanabilir. Burada, 6 oyuklu plaka için cihazla ilgili verileri gösteriyoruz. Kuyucuk başına 750 homojen mikro rezeksiyon veya 6 kuyu plakası başına 4.716 homojen mikro rezeksiyon üretti (Şekil 2C-D). Cihaz erken çekilirse yapışık olmayan kalıbın bozulması ve mikro rezeksiyon geometrisinin deformasyonu gibi dezavantajlar meydana gelebilir (Şekil 2G).
Doku sferoidlerinin büyük ölçekli üretimi
Hücreler, yapışmayan agaroz kalıpları üzerine ekildi, çökeltildi ve yaklaşık 24 saat sonra doku sferoidlerini oluşturdu. Sferoidlerin büyük ölçekli üretimi, şekillerini, boyutlarını (123 μm ± 3 μm) ve canlılıklarını koruyarak elde edildi (Şekil 3A-D). Bu metodoloji sferoid kültürünü aylarca destekledi (veriler gösterilmemiştir).
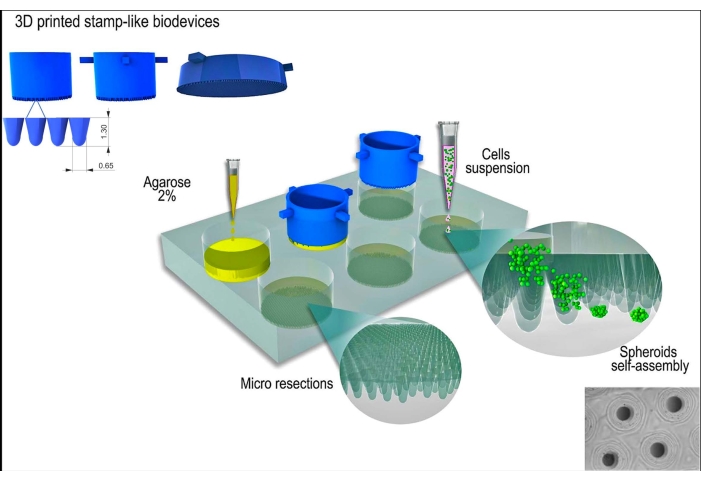
Şekil 1: Damga benzeri bir 3D baskılı biyocihaz kullanılarak doku sferoid üretiminin şematik gösterimi. Silindirik mikropinlerden oluşan biyocihaz, bir dizi üniform mikro rezeksiyon oluşturmak için yapışmayan bir hidrojeli (örneğin agaroz) kalıplar. Agarozun katılaşmasından ve hücre kültürü ortamı ile inkübasyon süresinden sonra (yeni yapışmayan kalıpları iklimlendirmek için), hücre süspansiyonu kalıpların üzerine ekilir ve hücreler toplanır, kendi kendine birleşir ve küresel bir şekle sıkıştırılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Yapışmayan mikro kalıplı agaroz oluşturmak için ana kalıp olarak kullanılan 3D baskılı damga benzeri cihaz. (A) 3D baskılı damga benzeri cihaz. (B) Mikro rezeksiyonları oluşturmak için cihazın sıvı agaroz içine yerleştirilmesi. (C-E) Cihazın çıkarılmasından sonra homojen rezeksiyonlar oluşur. (E) Ölçek çubuğu = 200 μm. (F) Hücre kültürü ortamı ile inkübasyondan sonra mikro kalıplanmış agaroz (pembe renk: hücre ortamı). (G) Tamamen katılaşmadığında cihazın agarozdan çıkarılması, bozulmasına yol açar (oklu sarı çizgi). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
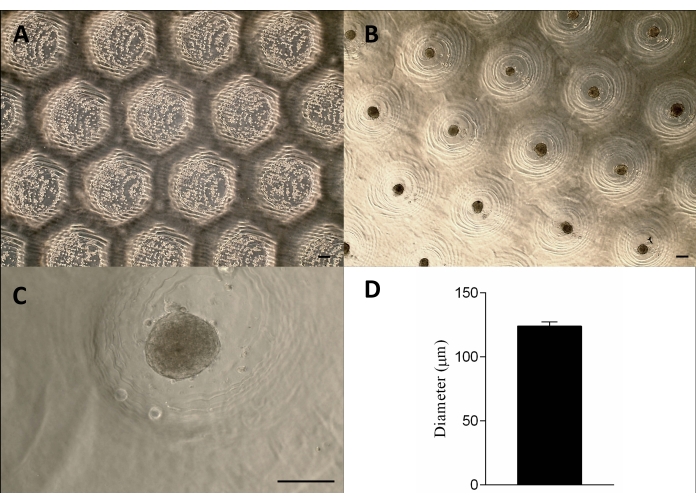
Şekil 3: Hücre tohumlaması ve sferoid oluşumu. Faz kontrast mikroskobu (A) mikro rezeksiyonlarda hücrelerin tohumlanmasından 0 saat sonra (rezeksiyonlar içindeki noktalar). (İ.Ö.) Sferoidler tohumlamadan yaklaşık 24 saat sonra oluştu. Ölçek çubuğu = 100 μm. (D) Kürelerin çapının grafik gösterimi, n = 4. Oluşan sferoidler şekil ve boyut olarak homojendir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Video 1: Damga benzeri cihazın çıkarılmasından sonra mikro kalıplanmış agaroz. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Mevcut protokol, doku sferoidlerinin büyük ölçekli üretimi için basit, hızlı ve ucuz bir yöntemi tanımlamaktadır. Ana kalıp olarak damga benzeri bir 3D baskılı cihaz kullanıldı ve bu da 6 oyuklu plaka başına 4.716'ya kadar sferoid üretti. Sferoid olarak yetiştirilen hücrelerin, in vivo ortama çok benzeyen daha gerçekçi biyolojik tepkilere sahip olduğu gösterilmiştir1. Avantajları nedeniyle, doku sferoidleri üstün, daha güvenilir ve daha öngörücü çalışma modellerine doğru yükselen bir eğilimi temsil etmektedir13,14. Bu nedenle, büyük ölçekli üretim elde etmek için yeni metodolojiler geliştirmek, uygulamalarından yararlanmak için çok önemlidir.
Bu metodolojiyi kullanarak doku sferoidlerinin oluşturulmasını başarılı bir şekilde başarmak için, cihazı sıvı agarozun içine yerleştirmek gibi kritik adımların, hava kabarcıklarını önlemek için dikkatli bir şekilde gerçekleştirilmesi gerekir. Hava kabarcıklarının varlığı mikro rezeksiyonların doğru kalıplanmasını bozabilir. Buna göre, agarozun tamamen katılaşmasından önce cihazın çıkarılması, agaroz kalıbının yırtılmasına neden olabilir. Bu adımlar, doku sferoid oluşumuna uygun agaroz kalıpları üretmek için gereklidir. Oluşturulan sferoid partisi için şekil ve boyut değişkenliğinin minimum düzeyde olması gerekir. Bu nedenle, deterministik noktalardan biri, hücreler agaroz kalıbına ekildikten sonra kültür ortamının yavaş yavaş eklenmesidir. Bu, mikro rezeksiyonlara zaten girmiş olan hücreleri rahatsız etmemek için sıvının nazikçe dağıtılmasını gerektirir. Aksi takdirde, bazı mikro rezeksiyonlar, sferoidler arasında boyut olarak heterojenliğe yol açacak şekilde artırılmış hücre konsantrasyonlarına sahip olabilir.
Basit, hızlı ve ucuz olmasının yanı sıra, bu protokol aynı zamanda esnektir (yani, deneyin özelliklerine göre ayarlamak için bazı değişiklikler yapmak mümkündür). Agaroza alternatif olarak, kalıpları oluşturmak için polidimetilsiloksan (PDMS) kullanılabilir. PDMS, mikroakışkan çipleri15 üretmek için yaygın olarak kullanılan bir elastomerdir. Biyouyumluluk, optik şeffaflık, kimyasal olarak inert olma, termal kararlılık ve gaz geçirgenliği gibi özelliklere sahiptir15. Agarozdan farklı olarak, PDMS ile yapılan kalıplar daha dirençlidir ve mikro rezeksiyon geometrisi korunarak tekrar kullanılabilir.
Şu anda, alternatif bir serumsuz hücre kültürü ortamı arayışı dünya çapında artmıştır16,17. FBS, hücre kültürü için geleneksel bir takviye olmasına rağmen, kullanımının etik sorunları ve olası parti değişkenliği vardır. Bununla birlikte, sferoidlerin klinik uygulaması göz önüne alındığında, immün reaksiyonlar ve hastalık bulaşma riskleri, FBS'nin bir orta takviye olarak kullanımını bozmaktadır16. Bu nedenle, mevcut metodolojiyi izleyerek sferoidleri oluşturmak için serum/kseno içermeyen bir hücre kültürü ortamı kullanılabilir. Örneğin, çalışmalar, insan mezenkimal / stromal kök hücre sferoidlerini oluşturmak için insan albümini, askorbik asit, insülin, transferrin ve selenyumdan oluşan özel bir 3D kültür ortamı kullanmıştır 4,8.
Spheroidlerin başarılı oluşumu, kompakt küresel şekilleri ile belirlenebilir. Bugüne kadar, bazı çalışmalar, hücre adezyon aracılarının (örneğin, E-kaderin, integrinler) yanı sıra hücre iskeleti mikrotübülleri ve aktin filamentlerinin hücrenin kendi kendine montajı ve sferoidlere daha fazla sıkıştırma üzerindeki etkisini bildirmiştir18,19. Bu nedenle, bu bileşenleri ifade etmede dengesizlik gösteren hücreler, sferoidleri sıkıştırıp oluşturamayabilir. Bu nedenle, sferoid oluşumu hücre hattına göre farklılık gösterir; Bu nedenle, bazı hücre türleri burada açıklanan metodoloji için uygun seçenekler olmayabilir.
Mevcut protokolde, silindirik mikropinlerden oluşan 3D baskılı damga benzeri bir cihaz, bir dizi düzgün mikroyapılı rezeksiyon oluşturmak için yapışmayan bir hidrojeli (örneğin, agaroz) kalıplamak için kullanıldı. Hücrenin toplanmasını, kendi kendine montajını ve sıkıştırmasını gerçek zamanlı olarak gözlemlemek (yani görüntüleme kullanarak) da mümkündür. Ayrıca, ortam eklemek/değiştirmek ve ilaçlar veya diğer bileşikler eklemek için minimum emeğe sahiptir. Ek olarak, elektron mikroskobu, sitometri ve histoloji gibi analiz sonrası için sferoidler, ortam veya PBS yüklü bir pipet kullanılarak yalnızca yönlendirilmiş bir jet uygulanarak geri çekilebilir. Asılı damla, kaplanmış u şeklindeki dip kuyuları, mikroakışkan cihazlar ve bir polimerik matris kullanma gibi sferoidler üretmek için çeşitli metodolojiler bildirilmiştir. Bununla birlikte, genellikle karmaşık, zaman alıcı, emek yoğun, pahalıdırlar veya heterojen sferoidler oluşturabilirler 9,10. Her ne kadar sferoidlerin büyük ölçekli üretimi asılı damla metodolojisi20 kullanılarak gerçekleştirilmiş olsa da, sferoid oluşum sürecini takip etmek ve orta madde değişimi veya ilaç/bileşik ilavesi10 yapmak hala zordur.
Mikro kalıplanmış yapışkan olmayan hidrojeller, daha büyük mikro dokuların oluşumuna rehberlik etmek için sferoidler ve ayrıca kalıplar oluşturmak için bir strateji olarak kullanılmıştır10. Bununla birlikte, kullanılan ana kalıplar esas olarak silikondur, uzun süreli kullanım için uygun değildir ve pahalı olabilir21. Bu çalışma, 3D baskı teknolojisi için son derece düzgün ana kalıplar oluşturmak için stereolitografi (SLA) kullandı. SLA, prototipi hız, maliyet etkinliği, esneklik ve hassasiyetle oluşturur22. Ek olarak, özelleştirilmiş üretim için avantajları, doku mühendisliği ve genel olarak biyotıp dahil olmak üzere çeşitli alanlarda kullanılmıştır22.
Küresel hücre kültürlerinin, insan özelliklerine çok benzeyebilen in vitro çalışma modelleri fizyolojik olarak ilgili olduğu bilinmektedir. Bu nedenle, hastalıkların ve toksikolojinin başlangıcını incelemek için bir model olarak kullanılmıştır ve halihazırda rejeneratif tıp için bir biyoürün olarak ticarileştirilmiştir 23,24,25. Buna göre, 3D biyo-baskı 3,26 ve çip üzerinde organlar24,27 gibi ön teknolojiler için hammadde olarak kullanılmakta ve sürekli olarak sferoid kültürlerinin ne kadar önemli olduğunu ve bunları büyük ölçekte oluşturmak için yeni stratejiler geliştirmenin önemini göstermektedir.
Açıklamalar
3D baskılı pul benzeri cihazlar, Janaína Dernovsek'in kurucu ortağı ve inovasyon direktörü olduğu Bioedtech girişimi tarafından sunuldu. Yazarlar rekabet eden hiçbir mali çıkar beyan etmemektedir.
Teşekkürler
Bu çalışma, Rio de Janeiro Eyaleti Araştırma Destek Vakfı (FAPERJ, Brezilya), Yüksek Öğretim Personelinin Geliştirilmesi Koordinasyonu (CAPES, Brezilya) ve Brezilya Ulusal Bilimsel ve Teknolojik Kalkınma Konseyi (CNPq, Brezilya) tarafından desteklenmiştir. Bu çalışmada kullanılan damga benzeri cihazları sağladığı için Bioedtech'e ve hücre kültürü tesislerinin kullanımı için İmmünofarmakoloji Laboratuvarı'ndan Profesör Bartira Bergmann'a teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
Referanslar
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
ISSN 2578-2037
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
Sitemizdeki deneyiminizi iyileştirmek için çerezleri kullanıyoruz
Sitemizi kullanmaya devam ederek ya da "Devam et" butonuna tıklayarak, çerezleri kabul edebilirsiniz.
