Method Article
Erzeugung von Gewebesphäroiden über ein 3D-gedrucktes stempelähnliches Gerät
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt eine Technik zur kostengünstigen Herstellung von Gewebesphäroiden in großem Maßstab unter Verwendung eines 3D-gedruckten stempelähnlichen Geräts.
Zusammenfassung
Fortschritte in der 3D-Zellkultur haben physiologisch relevantere In-vitro-Modelle entwickelt, wie z. B. Gewebesphäroide. Zellen, die als Sphäroide kultiviert werden, haben realistischere biologische Reaktionen, die der In-vivo-Umgebung ähneln. Aufgrund ihrer Vorteile stellen Gewebesphäroide einen aufkommenden Trend hin zu überlegenen, zuverlässigeren und prädiktiveren Studienmodellen mit einem breiten Spektrum biotechnologischer Anwendbarkeit dar. Reproduzierbare Plattformen, die eine großtechnische Produktion von Gewebesphäroiden ermöglichen können, sind jedoch zu einem ungedeckten Bedarf geworden, um ihr Potenzial vollständig zu erforschen und zu steigern. In dieser Arbeit wird über die großtechnische Produktion von homogenen Gewebesphäroiden unter Verwendung einer kostengünstigen und zeitsparenden Methode berichtet. Ein 3D-gedrucktes stempelähnliches Gerät wird entwickelt, um bis zu 4.716 Sphäroide pro 6-Well-Platte zu erzeugen. Das Gerät wird durch das Stereolithographie-Verfahren unter Verwendung eines lichthärtenden Harzes hergestellt. Das Endprodukt besteht aus zylindrischen Mikropins mit einer Höhe von 1,3 mm und einer Breite von 650 μm. Dieser Ansatz ermöglicht die schnelle Erzeugung von homogenen Sphäroiden und co-kultivierten Sphäroiden mit einheitlicher Form und Größe und einer Zellviabilität von >95 %. Darüber hinaus ist das stempelähnliche Gerät für unterschiedliche Größen von Well-Platten und Petrischalen abstimmbar. Es ist leicht zu sterilisieren und kann über lange Zeiträume wiederverwendet werden. Die effiziente Produktion von homogenen Gewebesphäroiden in großem Maßstab ist unerlässlich, um ihre Übersetzung für verschiedene Industriebereiche wie Tissue Engineering, Arzneimittelentwicklung, Krankheitsmodellierung und personalisierte On-Demand-Medizin zu nutzen.
Einleitung
Gewebesphäroide sind 3D-Mikrogewebe, die aus Zellsuspensionen gebildet werden, die sich ohne äußere Kräfte selbst organisieren1. Diese Sphäroide wurden aufgrund ihrer Ähnlichkeit mit Schlüsselmerkmalen des menschlichen physiologischen Systems häufig in Biofabrikationsprotokollen verwendet 2,3. Gewebesphäroide bieten einen ähnlicheren Stoffwechsel, eine ähnliche Dynamik des Zytoskeletts, eine ähnliche Zellviabilität sowie eine ähnliche Stoffwechsel- und Sekretionsaktivität als herkömmliche Monolayer-Zellkulturen1. Aufgrund ihrer Fusionsfähigkeit können sie auch als Bausteine (z. B. Bioprinting-Protokolle) verwendet werden, um komplexe Tissue-Engineering-Konstrukte mit erhöhter biologischer Relevanz zu bilden 4,5.
Aufgrund ihrer biologischen Relevanz wurden Gewebesphäroide als biotechnologisches Werkzeug für Protokolle verwendet, die sich über Gewebezüchtung, Arzneimittelentwicklung, Krankheitsmodellierung und nanotoxikologische Bewertung erstrecken, wodurch Zeit, Platzkosten und Tierversuche reduziert wurden 3,6,7,8. Um das Potenzial von Gewebesphäroiden jedoch vollständig zu erforschen und zu nutzen, sind zuverlässige und reproduzierbare Methoden, die auf ihre großtechnische Produktion abzielen, dringend erforderlich, und dies bleibt eine anhaltende Herausforderung.
Mehrere Verfahren stellen Sphäroide her, wie z. B. hängende Tropfen, beschichtete U-förmige Bodenvertiefungen, Mikrofluidik und die Verwendung einer polymeren Matrix 9,10. Obwohl diese Methoden den Weg auf dem Markt für die Herstellung von Sphäroiden geebnet haben, sind sie immer noch komplex, zeitaufwändig, arbeitsintensiv oder teuer10.
Das vorliegende Protokoll berichtet über die großtechnische Produktion von homogenen Gewebesphäroiden unter Verwendung einer kostengünstigen und zeitsparenden Methodik. Wir haben ein 3D-gedrucktes stempelähnliches Gerät entwickelt, mit dem bis zu 4.716 Sphäroide pro 6-Well-Platte erzeugt werden können. Darüber hinaus kann das stempelähnliche Gerät so angepasst werden, dass es mehr Sphäroide pro Vertiefung produziert, die für verschiedene Zellkulturplatten geeignet sind. Es ist leicht sterilisierbar und kann über lange Zeiträume wiederverwendet werden. Die effiziente Produktion von homogenen Gewebesphäroiden in großem Maßstab ist unerlässlich, um ihren Einsatz in die Kliniken zu übertragen und trägt zu mehreren Industriebereichen bei, wie z. B. Tissue Engineering, Arzneimittelentwicklung, Krankheitsmodellierung und personalisierte On-Demand-Medizin.
Protokoll
Die L929-Zelllinie, Mausfibroblasten, wurde für die vorliegende Studie verwendet. Das stempelähnliche 3D-gedruckte Biogerät wurde aus einer kommerziellen Quelle bezogen (siehe Materialtabelle). Während des gesamten Protokolls wurden gute Zellkulturpraktiken und sterile Techniken befolgt. Das hergestellte Gerät wurde sterilisiert, indem es mit 70% Alkohol abgewischt und 15 Minuten lang UV-Licht ausgesetzt wurde. Die Zellkulturmedien und -lösungen wurden auf 37 °C erwärmt, bevor sie mit den Zellen oder Gewebesphäroiden in Kontakt kamen. Eine schematische Darstellung des Protokolls ist in Abbildung 1 dargestellt.
1. Vorbereitung von nicht anhaftenden Formen aus der stempelartigen Vorrichtung
- Bereiten Sie 2% (w/v) Agarose-Gel vor, indem Sie die folgenden Schritte befolgen.
- Verdünnen Sie das Agarosepulver in phosphatgepufferter Kochsalzlösung (1x PBS) und homogenisieren Sie die resultierende Suspension mit kreisenden Bewegungen.
HINWEIS: Diese Lösung kann in eine Glasflasche gefüllt werden. In diesem Schritt ist die Agaroselösung nicht durchscheinend. - Stellen Sie die Glasflasche in die Mikrowelle und stellen Sie sie auf 30 s ein. Stoppen Sie alle 5 s die Mikrowelle, nehmen Sie die Glasflasche heraus und homogenisieren Sie die Lösung manuell mit kreisenden Bewegungen. Der Erhitzungsprozess muss so lange durchgeführt werden, bis die Lösung einen flüssig-klaren Zustand erreicht.
HINWEIS: Eine Kochplatte kann auch als Mikrowellenalternative verwendet werden. Nach dem Erhitzungsprozess muss die Lösung durchscheinend/klar sein. - Geben Sie 1 ml der Agaroselösung in jede Vertiefung einer für das Experiment geplanten 6-Well-Platte.
- Warten Sie ~15 Minuten oder bis die Agarose fest wird.
HINWEIS: Eine Kühlplatte kann verwendet werden, um die Erstarrungszeit zu verkürzen. - Geben Sie 1-2 mL der Agaroselösung hinzu und führen Sie das Gerät vorsichtig über die flüssige Agarose ein.
HINWEIS: Die Platzierung des Geräts muss sorgfältig erfolgen, um Luftblasen in der Schnittstelle zwischen Agarose und Gerät zu vermeiden. - Warten Sie ~30 min oder bis die Agarose fest wird.
HINWEIS: Eine Kühlplatte kann verwendet werden, um die Erstarrungszeit zu verkürzen. - Nehmen Sie das Gerät vorsichtig aus der Agarose.
HINWEIS: Die Entfernung ist kritisch. Man sollte es vorsichtig entfernen, um die Agarose-Merkmale intakt zu halten; Andernfalls kann die Agarose gestört werden. - Fügen Sie 2 ml DMEM-Medium hinzu, warten Sie 10 Minuten, entsorgen Sie das Medium und ersetzen Sie es durch frisches DMEM. Wiederholen Sie dies dreimal, um die Mulde richtig zu waschen.
- Fügen Sie 2 mL DMEM hinzu und stellen Sie die 6-Well-Platte in einen Inkubator (bei 37 °C bei 5 % CO2 und 80 % Luftfeuchtigkeit), bis die Zellen ausgesät sind (Abbildung 2A-F, Ergänzendes Video 1).
- Verdünnen Sie das Agarosepulver in phosphatgepufferter Kochsalzlösung (1x PBS) und homogenisieren Sie die resultierende Suspension mit kreisenden Bewegungen.
2. Erzeugung von Gewebesphäroiden
HINWEIS: Unterschiedliche Zelllinien haben unterschiedliche Adhäsionseigenschaften. Daher kann es bei dieser Methode vorkommen, dass einige Zelltypen die Gewebesphäroide nicht richtig bilden.
- Züchten Sie die Zellen nach herkömmlicher Monolayer-Kultur (d. h. züchten Sie die Zellen in Zellkulturflaschen unter Verwendung von DMEM mit niedrigem Glukosegehalt, ergänzt mit 10 % fötalem Rinderserum (FBS), 100 μg/ml Penicillin und 100 μg/ml Streptomycin) (siehe Materialtabelle). Halten Sie die Zellen in einem 5 % CO2 -Inkubator bei 37 °C und überwachen Sie, bis sie 80 % der Konfluenz erreichen.
- Nach Erreichen der gewünschten Konfluenz waschen Sie die Zellen mit 1x PBS.
HINWEIS: Es wird empfohlen, 5 mL für 25 cm2 Flaschen, 10 mL für 75 cm2 Flaschen und 15 mL für 150 cm2 Flaschen zu verwenden. - Fügen Sie das Dissoziationsenzym hinzu und inkubieren Sie die Zellen für 2-5 min bei 37 °C bei 5 % CO2 und 80 % Luftfeuchtigkeit.
HINWEIS: In der vorliegenden Studie wurden 0,125 % Trypsin mit 0,78 mM Ethylendiamintetraessigsäure (EDTA) als Dissoziationsenzym verwendet (siehe Materialtabelle). - Beobachten Sie die Ablösung der Zellen von den Zellkulturkolben und fügen Sie ein mit FBS ergänztes Wachstumsmedium hinzu, um das Zelldissoziationsenzym zu neutralisieren.
HINWEIS: Für die vorliegende Studie wurde DMEM mit niedrigem Glukosespiegel (siehe Materialtabelle) verwendet, ergänzt mit 10 % FBS. - Die Zellsuspension wird bei 400 x g 5 min bei Raumtemperatur zentrifugiert. Zählen Sie dann die Zellen manuell.
- Nehmen Sie 50 x 105 Zellen pro Röhrchen und fügen Sie 5 ml 1x PBS hinzu.
HINWEIS: Die Anzahl der ausgesäten Zellen beeinflusst den endgültigen Durchmesser des Gewebesphäroids. Daher kann man die Zellzahl erhöhen, um Gewebesphäroide mit größeren Durchmessern zu erzeugen. - Die Zellsuspension wird bei 400 x g 5 min bei Raumtemperatur zentrifugiert.
- Entfernen Sie den Überstand mit einer Pipette, fügen Sie 1 ml des Zellkulturmediums hinzu und homogenisieren Sie die Lösung.
HINWEIS: In der vorliegenden Studie wurde ein vollständiges Nährmedium aus DMEM mit niedrigem Glukosegehalt, ergänzt mit 10 % FBS, 100 μg/ml Penicillin und 100 μg/ml Streptomycin, verwendet. - Entfernen Sie 2 mL Medium von der 6-Well-Platte (Schritt 1.1.9) und geben Sie 1 ml der Zellsuspension in die Mitte der Agaroseform, die durch das 3D-gedruckte Biogerät gebildet wird (Schritt 1.1.7). Warten Sie, bis sich die Zellen in den Mikroresektionen sedimentieren (~20-30 min) und geben Sie vorsichtig 1 mL Zellkulturmedium in die Vertiefung.
HINWEIS: In diesem Schritt muss man besonders vorsichtig sein. Es wird empfohlen, das Medium vorsichtig hinzuzufügen, die Pipettenspitze nahe an der Well-Wand zu platzieren und in kleinen Mengen zu dosieren. - Legen Sie die 6-Well-Platte in den Inkubator (bei 37 °C bei 5 % CO2 und 80 % Luftfeuchtigkeit), damit sich die Gewebesphäroide bilden können (ca. 24-48 h, je nach Zelltyp) (Abbildung 3).
HINWEIS: Unterschiedliche Zelltypen (z. B. Krebszellen, Primärzellen) haben eine unterschiedliche Selbstorganisationskinetik11.
Ergebnisse
Erzeugung von homogenen Mikroresektionen mit dem 3D-gedruckten stempelähnlichen Gerät
Das 3D-gedruckte stempelähnliche Gerät wurde erfolgreich durch das Stereolithographie-Verfahren12 unter Verwendung eines lichthärtenden Harzes hergestellt (Abbildung 2A). Das endgültige Gerät bestand aus zylindrischen Mikropins mit einer Höhe von 1,3 mm und einer Breite von 650 μm (Abbildung 2A). Seine Verwendung als Urform zur Herstellung von nicht anhaftenden Mikroresektionen wurde durch Beibehaltung der Geometrie erreicht (Abbildung 2B-F und ergänzendes Video 1). Das Gerät war einfach zu bedienen, leicht zu sterilisieren und konnte langfristig wiederverwendet werden. Darüber hinaus ist es auch für verschiedene Größen von Well-Platten (d. h. 6 Wells, 12 Wells, 24 Wells, 96 Wells) und Petrischalen (d. h. 30 mm, 50 mm, 90 mm, 150 mm) abstimmbar. Hier zeigen wir Daten zum Gerät für die 6-Well-Platte. Es wurden 750 homogene Mikroresektionen pro Well oder 4.716 pro 6-Well-Platte erzeugt (Abbildung 2C-D). Nachteile wie das Aufbrechen der nicht haftenden Form und die Verformung der Mikroresektionsgeometrie können auftreten, wenn das Gerät frühzeitig zurückgezogen wird (Abbildung 2G).
Großserienproduktion von Gewebesphäroiden
Die Zellen wurden auf die nicht adhärenten Agarose-Schimmelpilze ausgesiedelt, sedimentiert und etwa 24 h später bildeten sie die Gewebe-Sphäroide. Die Produktion der Sphäroide in großem Maßstab wurde unter Beibehaltung ihrer Form, Größe (123 μm ± 3 μm) und Lebensfähigkeit (Abbildung 3A-D) erreicht. Diese Methodik unterstützte die Sphäroidkultur monatelang (Daten nicht gezeigt).
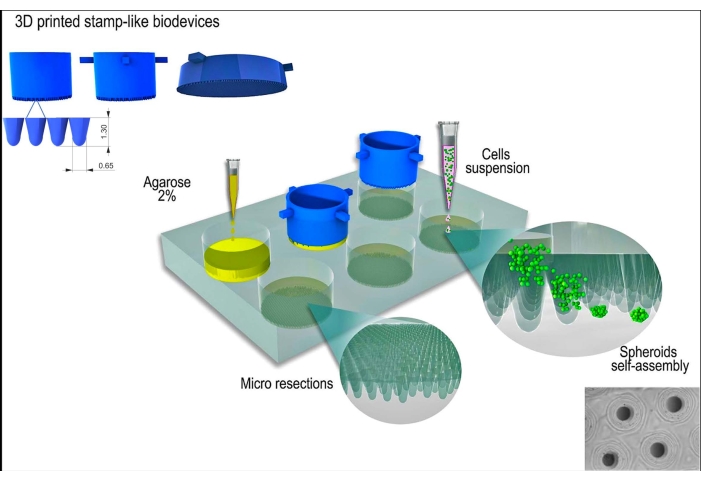
Abbildung 1: Schematische Darstellung der Erzeugung von Gewebesphäroiden mit Hilfe eines stempelartigen 3D-gedruckten Biogeräts. Das Biogerät, das aus zylindrischen Mikropins besteht, formt ein nicht haftendes Hydrogel (z. B. Agarose), um ein Array von gleichmäßigen Mikroresektionen zu bilden. Nach der Verfestigung der Agarose und der Inkubationszeit mit dem Zellkulturmedium (zur Akklimatisierung der neuen, nicht anhaftenden Formen) wird die Zellsuspension auf die Formen ausgesät, und die Zellen aggregieren, organisieren sich selbst und verdichten sich zu einer kugelförmigen Form. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Das 3D-gedruckte stempelähnliche Gerät, das als Urform verwendet wird, um nicht haftende mikrogeformte Agarose zu formen. (A) Das 3D-gedruckte stempelähnliche Gerät. (B) Das Einführen des Geräts in die flüssige Agarose, um die Mikroresektionen zu bilden. (C-E) Nach der Entnahme des Gerätes bilden sich homogene Resektionen. (E) Maßstabsleiste = 200 μm. (F) Mikrogeformte Agarose nach Inkubation mit Zellkulturmedium (rosa Farbe: Zellmedium). (G) Das Entfernen des Geräts aus der Agarose, wenn es nicht vollständig erstarrt ist, führt zu dessen Störung (gelbe Linie mit Pfeil). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
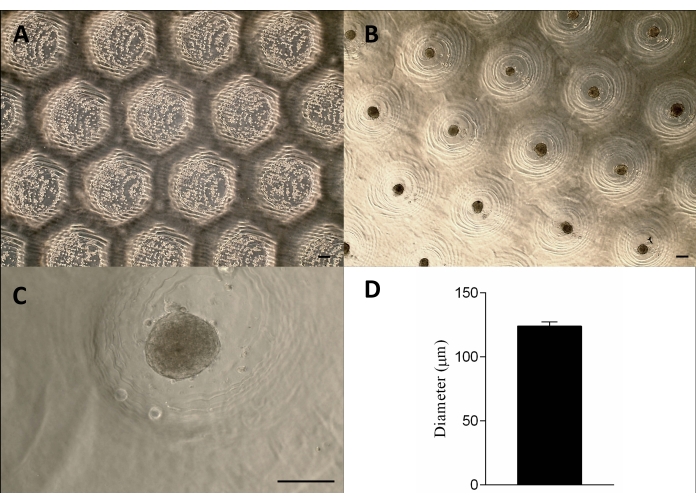
Abbildung 3: Zellaussaat und Sphäroidbildung. Phasenkontrastmikroskopie (A) 0 h nach der Aussaat der Zellen in den Mikroresektionen (Punkte innerhalb der Resektionen). (B-C) Die Sphäroide bildeten sich ca. 24 h nach der Aussaat. Maßstabsbalken = 100 μm. (D) Grafische Darstellung des Durchmessers der Sphäroide, n = 4. Die gebildeten Sphäroide sind in Form und Größe homogen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzendes Video 1: Mikrogeformte Agarose nach Entnahme der stempelartigen Vorrichtung. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Das vorliegende Protokoll beschreibt ein einfaches, schnelles und kostengünstiges Verfahren zur großtechnischen Herstellung von Gewebesphäroiden. Als Urform wurde ein stempelähnliches 3D-gedrucktes Gerät verwendet, das bis zu 4.716 Sphäroide pro 6-Well-Platte erzeugte. Es wurde gezeigt, dass Zellen, die als Sphäroide kultiviert werden, realistischere biologische Reaktionen aufweisen, die der In-vivo-Umgebung sehr ähnlich sind1. Aufgrund ihrer Vorteile stellen Gewebesphäroide einen aufkommenden Trend zu überlegenen, zuverlässigeren und prädiktiveren Studienmodellen dar13,14. Daher ist die Entwicklung neuer Methoden zur Erzielung einer Großserienproduktion von entscheidender Bedeutung, um ihre Anwendung zu nutzen.
Um die Erzeugung von Gewebesphäroiden mit dieser Methode erfolgreich zu erreichen, müssen kritische Schritte wie das Einführen des Geräts in die flüssige Agarose mit Vorsicht durchgeführt werden, um Luftblasen zu vermeiden. Das Vorhandensein von Luftblasen kann die korrekte Formgebung der Mikroresektionen beeinträchtigen. Dementsprechend kann das Entfernen der Vorrichtung vor der vollständigen Erstarrung der Agarose zum Bruch der Agaroseform führen. Diese Schritte sind unerlässlich, um Agaroseformen herzustellen, die für die Bildung von Gewebesphäroiden geeignet sind. Die Form- und Größenvariabilität für die generierte Charge von Sphäroiden muss minimal sein. Daher ist einer der deterministischen Punkte die langsame Zugabe des Kulturmediums nach der Aussaat der Zellen in die Agaroseform. Dies erfordert eine schonende Abgabe der Flüssigkeit, um die Zellen, die bereits in die Mikroresektionen eingetreten sind, nicht zu stören. Andernfalls könnten einige Mikroresektionen die Konzentrationen der Zellen erhöht haben, was zu einer Heterogenität in der Größe der Sphäroide führt.
Dieses Protokoll ist nicht nur einfach, schnell und kostengünstig, sondern auch flexibel (d.h. es sind einige Modifikationen möglich, um es an die Besonderheiten des Experiments anzupassen). Alternativ zu Agarose kann man Polydimethylsiloxan (PDMS) verwenden, um die Formen zu formen. PDMS ist ein Elastomer, das häufig zur Herstellung von mikrofluidischen Chips15 verwendet wird. Es hat Eigenschaften wie Biokompatibilität, optische Transparenz, chemische Inertheit, thermische Stabilität und Gasdurchlässigkeit15. Im Gegensatz zu Agarose sind mit PDMS hergestellte Formen widerstandsfähiger und können unter Beibehaltung der Mikroresektionsgeometrie auch wiederverwendet werden.
Derzeit hat die Suche nach einem alternativen serumfreien Zellkulturmedium weltweit zugenommen16,17. Obwohl FBS ein traditionelles Nahrungsergänzungsmittel für die Zellkultur ist, ist seine Verwendung mit ethischen Problemen und möglicher Chargenvariabilität verbunden. In Anbetracht der klinischen Anwendung von Sphäroiden beeinträchtigen jedoch die Risiken von Immunreaktionen und Krankheitsübertragungen die Verwendung von FBS als Nahrungsergänzungsmittel16. So kann man ein serum/xenofreies Zellkulturmedium verwenden, um die Sphäroide nach der vorliegenden Methodik zu bilden. So wurde in Studien beispielsweise ein spezielles 3D-Kulturmedium verwendet, das aus humanem Albumin, Ascorbinsäure, Insulin, Transferrin und Selen besteht, um menschliche mesenchymale/stromale Stammzell-Sphäroide zu bilden 4,8.
Die erfolgreiche Bildung von Sphäroiden lässt sich an ihrer kompakten Kugelform ablesen. Bisher haben einige Studien über den Einfluss von Zelladhäsionsmediatoren (z. B. E-Cadherin, Integrine) sowie Mikrotubuli des Zytoskeletts und Aktinfilamenten auf die Selbstorganisation der Zellen und die weitere Verdichtung zu Sphäroiden berichtet18,19. Daher sind Zellen, die ein Ungleichgewicht bei der Expression dieser Komponenten aufweisen, möglicherweise nicht in der Lage, sich zu verdichten und die Sphäroide zu bilden. Daher unterscheidet sich die Sphäroidbildung je nach Zelllinie; Daher könnten einige Arten von Zellen keine geeigneten Optionen für die hierin beschriebene Methode sein.
In dem vorliegenden Protokoll wurde eine 3D-gedruckte stempelähnliche Vorrichtung, bestehend aus zylindrischen Mikropinen, verwendet, um ein nicht haftendes Hydrogel (z. B. Agarose) zu formen, um eine Anordnung von gleichmäßigen mikrostrukturierten Resektionen zu bilden. Es ist auch möglich, die Aggregation, Selbstorganisation und Verdichtung der Zelle in Echtzeit zu beobachten (d. h. mit Hilfe von Bildgebung). Darüber hinaus hat man nur minimalen Arbeitsaufwand, um Medium hinzuzufügen/auszutauschen und Medikamente oder andere Verbindungen hinzuzufügen. Darüber hinaus kann man die Sphäroide für die Nachanalyse, wie z. B. Elektronenmikroskopie, Zytometrie und Histologie, entnehmen, indem man einfach einen gerichteten Strahl mit einer Pipette aufbringt, die mit Medium oder PBS beladen ist. Es wurde über mehrere Methoden zur Erzeugung von Sphäroiden berichtet, wie z. B. hängende Tropfen, beschichtete U-förmige Bodenvertiefungen, Mikrofluidikgeräte und die Verwendung einer polymeren Matrix. Nichtsdestotrotz sind sie in der Regel komplex, zeitaufwändig, arbeitsintensiv, teuer oder können heterogene Sphäroide erzeugen 9,10. Obwohl die großtechnische Produktion von Sphäroiden unter Verwendung der Hanging-Drop-Methode20 erreicht wurde, ist es immer noch schwierig, den Prozess der Sphäroidbildung zu verfolgen und einen Medienaustausch oder die Zugabe von Arzneimitteln/Verbindungendurchzuführen 10.
Mikrogeformte nicht-adhäsive Hydrogele wurden als Strategie zur Bildung von Sphäroiden und auch Formen verwendet, um die Bildung größerer Mikrogewebe zu steuern10. Die verwendeten Urformen bestehen jedoch hauptsächlich aus Silikon, sind für den Langzeiteinsatz ungeeignet und können teuer sein21. In dieser Studie wurde Stereolithographie (SLA) für die 3D-Drucktechnologie eingesetzt, um hochgradig gleichmäßige Urformen zu erzeugen. SLA generiert den Prototyp mit Geschwindigkeit, Wirtschaftlichkeit, Flexibilität und Präzision22. Darüber hinaus wurden seine Vorteile für die kundenspezifische Fertigung in mehreren Bereichen genutzt, darunter Tissue Engineering und Biomedizin im Allgemeinen22.
Es ist bekannt, dass Sphäroid-Zellkulturen physiologisch relevante In-vitro-Studienmodelle sind, die menschlichen Merkmalen sehr ähnlich sein können. Daher wurden sie als Modell für die Untersuchung des Auftretens von Krankheiten und der Toxikologie verwendet und sind bereits als Bioprodukt für die regenerative Medizin kommerzialisiert 23,24,25. Dementsprechend werden sie als Rohstoff für Spitzentechnologien wie 3D-Bioprinting 3,26 und Organs-on-Chips24,27 verwendet, was immer wieder zeigt, wie wichtig Sphäroidkulturen sind und wie wichtig es ist, neue Strategien zu entwickeln, um sie in großem Maßstab zu erzeugen.
Offenlegungen
Die 3D-gedruckten briefmarkenähnlichen Geräte wurden von dem Startup Bioedtech angeboten, bei dem Janaína Dernovsek Mitbegründerin und Innovationsdirektorin ist. Die Autoren erklären, dass keine konkurrierenden finanziellen Interessen bestehen.
Danksagungen
Diese Arbeit wurde unterstützt von der Stiftung für Forschungsförderung des Bundesstaates Rio de Janeiro (FAPERJ, Brasilien), der Koordination zur Verbesserung des Hochschulpersonals (CAPES, Brasilien) und dem brasilianischen Nationalen Rat für wissenschaftliche und technologische Entwicklung (CNPq, Brasilien). Wir danken Bioedtech für die Bereitstellung der briefartigen Geräte, die in dieser Studie verwendet wurden, und Professor Bartira Bergmann vom Immunpharmakologischen Labor für die Nutzung ihrer Zellkulturanlagen.
Materialien
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
Referenzen
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten