Method Article
توليد الأنسجة الكروية عبر جهاز يشبه الطوابع المطبوعة ثلاثية الأبعاد
In This Article
Summary
يصف البروتوكول الحالي تقنية لإنتاج كرويات الأنسجة على نطاق واسع وفعالة من حيث التكلفة باستخدام جهاز يشبه الطوابع المطبوعة ثلاثية الأبعاد.
Abstract
تطورت التطورات في زراعة الخلايا ثلاثية الأبعاد بشكل أكثر صلة من الناحية الفسيولوجية في النماذج المختبرية ، مثل الأنسجة الكروية. الخلايا المزروعة على شكل كرويات لها استجابات بيولوجية أكثر واقعية تشبه البيئة في الجسم الحي . نظرا لمزاياها ، تمثل كرويات الأنسجة اتجاها ناشئا نحو نماذج دراسة متفوقة وأكثر موثوقية وتنبؤية مع مجموعة واسعة من قابلية تطبيق التكنولوجيا الحيوية. ومع ذلك ، فإن المنصات القابلة للتكاثر التي يمكنها تحقيق إنتاج على نطاق واسع من الأنسجة الكروية أصبحت حاجة غير ملباة في استكشاف إمكاناتها وتعزيزها بشكل كامل. هنا ، يتم الإبلاغ عن الإنتاج على نطاق واسع لكرويات الأنسجة المتجانسة باستخدام منهجية منخفضة التكلفة وفعالة من حيث الوقت. تم تطوير جهاز يشبه الطوابع المطبوعة ثلاثية الأبعاد لتوليد ما يصل إلى 4,716 كروية لكل لوحة ذات 6 آبار. يتم تصنيع الجهاز بطريقة الطباعة الحجرية المجسمة باستخدام راتنج قابل للمعالجة الضوئية. يتكون الجهاز النهائي من دبابيس دقيقة أسطوانية ، يبلغ ارتفاعها 1.3 مم وعرضها 650 ميكرومتر. يسمح هذا النهج بالتوليد السريع للكبوتات الكروية المتجانسة والأشكال الكروية المستزرعة المشتركة ذات الشكل والحجم الموحدين وقابلية الخلية بنسبة >95٪. علاوة على ذلك ، فإن الجهاز الشبيه بالطوابع قابل للضبط لأحجام مختلفة من ألواح الآبار وأطباق بتري. يتم تعقيمه بسهولة ويمكن إعادة استخدامه لفترات طويلة. يعد الإنتاج الفعال على نطاق واسع لكرويات الأنسجة المتجانسة أمرا ضروريا للاستفادة من ترجمتها لمجالات متعددة من الصناعة ، مثل هندسة الأنسجة ، وتطوير الأدوية ، ونمذجة الأمراض ، والطب الشخصي عند الطلب.
Introduction
كرويات الأنسجة عبارة عن أنسجة دقيقة ثلاثية الأبعاد تتكون من معلقات الخلايا التي تخضع للتجميع الذاتي دون قوى خارجية1. تم استخدام هذه الفيريات على نطاق واسع في بروتوكولات التصنيع الحيوي نظرا لتشابهها مع السمات الرئيسية للنظام الفسيولوجي البشري2،3. توفر كرويات الأنسجة عملية التمثيل الغذائي الأكثر تشابها ، وديناميكيات الهيكل الخلوي ، وقابلية الخلية للحياة ، ونشاط التمثيل الغذائي والإفراز من زراعة الخلايا التقليدية أحاديةالطبقة 1. نظرا لقدرتها على الاندماج ، يمكن استخدامها أيضا ككتل بناء (على سبيل المثال ، بروتوكولات الطباعة الحيوية) لتشكيل تركيبات معقدة هندسية للأنسجة مع أهمية بيولوجية محسنة4،5.
نظرا لأهميتها البيولوجية ، فقد تم استخدام كرويات الأنسجة كأداة للتكنولوجيا الحيوية للبروتوكولات التي تتراوح عبر هندسة الأنسجة ، وتطوير الأدوية ، ونمذجة الأمراض ، وتقييم السموم النانوية ، مما يقلل من الوقت وتكاليف المساحة والتجارب على3،6،7،8. ومع ذلك ، لاستكشاف إمكانات الأنسجة الكروية والاستفادة منها بشكل كامل ، فإن الأساليب الموثوقة والقابلة للتكرار التي تهدف إلى إنتاجها على نطاق واسع ضرورية للغاية ، ولا تزال هذه تحديا مستمرا.
تنتج العديد من المنهجيات الكرات ، مثل القطرة المعلقة ، والآبار السفلية المطلية على شكل حرف U ، والموائع الدقيقة ، واستخدام مصفوفة بوليمرية9،10. على الرغم من أن هذه المنهجيات مهدت الطريق داخل سوق الإنتاج الكروي ، إلا أنها لا تزال معقدة أو تستغرق وقتا طويلا أو كثيفة العمالة أومكلفة 10.
ويشير هذا البروتوكول إلى إنتاج الأنسجة الكروية المتجانسة على نطاق واسع باستخدام منهجية منخفضة التكلفة وفعالة من حيث الوقت. لقد قمنا بتطوير جهاز يشبه الطوابع المطبوعة ثلاثية الأبعاد لتوليد ما يصل إلى 4,716 كروية لكل لوحة ذات 6 آبار. علاوة على ذلك ، يمكن تصميم الجهاز الشبيه بالطوابع لإنتاج المزيد من الكرات الكروية لكل بئر ، ومناسبة لألواح زراعة الخلايا المختلفة. يمكن تعقيمه بسهولة ويمكن إعادة استخدامه لفترات طويلة. يعد الإنتاج الفعال على نطاق واسع للأنسجة الكروية المتجانسة أمرا ضروريا لترجمة استخدامها إلى العيادات ، مما يساهم في مجالات متعددة من الصناعة مثل هندسة الأنسجة ، وتطوير الأدوية ، ونمذجة الأمراض ، والطب الشخصي عند الطلب.
Protocol
تم استخدام خط الخلايا L929 ، الخلايا الليفية للفأر ، في هذه الدراسة. تم الحصول على الجهاز الحيوي المطبوع ثلاثي الأبعاد الشبيه بالطوابع من مصدر تجاري (انظر جدول المواد). تم اتباع ممارسات زراعة الخلايا الجيدة والتقنيات المعقمة طوال البروتوكول. تم تعقيم الجهاز المصنع عن طريق مسحه بنسبة 70٪ كحول وتعريضه للأشعة فوق البنفسجية لمدة 15 دقيقة. تم تسخين وسائط ومحاليل زراعة الخلايا إلى 37 درجة مئوية قبل ملامسة الخلايا أو كرويات الأنسجة. يظهر تمثيل تخطيطي للبروتوكول في الشكل 1.
1. تحضير قوالب غير ملتصقة من جهاز يشبه الختم
- تحضير جل الاغاروز بنسبة 2٪ (وزن / حجم) باتباع الخطوات أدناه.
- خفف مسحوق الاغاروز في محلول ملحي مخزن بالفوسفات (1x PBS) وقم بتجانس المعلق الناتج بحركات دائرية.
ملاحظة: يمكن وضع هذا المحلول في زجاجة زجاجية. في هذه الخطوة ، لن يكون محلول الاغاروز شفافا. - ضع الزجاجة في الميكروويف واضبطها لمدة 30 ثانية. كل 5 ثوان ، أوقف الميكروويف ، وقم بإزالة الزجاجة ، وقم بتجانس المحلول يدويا بحركات دائرية. يجب إجراء عملية التسخين حتى يصل المحلول إلى حالة شفافة سائلة.
ملاحظة: يمكن أيضا استخدام اللوح الساخن كبديل للميكروويف. بعد عملية التسخين ، يجب أن يكون المحلول شفافا / شفافا. - أضف 1 مل من محلول الاغاروز إلى كل بئر من صفيحة 6 آبار مخططة للتجربة.
- انتظر لمدة ~ 15 دقيقة أو حتى يتماسك الاغاروز.
ملاحظة: يمكن استخدام لوحة التبريد لتقليل وقت التصلب. - أضف 1-2 مل من محلول الاغاروز وأدخل الجهاز برفق فوق الاغاروز السائل.
ملاحظة: يجب أن يتم وضع الجهاز بعناية لمنع فقاعات الهواء في واجهة جهاز الاغاروز. - انتظر لمدة ~ 30 دقيقة أو حتى يتجمد الاغاروز.
ملاحظة: يمكن استخدام لوحة التبريد لتقليل وقت التصلب. - قم بإزالة الجهاز برفق من الاغاروز.
ملاحظة: الإزالة أمر بالغ الأهمية. يجب على المرء إزالته بعناية للحفاظ على ميزات الاغاروز سليمة. خلاف ذلك ، يمكن أن تتعطل الاغاروز. - أضف 2 مل من وسائط DMEM ، وانتظر لمدة 10 دقائق ، وتخلص من الوسائط ، واستبدلها ب DMEM جديد. كرر هذا ثلاث مرات لغسل البئر بشكل صحيح.
- أضف 2 مل من DMEM وضع الصفيحة المكونة من 6 آبار في حاضنة (عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 و 80٪ رطوبة) حتى بذر الخلية (الشكل 2A-F ، الفيديو التكميلي 1).
- خفف مسحوق الاغاروز في محلول ملحي مخزن بالفوسفات (1x PBS) وقم بتجانس المعلق الناتج بحركات دائرية.
2. توليد الأنسجة الكروية
ملاحظة: سلالات الخلايا المختلفة لها خصائص التصاق مختلفة. وبالتالي ، باستخدام هذه المنهجية ، قد لا تشكل بعض أنواع الخلايا الأنسجة الكروية بشكل صحيح.
- قم بزراعة الخلايا باتباع الزراعة أحادية الطبقة التقليدية (أي زراعة الخلايا في قوارير زراعة الخلايا باستخدام DMEM مع نسبة منخفضة من الجلوكوز مع 10٪ مصل بقري جنيني (FBS) ، و 100 ميكروغرام / مل بنسلين ، و 100 ميكروغرام / مل من الستربتومايسين) (انظر جدول المواد). حافظ على الخلايا عند 37 درجة مئوية في حاضنة ثاني أكسيد الكربونبنسبة 5٪ ، وراقبها حتى تصل إلى 80٪ من التقاء.
- بعد الوصول إلى التقاء المرغوب فيه ، اغسل الخلايا باستخدام 1x PBS.
ملاحظة: يوصى باستخدام 5 مل لقارورة 25 سم2 ، و 10 مل لقوارير 75 سم2 ، و 15 مل لقوارير 150 سم2 . - أضف إنزيم التفكك واحتضان الخلايا لمدة 2-5 دقائق عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 و 80٪ رطوبة.
ملاحظة: استخدمت الدراسة الحالية 0.125٪ تريبسين مع 0.78 ملي مولار حمض الإيثيلين ديامين رباعي الأسيتيك (EDTA) كإنزيم التفكك (انظر جدول المواد). - راقب انفصال الخلايا عن قوارير زراعة الخلايا وأضف وسط نمو مكمل ب FBS لتحييد إنزيم تفكك الخلية.
ملاحظة: في هذه الدراسة ، تم استخدام DMEM مع نسبة منخفضة من الجلوكوز (انظر جدول المواد) مع استكمال 10٪ FBS. - جهاز الطرد المركزي لتعليق الخلية عند 400 × جم لمدة 5 دقائق في درجة حرارة الغرفة. ثم قم بحساب الخلايا يدويا.
- خذ 50 × 105 خلايا لكل أنبوب وأضف 5 مل من 1x PBS.
ملاحظة: يؤثر عدد الخلايا المزروعة على القطر الكروي النهائي للنسجة. وبالتالي ، يمكن للمرء زيادة عدد الخلايا لتوليد كرويات نسيجية بأقطار أكبر. - جهاز الطرد المركزي لتعليق الخلية عند 400 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- قم بإزالة المادة الطافية باستخدام ماصة ، وأضف 1 مل من وسط زراعة الخلية ، وقم بتجانس المحلول.
ملاحظة: في هذه الدراسة، تم استخدام وسط استزراع كامل من DMEM مع نسبة منخفضة من الجلوكوز، مكمل بنسبة 10٪ FBS، و100 ميكروغرام/مل من البنسلين، و100 ميكروغرام/مل من الستربتومايسين. - قم بإزالة 2 مل من الوسط من اللوحة المكونة من 6 آبار (الخطوة 1.1.9) وأضف 1 مل من تعليق الخلية إلى مركز قالب الاغاروز الذي يتكون من الجهاز الحيوي المطبوع ثلاثي الأبعاد (الخطوة 1.1.7). انتظر حتى تترسب الخلايا في الاستئصال الدقيق (~ 20-30 دقيقة) وأضف بعناية 1 مل من وسط زراعة الخلايا في البئر.
ملاحظة: يحتاج المرء إلى توخي مزيد من الحذر في هذه الخطوة. يوصى بإضافة الوسط برفق ، ووضع طرف الماصة بالقرب من جدار البئر ، والتوزيع بكميات صغيرة. - ضع الصفيحة المكونة من 6 آبار في الحاضنة (عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 و 80٪ رطوبة) حتى تتشكل الأنسجة الكروية (حوالي 24-48 ساعة ، حسب نوع الخلية) (الشكل 3).
ملاحظة: أنواع الخلايا المختلفة (على سبيل المثال ، الخلايا السرطانية والخلايا الأولية) لها حركية مختلفة للتجميعالذاتي 11.
النتائج
توليد عمليات الاستئصال الدقيقة المتجانسة باستخدام جهاز يشبه الطابع المطبوع ثلاثي الأبعاد
تم تصنيع الجهاز الشبيه بالطوابع المطبوعة ثلاثية الأبعاد بنجاح بطريقة الطباعة الحجريةالمجسمة 12 باستخدام راتنج قابل للمعالجة الضوئية (الشكل 2 أ). يتكون الجهاز النهائي من دبابيس صغيرة أسطوانية بارتفاع 1.3 مم وعرض 650 ميكرومتر (الشكل 2 أ). تم تحقيق استخدامه كقالب رئيسي لإنتاج عمليات استئصال دقيقة غير ملتصقة من خلال الحفاظ على الهندسة (الشكل 2B-F والفيديو التكميلي 1). كان الجهاز سهل الاستخدام وسهل التعقيم ويمكن إعادة استخدامه على المدى الطويل. علاوة على ذلك ، يمكن ضبطه أيضا لأحجام مختلفة من ألواح الآبار (أي 6 آبار ، 12 بئرا ، 24 بئرا ، 96 بئرا) وأطباق بتري (أي 30 مم ، 50 مم ، 90 مم ، 150 مم). هنا ، نعرض البيانات المتعلقة بالجهاز للوحة 6 آبار. أنتجت 750 عملية استئصال دقيقة متجانسة لكل بئر أو 4,716 لكل 6 ألواح بئر (الشكل 2C-D). يمكن أن تحدث عيوب مثل تعطيل القالب غير الملتصق وتشوه هندسة الاستئصال الدقيق إذا تم سحب الجهاز مبكرا (الشكل 2G).
إنتاج الأنسجة الكروية على نطاق واسع
تم زرع الخلايا على قوالب الاغاروز غير الملتصقة ، وترسبها ، وبعد حوالي 24 ساعة شكلت كرويات الأنسجة. تم تحقيق الإنتاج على نطاق واسع للفيريات من خلال الحفاظ على شكلها وحجمها (123 ميكرومتر ± 3 ميكرومتر) وقابليتها للحياة (الشكل 3A-D). دعمت هذه المنهجية ثقافة الكرويات لأشهر (البيانات غير معروضة).
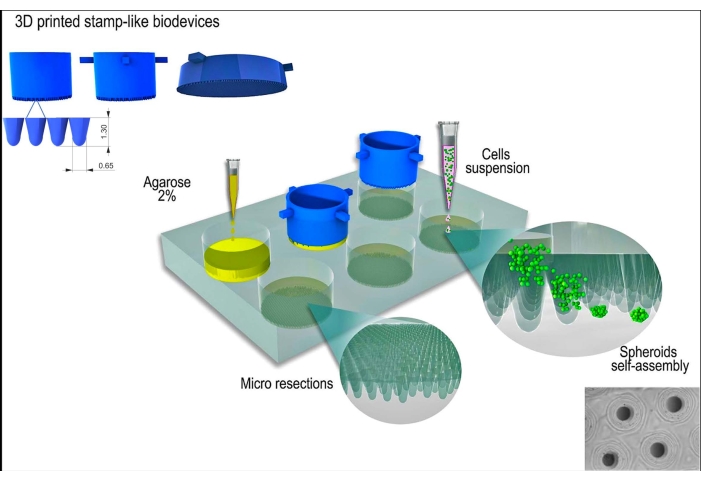
الشكل 1: تمثيل تخطيطي لتوليد كروية الأنسجة باستخدام جهاز حيوي مطبوع ثلاثي الأبعاد يشبه الطوابع. يقوم الجهاز الحيوي ، المكون من دبابيس صغيرة أسطوانية ، بتشكيل هيدروجيل غير ملتصق (على سبيل المثال ، الاغاروز) لتشكيل مجموعة من عمليات الاستئصال الدقيقة الموحدة. بعد تصلب الاغاروز ووقت الحضانة مع وسط زراعة الخلية (لتأقلم القوالب الجديدة غير الملتصقة) ، يتم زرع تعليق الخلية على القوالب ، وتتجمع الخلايا ، وتتجمع ذاتيا ، وتضغط في شكل كروي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الجهاز الشبيه بالطوابع المطبوعة ثلاثية الأبعاد المستخدم كقالب رئيسي لتشكيل الاغاروز غير الملتصق. (أ) الجهاز الشبيه بالطوابع المطبوعة ثلاثية الأبعاد. (ب) إدخال الجهاز في الاغاروز السائل لتشكيل الاستئصال الدقيق. (C-E) بعد إزالة الجهاز ، يتم تشكيل عمليات استئصال متجانسة. (ه) شريط المقياس = 200 ميكرومتر. (F) الاغاروز المصبوب بعد الحضانة بوسط زراعة الخلية (اللون الوردي: وسط الخلية). (ز) تؤدي إزالة الجهاز من الاغاروز عندما لا يتم تجميده تماما إلى تقطيعه (الخط الأصفر مع السهم). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
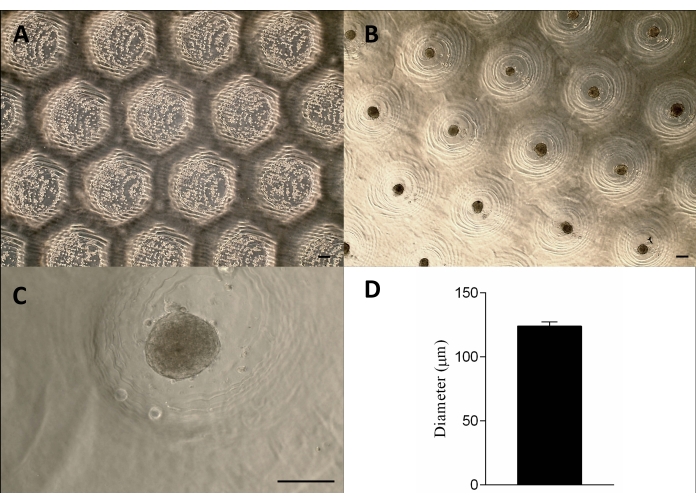
الشكل 3: بذر الخلايا وتكوين كروي. الفحص المجهري لتباين الطور (A) بعد 0 ساعة من بذر الخلايا في الاستئصال الدقيق (النقاط داخل الاستئصال). (ب - ج) تشكلت الكرات بعد حوالي 24 ساعة من البذر. شريط المقياس = 100 ميكرومتر. (د) تمثيل رسومي لقطر الكرويات ، ن = 4. الكرات المتكونة متجانسة في الشكل والحجم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو تكميلي 1: agarose دقيق التشكيل بعد إزالة الجهاز الشبيه بالطوابع. الرجاء النقر هنا لتنزيل هذا الفيديو.
Discussion
يصف البروتوكول الحالي طريقة بسيطة وسريعة وغير مكلفة لإنتاج الأنسجة الكروية على نطاق واسع. تم استخدام جهاز مطبوع ثلاثي الأبعاد يشبه الطوابع كقالب رئيسي ، والذي أنتج ما يصل إلى 4,716 كرويا لكل لوحة ذات 6 آبار. لقد ثبت أن الخلايا المزروعة على شكل كرويات لها استجابات بيولوجية أكثر واقعية تشبه إلى حد كبير البيئة في الجسم الحي 1. نظرا لمزاياها ، تمثل كرويات الأنسجة اتجاها ناشئا نحو نماذج دراسة متفوقة وأكثر موثوقية وأكثر تنبؤية13،14. ومن ثم ، فإن تطوير منهجيات جديدة لتحقيق الإنتاج على نطاق واسع أمر محوري للاستفادة من تطبيقها.
لتحقيق توليد كرويات الأنسجة بنجاح باستخدام هذه المنهجية ، يجب تنفيذ خطوات حاسمة مثل إدخال الجهاز في الاغاروز السائل بحذر لتجنب فقاعات الهواء. قد يؤدي وجود فقاعات الهواء إلى إضعاف التشكيل الصحيح للاستئصال الدقيق. وفقا لذلك ، قد تؤدي إزالة الجهاز قبل التصلب الكلي للأغروز إلى تمزق قالب الاغاروز. هذه الخطوات ضرورية لإنتاج قوالب الاغاروز المناسبة لتكوين الأنسجة الكروية. يجب أن يكون تباين الشكل والحجم لمجموعة الكرويات التي تم إنشاؤها ضئيلا. لذلك ، فإن إحدى النقاط الحتمية هي الإضافة البطيئة لوسط الاستزراع بعد زرع الخلايا في قالب الاغاروز. يتطلب ذلك توزيعا لطيفا للسائل حتى لا يزعج الخلايا التي دخلت بالفعل في الاستئصال الدقيق. خلاف ذلك ، يمكن أن تؤدي بعض عمليات الاستئصال الدقيقة إلى زيادة تركيزات الخلايا ، مما يؤدي إلى عدم تجانس الحجم بين الكرويات.
بالإضافة إلى كونه بسيطا وسريعا وغير مكلف ، فإن هذا البروتوكول مرن أيضا (أي أن بعض التعديلات فيه يمكن التكيف مع خصوصيات التجربة). بدلا من agarose ، يمكن للمرء استخدام polydimethylsiloxane (PDMS) لتشكيل القوالب. PDMS هو مطاط صناعي يستخدم على نطاق واسع لتصنيع رقائق الموائعالدقيقة 15. لها خصائص مثل التوافق الحيوي ، والشفافية البصرية ، وكونها خاملة كيميائيا ، والاستقرار الحراري ، ونفاذية الغاز15. تختلف عن الاغاروز ، القوالب المصنوعة من PDMS أكثر مقاومة ويمكن أيضا إعادة استخدامها مع الحفاظ على هندسة الاستئصال الدقيق.
حاليا ، زاد البحث عن وسيط بديل لزراعة الخلايا خالية من المصل في جميع أنحاء العالم16،17. على الرغم من أن FBS هو مكمل تقليدي لزراعة الخلايا ، إلا أن استخدامه له مشكلات أخلاقية وتباين محتمل في الدفعات. ومع ذلك ، بالنظر إلى التطبيق السريري للفيريات ، فإن مخاطر ردود الفعل المناعية وانتقال المرض تضعف استخدام FBS كمكمل متوسط16. وبالتالي ، يمكن للمرء استخدام وسيط زراعة الخلايا المصلي / الخالي من xeno لتشكيل الكرويات باتباع المنهجية الحالية. على سبيل المثال ، استخدمت الدراسات وسيطا خاصا للثقافة ثلاثية الأبعاد يتكون من الألبومين البشري وحمض الأسكوربيك والأنسولين والترانسفيرين والسيلينيوم لتشكيل الخلايا الجذعية الوسيطة / اللحمية البشرية4،8.
يمكن تحديد التكوين الناجح للكبوتات من خلال شكلها الكروي المضغوط. حتى الآن ، أبلغت بعض الدراسات عن تأثير وسطاء التصاق الخلية (على سبيل المثال ، E-cadherin ، Integrins) ، بالإضافة إلى الأنابيب الدقيقة للهيكل الخلوي وخيوط الأكتين ، على التجميع الذاتي للخلية ومزيد من الضغط في الكرات18،19. لذلك ، قد لا تتمكن الخلايا التي تظهر عدم التوازن في التعبير عن هذه المكونات من ضغط وتشكيل الكرويات. ومن ثم ، يختلف تكوين كروي وفقا لخط الخلية. وبالتالي ، قد لا تكون بعض أنواع الخلايا خيارات مناسبة للمنهجية الموضحة هنا.
في البروتوكول الحالي ، تم استخدام جهاز يشبه الطوابع المطبوعة ثلاثية الأبعاد ، يتكون من دبابيس دقيقة أسطوانية ، لتشكيل هيدروجيل غير ملتصق (على سبيل المثال ، الاغاروز) لتشكيل مجموعة من عمليات الاستئصال المجهرية الموحدة. من الممكن أيضا ملاحظة (أي باستخدام التصوير) تجميع الخلية والتجميع الذاتي والضغط في الوقت الفعلي. علاوة على ذلك ، لدى المرء الحد الأدنى من العمل لإضافة / تبادل الوسط وإضافة الأدوية أو المركبات الأخرى. بالإضافة إلى ذلك ، يمكن للمرء سحب الكرويات للتحليل اللاحق ، مثل المجهر الإلكتروني ، وقياس الخلايا ، وعلم الأنسجة ، بمجرد تطبيق نفاثة موجهة باستخدام ماصة محملة بوسط أو PBS. تم الإبلاغ عن العديد من المنهجيات لتوليد الكرات ، مثل القطرة المعلقة ، والآبار السفلية المطلية على شكل حرف U ، وأجهزة الموائع الدقيقة ، واستخدام مصفوفة بوليمري. ومع ذلك ، فهي عادة ما تكون معقدة ، وتستغرق وقتا طويلا ، وكثيفة العمالة ، ومكلفة ، أو قد تولد كرويات غير متجانسة 9،10. على الرغم من أن الإنتاج الكروي على نطاق واسع قد تم تحقيقه باستخدام منهجية القطرة المعلقة20 ، إلا أنه لا يزال من الصعب متابعة عملية تكوين الكرة وإجراء التبادل المتوسط أو إضافة الأدوية / المركبات10.
تم استخدام الهلاميات المائية غير اللاصقة المصبوبة كاستراتيجية لتشكيل الكرات الكروية وكذلك القوالب لتوجيه تكوين الأنسجة الدقيقة الأكبر10. ومع ذلك ، فإن القوالب الرئيسية المستخدمة هي السيليكون بشكل أساسي ، وهي غير مناسبة للاستخدام طويل الأمد ، وقد تكون باهظة الثمن21. استخدمت هذه الدراسة الطباعة الحجرية المجسمة (SLA) لتقنية الطباعة ثلاثية الأبعاد لإنشاء قوالب رئيسية موحدة للغاية. تقوم اتفاقية مستوى الخدمة بإنشاء النموذج الأولي بسرعة وفعالية من حيث التكلفة والمرونة والدقة22. بالإضافة إلى ذلك ، تم استخدام مزاياها للتصنيع المخصص في العديد من المجالات ، بما في ذلك هندسة الأنسجة والطب الحيوي بشكل عام22.
من المعروف أن مزارع الخلايا الكروية ذات صلة من الناحية الفسيولوجية في نماذج الدراسة المختبرية التي يمكن أن تشبه إلى حد كبير السمات البشرية. ومن ثم ، فقد تم استخدامها كنموذج لدراسة ظهور الأمراض وعلم السموم ويتم تسويقها بالفعل كمنتج حيوي للطبالتجديدي 23،24،25. وفقا لذلك ، يتم استخدامها كمادة خام للتقنيات الرائدة مثل الطباعة الحيوية ثلاثية الأبعاد3،26 والأعضاء على الرقائق24،27 ، مما يدل باستمرار على مدى أهمية الثقافات الكروية وأهمية تطوير استراتيجيات جديدة لتوليدها على نطاق واسع.
Disclosures
تم تقديم الأجهزة الشبيهة بالطوابع المطبوعة ثلاثية الأبعاد من قبل شركة Bioedtech الناشئة ، حيث تشارك Janaína Dernovsek في المؤسس المشارك ومدير الابتكار. ويعلن أصحاب البلاغ عدم وجود مصالح مالية متنافسة.
Acknowledgements
وحظي هذا العمل بدعم من مؤسسة دعم البحوث في ولاية ريو دي جانيرو (FAPERJ، البرازيل)، وتنسيق تحسين موظفي التعليم العالي (CAPES، البرازيل)، والمجلس الوطني البرازيلي للتنمية العلمية والتكنولوجية (CNPq، البرازيل). نشكر Bioedtech على توفير الأجهزة الشبيهة بالطوابع المستخدمة في هذه الدراسة والبروفيسورة بارتيرا بيرجمان من مختبر علم الأدوية المناعية لاستخدام مرافق زراعة الخلايا الخاصة بهم.
Materials
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
References
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved