Method Article
Generación de esferoides de tejido a través de un dispositivo similar a un sello impreso en 3D
En este artículo
Resumen
El presente protocolo describe una técnica para producir esferoides tisulares a gran escala de forma rentable utilizando un dispositivo similar a un sello impreso en 3D.
Resumen
Los avances en el cultivo celular 3D han desarrollado modelos in vitro más relevantes fisiológicamente , como los esferoides de tejidos. Las células cultivadas como esferoides tienen respuestas biológicas más realistas que se asemejan al entorno in vivo . Debido a sus ventajas, los esferoides tisulares representan una tendencia emergente hacia modelos de estudio superiores, más fiables y más predictivos con una amplia gama de aplicabilidad biotecnológica. Sin embargo, las plataformas reproducibles que pueden lograr la producción a gran escala de esferoides tisulares se han convertido en una necesidad insatisfecha para explorar y aumentar completamente su potencial. En este trabajo, se informa de la producción a gran escala de esferoides tisulares homogéneos utilizando una metodología de bajo costo y eficaz en el tiempo. Se desarrolla un dispositivo similar a un sello impreso en 3D para generar hasta 4.716 esferoides por placa de 6 pocillos. El dispositivo se fabrica mediante el método de estereolitografía utilizando una resina fotocurable. El dispositivo final está compuesto por micropines cilíndricos, con una altura de 1,3 mm y un ancho de 650 μm. Este enfoque permite la generación rápida de esferoides homogéneos y esferoides cocultivados con forma y tamaño uniformes y una viabilidad celular del >95%. Además, el dispositivo similar a un sello es ajustable para diferentes tamaños de placas de pocillos y placas de Petri. Se esteriliza fácilmente y se puede reutilizar durante largos períodos. La producción eficiente a gran escala de esferoides de tejidos homogéneos es esencial para aprovechar su traducción en múltiples áreas de la industria, como la ingeniería de tejidos, el desarrollo de fármacos, el modelado de enfermedades y la medicina personalizada bajo demanda.
Introducción
Los esferoides tisulares son microtejidos 3D formados por suspensiones celulares que se autoensamblan sin fuerzas externas1. Estos esferoides han sido ampliamente utilizados en protocolos de biofabricación debido a su semejanza con características clave del sistema fisiológico humano 2,3. Los esferoides tisulares proporcionan un metabolismo, una dinámica del citoesqueleto, una viabilidad celular y una actividad metabólica y de secreción más similares queel cultivo celular monocapa tradicional. Debido a su capacidad de fusión, también se pueden utilizar como bloques de construcción (por ejemplo, protocolos de bioimpresión) para formar construcciones complejas de ingeniería tisular con mayor relevancia biológica 4,5.
Debido a su relevancia biológica, los esferoides de tejidos se han utilizado como herramienta biotecnológica para protocolos que abarcan la ingeniería de tejidos, el desarrollo de fármacos, el modelado de enfermedades y la evaluación nanotoxicológica, reduciendo el tiempo, los costos de espacio y las pruebas en animales 3,6,7,8. No obstante, para explorar y aprovechar plenamente el potencial de los esferoides tisulares, son muy necesarios métodos fiables y reproducibles destinados a su producción a gran escala, que siguen siendo un reto constante.
Varias metodologías producen esferoides, como la gota colgante, los pozos de fondo recubiertos en forma de U, la microfluídica y el uso de una matriz polimérica 9,10. Aunque estas metodologías allanaron el camino dentro del mercado de producción de esferoides, siguen siendo complejas, lentas, laboriosas o costosas10.
El presente protocolo informa de la producción a gran escala de esferoides tisulares homogéneos utilizando una metodología de bajo costo y eficaz en el tiempo. Hemos desarrollado un dispositivo similar a un sello impreso en 3D para generar hasta 4.716 esferoides por placa de 6 pocillos. Además, el dispositivo similar a un sello se puede adaptar para producir más esferoides por pocillo, adecuado para diferentes placas de cultivo celular. Es fácilmente esterilizable y se puede reutilizar durante largos períodos. La producción eficiente a gran escala de esferoides tisulares homogéneos es esencial para trasladar su uso a las clínicas, contribuyendo a múltiples áreas de la industria, como la ingeniería de tejidos, el desarrollo de fármacos, el modelado de enfermedades y la medicina personalizada bajo demanda.
Protocolo
Para el presente estudio se utilizó la línea celular L929, fibroblastos de ratón. El biodispositivo impreso en 3D con forma de sello se obtuvo de una fuente comercial (consulte la tabla de materiales). Se siguieron las buenas prácticas de cultivo celular y las técnicas estériles durante todo el protocolo. El dispositivo fabricado se esterilizó limpiándolo con alcohol al 70% y exponiéndolo a la luz ultravioleta durante 15 minutos. Los medios y soluciones de cultivo celular se calentaron a 37 °C antes de entrar en contacto con las células o los esferoides tisulares. En la Figura 1 se muestra una representación esquemática del protocolo.
1. Preparación de moldes no adherentes a partir del dispositivo similar a un sello
- Prepare el gel de agarosa al 2% (p/v) siguiendo los pasos que se indican a continuación.
- Diluir el polvo de agarosa en solución salina tamponada con fosfato (1x PBS) y homogeneizar la suspensión resultante con movimientos circulares.
NOTA: Esta solución se puede colocar en una botella de vidrio. En este paso, la solución de agarosa no será translúcida. - Coloque la botella de vidrio en el microondas y déjela reposar durante 30 s. Cada 5 s, detenga el microondas, retire la botella de vidrio y homogeneice manualmente la solución con movimientos circulares. El proceso de calentamiento debe realizarse hasta que la solución alcance un estado líquido-límpido.
NOTA: Una placa calefactora también se puede utilizar como alternativa al microondas. Después del proceso de calentamiento, la solución debe ser translúcida/límpida. - Agregue 1 mL de la solución de agarosa a cada pocillo de una placa de 6 pocillos planeada para el experimento.
- Espere ~ 15 minutos o hasta que la agarosa se solidifique.
NOTA: Se puede utilizar una placa de enfriamiento para disminuir el tiempo de solidificación. - Agregue 1-2 ml de la solución de agarosa e inserte suavemente el dispositivo sobre la agarosa líquida.
NOTA: La colocación del dispositivo debe realizarse con cuidado para evitar burbujas de aire en la interfaz del dispositivo de agarosa. - Espere ~ 30 minutos o hasta que la agarosa se solidifique.
NOTA: Se puede utilizar una placa de enfriamiento para disminuir el tiempo de solidificación. - Retire suavemente el dispositivo de la agarosa.
NOTA: La eliminación es fundamental. Se debe retirar con cuidado para mantener intactas las características de la agarosa; de lo contrario, la agarosa puede interrumpirse. - Agregue 2 ml de medio DMEM, espere 10 minutos, deseche el medio y reemplácelo con DMEM nuevo. Repita esto tres veces para lavar el pozo correctamente.
- Agregue 2 mL de DMEM y coloque la placa de 6 pocillos en una incubadora (a 37 °C con 5% de CO2 y 80% de humedad) hasta la siembra de la celda (Figura 2A-F, Video Suplementario 1).
- Diluir el polvo de agarosa en solución salina tamponada con fosfato (1x PBS) y homogeneizar la suspensión resultante con movimientos circulares.
2. Generación de esferoides tisulares
NOTA: Los diferentes linajes celulares tienen diferentes propiedades de adhesión. Por lo tanto, con esta metodología, es posible que algunos tipos de células no formen correctamente los esferoides tisulares.
- Cultivar las células siguiendo el cultivo tradicional de monocapa (es decir, cultivar las células en matraces de cultivo celular utilizando DMEM con glucosa baja suplementada con suero fetal bovino (FBS) al 10%, 100 μg/mL de penicilina y 100 μg/mL de estreptomicina) (ver Tabla de Materiales). Mantenga las células a 37 °C en una incubadora de CO2 al 5% y controle hasta que alcancen el 80% de confluencia.
- Después de alcanzar la confluencia deseable, lave las células con 1x PBS.
NOTA: Se recomienda utilizar 5 mL para matraces de25 cm2, 10 mLpara matraces de 75 cm2 y 15 mL para matracesde 150 cm2 . - Añadir la enzima de disociación e incubar las células durante 2-5 min a 37 °C con 5% de CO2 y 80% de humedad.
NOTA: En el presente estudio se utilizó tripsina al 0,125% con 0,78 mM de ácido etilendiaminotetraacético (EDTA) como enzima de disociación (ver Tabla de Materiales). - Observe el desprendimiento de las células de los matraces de cultivo celular y agregue un medio de crecimiento suplementado con FBS para neutralizar la enzima de disociación celular.
NOTA: Para el presente estudio se utilizó DMEM con glucosa baja (ver Tabla de Materiales) suplementado con FBS al 10%. - Centrifugar la suspensión de la célula a 400 x g durante 5 min a temperatura ambiente. A continuación, cuente las celdas manualmente.
- Tome 50 x 105 celdas por tubo y agregue 5 mL de 1x PBS.
NOTA: El número de células sembradas influye en el diámetro final del esferoide tisular. Por lo tanto, se puede aumentar el número de células para generar esferoides de tejido con diámetros más grandes. - Centrifugar la suspensión de la célula a 400 x g durante 5 min a temperatura ambiente.
- Retirar el sobrenadante con una pipeta, añadir 1 mL del medio de cultivo celular y homogeneizar la solución.
NOTA: En el presente estudio, se utilizó un medio de cultivo completo de DMEM con glucosa baja, suplementado con FBS al 10%, 100 μg/mL de penicilina y 100 μg/mL de estreptomicina. - Retire 2 mL de medio de la placa de 6 pocillos (paso 1.1.9) y agregue 1 mL de la suspensión celular al centro del molde de agarosa formado por el biodispositivo impreso en 3D (paso 1.1.7). Espere hasta que las células se sedimenten en las micro resecciones (~ 20-30 min) y agregue con cuidado 1 mL de medio de cultivo celular en el pocillo.
NOTA: Hay que tener mucho cuidado en este paso. Se recomienda añadir suavemente el medio, colocar la punta de la pipeta cerca de la pared del pocillo y dispensar en pequeñas cantidades. - Coloque la placa de 6 pocillos en la incubadora (a 37 °C con 5% de CO2 y 80% de humedad) para que se formen los esferoides de tejido (aproximadamente 24-48 h, dependiendo del tipo de célula) (Figura 3).
NOTA: Los diferentes tipos de células (por ejemplo, células cancerosas, células primarias) tienen diferentes cinéticas de autoensamblaje11.
Resultados
Generación de micro resecciones homogéneas utilizando el dispositivo tipo sello impreso en 3D
El dispositivo similar a un sello impreso en 3D se fabricó con éxito mediante el método de estereolitografía12 utilizando una resina fotocurable (Figura 2A). El dispositivo final estaba compuesto por micropines cilíndricos con una altura de 1,3 mm y una anchura de 650 μm (Figura 2A). Su uso como molde maestro para producir micro resecciones no adherentes se logró manteniendo la geometría (Figura 2B-F y Video Suplementario 1). El dispositivo era fácil de usar, fácil de esterilizar y podía reutilizarse a largo plazo. Además, también es ajustable para diferentes tamaños de placas de pocillos (es decir, 6 pocillos, 12 pocillos, 24 pocillos, 96 pocillos) y placas de Petri (es decir, 30 mm, 50 mm, 90 mm, 150 mm). Aquí, mostramos datos sobre el dispositivo para la placa de 6 pocillos. Generó 750 micro resecciones homogéneas por pocillo o 4.716 por placa de 6 pocillos (Figura 2C-D). Pueden producirse inconvenientes como la rotura del molde no adherente y la deformación de la geometría de la microrresección si el dispositivo se retira antes de tiempo (Figura 2G).
Producción a gran escala de esferoides tisulares
Las células se sembraron en los moldes de agarosa no adherentes, se sedimentaron y, aproximadamente 24 h después, se formaron los esferoides de tejido. La producción a gran escala de los esferoides se logró manteniendo su forma, tamaño (123 μm ± 3 μm) y viabilidad (Figura 3A-D). Esta metodología apoyó el cultivo de esferoides durante meses (datos no mostrados).
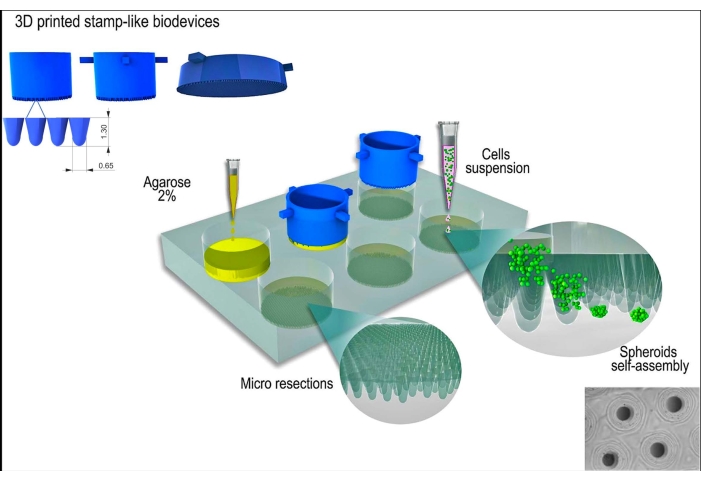
Figura 1: Representación esquemática de la generación de esferoides tisulares utilizando un biodispositivo impreso en 3D similar a un sello. El biodispositivo, compuesto por microclavijas cilíndricas, moldea un hidrogel no adherente (por ejemplo, agarosa) para formar una matriz de microrresecciones uniformes. Después de la solidificación de la agarosa y el tiempo de incubación con el medio de cultivo celular (para aclimatar los nuevos moldes no adherentes), la suspensión celular se siembra en los moldes y las células se agregan, se autoensamblan y se compactan en forma esférica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El dispositivo similar a un sello impreso en 3D utilizado como molde maestro para formar agarosa micromoldeada no adherente. (A) El dispositivo similar a un sello impreso en 3D. (B) La inserción del dispositivo en la agarosa líquida para formar las micro resecciones. (C-E) Después de la extracción del dispositivo, se forman resecciones homogéneas. (E) Barra de escala = 200 μm. (F) Agarosa micromoldeada después de la incubación con medio de cultivo celular (color rosa: medio celular). (G) Retirar el dispositivo de la agarosa cuando no está completamente solidificado conduce a su interrupción (línea amarilla con flecha). Haga clic aquí para ver una versión más grande de esta figura.
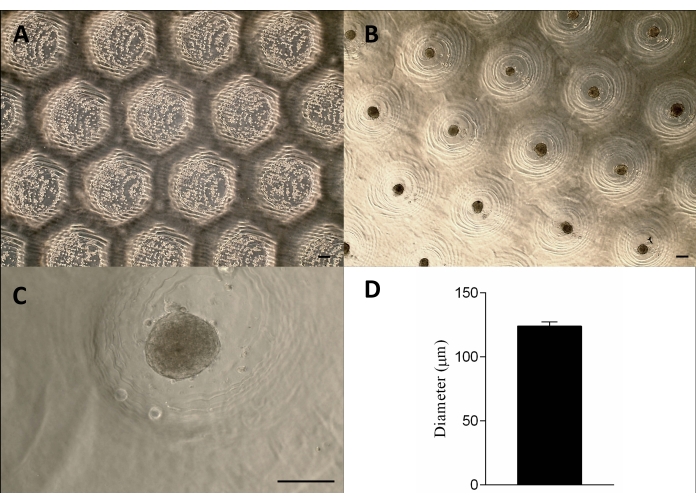
Figura 3: Siembra de células y formación de esferoides. Microscopía de contraste de fase (A) 0 h después de la siembra de las células en las micro resecciones (puntos dentro de las resecciones). (B-C) Los esferoides se formaron aproximadamente 24 h después de la siembra. Barra de escala = 100 μm. (D) Representación gráfica del diámetro de los esferoides, n = 4. Los esferoides formados son homogéneos en forma y tamaño. Haga clic aquí para ver una versión más grande de esta figura.
Video complementario 1: Agarosa micromoldeada después de la extracción del dispositivo similar a un sello. Haga clic aquí para descargar este video.
Discusión
El presente protocolo describe un método sencillo, rápido y barato para la producción a gran escala de esferoides tisulares. Se utilizó un dispositivo impreso en 3D similar a un sello como molde maestro, que generó hasta 4.716 esferoides por placa de 6 pocillos. Se ha demostrado que las células cultivadas como esferoides tienen respuestas biológicas más realistas que se asemejan mucho al entorno in vivo 1. Debido a sus ventajas, los esferoides tisulares representan una tendencia emergente hacia modelos de estudio superiores, más confiables y más predictivos13,14. Por lo tanto, el desarrollo de nuevas metodologías para lograr la producción a gran escala es fundamental para aprovechar su aplicación.
Para lograr con éxito la generación de esferoides tisulares utilizando esta metodología, los pasos críticos, como la inserción del dispositivo en la agarosa líquida, deben realizarse con precaución para evitar burbujas de aire. La presencia de burbujas de aire puede perjudicar el correcto moldeo de las micro resecciones. En consecuencia, retirar el dispositivo antes de la solidificación total de la agarosa puede resultar en la ruptura del molde de agarosa. Estos pasos son esenciales para producir moldes de agarosa adecuados para la formación de esferoides de tejidos. La variabilidad de forma y tamaño del lote de esferoides generado debe ser mínima. Por lo tanto, uno de los puntos deterministas es la adición lenta del medio de cultivo después de que las células se siembran en el molde de agarosa. Esto requiere una dispensación suave del líquido para no perturbar las células que ya han entrado en las micro resecciones. De lo contrario, algunas microrresecciones podrían haber aumentado las concentraciones de células, lo que conducirá a una heterogeneidad en el tamaño entre los esferoides.
Además de ser sencillo, rápido y económico, este protocolo también es flexible (es decir, es posible ajustar algunas modificaciones a las particularidades del experimento). Alternativamente a la agarosa, se puede usar polidimetilsiloxano (PDMS) para formar los moldes. El PDMS es un elastómero que se utiliza ampliamente para fabricar chips microfluídicos15. Tiene propiedades como la biocompatibilidad, la transparencia óptica, la inercia química, la estabilidad térmica y la permeabilidad a los gases15. A diferencia de la agarosa, los moldes fabricados con PDMS son más resistentes y también se pueden reutilizar con preservación de la geometría de micro resección.
En la actualidad, la búsqueda de un medio alternativo de cultivo celular libre de suero ha aumentado en todo el mundo16,17. Aunque FBS es un suplemento tradicional para el cultivo celular, su uso tiene problemas éticos y una posible variabilidad de lotes. Sin embargo, considerando la aplicación clínica de los esferoides, los riesgos de reacciones inmunes y transmisión de enfermedades perjudican el uso de FBS como suplemento medio16. Por lo tanto, se puede utilizar un medio de cultivo celular libre de suero/xeno para formar los esferoides siguiendo la metodología actual. Por ejemplo, los estudios han utilizado un medio especial de cultivo en 3D compuesto por albúmina humana, ácido ascórbico, insulina, transferrina y selenio para formar esferoides de células madre mesenquimales/estromales humanas 4,8.
La formación exitosa de esferoides se puede determinar por su forma esferoidal compacta. Hasta la fecha, algunos estudios han reportado el impacto que los mediadores de adhesión celular (e.g., E-cadherina, integrinas), así como los microtúbulos del citoesqueleto y los filamentos de actina, tienen sobre el autoensamblaje celular y la posterior compactación en esferoides18,19. Por lo tanto, las células que presentan desequilibrio en la expresión de estos componentes podrían no ser capaces de compactarse y formar los esferoides. Por lo tanto, la formación de esferoides difiere según la línea celular; Por lo tanto, es posible que algunos tipos de células no sean opciones adecuadas para la metodología descrita en este documento.
En el presente protocolo, se utilizó un dispositivo similar a un sello impreso en 3D, compuesto por micropines cilíndricos, para moldear un hidrogel no adherente (por ejemplo, agarosa) para formar una matriz de resecciones microestructuradas uniformes. También es posible observar (es decir, mediante imágenes) la agregación, el autoensamblaje y la compactación de la célula en tiempo real. Además, uno tiene una mano de obra mínima para agregar/intercambiar medio y agregar medicamentos u otros compuestos. Además, se pueden extraer los esferoides para su posterior análisis, como la microscopía electrónica, la citometría y la histología, simplemente aplicando un chorro dirigido con una pipeta cargada con medio o PBS. Se han reportado varias metodologías para generar esferoides, como la gota colgante, los pozos de fondo recubiertos en forma de U, los dispositivos microfluídicos y el uso de una matriz polimérica. Sin embargo, suelen ser complejos, lentos, laboriosos, costosos o pueden generar esferoides heterogéneos 9,10. A pesar de que la producción a gran escala de esferoides se logró utilizando la metodología de gota colgante20, todavía es difícil seguir el proceso de formación de esferoides y realizar el intercambio de medios o la adición de fármacos/compuestos10.
Los hidrogeles no adhesivos micromoldeados se han utilizado como estrategia para formar esferoides y también moldes para guiar la formación de microtejidos más grandes10. Sin embargo, los moldes maestros utilizados son principalmente de silicona, no son adecuados para el uso a largo plazo y pueden ser costosos21. Este estudio empleó estereolitografía (SLA) para la tecnología de impresión 3D para generar moldes maestros altamente uniformes. SLA genera el prototipo con velocidad, rentabilidad, flexibilidad y precisión22. Además, sus ventajas para la fabricación personalizada se han utilizado en varios campos, incluyendo la ingeniería de tejidos y la biomedicina en general22.
Se sabe que los cultivos de células esferoides son modelos de estudio in vitro fisiológicamente relevantes que pueden parecerse mucho a las características humanas. Por lo tanto, se han utilizado como modelo para estudiar la aparición de enfermedades y la toxicología y ya se comercializan como bioproducto para la medicina regenerativa 23,24,25. En consecuencia, se utilizan como materia prima para tecnologías de vanguardia como la bioimpresión 3D 3,26 y los órganos en chips24,27, lo que demuestra continuamente la importancia de los cultivos de esferoides y la importancia de desarrollar nuevas estrategias para generarlos a gran escala.
Divulgaciones
Los dispositivos impresos en 3D fueron ofrecidos por la startup Bioedtech, en la que Janaína Dernovsek es cofundadora y directora de innovación. Los autores declaran no tener intereses financieros contrapuestos.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación de Apoyo a la Investigación del Estado de Río de Janeiro (FAPERJ, Brasil), la Coordinación para el Perfeccionamiento del Personal de Nivel Superior (CAPES, Brasil) y el Consejo Nacional de Desarrollo Científico y Tecnológico de Brasil (CNPq, Brasil). Agradecemos a Bioedtech por proporcionar los dispositivos tipo sello utilizados en este estudio y al profesor Bartira Bergmann del Laboratorio de Inmunofarmacología por el uso de sus instalaciones de cultivo celular.
Materiales
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
Referencias
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados