Method Article
Generazione di sferoidi tissutali tramite un dispositivo simile a un timbro stampato in 3D
In questo articolo
Riepilogo
Il presente protocollo descrive una tecnica per produrre sferoidi tissutali su larga scala in modo economico utilizzando un dispositivo simile a un timbro stampato in 3D.
Abstract
I progressi nella coltura cellulare 3D hanno sviluppato modelli in vitro più rilevanti dal punto di vista fisiologico, come gli sferoidi tissutali. Le cellule coltivate come sferoidi hanno risposte biologiche più realistiche che assomigliano all'ambiente in vivo . Grazie ai loro vantaggi, gli sferoidi tissutali rappresentano una tendenza emergente verso modelli di studio superiori, più affidabili e più predittivi con un'ampia gamma di applicabilità biotecnologica. Tuttavia, le piattaforme riproducibili in grado di raggiungere la produzione su larga scala di sferoidi tissutali sono diventate un'esigenza insoddisfatta per esplorare appieno e potenziare il loro potenziale. In questo articolo, la produzione su larga scala di sferoidi tissutali omogenei è riportata utilizzando una metodologia a basso costo ed efficace in termini di tempo. È stato sviluppato un dispositivo simile a un timbro stampato in 3D per generare fino a 4.716 sferoidi per piastra a 6 pozzetti. Il dispositivo è fabbricato con il metodo della stereolitografia utilizzando una resina fotopolimerizzabile. Il dispositivo finale è composto da micropin cilindrici, con un'altezza di 1,3 mm e una larghezza di 650 μm. Questo approccio consente la rapida generazione di sferoidi omogenei e sferoidi co-coltivati con forma e dimensioni uniformi e vitalità cellulare del >95%. Inoltre, il dispositivo a forma di timbro è sintonizzabile per piastre a pozzetti di diverse dimensioni e piastre di Petri. È facilmente sterilizzabile e può essere riutilizzato per lunghi periodi. L'efficiente produzione su larga scala di sferoidi tissutali omogenei è essenziale per sfruttare la loro traduzione per molteplici aree industriali, come l'ingegneria tissutale, lo sviluppo di farmaci, la modellazione di malattie e la medicina personalizzata su richiesta.
Introduzione
Gli sferoidi tissutali sono micro-tessuti 3D formati da sospensioni cellulari che subiscono l'autoassemblaggio senza forze esterne1. Questi sferoidi sono stati ampiamente utilizzati nei protocolli di biofabbricazione grazie alla loro somiglianza con le caratteristiche chiave del sistema fisiologico umano 2,3. Gli sferoidi tissutali forniscono un metabolismo, una dinamica del citoscheletro, una vitalità cellulare e un'attività metabolica e secrezionale più simili rispetto alle tradizionali colture cellulari monostrato1. Grazie alla loro capacità di fusione, possono anche essere utilizzati come elementi costitutivi (ad esempio, protocolli di bioprinting) per formare complessi costrutti di ingegneria tissutale con una maggiore rilevanza biologica 4,5.
A causa della loro rilevanza biologica, gli sferoidi tissutali sono stati utilizzati come strumento biotecnologico per protocolli che spaziano dall'ingegneria tissutale, allo sviluppo di farmaci, alla modellazione di malattie e alla valutazione nanotossicologica, riducendo i tempi, i costi di spazio e i test sugli animali 3,6,7,8. Ciononostante, per esplorare appieno e sfruttare appieno il potenziale degli sferoidi tissutali, sono altamente necessari metodi affidabili e riproducibili che mirino alla loro produzione su larga scala, e questi rimangono una sfida continua.
Diverse metodologie producono sferoidi, come gocce sospese, pozzetti di fondo a forma di U rivestiti, microfluidica e utilizzando una matrice polimerica 9,10. Sebbene queste metodologie abbiano aperto la strada all'interno del mercato della produzione di sferoidi, sono ancora complesse, dispendiose in termini di tempo, laboriose o costose10.
Il presente protocollo riporta la produzione su larga scala di sferoidi tissutali omogenei utilizzando una metodologia a basso costo ed efficace in termini di tempo. Abbiamo sviluppato un dispositivo simile a un timbro stampato in 3D per generare fino a 4.716 sferoidi per piastra a 6 pozzetti. Inoltre, il dispositivo a forma di timbro può essere personalizzato per produrre più sferoidi per pozzetto, adatto a diverse piastre di coltura cellulare. È facilmente sterilizzabile e può essere riutilizzato per lunghi periodi. L'efficiente produzione su larga scala di sferoidi tissutali omogenei è essenziale per tradurre il loro uso nelle cliniche, contribuendo a molteplici aree dell'industria come l'ingegneria tissutale, lo sviluppo di farmaci, la modellazione delle malattie e la medicina personalizzata su richiesta.
Protocollo
La linea cellulare L929, fibroblasti di topo, è stata utilizzata per il presente studio. Il biodispositivo stampato in 3D simile a un francobollo è stato ottenuto da una fonte commerciale (vedi Tabella dei materiali). Durante tutto il protocollo sono state seguite buone pratiche di coltura cellulare e tecniche sterili. Il dispositivo fabbricato è stato sterilizzato strofinandolo con alcol al 70% ed esponendolo alla luce UV per 15 minuti. I terreni di coltura cellulare e le soluzioni sono stati riscaldati a 37 °C prima di entrare in contatto con le cellule o gli sferoidi tissutali. Una rappresentazione schematica del protocollo è mostrata nella Figura 1.
1. Preparazione di stampi non aderenti dal dispositivo a timbro
- Preparare il gel di agarosio al 2% (p/v) seguendo i passaggi seguenti.
- Diluire la polvere di agarosio in soluzione salina tamponata con fosfato (1x PBS) e omogeneizzare la sospensione risultante con movimenti circolari.
NOTA: Questa soluzione può essere inserita in una bottiglia di vetro. In questa fase, la soluzione di agarosio non sarà traslucida. - Metti la bottiglia di vetro nel microonde e impostala per 30 s. Ogni 5 s, fermare il microonde, rimuovere la bottiglia di vetro e omogeneizzare manualmente la soluzione con movimenti circolari. Il processo di riscaldamento deve essere eseguito fino a quando la soluzione non raggiunge uno stato liquido-limpido.
NOTA: Una piastra riscaldante può essere utilizzata anche come alternativa al microonde. Dopo il processo di riscaldamento, la soluzione deve essere traslucida/limpida. - Aggiungere 1 mL di soluzione di agarosio a ciascun pozzetto di una piastra a 6 pozzetti prevista per l'esperimento.
- Attendere ~15 minuti o fino a quando l'agarosio non si solidifica.
NOTA: Una piastra di raffreddamento può essere utilizzata per ridurre il tempo di solidificazione. - Aggiungere 1-2 ml di soluzione di agarosio e inserire delicatamente il dispositivo sopra l'agarosio liquido.
NOTA: Il posizionamento del dispositivo deve essere eseguito con attenzione per evitare bolle d'aria nell'interfaccia agarosio-dispositivo. - Attendere ~30 minuti o fino a quando l'agarosio non si solidifica.
NOTA: Una piastra di raffreddamento può essere utilizzata per ridurre il tempo di solidificazione. - Rimuovere delicatamente il dispositivo dall'agarosio.
NOTA: La rimozione è fondamentale. Bisogna rimuoverlo con cura per mantenere intatte le caratteristiche dell'agarosio; In caso contrario, l'agarosio può essere interrotto. - Aggiungere 2 ml di supporto DMEM, attendere 10 minuti, eliminare il supporto e sostituirlo con DMEM nuovo. Ripeti l'operazione tre volte per lavare correttamente il pozzo.
- Aggiungere 2 mL di DMEM e posizionare la piastra a 6 pozzetti in un incubatore (a 37 °C con 5% di CO2 e 80% di umidità) fino alla semina della cella (Figura 2A-F, Video supplementare 1).
- Diluire la polvere di agarosio in soluzione salina tamponata con fosfato (1x PBS) e omogeneizzare la sospensione risultante con movimenti circolari.
2. Generazione di sferoidi tissutali
NOTA: Diverse linee cellulari hanno proprietà di adesione diverse. Quindi, utilizzando questa metodologia, alcuni tipi di cellule potrebbero non formare correttamente gli sferoidi tissutali.
- Far crescere le cellule seguendo la tradizionale coltura monostrato (cioè, far crescere le cellule in fiasche di coltura cellulare utilizzando DMEM a basso contenuto di glucosio integrato con il 10% di siero fetale bovino (FBS), 100 μg/mL di penicillina e 100 μg/mL di streptomicina) (vedi Tabella dei materiali). Mantenere le celle a 37 °C in un incubatore al 5% di CO2 e monitorare fino a quando non raggiungono l'80% di confluenza.
- Dopo aver raggiunto la confluenza desiderata, lavare le celle con 1x PBS.
NOTA: Si consiglia di utilizzare 5 ml per pallonida 25 cm, 10 ml per palloni da 75 cm2 e 15 ml per palloni da 150 cm2 . - Aggiungere l'enzima di dissociazione e incubare le cellule per 2-5 minuti a 37 °C in 5% di CO2 e 80% di umidità.
NOTA: Il presente studio ha utilizzato lo 0,125% di tripsina con 0,78 mM di acido etilendiammina tetraacetico (EDTA) come enzima di dissociazione (vedi Tabella dei materiali). - Osservare il distacco delle cellule dai palloni di coltura cellulare e aggiungere un terreno di coltura integrato con FBS per neutralizzare l'enzima di dissociazione cellulare.
NOTA: Per il presente studio, è stato utilizzato DMEM a basso contenuto di glucosio (vedi Tabella dei materiali) integrato con FBS al 10%. - Centrifugare la sospensione cellulare a 400 x g per 5 minuti a temperatura ambiente. Quindi, conta le celle manualmente.
- Prelevare 50 x 105 cellule per provetta e aggiungere 5 mL di 1x PBS.
NOTA: Il numero di cellule seminate influenza il diametro finale dello sferoide del tessuto. Quindi, si può aumentare il numero di cellule per generare sferoidi tissutali con diametri maggiori. - Centrifugare la sospensione cellulare a 400 x g per 5 minuti a temperatura ambiente.
- Rimuovere il surnatante utilizzando una pipetta, aggiungere 1 mL del terreno di coltura cellulare e omogeneizzare la soluzione.
NOTA: Nel presente studio è stato utilizzato un terreno di coltura completo di DMEM a basso contenuto di glucosio, integrato con FBS al 10%, penicillina 100 μg/mL e streptomicina 100 μg/mL. - Rimuovere 2 mL di terreno dalla piastra a 6 pozzetti (passaggio 1.1.9) e aggiungere 1 mL di sospensione cellulare al centro dello stampo di agarosio formato dal biodispositivo stampato in 3D (passaggio 1.1.7). Attendere che le cellule si sedimentino nelle micro resezioni (~20-30 min) e aggiungere con cura 1 mL di terreno di coltura cellulare nel pozzetto.
NOTA: È necessario prestare particolare attenzione in questo passaggio. Si consiglia di aggiungere delicatamente il terreno, posizionare il puntale della pipetta vicino alla parete del pozzetto ed erogare in piccole quantità. - Posizionare la piastra a 6 pozzetti nell'incubatore (a 37 °C con 5% di CO2 e 80% di umidità) per la formazione degli sferoidi tissutali (circa 24-48 ore, a seconda del tipo di cellula) (Figura 3).
NOTA: Diversi tipi di cellule (ad esempio, cellule tumorali, cellule primarie) hanno una cinetica di autoassemblaggio diversa11.
Risultati
Generazione di micro resezioni omogenee utilizzando il dispositivo simile a un timbro stampato in 3D
Il dispositivo simile a un timbro stampato in 3D è stato prodotto con successo con il metodo della stereolitografia12 utilizzando una resina fotopolimerizzabile (Figura 2A). Il dispositivo finale era composto da micropin cilindrici con un'altezza di 1,3 mm e una larghezza di 650 μm (Figura 2A). Il suo utilizzo come stampo master per produrre micro resezioni non aderenti è stato ottenuto mantenendo la geometria (Figura 2B-F e Video supplementare 1). Il dispositivo era semplice da usare, facile da sterilizzare e poteva essere riutilizzato a lungo termine. Inoltre, è anche sintonizzabile per piastre a pozzetti di diverse dimensioni (ad esempio, 6 pozzetti, 12 pozzetti, 24 pozzetti, 96 pozzetti) e piastre di Petri (ad esempio, 30 mm, 50 mm, 90 mm, 150 mm). Qui mostriamo i dati relativi al dispositivo per la piastra a 6 pozzetti. Ha generato 750 micro resezioni omogenee per pozzetto o 4.716 per piastra a 6 pozzetti (Figura 2C-D). Se il dispositivo viene ritirato precocemente, possono verificarsi inconvenienti come la rottura dello stampo non aderente e la deformazione della geometria di microresezione (Figura 2G).
Produzione su larga scala di sferoidi tissutali
Le cellule sono state seminate sugli stampi di agarosio non aderenti, sedimentate e circa 24 ore dopo hanno formato gli sferoidi tissutali. La produzione su larga scala degli sferoidi è stata ottenuta mantenendo la loro forma, dimensione (123 μm ± 3 μm) e vitalità (Figura 3A-D). Questa metodologia ha supportato la coltura degli sferoidi per mesi (dati non mostrati).
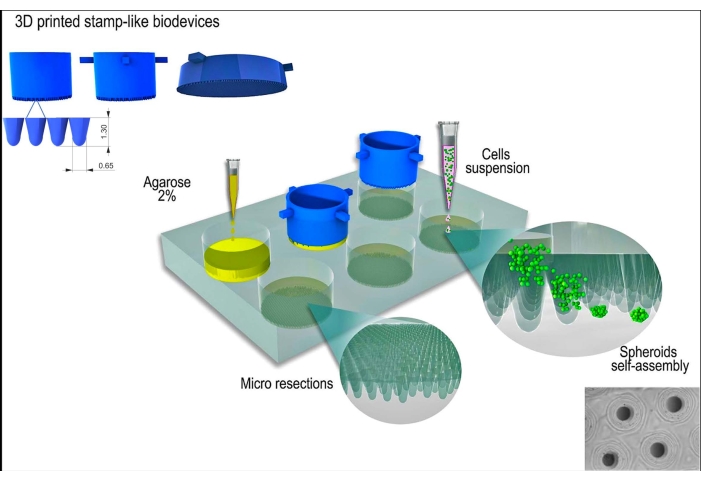
Figura 1: Rappresentazione schematica della generazione di sferoidi tissutali utilizzando un biodispositivo stampato in 3D simile a un timbro. Il biodispositivo, composto da microperni cilindrici, modella un idrogel non aderente (ad es. agarosio) per formare una serie di micro resezioni uniformi. Dopo la solidificazione dell'agarosio e il tempo di incubazione con il terreno di coltura cellulare (per acclimatare i nuovi stampi non aderenti), la sospensione cellulare viene seminata sugli stampi e le cellule si aggregano, si autoassemblano e si compattano in una forma sferica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Il dispositivo simile a un timbro stampato in 3D utilizzato come stampo master per formare agarosio microstampato non aderente. (A) Il dispositivo simile a un timbro stampato in 3D. (B) L'inserimento del dispositivo nell'agarosio liquido per formare le micro resezioni. (C-E) Dopo la rimozione del dispositivo, si formano resezioni omogenee. (E) Barra della scala = 200 μm. (F) Agarosio micromodellato dopo incubazione con terreno di coltura cellulare (colore rosa: terreno cellulare). (G) La rimozione del dispositivo dall'agarosio quando non è completamente solidificato provoca la sua rottura (linea gialla con freccia). Clicca qui per visualizzare una versione più grande di questa figura.
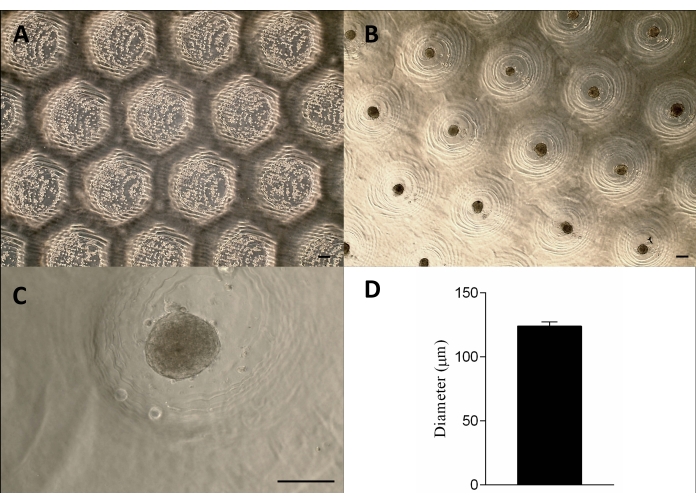
Figura 3: Semina cellulare e formazione di sferoidi. Microscopia a contrasto di fase (A) 0 h dopo la semina delle cellule nelle micro resezioni (punti all'interno delle resezioni). (B-C) Gli sferoidi si sono formati circa 24 ore dopo la semina. Barra della scala = 100 μm. (D) Rappresentazione grafica del diametro degli sferoidi, n = 4. Gli sferoidi formati sono omogenei per forma e dimensioni. Clicca qui per visualizzare una versione più grande di questa figura.
Video supplementare 1: Agarosio micromodellato dopo la rimozione del dispositivo simile a un timbro. Clicca qui per scaricare questo video.
Discussione
Il presente protocollo descrive un metodo semplice, veloce ed economico per la produzione su larga scala di sferoidi tissutali. Come stampo principale è stato utilizzato un dispositivo stampato in 3D simile a un timbro, che ha generato fino a 4.716 sferoidi per piastra a 6 pozzetti. È stato dimostrato che le cellule coltivate come sferoidi hanno risposte biologiche più realistiche che assomigliano molto all'ambiente in vivo 1. Grazie ai loro vantaggi, gli sferoidi tissutali rappresentano una tendenza emergente verso modelli di studio superiori, più affidabili e più predittivi13,14. Pertanto, lo sviluppo di nuove metodologie per ottenere una produzione su larga scala è fondamentale per sfruttare la loro applicazione.
Per ottenere con successo la generazione di sferoidi tissutali utilizzando questa metodologia, è necessario eseguire con cautela passaggi critici come l'inserimento del dispositivo nell'agarosio liquido per evitare bolle d'aria. La presenza di bolle d'aria potrebbe compromettere il corretto stampaggio delle micro resezioni. Di conseguenza, la rimozione del dispositivo prima della solidificazione totale dell'agarosio può provocare la rottura dello stampo di agarosio. Questi passaggi sono essenziali per produrre stampi per agarosio adatti alla formazione di sferoidi tissutali. La variabilità della forma e delle dimensioni per il lotto generato di sferoidi deve essere minima. Pertanto, uno dei punti deterministici è l'aggiunta lenta del terreno di coltura dopo che le cellule sono state seminate nello stampo di agarosio. Ciò richiede un'erogazione delicata del liquido per non disturbare le cellule che sono già entrate nelle micro resezioni. In caso contrario, alcune micro resezioni potrebbero avere concentrazioni aumentate di cellule, il che porterà a un'eterogeneità delle dimensioni tra gli sferoidi.
Oltre ad essere semplice, veloce ed economico, questo protocollo è anche flessibile (cioè, è possibile apportare alcune modifiche alle particolarità dell'esperimento). In alternativa all'agarosio, si può usare il polidimetilsilossano (PDMS) per formare gli stampi. PDMS è un elastomero ampiamente utilizzato per fabbricare chip microfluidici15. Ha proprietà come la biocompatibilità, la trasparenza ottica, l'inerzia chimica, la stabilità termica e la permeabilità ai gas15. A differenza dell'agarosio, gli stampi realizzati con PDMS sono più resistenti e possono essere riutilizzati anche con conservazione della geometria di micro resezione.
Attualmente, la ricerca di un terreno di coltura cellulare alternativo privo di siero è aumentata in tutto il mondo16,17. Sebbene FBS sia un integratore tradizionale per colture cellulari, il suo utilizzo presenta problemi etici e una possibile variabilità dei lotti. Tuttavia, considerando l'applicazione clinica degli sferoidi, i rischi di reazioni immunitarie e di trasmissione di malattie compromettono l'uso di FBS come integratore di terreno16. Pertanto, è possibile utilizzare un terreno di coltura cellulare privo di siero/xeno per formare gli sferoidi seguendo la presente metodologia. Ad esempio, gli studi hanno utilizzato uno speciale terreno di coltura 3D composto da albumina umana, acido ascorbico, insulina, transferrina e selenio per formare sferoidi di cellule staminali mesenchimali/stromali umane 4,8.
Il successo della formazione degli sferoidi può essere determinato dalla loro forma sferoidale compatta. Ad oggi, alcuni studi hanno riportato l'impatto che i mediatori dell'adesione cellulare (ad esempio, E-caderina, integrine), così come i microtubuli del citoscheletro e i filamenti di actina, hanno sull'autoassemblaggio cellulare e sull'ulteriore compattazione in sferoidi18,19. Pertanto, le cellule che presentano uno squilibrio nell'espressione di questi componenti potrebbero non essere in grado di compattarsi e formare gli sferoidi. Quindi, la formazione di sferoidi differisce a seconda della linea cellulare; Pertanto, alcuni tipi di cellule potrebbero non essere opzioni adatte per la metodologia qui descritta.
Nel presente protocollo, un dispositivo simile a un timbro stampato in 3D, composto da microperni cilindrici, è stato utilizzato per modellare un idrogel non aderente (ad esempio, agarosio) per formare una serie di resezioni microstrutturate uniformi. È anche possibile osservare (cioè utilizzando l'imaging) l'aggregazione, l'autoassemblaggio e la compattazione della cella in tempo reale. Inoltre, si ha un lavoro minimo per aggiungere/scambiare terreno e aggiungere farmaci o altri composti. Inoltre, è possibile prelevare gli sferoidi per la post-analisi, come la microscopia elettronica, la citometria e l'istologia, semplicemente applicando un getto diretto utilizzando una pipetta caricata con terreno o PBS. Sono state riportate diverse metodologie per generare sferoidi, come gocce sospese, pozzetti di fondo a forma di U rivestiti, dispositivi microfluidici e l'utilizzo di una matrice polimerica. Tuttavia, di solito sono complessi, richiedono molto tempo, richiedono molto lavoro, sono costosi o possono generare sferoidi eterogenei 9,10. Sebbene la produzione su larga scala di sferoidi sia stata ottenuta utilizzando la metodologia della goccia sospesa20, è ancora difficile seguire il processo di formazione degli sferoidi ed eseguire lo scambio medio o l'aggiunta di farmaci/composti10.
Gli idrogel non adesivi microstampati sono stati utilizzati come strategia per formare sferoidi e anche stampi per guidare la formazione di microtessuti più grandi10. Tuttavia, gli stampi master utilizzati sono principalmente in silicone, non sono adatti per un uso a lungo termine e potrebbero essere costosi21. Questo studio ha impiegato la stereolitografia (SLA) per la tecnologia di stampa 3D per generare stampi master altamente uniformi. SLA genera il prototipo con velocità, economicità, flessibilità e precisione22. Inoltre, i suoi vantaggi per la produzione personalizzata sono stati utilizzati in diversi campi, tra cui l'ingegneria tissutale e la biomedicina in generale22.
È noto che le colture cellulari di sferoidi sono modelli di studio in vitro fisiologicamente rilevanti che possono assomigliare molto alle caratteristiche umane. Pertanto, sono stati utilizzati come modello per studiare l'insorgenza di malattie e tossicologia e sono già commercializzati come bioprodotti per la medicina rigenerativa 23,24,25. Di conseguenza, vengono utilizzati come materia prima per tecnologie all'avanguardia come il bioprinting 3D 3,26 e gli organi su chip24,27, dimostrando continuamente quanto siano significative le colture di sferoidi e l'importanza di sviluppare nuove strategie per generarle su larga scala.
Divulgazioni
I dispositivi simili a francobolli stampati in 3D sono stati offerti dalla startup Bioedtech, di cui Janaína Dernovsek è cofondatrice e direttrice dell'innovazione. Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione per il Sostegno alla Ricerca dello Stato di Rio de Janeiro (FAPERJ, Brasile), dal Coordinamento per il Miglioramento del Personale dell'Istruzione Superiore (CAPES, Brasile) e dal Consiglio Nazionale Brasiliano per lo Sviluppo Scientifico e Tecnologico (CNPq, Brasile). Ringraziamo Bioedtech per aver fornito i dispositivi simili a timbri utilizzati in questo studio e il professor Bartira Bergmann del Laboratorio di Immunofarmacologia per l'uso delle loro strutture di coltura cellulare.
Materiali
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
Riferimenti
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon