Method Article
3Dプリントされたスタンプ状デバイス による 組織スフェロイドの生成
要約
本プロトコルは、3Dプリントされたスタンプ様デバイスを使用して、大規模かつ費用対効果の高い方法で組織スフェロイドを作製する技術を記載している。
要約
3D細胞培養の進歩により、組織スフェロイドなど、生理学的に関連性のある in vitro モデルが開発されました。スフェロイドとして培養された細胞は、 in vivo 環境に似た、より現実的な生物学的応答を示します。その利点により、組織スフェロイドは、幅広いバイオテクノロジーの適用性を備えた、より優れた、より信頼性が高く、より予測可能な研究モデルに向けた新たなトレンドを表しています。しかし、組織スフェロイドの大規模生産を達成できる再現性のあるプラットフォームは、その可能性を十分に探求し、後押しする上で満たされていないニーズとなっています。本明細書では、均質な組織スフェロイドの大規模生産が、低コストで時間効率の良い方法を用いて報告されている。3Dプリントされたスタンプのようなデバイスは、6ウェルプレートあたり最大4,716個のスフェロイドを生成するために開発されました。このデバイスは、光硬化性樹脂を使用した光造形法によって製造されます。最終的なデバイスは、高さ1.3mm、幅650μmの円筒形マイクロピンで構成されています。このアプローチにより、均一な形状とサイズ、および>95%の細胞生存率を持つ均質なスフェロイドおよび共培養されたスフェロイドを迅速に作製できます。さらに、スタンプのようなデバイスは、さまざまなサイズのウェルプレートとペトリ皿に合わせて調整可能です。滅菌が簡単で、長期間再利用できます。均質組織スフェロイドの効率的な大規模生産は、組織工学、医薬品開発、疾患モデリング、オンデマンドの個別化医療など、さまざまな産業分野でその翻訳を活用するために不可欠です。
概要
組織スフェロイドは、細胞懸濁液によって形成された3次元微小組織であり、外力なしに自己組織化します1。これらのスフェロイドは、ヒトの生理学的システム2,3の主要な特徴に類似しているため、バイオファブリケーションプロトコルで広く使用されています。組織スフェロイドは、従来の単層細胞培養よりも代謝、細胞骨格動態、細胞生存率、代謝活性、分泌活性が類似しています1。その融合能力により、生物学的関連性が強化された複雑な組織工学的構築物を形成するためのビルディングブロック(バイオプリンティングプロトコルなど)としても使用できます4,5。
その生物学的関連性から、組織スフェロイドは、組織工学、医薬品開発、疾患モデリング、ナノ毒物学的評価などのプロトコルのバイオテクノロジーツールとして使用され、時間、スペースコスト、動物実験を削減してきました3,6,7,8。しかし、組織スフェロイドの可能性を十分に探求し、活用するためには、その大規模生産を目指した信頼性と再現性のある方法が非常に必要であり、これらは依然として継続的な課題です。
いくつかの方法論では、ハンギングドロップ、コーティングされたU字型ボトムウェル、マイクロ流体工学、およびポリマーマトリックス9,10の使用など、スフェロイドを作製します。これらの方法論はスフェロイド製造市場への道を切り開きましたが、それでも複雑で、時間がかかり、労働集約的で、高価です10。
本プロトコールは、低コストで時間効率の良い方法を用いた均質な組織スフェロイドの大規模生産を報告しています。3Dプリントされたスタンプのようなデバイスを開発し、6ウェルプレートあたり最大4,716個のスフェロイドを生成しました。さらに、スタンプのようなデバイスは、ウェルごとにより多くのスフェロイドを生成するように調整することができ、さまざまな細胞培養プレートに適しています。滅菌が容易で、長期間再利用できます。均質な組織スフェロイドの効率的な大規模生産は、その使用を臨床に応用するために不可欠であり、組織工学、医薬品開発、疾患モデリング、オンデマンドの個別化医療など、さまざまな産業分野に貢献しています。
プロトコル
L929細胞株であるマウス線維芽細胞を本研究に使用しました。切手のような3Dプリントされたバイオデバイスは、商用ソースから入手しました( 材料の表を参照)。良好な細胞培養の実践と無菌技術は、プロトコール全体を通して行われました。作製した装置を70%アルコールで拭き取り、15分間紫外線を当てて滅菌した。細胞培養培地および溶液を37°Cに温めてから、細胞または組織スフェロイドと接触させました。プロトコルの概略図を 図1に示します。
1.スタンプ状装置からの非接着型の作成
- 以下の手順に従って、2%(w / v)アガロースゲルを調製します。
- アガロース粉末をリン酸緩衝生理食塩水(1x PBS)で希釈し、得られた懸濁液を円運動で均質化します。
注意: この溶液はガラス瓶に入れることができます。このステップでは、アガロース溶液は半透明になりません。 - ガラス瓶を電子レンジに入れ、30秒間セットします。5秒ごとに電子レンジを停止し、ガラス瓶を取り外し、円を描くように動かして溶液を手動で均質化します。加熱プロセスは、溶液が液体の透明な状態に達するまで実行する必要があります。
注意: ホットプレートは、電子レンジの代替品としても使用できます。加熱プロセス後、溶液は半透明/透明でなければなりません。 - 実験用に計画した6ウェルプレートの各ウェルに1 mLのアガロース溶液を加えます。
- ~15分、またはアガロースが固まるまで待ちます。
注:冷却プレートを使用して、固化時間を短縮できます。 - 1〜2mLのアガロース溶液を加え、液体アガロースの上にデバイスを静かに挿入します。
注意: デバイスの配置は、アガロースデバイスインターフェースの気泡を防ぐために慎重に行う必要があります。 - ~30分、またはアガロースが固まるまで待ちます。
注:冷却プレートを使用して、固化時間を短縮できます。 - デバイスをアガロースからそっと取り外します。
メモ: 取り外しは重要です。アガロースの特徴を損なわないように、慎重に取り外す必要があります。そうしないと、アガロースが乱れる可能性があります。 - 2 mLのDMEM培地を追加し、10分間待ってから、培地を廃棄し、新しいDMEMと交換します。これを3回繰り返して、井戸を適切に洗います。
- 2 mLのDMEMを添加し、6ウェルプレートをインキュベーター(37°C、5%CO2 、湿度80%)に細胞播種するまで置きます(図2A-F、補足ビデオ1)。
- アガロース粉末をリン酸緩衝生理食塩水(1x PBS)で希釈し、得られた懸濁液を円運動で均質化します。
2. 組織スフェロイドの作製
注:細胞系が異なれば、接着特性も異なります。したがって、この方法論を使用すると、一部の種類の細胞が組織スフェロイドを適切に形成できない場合があります。
- 従来の単層培養(すなわち、10%ウシ胎児血清(FBS)、100 μg/mLペニシリン、および100 μg/mLストレプトマイシンを添加した低グルコース添加DMEMを使用して、細胞培養フラスコで細胞を増殖させます( 材料の表を参照)。細胞を5%CO2 インキュベーターで37°Cに維持し、コンフルエンスの80%に達するまでモニターします。
- 望ましい合流点に達した後、細胞を1x PBSで洗浄します。
注:25 cm2 フラスコには5 mL、75 cm2 フラスコには10 mL、150 cm2 フラスコには15 mLを使用することをお勧めします。 - 解離酵素を添加し、細胞を37°C、5%CO2 、湿度80%で2〜5分間インキュベートします。
注:本研究では、解離酵素として0.78 mMエチレンジアミン四酢酸(EDTA)を含む0.125%トリプシンを使用しました( 材料の表を参照)。 - 細胞培養フラスコからの細胞の剥離を観察し、FBSを添加した増殖培地を添加して細胞解離酵素を中和します。
注:本研究では、低グルコースのDMEM( 材料の表を参照)に10%FBSを補充して使用しました。 - 細胞懸濁液を400 x g で室温で5分間遠心分離します。次に、セルを手動でカウントします。
- チューブあたり50 x 105 個の細胞を取り、1x PBSを5 mL加えます。
注:播種される細胞の数は、最終的な組織スフェロイドの直径に影響を与えます。したがって、細胞数を増やして、より大きな直径の組織スフェロイドを生成することができます。 - 細胞懸濁液を400 x g で室温で5分間遠心分離します。
- ピペットで上清を取り出し、細胞培養液1 mLを加えて溶液をホモジナイズします。
注:本研究では、10%FBS、100μg/mLペニシリン、および100μg/mLストレプトマイシンを補充した低グルコースを含むDMEMの完全な培養培地を使用しました。 - 6ウェルプレートから2 mLの培地を取り出し(ステップ1.1.9)、3Dプリントしたバイオデバイスによって形成されたアガロース型の中心に1 mLの細胞懸濁液を加えます(ステップ1.1.7)。細胞がマイクロ切除で沈殿するまで待ち(20~30分)、ウェルに1 mLの細胞培養培地を慎重に加えます。
注:この手順では特に注意する必要があります。培地を静かに加え、ピペットチップをウェル壁の近くに置き、少量分注することをお勧めします。 - 6ウェルプレートをインキュベーター(5%CO2 、湿度80%の37°C)に置き、組織スフェロイドが形成されます(細胞の種類によって異なりますが、約24〜48時間)(図3)。
注:異なる細胞タイプ(例えば、癌細胞、初代細胞)は、異なる自己組織化動態を有する11。
結果
3Dプリントされたスタンプ状デバイスによる均質なマイクロ切除術の生成
3Dプリントされたスタンプ状デバイスは、光硬化性樹脂を用いた光造形法12により成功裏に製造した(図2A)。最終的なデバイスは、高さ1.3mm、幅650μmの円筒形マイクロピンで構成されていました(図2A)。非接着性マイクロ切除を作成するためのマスターモールドとしての使用は、形状を維持することによって達成されました(図2B-Fおよび補足ビデオ1)。この装置は使いやすく、滅菌が容易で、長期的に再利用することができました。さらに、さまざまなサイズのウェルプレート(6ウェル、12ウェル、24ウェル、96ウェル)およびペトリ皿(30mm、50mm、90mm、150mm)にも調整可能です。ここでは、6ウェルプレートのデバイスに関するデータを示します。ウェルあたり750回、または6ウェルプレートあたり4,716回の均質なマイクロ切除を行いました(図2C-D)。デバイスを早期に引き抜くと、非接着性の金型の破壊やマイクロ切除形状の変形などの欠点が発生する可能性があります(図2G)。
組織スフェロイドの大規模生産
細胞を非接着性のアガロース型に播種し、沈殿させ、約24時間後に組織スフェロイドを形成しました。スフェロイドの大規模生産は、スフェロイドの形状、サイズ(123 μm ± 3 μm)、および生存率を維持することによって達成されました(図3A-D)。この方法論は、スフェロイド培養を数ヶ月間サポートしました(データは示されていません)。
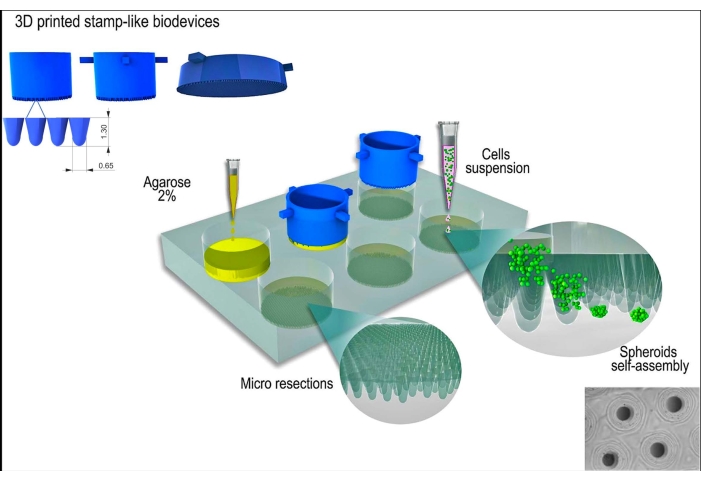
図1:スタンプのような3Dプリントバイオデバイスを使用した組織スフェロイド生成の概略図。 円筒形のマイクロピンで構成されるバイオデバイスは、非接着性のヒドロゲル(アガロースなど)を成形して、均一なマイクロ切除の配列を形成します。アガロースの固化と細胞培養培地とのインキュベーション時間(新しい非接着型に順応するため)の後、細胞懸濁液を型に播種し、細胞は凝集し、自己組織化し、球状に圧縮します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:非接着性のマイクロモールドアガロースを形成するためのマスターモールドとして使用される3Dプリントされたスタンプのようなデバイス。(B)デバイスを液体アガロースに挿入してマイクロ切除を形成すること。(C-E)装置の除去後、均質な切除が形成される。(E)スケールバー=200μm、(F)細胞培養培地(ピンク色:細胞培地)とインキュベートした後のマイクロモールドアガロース。(G)完全に固化していないときにデバイスをアガロースから取り外すと、デバイスが破壊されます(矢印付きの黄色の線)。この図の拡大版を表示するには、ここをクリックしてください。
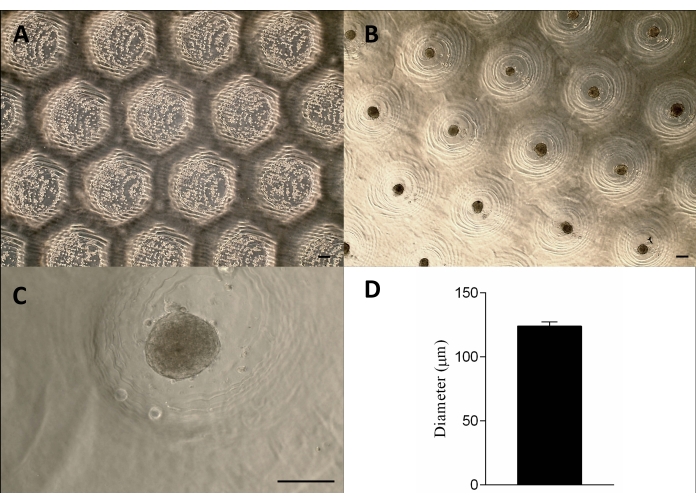
図3:細胞播種とスフェロイド形成。位相差顕微鏡法(A)は、細胞がマイクロ切除(切除内のドット)に播種してから0時間後です。(B-C)スフェロイドは播種後約24時間で形成されました。スケールバー = 100 μm. (D) スフェロイドの直径をグラフで表現したもの、n = 4。形成されたスフェロイドは、形状とサイズが均質です。この図の拡大版を表示するには、ここをクリックしてください。
補足ビデオ1:スタンプ状デバイスを取り外した後のマイクロモールドアガロース。このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
本プロトコールは、組織スフェロイドの大規模生産のための簡便で、迅速で、安価な方法を記載している。スタンプのような3Dプリントデバイスをマスターモールドとして使用し、6ウェルプレートあたり最大4,716個のスフェロイドを生成しました。スフェロイドとして培養された細胞は、in vivo環境1によく似た、より現実的な生物学的応答を持つことが示されています1。その利点により、組織スフェロイドは、より優れた、より信頼性が高く、より予測的な研究モデル13,14に向けた新たな傾向を表しています。したがって、大規模な生産を達成するための新しい方法論を開発することは、そのアプリケーションを活用するために極めて重要です。
この方法論を用いて組織スフェロイドの作製を成功させるには、液体アガロースへのデバイスの挿入などの重要なステップを、気泡を避けるために注意して実行する必要があります。気泡の存在は、マイクロ切除の正しい成形を損なう可能性があります。したがって、アガロースが完全に固化する前に装置を取り外すと、アガロース型が破裂する可能性があります。これらのステップは、組織スフェロイド形成に適したアガロース型を作製するために不可欠です。生成されたスフェロイドのバッチの形状とサイズのばらつきは最小限に抑える必要があります。したがって、決定論的な点の1つは、細胞がアガロース型に播種された後の培地のゆっくりとした添加です。これには、すでにマイクロ切除に入った細胞を乱さないように、液体を穏やかに分配する必要があります。そうでなければ、一部の微小切除によって細胞の濃度が増加し、スフェロイド間のサイズの不均一性につながる可能性があります。
このプロトコルは、シンプル、迅速、安価であることに加えて、柔軟性もあります(つまり、実験の特殊性に合わせて調整するために、いくつかの変更を加えることができます)。アガロースの代わりに、ポリジメチルシロキサン(PDMS)を使用して型を形成することもできます。PDMSは、マイクロ流体チップ15の製造に広く使用されているエラストマーである。生体適合性、光透過性、化学的に不活性であること、熱安定性、ガス透過性などの特性を持っています15。アガロースとは異なり、PDMSで作られた金型はより耐性があり、マイクロ切除形状を保持して再利用することもできます。
現在、代替の無血清細胞培養培地の探索は世界中で増加しています16,17。FBSは従来の細胞培養用サプリメントですが、その使用には倫理的な問題があり、バッチのばらつきが発生する可能性があります。それにもかかわらず、スフェロイドの臨床応用を考慮すると、免疫反応および疾患伝染のリスクは、培地サプリメントとしてのFBSの使用を損なう16。したがって、本方法論に従って、血清/ゼノフリー細胞培養培地を使用してスフェロイドを形成することができる。例えば、ヒトアルブミン、アスコルビン酸、インスリン、トランスフェリン、およびセレンからなる特殊な3D培地を用いて、ヒト間葉系/間質幹細胞スフェロイドを形成した研究が行われています4,8。
スフェロイドの形成が成功するかどうかは、そのコンパクトなスフェロイド形状によって判断できます。今日までに、いくつかの研究で、細胞接着メディエーター(E-カドヘリン、インテグリンなど)、細胞骨格微小管、アクチンフィラメントが細胞の自己組織化とスフェロイドへのさらなる圧縮に与える影響が報告されています18,19。したがって、これらの成分の発現に不均衡を示す細胞は、スフェロイドを圧縮して形成できない場合があります。したがって、スフェロイド形成は細胞株によって異なります。したがって、一部のタイプの細胞は、本明細書に記載される方法論に適した選択肢ではない可能性があります。
本プロトコルでは、円筒形のマイクロピンで構成された3Dプリントされたスタンプ様装置を使用して、非接着性のヒドロゲル(例えば、アガロース)を成形し、均一な微細構造切除の配列を形成した。また、細胞の凝集、自己組織化、圧縮をリアルタイムで観察(イメージング)することも可能です。さらに、培地の追加/交換や薬物や他の化合物の追加にかかる労力は最小限に抑えられます。さらに、電子顕微鏡、サイトメトリー、組織学などの事後分析のためにスフェロイドを回収することができますが、これは培地またはPBSを装填したピペットを使用して指向性ジェットを適用するだけです。スフェロイドを生成するためのいくつかの方法論が報告されており、例えば、ハンギングドロップ、コーティングされたU字型ボトムウェル、マイクロ流体デバイス、ポリマーマトリックスの使用などがあります。それにもかかわらず、それらは通常、複雑で、時間がかかり、労働集約的で、高価であるか、または不均一なスフェロイドを生成する可能性がある9,10。スフェロイドの大規模生産はハンギングドロップ法20を用いて達成されたが、スフェロイド形成過程を追跡し、培地交換や薬物/化合物の添加を行うことは依然として困難である10。
マイクロモールドされた非接着性ヒドロゲルは、スフェロイドを形成するための戦略として、また、より大きな微小組織の形成を導くための鋳型として使用されてきた10。ただし、使用されるマスターモールドは主にシリコンであり、長期間の使用には適さず、高価になる可能性があります21。本研究では、3Dプリンティング技術に光造形法(SLA)を採用し、均一性の高いマスターモールドを作製しました。SLAは、速度、費用対効果、柔軟性、および精度22でプロトタイプを生成します。さらに、カスタマイズされた製造のためのその利点は、組織工学や生物医学全般を含むいくつかの分野で使用されています22。
スフェロイド細胞培養は、ヒトの特徴によく似たin vitro研究モデルとして生理学的に重要であることが知られています。したがって、それらは疾患の発症や毒物学を研究するためのモデルとして使用されており、すでに再生医療のバイオ製品として商品化されています23,24,25。したがって、スフェロイドは3Dバイオプリンティング3,26や臓器チップ24,27などの最先端技術の原料として使用され、スフェロイド培養がいかに重要であるか、およびそれらを大規模に生成するための新しい戦略を開発することの重要性を継続的に示しています。
開示事項
3Dプリントされたスタンプのようなデバイスは、JanaínaDernovsekが共同創設者兼イノベーションディレクターであるスタートアップBioedtechによって提供されました。著者は、競合する金銭的利益を宣言しません。
謝辞
この研究は、リオデジャネイロ州研究支援財団(FAPERJ、ブラジル)、高等教育人材改善調整(CAPES、ブラジル)、ブラジル国立科学技術開発評議会(CNPq、ブラジル)の支援を受けました。この研究で使用されたスタンプのようなデバイスを提供してくれたBioedtechと、細胞培養施設の使用のために免疫薬理学研究所のBartira Bergmann教授に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
参考文献
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved