Method Article
通过 3D 打印的邮票状设备生成组织球体
摘要
本协议描述了一种使用 3D 打印邮票状设备经济高效地大规模生产组织球体的技术。
摘要
3D 细胞培养的进步已经开发出更具生理相关性 的体外 模型,例如组织球状体。培养为球状体的细胞具有更真实的生物反应,类似于 体内 环境。由于其优势,组织球状体代表了一种新兴趋势,即更优越、更可靠、更具预测性的研究模型,具有广泛的生物技术适用性。然而,能够实现组织球体大规模生产的可重复平台已成为充分探索和提升其潜力的未满足需求。在此,报道了使用低成本和时间有效的方法大规模生产均质组织球体。开发了一种 3D 打印的类似邮票的装置,每个 6 孔板可生成多达 4,716 个球体。该设备是使用光固化树脂通过立体光固化方法制造的。最终器件由圆柱形微引脚组成,高度为 1.3 mm,宽度为 650 μm。这种方法可以快速生成具有均匀形状和大小以及 >95% 细胞活力的均相球状体和共培养球状体。此外,该印章状装置可针对不同尺寸的孔板和培养皿进行调整。它易于消毒,可以长期重复使用。均质组织球体的高效大规模生产对于将其转化为多个工业领域(如组织工程、药物开发、疾病建模和按需个性化医疗)至关重要。
引言
组织球状体是由细胞悬液形成的 3D 微组织,在没有外力的情况下进行自组装1。由于这些球状体与人类生理系统的关键特征相似,因此已广泛用于生物制造方案 2,3。与传统的单层细胞培养相比,组织球体提供更相似的代谢、细胞骨架动力学、细胞活力以及代谢和分泌活性1。由于它们的融合能力,它们还可以用作构建单元(例如,生物打印方案),以形成具有增强生物学相关性的复杂组织工程结构 4,5。
由于其生物学相关性,组织球体已被用作生物技术工具,用于组织工程、药物开发、疾病建模和纳米毒理学评估等方案,从而减少了时间、空间成本和动物试验 3,6,7,8。尽管如此,为了充分探索和利用组织球体的潜力,针对其大规模生产的可靠且可重复的方法是非常必要的,而这些仍然是一个持续的挑战。
有几种方法可以产生球状体,例如悬滴、涂层 U 形底孔、微流体以及使用聚合物基质 9,10。尽管这些方法为球体生产市场铺平了道路,但它们仍然复杂、耗时、劳动密集或昂贵10。
本方案报告了使用低成本和时间有效的方法大规模生产均质组织球体。我们开发了一种 3D 打印的类似邮票的设备,每个 6 孔板可生成多达 4,716 个球体。此外,stamp 状装置可以定制,以每孔产生更多的球状体,适用于不同的细胞培养板。它易于消毒,可以长期重复使用。均质组织球体的高效大规模生产对于将其用途转化为临床至关重要,从而为组织工程、药物开发、疾病建模和按需个性化医疗等多个工业领域做出贡献。
研究方案
L929 细胞系小鼠成纤维细胞用于本研究。邮票状 3D 打印生物器件是从商业来源获得的(参见 材料表)。整个方案遵循良好的细胞培养规范和无菌技术。通过用 70% 酒精擦拭并将其暴露在紫外线下 15 分钟对制造的装置进行消毒。在与细胞或组织球体接触之前,将细胞培养基和溶液加热至 37 °C。该协议的示意图如图 1 所示。
1. 从印章状装置制备非粘附模具
- 按照以下步骤准备 2% (w/v) 琼脂糖凝胶。
- 在磷酸盐缓冲盐水 (1x PBS) 中稀释琼脂糖粉末,并通过圆周运动将所得悬浮液匀浆。
注意:该溶液可以放在玻璃瓶中。在此步骤中,琼脂糖溶液不会是半透明的。 - 将玻璃瓶放入微波炉中并放置 30 秒。每 5 秒停止微波,取出玻璃瓶,并以圆周运动手动匀浆溶液。需要执行加热过程,直到溶液达到液态清澈状态。
注意:热板也可以用作微波炉的替代品。加热过程后,溶液必须是半透明/清澈的。 - 将 1 mL 琼脂糖溶液添加到计划用于实验的 6 孔板的每个孔中。
- 等待 ~15 分钟或直到琼脂糖凝固。
注意:可以使用冷却板来减少凝固时间。 - 加入 1-2 mL 琼脂糖溶液,然后将装置轻轻插入液体琼脂糖上方。
注意:必须小心放置装置,以防止琼脂糖装置界面中出现气泡。 - 等待 ~30 分钟或直到琼脂糖凝固。
注意:可以使用冷却板来减少凝固时间。 - 轻轻地从琼脂糖中取出装置。
注意:删除至关重要。应小心地将其取出,以保持琼脂糖特征完好无损;否则,琼脂糖可能会被破坏。 - 加入 2 mL DMEM 培养基,等待 10 分钟,丢弃培养基,然后用新鲜的 DMEM 替换。重复此作 3 次以正确清洗孔。
- 加入 2 mL DMEM,将 6 孔板放入培养箱中(在 37 °C,5% CO2 和 80% 湿度下)直至细胞接种(图 2A-F,补充视频 1)。
- 在磷酸盐缓冲盐水 (1x PBS) 中稀释琼脂糖粉末,并通过圆周运动将所得悬浮液匀浆。
2. 组织球体的生成
注:不同的细胞谱系具有不同的粘附特性。因此,使用这种方法,某些类型的细胞可能无法正确形成组织球体。
- 在传统的单层培养后培养细胞(即,使用补充有 10% 胎牛血清 (FBS)、100 μg/mL 青霉素和 100 μg/mL 链霉素的低葡萄糖 DMEM 在细胞培养瓶中培养细胞)(参见 材料表)。将细胞保持在 37 °C 的 5% CO2 培养箱中,并监测直至它们达到 80% 的汇合度。
- 达到所需的汇合点后,用 1x PBS 洗涤细胞。
注:建议 25 cm2 培养瓶使用 5 mL,75 cm2 培养瓶推荐使用 10 mL,150 cm2 培养瓶推荐使用 15 mL。 - 加入解离酶,并将细胞在 37 °C、5% CO2 和 80% 湿度下孵育 2-5 分钟。
注:本研究使用 0.125% 胰蛋白酶和 0.78 mM 乙二胺四乙酸 (EDTA) 作为解离酶(参见 材料表)。 - 观察细胞从细胞培养瓶中分离的情况,并加入补充有 FBS 的生长培养基以中和细胞解离酶。
注意:在本研究中,使用低葡萄糖的 DMEM(参见 材料表),并补充 10% FBS。 - 在室温下以 400 x g 离心细胞悬液 5 分钟。然后,手动计数细胞。
- 每管取 50 x 105 个细胞,并加入 5 mL 的 1x PBS。
注:接种的细胞数会影响最终的组织球体直径。因此,可以增加细胞数量以产生直径更大的组织球体。 - 在室温下以 400 x g 离心细胞悬液 5 分钟。
- 用移液管去除上清液,加入 1 mL 细胞培养基,匀浆溶液。
注:在本研究中,使用低葡萄糖 DMEM 完全培养基,添加 10% FBS、100 μg/mL 青霉素和 100 μg/mL 链霉素。 - 从 6 孔板中取出 2 mL 培养基(步骤 1.1.9),并将 1 mL 细胞悬液添加到 3D 打印生物装置形成的琼脂糖模具的中心(步骤 1.1.7)。等到细胞在显微切除中沉淀(~20-30 分钟),然后小心地向孔中加入 1 mL 细胞培养基。
注意:在此步骤中需要格外小心。建议轻轻添加培养基,将移液器吸头靠近孔壁,然后少量分配。 - 将 6 孔板放入培养箱中(在 37 °C,5% CO2 和 80% 湿度下)以形成组织球体(大约 24-48 小时,取决于细胞类型)(图 3)。
注:不同的细胞类型(例如,癌细胞、原代细胞)具有不同的自组装动力学11.
结果
使用 3D 打印的邮票状设备生成均匀的显微切除
使用光固化树脂通过立体光固化方法12 成功制造了 3D 打印的邮票状装置(图 2A)。最终器件由高度为 1.3 mm、宽度为 650 μm 的圆柱形微针组成(图 2A)。通过保持几何形状,它被用作产生非粘附显微切除的母模(图 2B-F 和补充视频 1)。该设备使用简单,易于消毒,并且可以长期重复使用。此外,它还适用于不同尺寸的孔板(即 6 孔、12 孔、24 孔、96 孔)和培养皿(即 30 mm、50 mm、90 mm、150 mm)。在这里,我们显示了有关 6 孔板设备的数据。它每孔产生 750 个均匀的显微切除或每 6 个孔板产生 4,716 个(图 2C-D)。如果提前撤回设备,可能会出现非粘附模具的破坏和微切除几何形状的变形等缺点(图 2G)。
组织球体的大规模生产
将细胞接种到非贴壁琼脂糖模具上,沉淀,大约 24 小时后形成组织球体。通过保持其形状、大小 (123 μm ± 3 μm) 和活力来实现球体的大规模生产 (图 3A-D)。该方法支持球状体培养数月(数据未显示)。
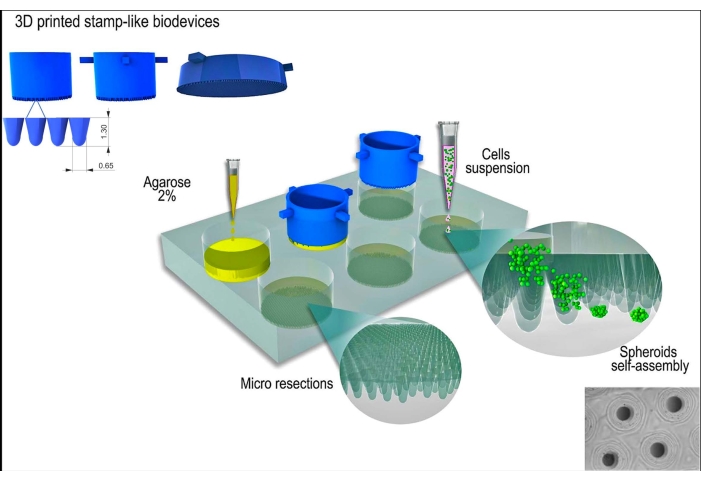
图 1:使用邮票状 3D 打印生物器件生成组织球体的示意图。 该生物装置由圆柱形微针组成,模制非粘附的水凝胶(例如琼脂糖)以形成一系列均匀的显微切片。在琼脂糖凝固并与细胞培养基孵育一段时间后(以适应新的非粘附模具),将细胞悬液接种在模具上,细胞聚集、自组装并压缩成球形。 请单击此处查看此图的较大版本。

图 2:用作母模的 3D 打印邮票状装置,用于形成非粘附的微成型琼脂糖。(A) 3D 打印的邮票状装置。(B) 将装置插入液体琼脂糖中以形成显微切除。(C-E)移除装置后,形成均匀切除。(E) 比例尺 = 200 μm。(F) 与细胞培养基孵育后的微成型琼脂糖(粉红色:细胞培养基)。(G) 当琼脂糖未完全凝固时从琼脂糖中取出装置会导致其破裂(带箭头的黄线)。请单击此处查看此图的较大版本。
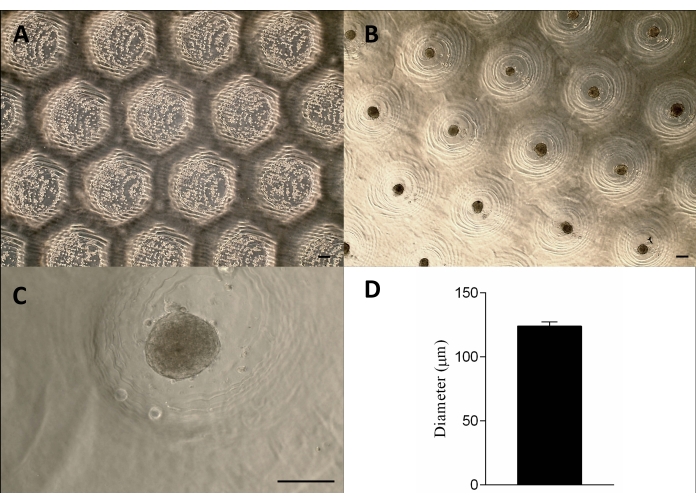
图 3:细胞接种和球状体形成。相差显微镜 (A) 细胞在显微切片中接种后 0 小时(切除内的点)。(B-C)球体在接种后约 24 小时形成。比例尺 = 100 μm。(D) 球体直径的图形表示,n = 4。形成的球体在形状和大小上是均匀的。请单击此处查看此图的较大版本。
补充视频 1:去除 stamp 状装置后的微成型琼脂糖。请点击此处下载此视频。
讨论
本方案描述了一种简单、快速且廉价的大规模生产组织球体的方法。使用邮票状 3D 打印设备作为母模,每个 6 孔板最多可生成 4,716 个球体。已经表明,培养为球状体的细胞具有更真实的生物反应,与体内环境非常相似1。由于其优势,组织球状体代表了一种新兴趋势,即向更优越、更可靠和更具预测性的研究模型发展13,14。因此,开发新方法以实现大规模生产对于利用其应用程序至关重要。
为了使用这种方法成功实现组织球体的生成,需要谨慎执行关键步骤,例如将装置插入液体琼脂糖中,以避免气泡。气泡的存在可能会损害显微切除术的正确成型。因此,在琼脂糖完全凝固之前移除装置可能会导致琼脂糖霉菌破裂。这些步骤对于生产适合组织球状体形成的琼脂糖模具至关重要。生成的旋转椭球体批次的形状和大小变化需要最小。因此,确定性点之一是在细胞接种到琼脂糖模具中后缓慢添加培养基。这需要轻柔地分配液体,以免干扰已经进入显微切除的细胞。否则,一些显微切除可能会增加细胞的浓度,这将导致球体之间大小的异质性。
除了简单、快速和便宜之外,该协议还具有灵活性(即,可以对其进行一些修改以适应实验的特殊性)。除了琼脂糖,还可以使用聚二甲基硅氧烷 (PDMS) 来形成模具。PDMS 是一种弹性体,广泛用于制造微流控芯片15。它具有生物相容性、光学透明度、化学惰性、热稳定性和透气性等特性15。与琼脂糖不同,用 PDMS 制成的模具更具抵抗力,也可以在保留微切除几何形状的情况下重复使用。
目前,全球对替代无血清细胞培养基的搜索有所增加16,17。尽管 FBS 是一种传统的细胞培养补充剂,但其使用存在伦理问题和可能的批次差异。尽管如此,考虑到球状体的临床应用,免疫反应和疾病传播的风险损害了 FBS 作为培养基补充剂的使用16。因此,可以按照目前的方法使用无血清/异种细胞培养基形成球状体。例如,研究使用由人白蛋白、抗坏血酸、胰岛素、转铁蛋白和硒组成的特殊 3D 培养基来形成人间充质/基质干细胞球体 4,8。
球体的成功形成可以通过其紧凑的球体形状来确定。迄今为止,一些研究报道了细胞粘附介质(例如 E-钙粘蛋白、整合素)以及细胞骨架微管和肌动蛋白丝对细胞自组装和进一步压缩成球体的影响18,19。因此,在表达这些成分时表现出不平衡的细胞可能无法压缩并形成球体。因此,球状体的形成因细胞系而异;因此,某些类型的细胞可能不适合本文描述的方法。
在本方案中,使用由圆柱形微针组成的 3D 打印邮票状装置来模制非粘附水凝胶(例如琼脂糖)以形成一系列均匀的微结构切除。还可以实时观察(即使用成像)细胞的聚集、自组装和压实。此外,添加/更换培养基和添加药物或其他化合物的劳动力最少。此外,只需使用装有培养基或 PBS 的移液器进行定向射流,即可取出球体进行后分析,例如电子显微镜、细胞术和组织学。据报道,有几种方法可以生成球状体,例如悬滴、涂层 U 形底孔、微流体装置和使用聚合物基质。尽管如此,它们通常很复杂、耗时、劳动密集型、成本高昂,或者可能会生成异质球状体 9,10。尽管使用悬滴法20 实现了球体的大规模生产,但仍然难以跟踪球体形成过程并进行培养基交换或添加药物/化合物10。
微成型的非粘附性水凝胶已被用作形成球状体的策略,也被用作引导较大微组织的形成的模具10。但是,使用的母模主要是硅,不适合长期使用,而且可能很昂贵21.本研究采用立体光固化成型 (SLA) 技术进行 3D 打印,以生成高度均匀的母模。SLA 以速度、成本效益、灵活性和精度生成原型22.此外,它在定制制造方面的优势已应用于多个领域,包括一般的组织工程和生物医学22。
众所周知,球状体细胞培养物是生理相关的体外研究模型,可以与人类特征非常相似。因此,它们已被用作研究疾病发作和毒理学的模型,并且已经作为再生医学的生物产品商业化 23,24,25。因此,它们被用作 3D 生物打印 3,26 和器官芯片24,27 等前沿技术的原材料,不断展示球状体培养物的重要性以及开发新策略以大规模生成球状体培养物的重要性。
披露声明
3D 打印的邮票状设备由初创公司 Bioedtech 提供,Janaína Dernovsek 是该公司的联合创始人兼创新总监。作者声明没有竞争性的经济利益。
致谢
这项工作得到了里约热内卢州研究支持基金会(FAPERJ,巴西)、高等教育人员改进协调(CAPES,巴西)和巴西国家科学技术发展委员会(CNPq,巴西)的支持。我们感谢 Bioedtech 提供本研究中使用的邮票状设备,并感谢免疫药理学实验室的 Bartira Bergmann 教授使用他们的细胞培养设施。
材料
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
参考文献
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。