Method Article
Génération de sphéroïdes tissulaires à l’aide d’un dispositif imprimé en 3D semblable à un tampon
Dans cet article
Résumé
Le protocole actuel décrit une technique permettant de produire des sphéroïdes tissulaires à grande échelle de manière rentable à l’aide d’un dispositif imprimé en 3D semblable à un tampon.
Résumé
Les progrès de la culture cellulaire 3D ont permis de développer des modèles in vitro plus pertinents sur le plan physiologique, tels que les sphéroïdes tissulaires. Les cellules cultivées sous forme de sphéroïdes ont des réponses biologiques plus réalistes qui ressemblent à l’environnement in vivo . En raison de leurs avantages, les sphéroïdes tissulaires représentent une tendance émergente vers des modèles d’étude supérieurs, plus fiables et plus prédictifs avec un large éventail d’applications biotechnologiques. Cependant, les plateformes reproductibles capables de produire à grande échelle des sphéroïdes tissulaires sont devenues un besoin non satisfait pour explorer pleinement et stimuler leur potentiel. Dans ce contexte, la production à grande échelle de sphéroïdes de tissus homogènes est rapportée à l’aide d’une méthodologie peu coûteuse et rapide. Un dispositif semblable à un tampon imprimé en 3D est développé pour générer jusqu’à 4 716 sphéroïdes par plaque à 6 puits. L’appareil est fabriqué par la méthode de la stéréolithographie à l’aide d’une résine photodurcissable. Le dispositif final est composé de microbroches cylindriques, d’une hauteur de 1,3 mm et d’une largeur de 650 μm. Cette approche permet de générer rapidement des sphéroïdes homogènes et des sphéroïdes co-cultivés avec une forme et une taille uniformes et une viabilité cellulaire de >95 %. De plus, le dispositif en forme de tampon est accordable pour différentes tailles de plaques de puits et de boîtes de Pétri. Il est facilement stérilisable et peut être réutilisé pendant de longues périodes. La production efficace à grande échelle de sphéroïdes tissulaires homogènes est essentielle pour tirer parti de leur traduction dans de multiples domaines de l’industrie, tels que l’ingénierie tissulaire, le développement de médicaments, la modélisation de maladies et la médecine personnalisée à la demande.
Introduction
Les sphéroïdes tissulaires sont des micro-tissus 3D formés par des suspensions cellulaires qui s’auto-assemblent sans forces externes1. Ces sphéroïdes ont été largement utilisés dans les protocoles de biofabrication en raison de leur ressemblance avec les principales caractéristiques du système physiologique humain 2,3. Les sphéroïdes tissulaires offrent un métabolisme, une dynamique du cytosquelette, une viabilité cellulaire et une activité métabolique et de sécrétion plus similaires à ceux de la culture cellulaire monocouche traditionnelle1. En raison de leur capacité de fusion, ils peuvent également être utilisés comme blocs de construction (par exemple, des protocoles de bio-impression) pour former des constructions complexes d’ingénierie tissulaire avec une pertinence biologique accrue 4,5.
En raison de leur pertinence biologique, les sphéroïdes tissulaires ont été utilisés comme outil biotechnologique pour des protocoles allant de l’ingénierie tissulaire, du développement de médicaments, de la modélisation de maladies et de l’évaluation nanotoxicologique, réduisant ainsi le temps, les coûts d’espaceet les tests sur les animaux. Néanmoins, pour explorer pleinement et exploiter le potentiel des sphéroïdes tissulaires, des méthodes fiables et reproductibles visant à leur production à grande échelle sont hautement nécessaires, et celles-ci restent un défi permanent.
Plusieurs méthodologies produisent des sphéroïdes, telles que des gouttes suspendues, des puits inférieurs en forme de U revêtus, la microfluidique et l’utilisation d’une matrice polymère 9,10. Bien que ces méthodologies aient ouvert la voie sur le marché de la production de sphéroïdes, elles restent complexes, longues, gourmandes en main-d’œuvre ou coûteuses10.
Le protocole actuel fait état de la production à grande échelle de sphéroïdes tissulaires homogènes à l’aide d’une méthodologie peu coûteuse et rapide. Nous avons développé un dispositif de type tampon imprimé en 3D pour générer jusqu’à 4 716 sphéroïdes par plaque à 6 puits. De plus, le dispositif en forme de tampon peut être adapté pour produire plus de sphéroïdes par puits, adapté à différentes plaques de culture cellulaire. Il est facilement stérilisable et peut être réutilisé pendant de longues périodes. La production efficace à grande échelle de sphéroïdes tissulaires homogènes est essentielle pour traduire leur utilisation dans les cliniques, contribuant à de multiples domaines de l’industrie tels que l’ingénierie tissulaire, le développement de médicaments, la modélisation de maladies et la médecine personnalisée à la demande.
Protocole
La lignée cellulaire L929, des fibroblastes de souris, a été utilisée pour la présente étude. Le biodispositif imprimé en 3D, semblable à un timbre, a été obtenu à partir d’une source commerciale (voir le tableau des matériaux). De bonnes pratiques de culture cellulaire et des techniques stériles ont été suivies tout au long du protocole. L’appareil fabriqué a été stérilisé en l’essuyant avec de l’alcool à 70 % et en l’exposant à la lumière UV pendant 15 minutes. Les milieux et les solutions de culture cellulaire ont été chauffés à 37 °C avant d’entrer en contact avec les cellules ou les sphéroïdes tissulaires. Une représentation schématique du protocole est illustrée à la figure 1.
1. Préparation de moules non adhérents à partir du dispositif en forme de tampon
- Préparez un gel d’agarose à 2 % (p/v) en suivant les étapes ci-dessous.
- Diluez la poudre d’agarose dans une solution saline tamponnée au phosphate (1x PBS) et homogénéisez la suspension résultante avec des mouvements circulaires.
REMARQUE : Cette solution peut être placée dans une bouteille en verre. Dans cette étape, la solution d’agarose ne sera pas translucide. - Placez la bouteille en verre dans le micro-ondes et réglez-la pendant 30 s. Toutes les 5 s, arrêtez le micro-ondes, retirez la bouteille en verre et homogénéisez manuellement la solution avec des mouvements circulaires. Le processus de chauffage doit être effectué jusqu’à ce que la solution atteigne un état liquide-limpide.
REMARQUE : Une plaque chauffante peut également être utilisée comme alternative au micro-ondes. Après le processus de chauffage, la solution doit être translucide/limpide. - Ajouter 1 mL de la solution d’agarose dans chaque puits d’une plaque à 6 puits prévue pour l’expérience.
- Attendre ~15 min ou jusqu’à ce que l’agarose se solidifie.
REMARQUE : Une plaque de refroidissement peut être utilisée pour réduire le temps de solidification. - Ajouter 1 à 2 mL de la solution d’agarose et insérer délicatement l’appareil au-dessus de l’agarose liquide.
REMARQUE : Le placement de l’appareil doit être fait avec soin pour éviter les bulles d’air dans l’interface agarose-dispositif. - Attendre ~30 min ou jusqu’à ce que l’agarose se solidifie.
REMARQUE : Une plaque de refroidissement peut être utilisée pour réduire le temps de solidification. - Retirez délicatement l’appareil de l’agarose.
REMARQUE : Le retrait est critique. Il faut l’enlever avec précaution pour conserver les caractéristiques de l’agarose intactes ; Sinon, l’agarose peut être perturbée. - Ajouter 2 ml de DMEM, attendre 10 min, jeter le support et le remplacer par du DMEM frais. Répétez cette opération trois fois pour bien laver le puits.
- Ajouter 2 mL de DMEM et placer la plaque à 6 puits dans un incubateur (à 37 °C avec 5 % de CO2 et 80 % d’humidité) jusqu’à l’ensemencement des cellules (figure 2A-F, vidéo supplémentaire 1).
- Diluez la poudre d’agarose dans une solution saline tamponnée au phosphate (1x PBS) et homogénéisez la suspension résultante avec des mouvements circulaires.
2. Génération de sphéroïdes tissulaires
REMARQUE : Différentes lignées cellulaires ont des propriétés d’adhésion différentes. Par conséquent, en utilisant cette méthodologie, certains types de cellules peuvent ne pas former correctement les sphéroïdes tissulaires.
- Cultiver les cellules après une culture monocouche traditionnelle (c.-à-d. cultiver les cellules dans des flacons de culture cellulaire à l’aide de DMEM à faible teneur en glucose complété par 10 % de sérum de veau fœtal (FBS), 100 μg/mL de pénicilline et 100 μg/mL de streptomycine) (voir le tableau des matières). Maintenez les cellules à 37 °C dans un incubateur à 5 % de CO2 et surveillez-les jusqu’à ce qu’elles atteignent 80 % de confluence.
- Après avoir atteint la confluence souhaitée, lavez les cellules avec 1x PBS.
REMARQUE : Il est recommandé d’utiliser 5 mL pour2 flacons de 25 cm, 10 mL pour2 flacons de 75 cm et 15 mL pour2 flacons de 150 cm. - Ajoutez l’enzyme de dissociation et incubez les cellules pendant 2 à 5 minutes à 37 °C dans 5% de CO2 et 80% d’humidité.
REMARQUE : La présente étude a utilisé de la trypsine à 0,125 % avec 0,78 mM d’acide éthylènediamine tétraacétique (EDTA) comme enzyme de dissociation (voir le tableau des matériaux). - Observez le détachement des cellules des fioles de culture cellulaire et ajoutez un milieu de croissance complété par du FBS pour neutraliser l’enzyme de dissociation cellulaire.
REMARQUE : Pour la présente étude, on a utilisé du DMEM à faible teneur en glucose (voir le tableau des matières) complété par 10 % de FBS. - Centrifuger la suspension cellulaire à 400 x g pendant 5 min à température ambiante. Ensuite, comptez les cellules manuellement.
- Prenez 50 x 105 cellules par tube et ajoutez 5 ml de 1x PBS.
REMARQUE : Le nombre de cellules ensemencées influence le diamètre final du sphéroïde tissulaire. Par conséquent, on peut augmenter le nombre de cellules pour générer des sphéroïdes tissulaires de plus grands diamètres. - Centrifuger la suspension cellulaire à 400 x g pendant 5 min à température ambiante.
- Retirer le surnageant à l’aide d’une pipette, ajouter 1 mL de milieu de culture cellulaire et homogénéiser la solution.
REMARQUE : Dans la présente étude, on a utilisé un milieu de culture complet de DMEM à faible teneur en glucose, complété par 10 % de FBS, 100 μg/mL de pénicilline et 100 μg/mL de streptomycine. - Retirez 2 ml de milieu de la plaque à 6 puits (étape 1.1.9) et ajoutez 1 ml de suspension cellulaire au centre du moule d’agarose formé par le biodispositif imprimé en 3D (étape 1.1.7). Attendez que les cellules se sédimentent dans les microrésections (~20-30 min) et ajoutez soigneusement 1 mL de milieu de culture cellulaire dans le puits.
REMARQUE : Il faut être très prudent dans cette étape. Il est recommandé d’ajouter délicatement le fluide, de placer la pointe de la pipette près de la paroi du puits et de distribuer en petites quantités. - Placez la plaque à 6 puits dans l’incubateur (à 37 °C dans 5 % de CO2 et 80 % d’humidité) pour que les sphéroïdes tissulaires se forment (environ 24 à 48 h, selon le type de cellule) (figure 3).
REMARQUE : Différents types de cellules (par exemple, cellules cancéreuses, cellules primaires) ont une cinétique d’auto-assemblage différente11.
Résultats
Génération de micro-résections homogènes à l’aide du dispositif de type tampon imprimé en 3D
Le dispositif imprimé en 3D ressemblant à un tampon a été fabriqué avec succès par la méthode de stéréolithographie12 à l’aide d’une résine photodurcissable (Figure 2A). Le dispositif final était composé de microbroches cylindriques d’une hauteur de 1,3 mm et d’une largeur de 650 μm (Figure 2A). Son utilisation en tant que moule maître pour produire des micro-résections non adhérentes a été réalisée en maintenant la géométrie (Figure 2B-F et Vidéo supplémentaire 1). L’appareil était simple à utiliser, facile à stériliser et pouvait être réutilisé à long terme. De plus, il est également accordable pour différentes tailles de plaques de puits (c’est-à-dire 6 puits, 12 puits, 24 puits, 96 puits) et de boîtes de Pétri (c’est-à-dire 30 mm, 50 mm, 90 mm, 150 mm). Ici, nous montrons les données concernant le dispositif pour la plaque à 6 puits. Il a généré 750 micro résections homogènes par puits ou 4 716 par plaque de 6 puits (Figure 2C-D). Des inconvénients tels que la rupture du moule non adhérent et la déformation de la géométrie de la micro-résection peuvent se produire si le dispositif est retiré prématurément (Figure 2G).
Production à grande échelle de sphéroïdes tissulaires
Les cellules ont été ensemencées sur les moisissures d’agarose non adhérentes, sédimentées et, environ 24 heures plus tard, ont formé les sphéroïdes tissulaires. La production à grande échelle des sphéroïdes a été obtenue en conservant leur forme, leur taille (123 μm ± 3 μm) et leur viabilité (figure 3A-D). Cette méthodologie a soutenu la culture des sphéroïdes pendant des mois (données non présentées).
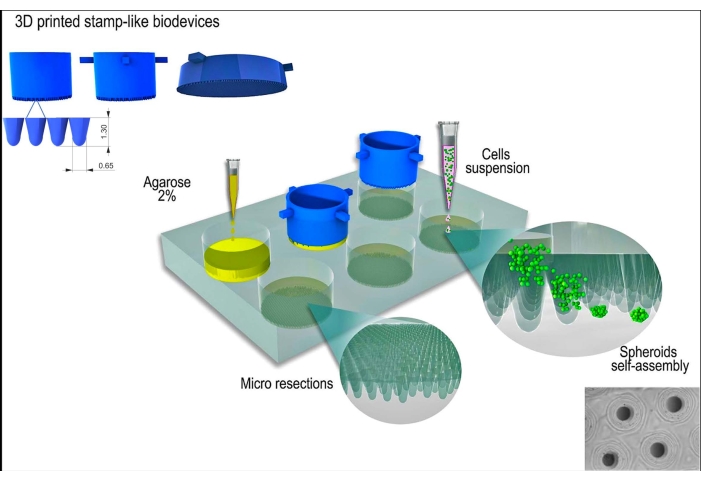
Figure 1 : Représentation schématique de la génération de sphéroïdes tissulaires à l’aide d’un biodispositif imprimé en 3D en forme de tampon. Le biodispositif, composé de microbroches cylindriques, moule un hydrogel non adhérent (par exemple, de l’agarose) pour former un réseau de micro-résections uniformes. Après la solidification de l’agarose et le temps d’incubation avec le milieu de culture cellulaire (pour acclimater les nouveaux moules non adhérents), la suspension cellulaire est ensemencée sur les moules, et les cellules s’agrègent, s’auto-assemblent et se compactent en une forme sphérique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Le dispositif de type tampon imprimé en 3D utilisé comme moule maître pour former une agarose micromoulée non adhérente. (A) Le dispositif de type tampon imprimé en 3D. (B) L’insertion du dispositif dans l’agarose liquide pour former les micro-résections. (C-E) Après le retrait de l’appareil, des résections homogènes se forment. (E) Barre d’échelle = 200 μm. (F) Agarose micromoulée après incubation avec un milieu de culture cellulaire (couleur rose : milieu cellulaire). (G) Le fait de retirer le dispositif de l’agarose alors qu’il n’est pas complètement solidifié entraîne sa rupture (ligne jaune avec flèche). Veuillez cliquer ici pour voir une version agrandie de cette figure.
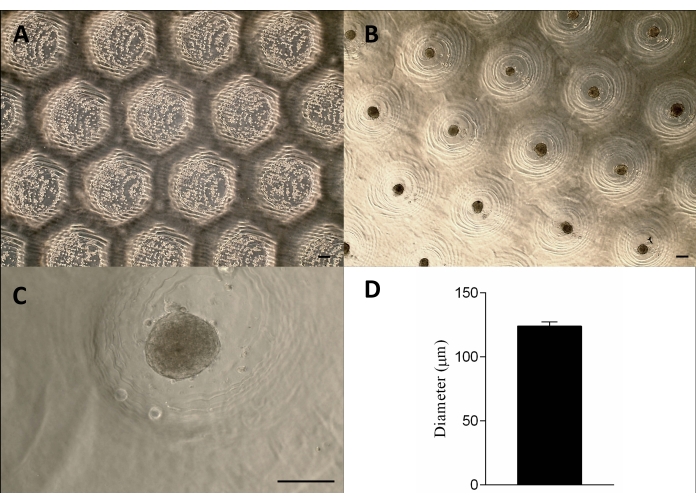
Figure 3 : Ensemencement cellulaire et formation des sphéroïdes. Microscopie à contraste de phase (A) 0 h après l’ensemencement des cellules dans les micro résections (points à l’intérieur des résections). (B-C) Les sphéroïdes se sont formés environ 24 h après l’ensemencement. Barre d’échelle = 100 μm. (D) Représentation graphique du diamètre des sphéroïdes, n = 4. Les sphéroïdes formés sont homogènes en forme et en taille. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo supplémentaire 1 : Agarose micromoulée après le retrait du dispositif en forme de tampon. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Le présent protocole décrit une méthode simple, rapide et peu coûteuse pour la production à grande échelle de sphéroïdes tissulaires. Un dispositif imprimé en 3D semblable à un tampon a été utilisé comme moule maître, ce qui a généré jusqu’à 4 716 sphéroïdes par plaque à 6 puits. Il a été démontré que les cellules cultivées sous forme de sphéroïdes ont des réponses biologiques plus réalistes qui ressemblent beaucoup à l’environnement in vivo 1. En raison de leurs avantages, les sphéroïdes tissulaires représentent une tendance émergente vers des modèles d’étude supérieurs, plus fiables et plus prédictifs13,14. Par conséquent, le développement de nouvelles méthodologies pour réaliser une production à grande échelle est essentiel pour tirer parti de leur application.
Pour réussir à générer des sphéroïdes tissulaires à l’aide de cette méthodologie, des étapes critiques telles que l’insertion du dispositif dans l’agarose liquide doivent être effectuées avec prudence pour éviter les bulles d’air. La présence de bulles d’air peut nuire au moulage correct des micro-résections. En conséquence, le retrait de l’appareil avant la solidification totale de l’agarose peut entraîner la rupture du moule de l’agarose. Ces étapes sont essentielles pour produire des moules d’agarose adaptés à la formation de sphéroïdes tissulaires. La variabilité de forme et de taille du lot généré de sphéroïdes doit être minimale. Par conséquent, l’un des points déterministes est l’ajout lent du milieu de culture après l’ensemencement des cellules dans le moule d’agarose. Cela nécessite une distribution douce du liquide pour ne pas perturber les cellules qui sont déjà entrées dans les micro-résections. Sinon, certaines microrésections pourraient avoir augmenté les concentrations de cellules, ce qui conduira à une hétérogénéité de taille parmi les sphéroïdes.
En plus d’être simple, rapide et peu coûteux, ce protocole est également flexible (c’est-à-dire que certaines modifications peuvent être ajustées aux particularités de l’expérience). Alternativement à l’agarose, on peut utiliser du polydiméthylsiloxane (PDMS) pour former les moules. Le PDMS est un élastomère largement utilisé pour fabriquer des puces microfluidiques15. Il possède des propriétés telles que la biocompatibilité, la transparence optique, l’inertie chimique, la stabilité thermique et la perméabilité aux gaz15. Contrairement à l’agarose, les moules fabriqués avec PDMS sont plus résistants et peuvent également être réutilisés avec préservation de la géométrie de la micro-résection.
Actuellement, la recherche d’un milieu de culture cellulaire alternatif sans sérum a augmenté dans le mondeentier 16,17. Bien que le FBS soit un complément traditionnel pour la culture cellulaire, son utilisation pose des problèmes éthiques et une possible variabilité des lots. Néanmoins, compte tenu de l’application clinique des sphéroïdes, les risques de réactions immunitaires et de transmission de maladies nuisent à l’utilisation de FBS en tant que complément moyen16. Ainsi, on peut utiliser un milieu de culture cellulaire exempt de sérum/xénogramme pour former les sphéroïdes en suivant la méthodologie actuelle. Par exemple, des études ont utilisé un milieu de culture 3D spécial composé d’albumine humaine, d’acide ascorbique, d’insuline, de transferrine et de sélénium pour former des sphéroïdes de cellules souches mésenchymateuses / stromales humaines 4,8.
La formation réussie des sphéroïdes peut être déterminée par leur forme sphéroïdale compacte. À ce jour, certaines études ont rapporté l’impact que les médiateurs d’adhésion cellulaire (par exemple, E-cadhérine, intégrines), ainsi que les microtubules du cytosquelette et les filaments d’actine, ont sur l’auto-assemblage cellulaire et le compactage ultérieur en sphéroïdes18,19. Par conséquent, les cellules qui présentent un déséquilibre dans l’expression de ces composants pourraient ne pas être en mesure de se compacter et de former les sphéroïdes. Par conséquent, la formation des sphéroïdes diffère selon la lignée cellulaire ; Par conséquent, certains types de cellules peuvent ne pas convenir à la méthodologie décrite dans le présent document.
Dans le protocole actuel, un dispositif imprimé en 3D, composé de microbroches cylindriques, a été utilisé pour mouler un hydrogel non adhérent (par exemple, de l’agarose) afin de former un ensemble de résections microstructurées uniformes. Il est également possible d’observer (c’est-à-dire à l’aide de l’imagerie) l’agrégation, l’auto-assemblage et le compactage de la cellule en temps réel. De plus, on a un minimum de travail pour ajouter / échanger du milieu et ajouter des médicaments ou d’autres composés. De plus, il est possible de prélever les sphéroïdes pour la post-analyse, comme la microscopie électronique, la cytométrie et l’histologie, en appliquant simplement un jet dirigé à l’aide d’une pipette chargée de milieu ou de PBS. Plusieurs méthodologies ont été signalées pour générer des sphéroïdes, telles que des gouttes suspendues, des puits de fond en forme de U revêtus, des dispositifs microfluidiques et l’utilisation d’une matrice polymère. Néanmoins, ils sont généralement complexes, prennent du temps, demandent beaucoup de main-d’œuvre, coûtent cher ou peuvent générer des sphéroïdes hétérogènes 9,10. Bien que la production à grande échelle de sphéroïdes ait été réalisée à l’aide de la méthodologie de la goutte suspendue20, il est encore difficile de suivre le processus de formation des sphéroïdes et d’effectuer l’échange de milieux ou l’ajout de médicaments/composés10.
Des hydrogels non adhésifs micromoulés ont été utilisés comme stratégie pour former des sphéroïdes et également des moules pour guider la formation de microtissus plus grands10. Cependant, les moules maîtres utilisés sont principalement en silicone, ne conviennent pas à une utilisation à long terme et peuvent être coûteux21. Cette étude a utilisé la stéréolithographie (SLA) pour la technologie d’impression 3D afin de générer des moules maîtres très uniformes. SLA génère le prototype avec rapidité, rentabilité, flexibilité et précision22. De plus, ses avantages pour la fabrication personnalisée ont été utilisés dans plusieurs domaines, notamment l’ingénierie tissulaire et la biomédecineen général.
On sait que les cultures de cellules sphéroïdes sont des modèles d’étude in vitro physiologiquement pertinents qui peuvent ressembler étroitement aux caractéristiques humaines. Par conséquent, ils ont été utilisés comme modèle pour étudier l’apparition de maladies et la toxicologie et sont déjà commercialisés en tant que bioproduit pour la médecine régénérative 23,24,25. En conséquence, ils sont utilisés comme matière première pour des technologies de pointe telles que la bio-impression 3D 3,26 et les organes sur puce24,27, montrant en permanence l’importance des cultures de sphéroïdes et l’importance de développer de nouvelles stratégies pour les générer à grande échelle.
Déclarations de divulgation
Les dispositifs imprimés en 3D ressemblant à des tampons ont été proposés par la startup Bioedtech, dont Janaína Dernovsek est la cofondatrice et directrice de l’innovation. Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Ce travail a été soutenu par la Fondation pour le soutien à la recherche de l’État de Rio de Janeiro (FAPERJ, Brésil), la Coordination pour l’amélioration du personnel de l’enseignement supérieur (CAPES, Brésil) et le Conseil national brésilien pour le développement scientifique et technologique (CNPq, Brésil). Nous remercions Bioedtech d’avoir fourni les dispositifs en forme de timbre utilisés dans cette étude et le professeur Bartira Bergmann du laboratoire d’immunopharmacologie pour l’utilisation de leurs installations de culture cellulaire.
matériels
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
Références
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon