Method Article
3D 프린팅된 스탬프와 같은 장치를 통한 조직 스페로이드 생성
요약
본 프로토콜은 3D 프린팅된 스탬프와 같은 장치를 사용하여 비용 효율적으로 조직 스페로이드를 대규모로 생산하는 기술을 설명합니다.
초록
3D 세포 배양의 발전으로 조직 스페로이드와 같이 생리학적으로 관련성이 높은 in vitro 모델이 개발되었습니다. 스페로이드로 배양된 세포는 in vivo 환경과 유사한 보다 현실적인 생물학적 반응을 보입니다. 이러한 장점으로 인해 조직 스페로이드는 광범위한 생명공학적 적용 가능성을 갖춘 우수하고 신뢰할 수 있으며 예측력이 뛰어난 연구 모델을 향한 새로운 추세를 나타냅니다. 그러나 조직 스페로이드의 대규모 생산을 달성할 수 있는 재현 가능한 플랫폼은 그 잠재력을 완전히 탐구하고 향상시키는 데 있어 충족되지 않은 요구 사항이 되었습니다. 여기에서, 균질한 조직 스페로이드의 대규모 생산은 저비용 및 시간 효율적인 방법론을 사용하여 보고됩니다. 3D 프린팅된 스탬프와 같은 장치는 6웰 플레이트당 최대 4,716개의 스페로이드를 생성하도록 개발되었습니다. 이 장치는 광경화성 수지를 사용하는 광조형법으로 제작됩니다. 최종 장치는 높이 1.3mm, 너비 650μm의 원통형 마이크로핀으로 구성됩니다. 이 접근법을 사용하면 모양과 크기가 균일하고 세포 생존율이 >95%인 균질 스페로이드 및 공동 배양 스페로이드를 빠르게 생성할 수 있습니다. 또한, 스탬프와 같은 장치는 다양한 크기의 웰 플레이트와 페트리 접시에 대해 조정할 수 있습니다. 쉽게 살균할 수 있으며 장기간 재사용할 수 있습니다. 균질 조직 스페로이드의 효율적인 대량 생산은 조직 공학, 약물 개발, 질병 모델링 및 주문형 맞춤형 의학과 같은 여러 산업 분야에서 스페로이드의 번역을 활용하는 데 필수적입니다.
서문
조직 스페로이드는 세포 현탁액에 의해 형성된 3D 미세 조직으로, 외력 없이 자가 조립을 거칩니다1. 이러한 스페로이드는 인간 생리학적 시스템 2,3의 주요 특징과 유사하기 때문에 생체 제조 프로토콜에 널리 사용되었습니다. 조직 스페로이드는 기존의 단층 세포 배양보다 더 유사한 대사, 세포골격 역학, 세포 생존력, 대사 및 분비 활성을 제공합니다1. 융합 능력으로 인해 생물학적 관련성이 향상된 복잡한 조직 공학 구조를 형성하기 위한 빌딩 블록(예: 바이오프린팅 프로토콜)으로도 사용할 수 있습니다 4,5.
생물학적 관련성으로 인해 조직 스페로이드는 조직 공학, 약물 개발, 질병 모델링 및 나노 독성 평가에 이르는 프로토콜의 생명 공학 도구로 사용되어 시간, 공간 비용 및 동물 실험을 줄였습니다 3,6,7,8. 그럼에도 불구하고 조직 스페로이드의 잠재력을 완전히 탐구하고 활용하기 위해서는 대규모 생산을 목표로 하는 신뢰할 수 있고 재현 가능한 방법이 매우 필요하며, 이는 여전히 지속적인 과제로 남아 있습니다.
여러 방법론은 행잉 드롭, 코팅된 U자형 바닥 웰, 미세 유체 공학 및 고분자 매트릭스 9,10 사용과 같은 스페로이드를 생산합니다. 이러한 방법론은 스페로이드 생산 시장에서 길을 열었지만 여전히 복잡하고 시간이 많이 걸리며 노동 집약적이거나 비용이 많이 듭니다10.
본 프로토콜은 저비용 및 시간 효율적인 방법론을 사용하여 균질한 조직 스페로이드의 대규모 생산을 보고합니다. 당사는 6웰 플레이트당 최대 4,716개의 스페로이드를 생성할 수 있는 3D 프린팅 스탬프와 같은 장치를 개발했습니다. 또한, 스탬프와 같은 장치는 웰당 더 많은 스페로이드를 생산하도록 맞춤화할 수 있으며, 이는 다양한 세포 배양 플레이트에 적합합니다. 쉽게 살균할 수 있으며 장기간 재사용할 수 있습니다. 균질 조직 스페로이드의 효율적인 대량 생산은 조직 공학, 약물 개발, 질병 모델링 및 주문형 맞춤형 의학과 같은 여러 산업 분야에 기여하여 임상에 사용을 전환하는 데 필수적입니다.
프로토콜
본 연구에는 L929 세포주인 마우스 섬유아세포(mouse fibroblasts)가 사용되었습니다. 스탬프와 같은 3D 프린팅 바이오 디바이스는 상업적 출처에서 획득했습니다( 재료 표 참조). 임상시험계획서 전반에 걸쳐 우수한 세포 배양 관행과 멸균 기법을 따랐습니다. 제작된 장치는 70% 알코올로 닦고 15분 동안 자외선에 노출시켜 살균했습니다. 세포 배양 배지 및 용액을 세포 또는 조직 스페로이드와 접촉하기 전에 37°C로 가온하였다. 프로토콜의 개략도는 그림 1에 나와 있습니다.
1. 스탬프와 같은 장치에서 비접착 금형 준비
- 아래 단계에 따라 2%(w/v) 아가로스 겔을 준비합니다.
- 아가로스 분말을 인산염 완충 식염수(1x PBS)에 희석하고 생성된 현탁액을 원형 운동으로 균질화합니다.
알림: 이 용액은 유리병에 넣을 수 있습니다. 이 단계에서 아가로스 용액은 반투명하지 않습니다. - 유리병을 전자레인지에 넣고 30초 동안 굳힙니다. 5초마다 전자레인지를 중지하고 유리병을 제거한 다음 원을 그리며 용액을 수동으로 균질화합니다. 용액이 액체 림피드 상태에 도달할 때까지 가열 공정을 수행해야 합니다.
알림: 핫 플레이트는 전자레인지 대체품으로도 사용할 수 있습니다. 가열 과정이 끝나면 용액은 반투명/림프여야 합니다. - 실험을 위해 계획된 6-웰 플레이트의 각 웰에 1mL의 아가로스 용액을 추가합니다.
- ~15분 동안 또는 아가로스가 응고될 때까지 기다립니다.
알림: 냉각판을 사용하여 응고 시간을 줄일 수 있습니다. - 아가로스 용액 1-2mL를 추가하고 액체 아가로스 위에 장치를 부드럽게 삽입합니다.
알림: agarose 장치 인터페이스에 기포가 발생하지 않도록 장치를 조심스럽게 배치해야 합니다. - ~30분 동안 또는 아가로스가 응고될 때까지 기다립니다.
알림: 냉각판을 사용하여 응고 시간을 줄일 수 있습니다. - 아가로스에서 장치를 부드럽게 제거합니다.
참고: 제거가 중요합니다. 아가로스 기능을 그대로 유지하기 위해 조심스럽게 제거해야 합니다. 그렇지 않으면 아가로스가 중단될 수 있습니다. - DMEM 배지 2mL를 넣고 10분 동안 기다린 후 배지를 버리고 새 DMEM으로 교체합니다. 우물을 제대로 씻으려면 이것을 세 번 반복하십시오.
- 2mL의 DMEM을 추가하고 세포 파종(그림 2A-F, 보충 비디오 1)이 이루어질 때까지 6웰 플레이트를 인큐베이터(5% CO2 및 80% 습도에서 37°C)에 놓습니다.
- 아가로스 분말을 인산염 완충 식염수(1x PBS)에 희석하고 생성된 현탁액을 원형 운동으로 균질화합니다.
2. 조직 스페로이드의 생성
참고: 서로 다른 세포 계통은 서로 다른 접착 특성을 가지고 있습니다. 따라서 이 방법을 사용하면 일부 유형의 세포가 조직 스페로이드를 제대로 형성하지 못할 수 있습니다.
- 전통적인 단층 배양에 따라 세포를 성장시킵니다(즉, 10% 소 태아 혈청(FBS), 100μg/mL 페니실린 및 100μg/mL 스트렙토마이신이 보충된 저포도당이 있는 DMEM을 사용하여 세포 배양 플라스크에서 세포를 성장시킵니다( 재료 표 참조). 5% CO2 인큐베이터에서 세포를 37°C로 유지하고 합류도의 80%에 도달할 때까지 모니터링합니다.
- 원하는 합류점에 도달한 후 1x PBS로 세포를 세척합니다.
참고: 25cm플라 스크의 경우 5mL, 75cm플라 스크의 경우 10mL, 150cm플라 스크의 경우 15mL를 사용하는 것이 좋습니다. - 해리 효소를 첨가하고 5 % CO2 및 80 % 습도에서 37 ° C에서 2-5 분 동안 세포를 배양합니다.
참고: 본 연구는 0.78mM 에틸렌디아민 테트라아세트산(EDTA)과 함께 0.125% 트립신을 해리 효소로 사용했습니다( 재료 표 참조). - 세포 배양 플라스크에서 세포가 분리되는 것을 관찰하고 세포 해리 효소를 중화하기 위해 FBS가 보충된 성장 배지를 추가합니다.
참고: 본 연구를 위해 저포도당( 재료 표 참조)의 DMEM에 10% FBS를 보충했습니다. - 셀 현탁액을 실온에서 400 x g 에서 5분 동안 원심분리합니다. 그런 다음 셀을 수동으로 계산합니다.
- 튜브당 50 x 105 세포를 취하고 5mL의 1x PBS를 추가합니다.
참고: 파종된 세포의 수는 최종 조직 스페로이드 직경에 영향을 미칩니다. 따라서 세포 수를 증가시켜 더 큰 직경을 가진 조직 스페로이드를 생성할 수 있습니다. - 셀 현탁액을 실온에서 400 x g 에서 5분 동안 원심분리합니다.
- 피펫을 사용하여 상층액을 제거하고 세포 배양 배지 1mL를 첨가하고 용액을 균질화합니다.
참고: 본 연구에서는 10% FBS, 100μg/mL 페니실린 및 100μg/mL 스트렙토마이신이 보충된 저포도당의 DMEM의 완전한 배양 배지를 사용했습니다. - 6웰 플레이트에서 2mL의 배지를 제거하고(단계 1.1.9) 3D 프린팅 바이오디바이스(단계 1.1.7)로 형성된 아가로스 몰드의 중앙에 세포 현탁액 1mL를 추가합니다. 미세 절제술에서 세포가 침전될 때까지 기다렸다가(~20-30분) 1mL의 세포 배양 배지를 웰에 조심스럽게 추가합니다.
참고: 이 단계에서는 각별히 주의해야 합니다. 배지를 부드럽게 추가하고 피펫 팁을 웰 벽 가까이에 놓고 소량으로 분주하는 것이 좋습니다. - 조직 스페로이드가 형성되도록 인큐베이터(37°C에서 5% CO2 및 80% 습도)에 6웰 플레이트를 놓습니다(세포 유형에 따라 약 24-48시간)(그림 3).
참고: 다른 세포 유형(예: 암세포, 일차 세포)은 서로 다른 자기 조립 역학을 가지고 있습니다11.
결과
3D 프린팅된 스탬프와 같은 장치를 사용한 균일한 미세 절제 생성
3D 프린팅된 스탬프와 같은 장치는 광경화성 수지를 사용하여 광조형 방법(12)으로 성공적으로 제조되었습니다(그림 2A). 최종 장치는 높이 1.3mm, 너비 650μm의 원통형 마이크로핀으로 구성되었습니다(그림 2A). 비접착 미세 절제를 생성하기 위한 마스터 몰드로 사용하는 것은 형상을 유지함으로써 달성되었습니다(그림 2B-F 및 보충 비디오 1). 이 장치는 사용이 간편하고 살균이 쉬우며 장기적으로 재사용할 수 있었습니다. 또한 다양한 크기의 웰 플레이트(즉, 6웰, 12웰, 24웰, 96웰) 및 페트리 접시(즉, 30mm, 50mm, 90mm, 150mm)에 대해서도 조정할 수 있습니다. 여기에서는 6웰 플레이트용 장치에 대한 데이터를 보여줍니다. 웰당 750개의 균질한 미세 절제 또는 6개의 웰 플레이트당 4,716개의 균일한 미세 절제를 생성했습니다(그림 2C-D). 비접착 금형의 파손 및 미세 절제 형상의 변형과 같은 단점은 장치를 조기에 철회할 경우 발생할 수 있습니다(그림 2G).
조직 스페로이드의 대규모 생산
세포를 비부착성 아가로스 몰드에 파종하고 침전시킨 후 약 24시간 후에 조직 스페로이드를 형성했습니다. 스페로이드의 대규모 생산은 스페로이드의 모양, 크기(123μm ± 3μm) 및 생존력을 유지함으로써 달성되었습니다(그림 3A-D). 이 방법론은 수개월 동안 스페로이드 배양을 지원했습니다(데이터는 표시되지 않음).
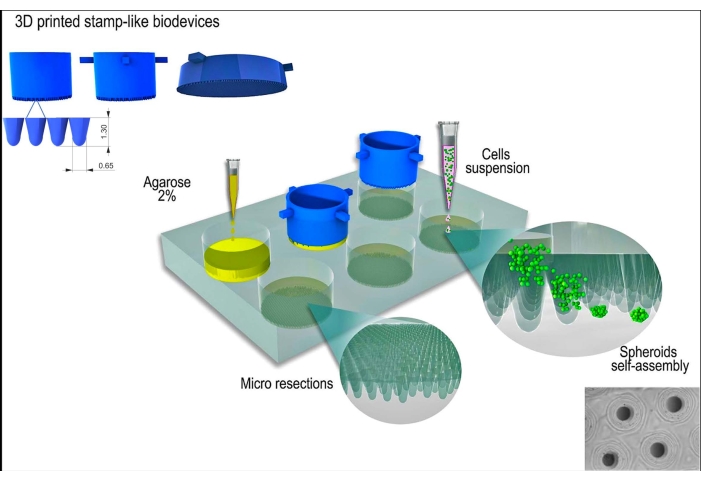
그림 1: 스탬프와 같은 3D 프린팅 바이오 디바이스를 사용한 조직 스페로이드 생성의 개략도. 원통형 마이크로핀으로 구성된 이 바이오디바이스는 비접착성 하이드로겔(예: 아가로스)을 성형하여 균일한 미세 절제 어레이를 형성합니다. 아가로스의 응고 및 세포 배양 배지로의 배양 시간(새로운 비접착 주형에 적응하기 위해) 후, 세포 현탁액을 주형에 파종하고 세포를 응집, 자체 조립 및 구형으로 압축합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 비접착 미세 성형 아가로스를 형성하기 위해 마스터 몰드로 사용되는 3D 프린팅 스탬프와 같은 장치. (A) 3D 프린팅된 스탬프와 같은 장치. (B) 미세 절제를 형성하기 위해 액체 아가로스에 장치를 삽입하는 단계. (C-E) 장치를 제거한 후 균일 한 절제가 형성됩니다. (E) 스케일 바 = 200 μm. (F) 세포 배양 배지(분홍색: 세포 배지)로 배양 후 미세 성형 아가로스. (G) 아가로스가 완전히 응고되지 않은 상태에서 장치를 제거하면 장치가 중단됩니다(화살표가 있는 노란색 선). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
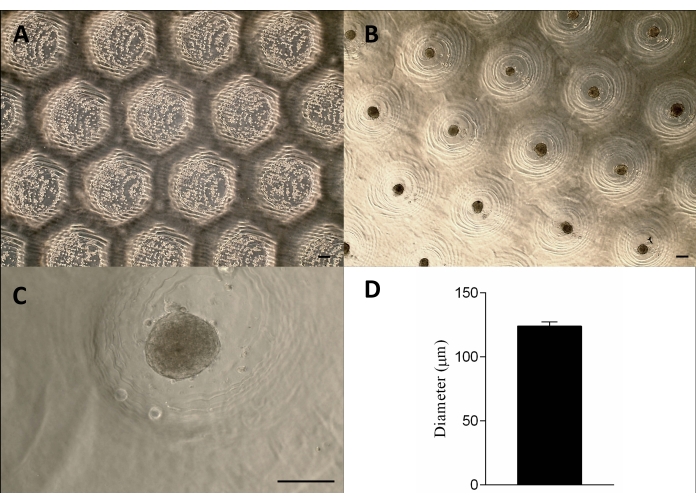
그림 3: 세포 파종 및 스페로이드 형성. 위상차 현미경 (A) 미세 절제(절제 내 점)에서 세포가 파종된 후 0시간. (BC-C) 스페로이드는 파종 후 약 24시간 후에 형성되었습니다. 스케일 바 = 100 μm. (D) 스페로이드의 직경을 그래픽으로 표현, n = 4. 형성된 스페로이드는 모양과 크기가 균일합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 비디오 1: 스탬프와 같은 장치를 제거한 후 미세 성형된 아가로스. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
본 프로토콜은 조직 스페로이드의 대규모 생산을 위한 간단하고 빠르며 저렴한 방법을 설명합니다. 스탬프와 같은 3D 프린팅 장치를 마스터 몰드로 사용하여 6웰 플레이트당 최대 4,716개의 스페로이드를 생성했습니다. 스페로이드로 배양된 세포는 in vivo 환경1과 매우 유사한 보다 현실적인 생물학적 반응을 갖는 것으로 나타났습니다. 이러한 장점으로 인해 조직 스페로이드는 우수하고 신뢰할 수 있으며 예측이 더 많은 연구 모델을 향한 새로운 추세를 나타냅니다13,14. 따라서 대규모 생산을 달성하기 위한 새로운 방법론을 개발하는 것은 해당 응용 프로그램을 활용하는 데 매우 중요합니다.
이 방법론을 사용하여 조직 스페로이드를 성공적으로 생성하려면 장치를 액체 아가로스에 삽입하는 것과 같은 중요한 단계를 기포를 피하기 위해 주의해서 수행해야 합니다. 기포가 있으면 미세 절제술의 올바른 성형이 손상될 수 있습니다. 따라서, 아가로스의 완전 응고 전에 장치를 제거하면 아가로스 곰팡이가 파열될 수 있다. 이러한 단계는 조직 스페로이드 형성에 적합한 아가로스 몰드를 생산하는 데 필수적입니다. 생성된 스페로이드 배치의 모양과 크기 변동성은 최소화되어야 합니다. 따라서 결정론적 포인트 중 하나는 세포가 아가로스 몰드에 파종된 후 배양 배지를 천천히 첨가하는 것입니다. 이를 위해서는 이미 미세 절제에 들어간 세포를 방해하지 않도록 액체를 부드럽게 분배해야 합니다. 그렇지 않으면, 일부 미세 절제술은 세포의 농도를 증가시킬 수 있으며, 이는 스페로이드 간의 크기의 이질성으로 이어질 수 있습니다.
이 프로토콜은 간단하고 빠르며 저렴할 뿐만 아니라 유연합니다(즉, 실험의 특성에 맞게 일부 수정이 가능함). 아가로스 대신 폴리디메틸실록산(PDMS)을 사용하여 금형을 형성할 수 있습니다. PDMS는 미세유체 칩(microfluidic chips)15을 제조하는 데 널리 사용되는 엘라스토머이다. 생체 적합성, 광학 투명성, 화학적으로 불활성, 열 안정성 및 가스 투과성과 같은 특성을 가지고 있습니다15. 아가로스와 달리 PDMS로 만든 금형은 저항성이 더 높으며 미세 절제 형상을 보존하면서 재사용할 수도 있습니다.
현재 무혈청 세포 배양 배지를 대체할 수 있는 물질에 대한 검색이 전 세계적으로 증가하고있습니다 16,17. FBS는 세포 배양을 위한 전통적인 보충제이지만, 그 사용에는 윤리적 문제와 배치 변동성이 있을 수 있습니다. 그럼에도 불구하고, 스페로이드의 임상적 적용을 고려할 때, 면역 반응 및 질병 전염의 위험은 FBS를 배지 보충제로 사용하는 것을 저해한다16. 따라서 본 방법론에 따라 혈청/무생물 세포 배양 배지를 사용하여 스페로이드를 형성할 수 있습니다. 예를 들어, 연구에서는 인간 알부민, 아스코르브산, 인슐린, 트랜스페린 및 셀레늄으로 구성된 특수 3D 배양 배지를 사용하여 인간 중간엽/기질 줄기 세포 스페로이드를 형성했습니다 4,8.
스페로이드의 성공적인 형성은 조밀한 구상체 모양에 의해 결정될 수 있습니다. 현재까지 일부 연구에서는 세포 접착 매개체(예: E-cadherin, 인테그린)와 세포골격 미세소관 및 액틴 필라멘트가 세포 자가 조립 및 스페로이드로의 추가 압축에 미치는 영향을 보고했습니다18,19. 따라서 이러한 구성 요소를 발현하는 데 불균형을 보이는 세포는 스페로이드를 압축하여 형성하지 못할 수 있습니다. 따라서 스페로이드 형성은 세포주에 따라 다릅니다. 따라서, 일부 유형의 셀은 본원에 설명된 방법론에 적합한 옵션이 아닐 수 있다.
본 프로토콜에서는 원통형 마이크로핀으로 구성된 3D 프린팅된 스탬프와 같은 장치를 사용하여 비접착성 하이드로겔(예: 아가로스)을 성형하여 균일한 미세 구조 절제 어레이를 형성했습니다. 또한 셀의 응집, 자체 조립 및 압축을 실시간으로 관찰(즉, 이미징 사용)할 수 있습니다. 또한 매체를 추가/교환하고 약물 또는 기타 화합물을 추가하는 데 최소한의 노동력이 있습니다. 또한 전자 현미경, 세포 분석 및 조직학과 같은 사후 분석을 위해 배지 또는 PBS가 로드된 피펫을 사용하여 직접 제트를 적용하기만 하면 스페로이드를 회수할 수 있습니다. 스페로이드를 생성하기 위해 여러 가지 방법론이 보고되었는데, 예를 들어 행잉 드롭, 코팅된 U자형 바닥 웰, 미세유체역학 장치, 고분자 매트릭스 사용이 있습니다. 그럼에도 불구하고, 그들은 일반적으로 복잡하고, 시간이 많이 걸리고, 노동 집약적이고, 비용이 많이 들거나, 불균일한 스페로이드를 생성할 수 있다 9,10. 스페로이드의 대량 생산은 행잉 드롭 방법론(Hanging Drop Methodology)20을 사용하여 이루어졌지만, 스페로이드 형성 과정을 따르고 약물/화합물(10)의 매질 교환 또는 첨가를 수행하는 것은 여전히 어렵다.
미세성형된 비접착성 하이드로겔은 스페로이드를 형성하기 위한 전략으로 사용되어 왔으며 또한 더 큰 미세조직의 형성을 안내하기 위한 주형으로 사용되어왔다 10. 그러나 사용되는 마스터 몰드는 주로 실리콘이며 장기간 사용하기에 적합하지 않으며 비용이 많이 들 수 있습니다21. 이 연구는 3D 프린팅 기술에 SLA(Stereolithography)를 사용하여 매우 균일한 마스터 금형을 생성했습니다. SLA는 속도, 비용 효율성, 유연성 및 정밀도를 갖춘 프로토타입을 생성합니다22. 또한 맞춤형 제조에 대한 이점은 일반적으로 조직 공학 및 생물 의학을 포함한 여러 분야에서 사용되었습니다22.
스페로이드 세포 배양은 인간의 특징과 매우 유사할 수 있는 생리학적으로 관련성이 있는 체외 연구 모델인 것으로 알려져 있습니다. 따라서 그들은 질병의 발병 및 독성학을 연구하기 위한 모델로 사용되어 왔으며 이미 재생 의학의 바이오 제품으로 상용화되어 있습니다 23,24,25. 따라서 3D 바이오프린팅(3,26) 및 장기 칩(organs-on-chips)24,27과 같은 첨단 기술의 원료로 사용되며, 스페로이드 배양이 얼마나 중요한지, 그리고 스페로이드를 대규모로 생성하기 위한 새로운 전략 개발의 중요성을 지속적으로 보여주고 있습니다.
공개
3D 프린팅된 스탬프와 같은 장치는 Janaína Dernovsek이 공동 창립자이자 혁신 이사인 스타트업 Bioedtech에서 제공했습니다. 저자는 경쟁하는 재정적 이익이 없음을 선언합니다.
감사의 말
이 연구는 리우데자네이루 주 연구 지원 재단(FAPERJ, 브라질), 고등교육 인력 향상을 위한 조정(CAPES, 브라질) 및 브라질 국가 과학 기술 개발 위원회(CNPq, 브라질)의 지원을 받았습니다. 이 연구에 사용된 스탬프와 같은 장치를 제공한 Bioedtech와 세포 배양 시설을 사용해 준 면역약리학 실험실의 Bartira Bergmann 교수에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 6 well plate | Merck | CLS3516 | |
| Agarose | Promega | V3121 | |
| Biodevice | Bioedtech | ||
| Biological Safety Cabinet | ThermoFisher | 51029701 | |
| Centrifugue | ThermoFisher | 75004031 | |
| Corning 50 mL centrifuge tubes | Merck | CLS430829-500EA | |
| Corning cell culture flasks surface area 75 cm2 | Merck | CLS430641 | |
| Draft Resin | FormLabs | FLDRBL01 | |
| Dulbecco′s Modified Eagle′s Medium - low glucose | Merck | D6046 | |
| Fetal Bovine Serum (FBS) | ThermoFisher | 16000044 | |
| Form 2 | FormLabs | ||
| Incubator | ThermoFisher | 51033782 | |
| L929 cell lines | Stablished in the lab | ||
| Penicillin and Streptomycin (PS) | ThermoFisher | 15140122 | |
| Phosphate-Buffered Saline (PBS) | Merck | 806552 | |
| Trypsin with EDTA | Merck | T3924 |
참고문헌
- Laschke, M., Menger, M. Life is 3D: Boosting spheroid function for tissue engineering. Trends in Biotechnology. 35 (2), 133-144 (2017).
- Mekhileri, N., et al. Automated 3D bioassembly of micro-tissues for biofabrication of hybrid tissue engineered constructs. Biofabrication. 10 (2), 024103 (2018).
- Itoh, M., et al. Scaffold-free tubular tissues created by a bio-3D printer undergo remodeling and endothelialization when implanted in rat aortae. PLoS One. 10 (12), 0145971 (2015).
- Kronemberger, G., et al. The hypertrophic cartilage induction influences the building-block capacity of human adipose stem/stromal cell spheroids for biofabrication. Artificial Organs. 45 (10), 1208-1218 (2021).
- Mironov, V., et al. Organ printing: Tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Skardal, A., Shupe, T., Atala, A. Organoid-on-a-chip and body-on-a-chip systems for drug screening and disease modeling. Drug Discovery Today. 21 (9), 1399-1411 (2016).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Charelli, L., et al. Biologically produced silver chloride nanoparticles from B. megaterium modulate interleukin secretion by human adipose stem cell spheroids. Cytotechnology. 70 (6), 1655-1669 (2018).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Achilli, T., Meyer, J., Morgan, J. Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy. 12 (10), 1347-1360 (2012).
- Rolver, M., Elingaard-Larsen, L., Pedersen, S. Assessing cell viability and death in 3D spheroid cultures of cancer cells. Journal of Visualized Experiments. (148), e59714 (2019).
- Quan, H., et al. Photo-curing 3D printing technique and its challenges. Bioactive Materials. 5 (1), 110-115 (2020).
- Rodriguez-Salvador, M., Perez-Benitez, B., Padilla-Aguirre, K. Discovering the latest scientific pathways on tissue spheroids: Opportunities to innovate. International Journal of Bioprinting. 7 (1), 331 (2021).
- Baptista, L., et al. Adult stem cells spheroids to optimize cell colonization in scaffolds for cartilage and bone tissue engineering. International Journal of Molecular Sciences. 19 (5), 1285 (2018).
- Shakeri, A., Khan, S., Didar, T. Conventional and emerging strategies for the fabrication and functionalization of PDMS-based microfluidic devices. Lab on a Chip. 21 (16), 3053-3075 (2021).
- vander Valk, J. Fetal bovine serum (FBS): Past - present - future. ALTEX. 35 (1), 99-118 (2018).
- vander Valk, J., Brunner, D., et al. Optimization of chemically defined cell culture media - Replacing fetal bovine serum in mammalian in vitro methods. Toxicology in Vitro. 24 (4), 1053-1063 (2010).
- Smyrek, I., et al. microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8 (1), 037051 (2018).
- McMillen, P., Holley, S. Integration of cell-cell and cell-ECM adhesion in vertebrate morphogenesis. Current Opinion in Cell Biology. 36, 48-53 (2015).
- Tung, Y., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Guo, X., Li, S., Ji, Q., Lian, R., Chen, J. Enhanced viability and neural differential potential in poor post-thaw hADSCs by agarose multi-well dishes and spheroid culture. Human Cell. 28 (4), 175-189 (2015).
- Andréa Dernowsek, J., Rezende, R., Lopes daSilva, J. The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine. 1 (1), 63-74 (2017).
- Garcez, P., et al. Zika virus impairs growth in human neurospheres and brain organoids. Science. 352 (6287), 816-818 (2016).
- Skardal, A., et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports. 7, 8837 (2017).
- Armoiry, X., et al. Autologous chondrocyte implantation with chondrosphere for treating articular cartilage defects in the knee: An evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 37 (7), 879-886 (2018).
- Nakamura, A., et al. Bio-3D printing iPSC-derived human chondrocytes for articular cartilage regeneration. Biofabrication. 13 (4), 044103 (2021).
- Mesquita, C., Charelli, L., Baptista, L., Naveira-Cotta, C., Balbino, T. Continuous-mode encapsulation of human stem cell spheroids using droplet-based glass-capillary microfluidic device for 3D bioprinting technology. Biochemical Engineering Journal. 174, 108122 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유