Method Article
Pluripotent Kök Hücrelerden Elde Edilen Kendi Kendine Monte Edilen İnsan Kalbi Organoidlerinin Üretilmesi
Bu Makalede
Özet
Burada, insan pluripotent kök hücrelerini kendi kendine örgütlenerek verimli bir şekilde kullanarak gelişimsel olarak ilgili insan kalbi organoidleri (hSO'lar) oluşturmak için bir protokol açıklıyoruz. Protokol, gelişimsel ipuçlarının sıralı aktivasyonuna dayanır ve son derece karmaşık, işlevsel olarak ilgili insan kalp dokuları üretir.
Özet
Sağlık ve hastalıkta insan kardiyak gelişimini inceleme yeteneği, insan kalbinin in vitro karmaşıklığını modelleme kapasitesi ile oldukça sınırlıdır. Organoidler ve çip üzerindeki organlar gibi karmaşık in vivo fenotipleri modelleyebilen daha verimli organ benzeri platformlar geliştirmek, insan kalbi gelişimini ve hastalığını inceleme yeteneğini artıracaktır. Bu makalede, insan pluripotent kök hücreleri ve küçük molekül inhibitörleri kullanılarak adım adım gelişimsel yol aktivasyonu kullanılarak kendi kendine örgütlenerek son derece karmaşık insan kalbi organoidleri (hMO'lar) oluşturmak için bir protokol açıklanmaktadır. Embriyoid cisimler (EBs), 96 kuyulu bir plakada yuvarlak tabanlı, ultra düşük bağlantı kuyuları ile üretilir ve bireyselleştirilmiş yapıların süspansiyon kültürünü kolaylaştırır.
EB'ler, kardiyak mezoderm kaderini teşvik etmek için ilk Wnt yolu aktivasyonunu, kesin kardiyak soylar oluşturmak için Wnt inhibisyonunun ikinci bir adımını ve proepikardiyal organ dokularını indükleyen üçüncü bir Wnt aktivasyon adımını içeren üç adımlı bir Wnt sinyal modülasyon stratejisi ile hMO'lara farklılaşmaya tabir edilir. 96 kuyu formatında gerçekleştirilen bu adımlar son derece verimli, tekrarlanabilir ve çalışma başına büyük miktarlarda organoid üretir. Farklılaşmanın 3. gününden 11. gününe kadar immünofluoresans görüntüleme ile yapılan analizler, atriyal ve ventrikül kardiyomiyosit bölgelerine sahip miyokard dokusunun yanı sıra endokardiyal doku ile kaplı iç odalar da dahil olmak üzere, 15. günde hMO'ların içindeki birinci ve ikinci kalp alanı spesifikasyonlarını ve son derece karmaşık dokuları ortaya koymaktadır. Organoidler ayrıca yapı boyunca karmaşık bir damar ağı ve epikardial dokunun dış astarını sergiler. Fonksiyonel açıdan, hMO'lar sağlam bir şekilde döver ve Fluo-4 canlı görüntüleme ile belirlenen normal kalsiyum aktivitesini sunar. Genel olarak, bu protokol insan organı benzeri kalp dokularında in vitro çalışmalar için sağlam bir platform oluşturmaktadır.
Giriş
Konjenital kalp defektleri (CHD) insanlarda en sık görülen konjenital defekt türüdür ve tüm canlı doğumların yaklaşık % 1'ini etkiler1,2,3. Çoğu durumda, CHD'lerin nedenleri bilinmemektedir. Laboratuvarda gelişmekte olan insan kalbine çok benzeyen insan kalbi modelleri oluşturma yeteneği, vekil hayvan modellerinden ziyade insanlarda CHD'lerin altında kalan nedenleri doğrudan incelemek için önemli bir adım oluşturmaktadır.
Laboratuvarda yetiştirilen doku modellerinin özeti organoidlerdir, hücre kompozisyonuna ve fizyolojik işleve ilgi gösteren bir organa benzeyen 3D hücre yapılarıdır. Organoidler genellikle kök hücrelerden veya progenitör hücrelerden türetilir ve beyin4,5, böbrek6,7, bağırsak8,9, akciğer10,11, karaciğer12,13 ve pankreas14,15 gibi birçok organı modellemek için başarıyla kullanılmıştır. , sadece birkaç isim vermek için. Son çalışmalar, kalp gelişimini in vitro olarak incelemek için kendi kendine bir araya getiren kalp organoidleri oluşturmanın fizibilitesini göstermiştir. Bu modeller, erken kalp gelişimini modellemek için fare embriyonik kök hücrelerini (mESC' ler) kullanmayı içerir16,17 atriyoventriküler spesifikasyon18'e kadar ve insan pluripotent kök hücreleri (hPSC' ler) çok mikrop tabakası kardiyak-endoderm organoidleri19 ve son derece karmaşık hücresel bileşime sahip odalı kardiyooidler20 üretmek için.
Bu makale, son derece karmaşık hMO'ları verimli ve uygun maliyetli bir şekilde oluşturmak için yeni bir 3 adımlı WNT modülasyon protokolü sunun. Organoidler 96 kuyulu plakalarda üretilir, bu da kolayca otomatikleştirilebilir ölçeklenebilir, yüksek verimli bir sistemle sonuçlanır. Bu yöntem, hPSC agregalarının oluşturulmasına ve mezoderm ve kardiyak mezoderm oluşumu, birinci ve ikinci kalp alanı spesifikasyonu, proepikardiyal organ oluşumu ve atriyoventriküler spesifikasyon dahil olmak üzere kardiyogenez gelişim adımlarını tetiklemeye dayanır. 15 günlük farklılaşmadan sonra, hNO'lar kalpte bulunan tüm ana hücre soylarını, iyi tanımlanmış iç odaları, atriyal ve ventrikül odalarını ve organoid boyunca bir damar ağını içerir. Bu son derece sofistike ve tekrarlanabilir kalp organoid sistemi, kalp gelişimi, hastalıkları ve farmakolojik tarama çalışmalarında yapısal, fonksiyonel, moleküler ve transkriptomik analizleri araştırmaya açıktır.
Protokol
1. hPSC kültürü ve bakımı
NOT: İnsan indüklenen PSC'ler (hiPSC'ler) veya insan embriyonik kök hücreleri (hESC'ler), farklılaşma veya daha fazla kriyoprezervasyon için EB üretmek için kullanılmadan önce çözdükten sonra en az 2 ardışık pasaj için kültüre edilmelidir. hPSC'ler, bodrum-membran-hücre dışı matris (BM-ECM) kaplı 6 kuyulu kültür plakalarında PSC ortamında kültürlenir ( Bkz. Malzeme Tablosu). 6 kuyulu plakalarda hPSC'lerde orta değişiklikler yaparken, istenmeyen hücre kopmasını veya stresini önlemek için ortamı doğrudan hücrelerin üzerine değil, doğrudan kuyunun iç tarafına ekleyin. Kullanıcılar, 37 °C'de ısıtılmaması gereken ısınma öncesi PSC medyasına karşı dikkatli olmalıdır; bu protokolde kullanılan tüm PSC ortamları termostable'dı.
- Kuyu plakalarını BM-ECM ile kaplamak için, BM-ECM'nin bir aliquot'unu (üreticinin talimatlarına göre -20 °C'de saklanır) buz üzerinde çözün ve BM-ECM'nin 0,5 mg'ını 12 mL soğuk Dulbecco'nun modifiye Eagle ortası (DMEM)/F12 ortamıyla karıştırın (4 °C'de saklanır). DMEM/F12-BM-ECM karışımının 2 mL'lik kısmını 6 kuyulu bir plakanın her kuyusuna dağıtın ve en az 2 saat boyunca 37 °C'de kuluçkaya yatırın.
- Hücreleri eritmek için, önce, hPSC cryovial'ı 37 °C boncuk veya su banyosunda 1-2 dakika boyunca sadece az miktarda buz görünene kadar çözün. Çözülen hücreleri bir santrifüj tüpüne aktarın ve yavaşça 2 μM ROCK inhibitörü, tiazovivin (Thiaz) ile desteklenmiş PSC ortamının 8-9 mL'sini ekleyin ve 5 dakika boyunca 300 × g'da santrifüj ekleyin. Süpernatantı çıkarın ve hücre peletini 2 μM Thiaz ile desteklenmiş PSC ortamına yeniden ısıtın. Kültür ortamındaki hücreleri, PSC ortamını değiştirmeden önce 37 °C'deki cryovial hücre konsantrasyonuna ve kültürüne bağlı olarak 1-2 kuyuya, 24 saat boyunca% 5 CO2'ye dağıtın.
- Hücrelerdeki ortamı 48 saat aralıklarla değiştirin. Sırasıyla DMEM/F12 (1 mL/kuyu) ve PSC ortamını (2 mL/kuyu) kullanarak yıkama ve orta değişiklikler gerçekleştirin.
NOT: Yıkamalar hücre atıklarının ve döküntülerinin giderilmesine yardımcı olurken, taze medya değişiklikleri hücrelere yenilenmiş bir besin kaynağı sağlar. - Ortamı aspire ederek alt iletkenlik üzerine hücreleri (%60-80 bir arada) geçirme, ardından her bir kuyuyu 1x Dulbecco'nun fosfat tamponlu çözeltisinin 1 mL'si ile yıkama (kalsiyum yok, magnezyum yok; DPBS). DPBS'yi aspire edin ve hPSC'ler için ayrışma reaktifinin 1 mL'lik kısmını ekleyin ( Bkz. Malzeme Tablosu), ardından 10 sn'den sonra reaktifin ince bir filmi hariç hepsinin aspirasyonu.
- Hücreler arasında boşluklar oluşana kadar hPSC'ler için dissositasyon reaktifinin ince filmiyle 2-5 dakika kuluçkaya yatırın.
NOT: Ayrışmayı durdurma süresi hücre satırına bağlıdır. - Kuyuya 2 μM Thiaz (PSC medium+Thiaz) ile desteklenmiş PSC ortamının 1 mL'lik kısmını ekleyin ve hücre müfrezesini indük etmek için plakaya hafifçe dokunun. Herhangi bir büyük koloniyi parçalamak için ortamdaki müstakil hücreleri 1-2 kez pipetleyin ve PSC medium +Thiaz'daki hücreleri 1:6 kuyu oranında yeniden biriktirin (1'den hücreler 12 mL kültür ortamında yeniden canlandırılmış). Hücreleri BM-ECM kaplı kuyulara yeniden plakala.
2. 3D kendi kendine monte insan kalp organoidleri üretimi
- Embriyoid vücut (EB) oluşumu:
NOT: Embriyoid vücut oluşumu öncesinde gözlemlenebilir farklılaşmış hücrelerin sınırlandırılması zorunludur. %60-80'lik bir konfülemede 6-well plakasının iki ila üç kuyusu, tek bir 96 kuyu plakası organoid için yeterli hücre sağlayacaktır. Tüm ortamlar, EBs veya organoidlere sıcaklık şokunu en aza indirmek için herhangi bir orta değişiklik yapmadan önce 37 °C'lik bir boncuk veya su banyosunda aliquoted ve ısıtılmalıdır (bu hücre dissositasyon reaktiflerini içermez). Bkz. Şekil 1A,B.- Gün -2
- EBs oluşturmak için, -2 gününde, herhangi bir hücre kalıntılarını yıkamak ve DPBS'yi aspire etmek için en az 10 sn boyunca DPBS ile alt konfluent hPSC'leri (%60-80 confluent) yıkayın.
- Hücreleri ayırmak ve tek hücreli bir duruma bırakmak için, her kuyuya 3-6 dakika boyunca 1 mL oda sıcaklığı hücre ayrıştırma reaktifi ekleyin ( Malzeme Tablosuna bakın). Mikroskop altında kontrol ederken ayırmaya neden olmak için plakaya dakikada ~ 5 kez hafifçe dokunun. Reaksiyonu durdurmak için 1 mL PSC medium+Thiaz ekleyin.
- Hücreleri toplamak ve kalan agregaları parçalamak için, tek hücreli bir süspansiyon oluşturmak için ortamı kuyuda 2-3 kez yukarı ve aşağı pipetlayın. Tek hücreli süspansiyonu bir santrifüj tüpüne aktarın ve 300 × g'da 5 dakika döndürün.
- İstenilen hücre konsantrasyonu elde etmek için, süpernatant atın ve psc orta + Thiaz 1 mL hücreleri yeniden atın. Bir hücre sayacı veya hemositometre kullanarak hücreleri sayın ve PSC medium+Thiaz'daki hücreleri 100.000 hücre/mL konsantrasyonuna seyreltin.
- EB oluşumu için hücreleri dağıtmak için, yuvarlak tabanlı ultra düşük ataşman 96 kuyu plakasının her kuyusuna 100 μL (10.000 hücre) eklemek için çok kanallı bir pipet kullanın. Plakayı 100 × g'da 3 dakika santrifüj edin ve 37 °C,% 5 CO2'de 24 saat kuluçkaya yatırın.
- Gün -1
- Her kuyudan 50 μL orta dikkatlice çıkarın ve kuyu başına 250 μL'lik son bir hacim elde etmek için 37 °C'ye ısıtılmış 200 μL taze PSC ortamı ekleyin. Hücreleri 37 °C'de 24 saat kuluçkaya yatır, %5 CO2.
NOT: Kuyunun altındaki ED'leri rahatsız etmemek için kuyunun kenarına dikkatlice orta ekleyin ve ekleyin. EBs'nin hassas doğası ve süspansiyon kültürü nedeniyle, EB'leri rahatsız etmemek için ortamı değiştirirken her kuyuda küçük bir hacim sıvı bırakmak gerekir.
- Her kuyudan 50 μL orta dikkatlice çıkarın ve kuyu başına 250 μL'lik son bir hacim elde etmek için 37 °C'ye ısıtılmış 200 μL taze PSC ortamı ekleyin. Hücreleri 37 °C'de 24 saat kuluçkaya yatır, %5 CO2.
- Gün -2
- İnsan Kalbi Organoidi (hHO) Farklılaşması:
NOT: Tüm ortamlar, herhangi bir medya değişikliğine gerek duymadan önce 37 °C'lik bir boncuk veya su banyosunda ısıtılmalıdır. Kuyunun dibinde gelişen organoidleri rahatsız etmemek için kuyunun kenarına dikkatlice orta ekleyin ve ekleyin. Ajitasyonu en aza indirmek ve inhibitörlerin ve büyüme faktörlerinin kademeli olarak giderilmesine izin vermek için medya değişiklikleri arasında yıkamalara gerek yoktur. Farklılaşma protokolü boyunca %2 B-27 ekli (Malzeme Masası) RPMI kullanılmıştır. B-27 takviyesi belirtilmedikçe insülin içerir (0-5 gün içinde insülin içermez). Bkz. Şekil 1C.- 0. Gün
- Bir mezoderm soyuna doğru farklılaşma başlatmak için, her kuyudan 166 μL orta (toplam kuyu hacminin ~ 2 / 3' ü ) çıkarın ve insülin içermeyen B-27 takviyesi içeren 166 μL RPMI 1640 ekleyin, 6 μM CHIR99021, 1.875 ng/mL kemik morfogenetik protein 4 (BMP4) ve 1.5 ng/mL Activin A 4 μM CHIR99021 son kuyu konsantrasyonu için, 1.25 ng/mL BMP4 ve 1 ng/mL Activin A. 37 °C'de 24 saat kuluçkaya yatır, %5 CO2.
- 1. Gün
- Her kuyudan 166 μL orta çıkarın ve insülin içermeyen B-27 takviyesi ile 166 μL taze RPMI 1640 ekleyin. 37 °C'de 24 saat kuluçkaya yaslanın, %5 CO2.
- 2. Gün
- Kardiyak mezoderm spesifikasyonunu teşvik etmek için, her kuyudan 166 μL orta çıkarın ve 37 °C'de 48 saat boyunca 2 μM Wnt-C59. Incubate için insülinsiz B-27 takviyesi ve 3 μM Wnt-C59 içeren 166 μL RPMI 1640 ekleyin.
- 4. Gün
- Her kuyudan 166 μL orta çıkarın ve insülin içermeyen B-27 takviyesi ile 166 μL taze RPMI 1640 ekleyin. 37 °C'de 48 saat kuluçkaya yaslanın, %5 CO2.
- 6. Gün
- Her kuyudan 166 μL orta çıkarın ve B-27 takviyesi ile 166 μL RPMI 1640 ekleyin. 37 °C'de 24 saat kuluçkaya yaslanın, %5 CO2.
- 7. Gün
- Proepikardiyal farklılaşmayı teşvik etmek için, her kuyudan 166 μL orta çıkarın ve 2 μM CHIR99021 son kuyu konsantrasyonu için B-27 takviyesi ve 3 μM CHIR99021 içeren 166 μL taze RPMI 1640 ekleyin. 37 °C'de 1 saat kuluçkaya yaslanın, %5 CO2.
- Her kuyudan 166 μL orta çıkarın ve B-27 takviyesi içeren 166 μL taze RPMI 1640 ekleyin. 37 °C'de 48 saat kuluçkaya yaslanın, %5 CO2.
NOT: Organoidler medya değişiklikleri nedeniyle harekete daha yatkın olduğu için 7. - Analizler veya deneyler için toplama veya aktarma işlemine kadar, her kuyudan 166 μL orta çıkararak her 48 saat orta değişiklikler yapın ve B-27 takviyesi içeren 166 μL taze RPMI 1640 ekleyin.
NOT: Organoidler, daha erken gelişim aşamaları ilgi çekici olmadıkça 15. Uzun süreli kültür veya olgunlaşma deneyleri için 15.
- 0. Gün
3. Organoid analizi
- Tüm organoidlerin aktarılması (canlı veya sabit)
NOT: Canlı organoid transferi için kullanılan pipet uçlarının steril olduğundan emin olun.- P200 pipet ucunun uc ucunu uç açıklığından 5-10 mm kesin, böylece ~2-3 mm çapında geniş bir açıklık elde edin.
- Ucu doğrudan organoid içeren yuvarlak tabanlı kuyuya yerleştirin, böylece pipet tamamen dikeydir (plakaya dik). Ucu ortama yerleştirmeden önce pipet pistonuna zaten basıldığından emin olun.
- Pipet pistonu yavaşça serbest bırakın, organoidi toplamak için yeterli ortamı (100-200 μL) alın.
- Organoidi orta olarak hedef hedefe aktarın (örneğin, sabitleme, canlı görüntüleme, elektrofizyoloji kaydı, yeni plaka kültürü).
- Organoidlerin sabitlenerek sabitlendirme
NOT: Organoidlerin sabitlenilmesi ve boyanması 96 kuyu kültür plakasında veya mikrosantrifüj tüplerinde yapılabilir. Paraformaldehit (PFA) sadece duman kaputunda ele alınmalıdır.- Mikrosantrifüj tüplerde sabitleme için, canlı organoidleri tüp başına 1-8 organoid ile ayrı tüplere aktarın.
NOT: Tüp başına 8 organoidi aşmayın. - Organoidlere dokunmadan tüpten mümkün olduğunca fazla ortamı dikkatlice çıkarın ve atın.
- Her tüpe veya kuyuya %4 PFA ekleyin (mikrosantrifüj tüpü başına 300-400 μL ve 96 kuyu plakası kuyusu başına 100-200 μL). Oda sıcaklığında 30-45 dakika kuluçkaya yatır.
NOT: 1 saatin üzerindeki kuluçka süreleri antijen alma adımları gerektirebilir ve önerilmez. - Organoidleri bozmadan PFA'yı güvenli bir şekilde atın. %4 PFA için kullanılan aynı hacmi kullanarak, yıkamalar arasında 5 dakika bekleyerek, 1,5 g/L glisin (DPBS/Gly) ile desteklenmiş DPBS ile 3 yıkama gerçekleştirin. DPBS/Gly'yi çıkarın ve immünostaining veya diğer analizlere geçin veya DPBS ekleyin ve 2 haftaya kadar ileride kullanılmak üzere 4 °C'de saklayın.
NOT: Sabit organoidlerin 2 haftadan uzun süre saklanması doku bozulmasına ve kirlenmesine neden olabilir ve önerilmez.
- Mikrosantrifüj tüplerde sabitleme için, canlı organoidleri tüp başına 1-8 organoid ile ayrı tüplere aktarın.
- Tüm montajlı immünofluoresan boyama
- Sabit organoidleri içeren her kuyuya veya tüpe 100 μL blokaj/permeabilizasyon çözeltisi (%10 normal eşek serumu + %0,5 sığır serum albümini (BSA) + 1x DPBS'de %0,5 Triton X-100) ekleyin. Bir çalkalayıcıda gece boyunca oda sıcaklığında kuluçkaya yatırın.
NOT: Tüp başına 8 organoidi aşmayın. - Organoidlere dokunmadan engelleme çözeltisinin mümkün olduğunca çoğunu dikkatlice çıkarın ve atın. DPBS ile 3 yıkama gerçekleştirin, yıkamalar arasında 5 dakika bekletin.
- Önerilen konsantrasyonlarda istenen primer antikor çözeltisi (%1 normal eşek serumu + %0,5 BSA + %0,5 Triton X-100 in 1x DPBS) hazırlayın. Bir çalkalayıcıda 24 saat boyunca 4 °C'de kuluçkaya yaslanın.
- Organoidlere dokunmadan antikor çözeltisinin mümkün olduğunca çoğunu dikkatlice çıkarın ve atın. DPBS ile 3 yıkama gerçekleştirin, yıkamalar arasında 5 dakika bekletin.
- Önerilen konsantrasyonlarda istenen ikincil antikorlarla sekonder antikor çözeltisi (%1 normal eşek serumu + %0,5 BSA + %0,5 Triton X-100 in 1x DPBS) hazırlayın. Antikorlar floresan olarak etiketlenmişse, bir çalkalayıcı üzerinde 24 saat boyunca karanlıkta 4 °C'de (örneğin alüminyum folyo ile kaplı) kuluçkaya yatırın.
- Organoidlere dokunmadan antikor çözeltisinin mümkün olduğunca çoğunu dikkatlice çıkarın ve atın. DPBS ile 3 yıkama gerçekleştirin, yıkamalar arasında 5 dakika bekletin.
- Organoidlerle kapak ucunun yerleştirileceği slaydın kenarlarına yakın bir montaj ortamına monte edilmiş boncuklu (90-300 μm çapında) slaytlar hazırlayın ( Malzeme Tablosuna bakın).
NOT: Devam etmeden önce boncukların etrafındaki montaj ortamının kurumasına izin vermeniz önerilir; bu, boncukların hareket etmesini önleyecektir. Bkz. Şekil 2. - Lekeli organoidleri kesilmiş bir pipet ucu kullanarak slayta, boncuklar arasında aktarın, slaytta bir kez organoidler arasında teması önlemek için aralık sağlayın. Organoidin etrafındaki fazla sıvıyı dikkatlice çıkarmak için yuvarlanmış bir laboratuvar mendilinin köşesini kullanın.
- Organoidleri montaj temizleme ortamı ile örtün (fruktoz-gliserol temizleme çözeltisi slayt başına montaj temizleme ortamının 120-150 μL'sini kullanarak% 60 (vol/vol) gliserol ve 2,5 M fruktozdur)37 .
NOT: Çok viskoz olduğu için montaj temizleme ortamıyla çalışırken kesilmiş pipet ucu kullanılması önerilir. - Kapak kapağını montaj temizleme çözeltisi ile kaplı organoidlerle kaydırağın üzerine gelin ve organoidlerin monte edilen boncuklar arasında olduğundan emin olarak kapak kapağını slaytın üzerine yavaşça bastırın.
- Üst kat tırnak verniği kullanarak slayttaki kapak cilasının çevresini kapatın. Kaydırağın oda sıcaklığında 1 saat boyunca karanlıkta kurumasını bekleyin. Uzun süreli depolama için karanlıkta 4 °C'de saklayın.
- Sabit organoidleri içeren her kuyuya veya tüpe 100 μL blokaj/permeabilizasyon çözeltisi (%10 normal eşek serumu + %0,5 sığır serum albümini (BSA) + 1x DPBS'de %0,5 Triton X-100) ekleyin. Bir çalkalayıcıda gece boyunca oda sıcaklığında kuluçkaya yatırın.
- Canlı kalp organoidlerinde kalsiyum geçici görüntüleme
NOT: Üreticinin talimatlarına göre, Fluo4-AM 0,5 mM'lik nihai stok çözelti konsantrasyonuna dimetil sülfit (DMSO) olarak yeniden inşa edilmiştir. Fluo4-AM, 96 kuyu plakasındaki organoid kuyusuna doğrudan eklendi.- RPMI 1640 ortamını kullanarak organoidler üzerinde 2 yıkama gerçekleştirin.
- Harcanan ortamın 166 μL'lik kısmını kuyudan çıkarın.
- 166 μL ısıtılmış RPMI 1640 ortamı ekleyin, 166 μL ortayı çıkarın ve 166 μL taze RPMI 1640 orta ekleyin.
NOT: Yıkamalar atık malzeme ve hücre kalıntılarını gidermek için yapılır. Fonksiyonel tahlilden önce kuyunun dibindeki organoidleri rahatsız etmemek için yıkamalar sırasında ortamın üçte ikisi kuyulardan çıkarılır.
- Organoidlere Fluo4-AM ortamı ekleyin.
- 1,5 μM'lik bir çözelti hazırlamak için B-27 takviyesi içeren RPMI 1640'a DMSO'da yeniden inşa edilen Fluo4-AM'yi ekleyin.
- Kuyudan 166 μL orta çıkarın.
- RPMI 1640'ta 166 μL 1.5 μM Fluo4-AM ekleyin ve 1 μM'lik son kuyu konsantrasyonu için B-27 takviyesi ekleyin.
- Adım 3.4.1'deki gibi 2 yıkama gerçekleştirin.
- Kuyuya B-27 takviyesi içeren 166 μL RPMI 1640 ekleyin.
- Bir P200 pipet ucunun kesilmiş bir ucunu kullanarak, organoidi 100-200 μL orta boy bir cam tabanlı Petri kabına (örneğin, 1,5 yüksek performanslı kapaklı 8 kuyulu kapak camı) aktarın.
NOT: Tüm organoidlerin aktarılmasıyla ilgili bölüm 3.1'e bakın. - Görüntü organoidler, 37 °C, %5 CO2 sıcaklık ve CO2 kontrollü bir oda ile mikroskop altında yaşar.
- Organoidin çeşitli yerlerinde, kalsiyum hücrelere girip çıkarken floresan yoğunluğu seviyelerindeki artışı ve azalmayı gösteren birkaç 10-20 s video kaydedin.
NOT: Yüksek çözünürlüklü kayıtlar için 10 fps veya daha hızlı bir hızda kayıt yapılması önerilir; 50 fps önerilir. - İlgi çekici bölgeleri seçerek ve zaman içinde yoğunluk seviyelerini ölçerek görüntü analizi yazılımı (örneğin, ImageJ) kullanarak videoları analiz edin.
- ΔF/F0 ve zaman karşılaştırmasını milisaniyeler ve çizimler halinde kullanarak yoğunluk kayıtlarını normalleştirin.
- RPMI 1640 ortamını kullanarak organoidler üzerinde 2 yıkama gerçekleştirin.
Sonuçlar
Kendi kendini organize eden hHO in vitro elde etmek, Daha önce Wnt yol modülatörleri kullanılarak kardiyomiyositlerin ve epikardiyal hücrelerin 2D monolayer farklılaşması için ve 3D prekardiyak organoidler16 için BMP4 ve Activin A. Burada açıklanan ve Şekil 1'de gösterilen 96 kuyu plakası EB ve hHO farklılaşma protokolünü kullanarak modifiye ettik ve birleştirdik. , Wnt yolu aktivatör CHIR99021'in konsantrasyonları ve maruz kalma süreleri, insan PSC'lerinden türetilen yüksek oranda tekrarlanabilir ve karmaşık hMO'lar verecek şekilde optimize edilmiştir.
0. günde farklılaşmaya başlamadan önce 24 saat sonra orta bir değişiklikle 48 saat boyunca ES'lerin kuluçkaya yatmasına izin verildi. 0. günde, ED'ler ışık mikroskobu altında her kuyunun merkezinde koyu küresel bir agrega olarak görünmelidir (Şekil 1B). Farklılaşma protokolü 0. günde Wnt yolu aktivasyonu ve tam olarak 24 saat boyunca büyüme faktörü ilavesi ile başlar. Bu mezoderm indüksiyonu ve ardından Wnt yol inhibitörü Wnt-C59 kullanılarak 2. günde kardiyak mezoderm indüksiyonu, organoidin ~200 200'den itibaren önemli ölçüde genişlemesine neden olacaktır. μm çapı 4. günde 500-800 μm çapında ve 1 mm'ye kadar (organoidler 15. güne kadar boyut olarak hafif bir azalma yaşayabilir (Şekil 1C)). hHO 6. gün kadar erken atmaya başlayacaktır (Video 1), organoidlerin% 100'ü 10. Bu 5 farklı hPSC hücre hattında gözlenmiştir23.
HMO'ların kalbin fizyolojik gelişiminin çeşitli adımlarını temsil etme kapasitesini değerlendirmek için, farklılaşma protokolü boyunca çeşitli zaman noktalarında organoidler topladık ve kalp alanı belirteçlerinin varlığını ve transkriptomik ifadesini aradık. İlk kalp alanı (FHF) belirteci hand1 ve ikinci kalp alanı (SHF) işaretleyicisi HAND2 için immünoresan lekelenme, sırasıyla 3 ve 5. gün civarında ortaya çıkan bu kardiyak progenitör hücrelerde nükleer varlıklarını ortaya koydu (Şekil 3A).
Her iki belirtecin ifadesi, FHF için 7. günden ve SHF için 9. İlginçtir ki, 7. Buna karşılık, HAND2 eksprese eden hücrelerin çoğu kardiyomiyosit işaretleyicisini ifade etmedi (Şekil 3B). Bu gözlem, SHF progenitör hücrelerinden miyosit olmayan hücrelerin gelişimini gösteren fare ESC'lerinden elde edilen prekardiyak organoidlerle aynı fikirdedir16. RNA-Dizileme verilerinin, hem HAND1 hem de HAND2 için RNA transkriptlerinin 3. günden itibaren ifade edildiğini, FHF işaretleyicisinin 3 ila 11 gün arasında daha yüksek şekilde ifade edildiğini ve SHF işaretleyicisinin 13. günden sonra daha yüksek bir şekilde ifade edildiğini göstermek önemlidir (Şekil 3C).
İmmünofluoresans lekesi, insan kalbini oluşturan çeşitli hücre tipi soyların belirteçlerinin varlığını ortaya koydu. Epikardiyal dokuya bitişik miyokard dokusu (kardiyomiyosit spesifik belirteç TNNT2 kullanılarak tanımlanabilir) (nükleer transkripsiyon faktörü WT1 ve epitel membran işaretleyici TJP1 ile işaretlenmiştir) (Şekil 4A). Organoidler içinde iç oda benzeri yapıların duvarlarını astarlayan NFATC1'i ifade eden endokardiyal hücreler saptanmıştır (Şekil 4B). Damar benzeri bir ağdaki endotel hücreleri farklılaşmanın 13. Son olarak, organoid boyunca birbirine karışmış kardiyak fibroblastların varlığını rapor ediyoruz (Şekil 4D). Bu hücre tipi belirteçler RNA-Seq gen ekspresyon profillerinde de gözlenmiştir (Şekil 4E). Organoidlerdeki hücre tiplerinin bileşimi, işgal ettikleri organoidin alanına göre ölçüldüğünde, geri kalanı epikardial hücreler (~% 15), endokardiyal hücreler (~ % 13), kardiyak fibroblastlar (~ % 12) ve endotel hücreleri (~% 1) dahil olmak üzere miyosit dışı kardiyak hücrelerden oluşan ~ % 58 kardiyomiyositler olarak bulunmuştur (Şekil 4F).
Organoidlerin elektrofizyolojik fonksiyonu, tüm organoidlerdeki tek tek hücrelerin canlı kalsiyum görüntülemesi ile ölçüldü. Fluo-4 floresan yoğunluğu, kalsiyumun hücreye giriş ve çıkışı nedeniyle zamanla değişerek düzenli etki potansiyellerini ortaya çıkarır (Şekil 5A). Organoidin yüksek büyütme bölgesi üzerinde kalsiyum yoğunluğu gösteren ısı eşlemleri, tek tek hücrelerdeki kalsiyum geçicileri nedeniyle artan yoğunluğu göstermektedir (Şekil 5B ve Video 3).
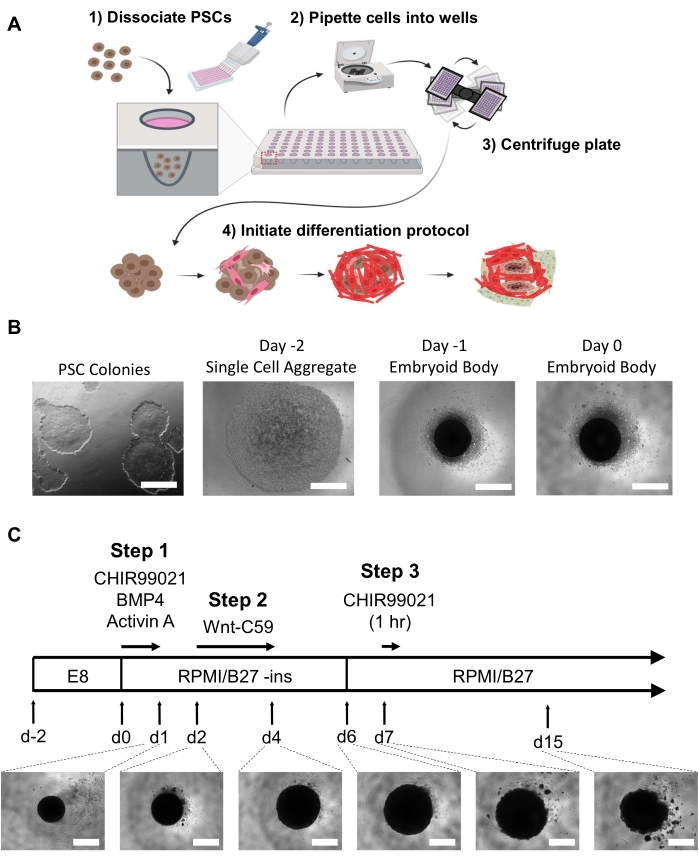
Şekil 1: Embriyoid vücut üretimi ve kalp organoid farklılaşma adımları. (A) (1-2) Ayrışmış hücreler, çok kanallı bir pipet aracılığıyla 96 kuyulu ultra düşük bağlanma plakasının kuyularına tohumlanır. (3) 96 kuyu plakası daha sonra santrifüj edilir, bu da hücrelerin merkezde bir araya top olmasını sağlar. (4) Zamanla, büyüme faktörlerinin ve yol modülatörlerinin eklenmesinden sonra, embriyoid gövdesi birkaç kardiyak soyuna farklılaşmaya başlar ve iç mikro şarampolleri çevreleyen mekansal ve fizyolojik olarak ilgili farklı hücre popülasyonları oluşturur. (B) Embriyoid vücut neslinin ilerleyişinin temsili görüntüleri, 2 boyutlu iPSC kültürü ile başlayan (solda) ve 0 günlük embriyoid vücutla biten (sağda); ölçek çubuğu = 500 μm. (C) 1. günden 15. güne kadar ışık mikroskopisi altında ilgili zaman noktalarına, sürelere ve organoid görüntüleri geliştiren kimyasal yol modülatörleri ve inhibitörleri de dahil olmak üzere insan kalbi organoid farklılaşma protokolünün özeti; ölçek çubuğu = 500 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
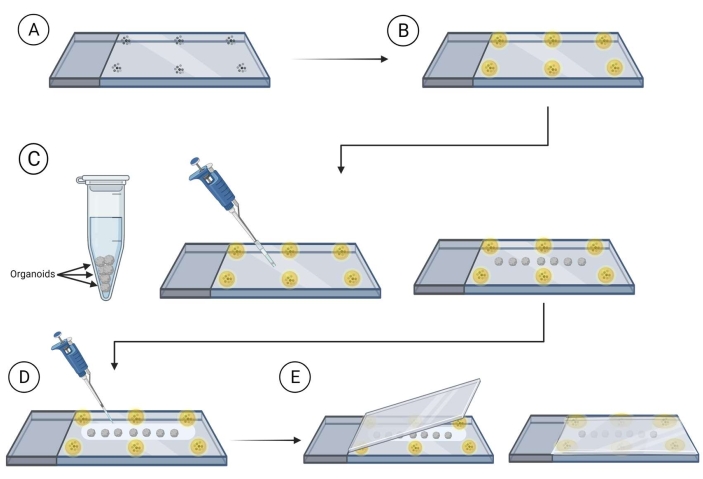
Şekil 2: Görüntüleme için slaytlara tüm organoid montajı. Slayt hazırlama ve organoidleri görüntüleme için monte etme adımları. (A) Mikropların cam bir slaytın çevresine yerleştirilmesi. (B) Mikropları montaj ortamı ile örtmek. (C) Organoidlerin boncuklar arasındaki kaydırağa aktarılması ve organoidleri çevreleyen fazla sıvının çıkarılması. (D) Organoidlerin temizleme/montaj ortamı ile kaplanır. (E) Kapak kapağını organoid ve boncuklarla kaydırağın üzerine yerleştirmek. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: HMO'larda birinci kalp alanı ve ikinci kalp alanı spesifikasyonu fizyolojik insan kalbi gelişimini özetler. (A) FHF (HAND1, üst) ve SHF (HAND2, alt) ve kardiyomiyositler (TNNT2) ve nükleer boya DAPI oluşumunu gösteren 3 ila 11 günlük konfokal immünofluoresans görüntüleri; ölçek çubukları = 500 μm. (B) HAND1 ve HAND2'nin kardiyomiyosit işaretleyicisi TNNT2 ile birlikte lokalizasyonunu gösteren 7. ölçek çubukları = 0 günden 19. güne kadar FHF işaretleyici HAND1 (kırmızı) ve SHF işaretleyici HAND2 (mavi) RNA-Seq gen ekspresyon profilleri. Kısaltmalar: hMO'lar = insan kalp organoidleri; FHF = ilk kalp alanı; SHF = ikinci kalp alanı; HAND = kalp ve sinir arması türevleri ifade edilir; TNNT2 = kardiyak troponin T2; DAPI = 4',6-diamidino-2-fenylindole. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: HMO'larda kardiyak soylar gelişir. (A-D) 15. günün konfokal immünofluoresans görüntüleri, miyomit olmayan kardiyak hücrelerde kardiyomiyositlerin (TNNT2) oluşumunu ve nükleer boya DAPI ile lekelenmeyi gösterir. (A) Miyokard dokusunun üstünde ve bitişiğinde epitel kökenli epitel hücrelerini gösteren epikardiyal belirteç WT1 (yeşil) ve epitel membran işaretleyici TJP1'in (beyaz) tüm organoid ve yüksek büyütmesi; ölçek çubuğu = 500 μm, giriş = 50 μm. (B) Odaların astarında endokardiyal işaretleyici NFATC1 (yeşil) ifadesi; ölçek çubuğu = PECAM1 (yeşil) tarafından gösterilen hMO'larda 500 μm. (C) Endotel damar ağı. Ölçek çubuğu = 500 μm. (D) Kardiyak fibroblastlar, organoid boyunca dağılmış, sırasıyla yeşil ve beyaz olarak gösterilen THY1 ve VIM işaretleyicileri. Ölçek çubuğu = 500 μm. (E) HMO'larda bulunan başlıca hücre tiplerinin RNA-Seq gen ekspresyon profilleri 0 ile 19. Kısaltmalar: hMO'lar = insan kalp organoidleri; TNNT2 = kardiyak troponin T2; DAPI = 4',6-diamidino-2-fenylindole; WT1 = Wilm'in tümör-1 transkripsiyon faktörü; NFATC1 = aktif T hücresinin sitoplazmik nükleer faktörü; PECAM1 = trombosit endotel hücre yapışma molekülü-1; VIM = vimentin. (F) ImageJ kullanılarak organoid boyunca üç z düzleminde nükleer boyama ile tüm organoid üzerinde ilgili hücre işaretleyicisi ile yüzde alanı olarak hesaplanan hMO'larda ortalama doku tipi bileşiminin pasta grafiği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Canlı insan kalp organoidlerinde fluo-4 canlı kalsiyum geçici kayıtları. (A) Tüm organoidler içindeki bireysel kardiyomiyositlerin temsili kalsiyum geçici kayıtları. (B) Fluo-4 yoğunluğu ile belirlenen eylem potansiyelleri arasında düşük ve en yüksek kalsiyum seviyelerini gösteren ısı haritası; ölçek çubukları = 10 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Video 1: Oda sıcaklığında ışık mikroskopisi altında farklılaşmanın 6. gününde hPSC'lerden elde edilen temsili organoidin canlı görüntülenmesi. Kısaltma: hPSC = insan pluripotent kök hücre. Bu Videoyu indirmek için lütfen tıklayınız.
Video 2: Oda sıcaklığında ışık mikroskopisi altında farklılaşmanın 15. gününde hPSC'lerden elde edilen temsili organoidin canlı görüntülenmesi. Kısaltma: hPSC = insan pluripotent kök hücre. Bu Videoyu indirmek için lütfen tıklayınız.
Video 3: Floresan mikroskobu altında kalsiyum geçicilerinin ısı haritası gösteren 10 günlük organoidin canlı kaydı. Bu Videoyu indirmek için lütfen tıklayınız.
Tartışmalar
İnsan kök hücre türevli kardiyomiyositler ve kardiyak kökenli diğer hücrelerdeki son gelişmeler, insan kalbi gelişimini modellemek için 22,24,25 ve hastalık26,27,28 ve terapötikleri taramak için araçlar olarak kullanılmıştır29,30 ve toksik ajanlar31,32 . Burada, EBs'yi oluşturmak ve son derece karmaşık hMO'lara ayırt etmek için uygulanması kolay, son derece tekrarlanabilir bir protokol bildiriyoruz. Bu protokol, hPSC'ler ve hESCs23 dahil olmak üzere birden çok hücre satırında başarılı oldu ve tutarlı dayak frekansları ve hücre türü organizasyonu gösterdi. Bu protokol, kardiyomiyosit farklılaşması24, epikardiyal hücre farklılaşması22 ve fare ESCs16'dan türetilen prekardiyak organoidler için önceden tanımlanmış protokollerden bazı yönler çizer ve tam tanımlı bir ortamda kimyasal inhibitörler ve büyüme faktörleri kullanarak kanonik WNT sinyalinin adım adım modülasyonunu optimize eder. Bu protokolün geliştirilmesinde çeşitli optimizasyon metodolojileri kullanıldı.
İlk olarak, kimyasal inhibitör konsantrasyonları ve maruz kalma sürelerinin yanı sıra büyüme faktörlerinin eklenmesi, 3D ortam için optimize edilmiştir ve önceki çalışmalarda tartışılmaktadır23. Bunlar, fizyolojik karmaşıklık ve in vivo insan kalbinin temsili ile yapıları, fizyolojik bileşim ve kardiyomiyositlerin miyosit dışı kardiyak hücre tiplerine (epikardiyal hücreler, kardiyak fibroblastlar) oranları ile aydınlatacak şekilde optimize edilmiştir. İkincisi, üçte iki orta değişim stratejisi, kuyunun dibine yakın süspansiyonda oturdukları için EBs / organoidlerin minimum ajitasyonunu sağlarken, ortam yenilendiğinde kimyasal inhibitörlere ve büyüme faktörlerine gradyan maruziyetini kolaylaştırır. Wnt yolu aktivasyonu yoluyla kardiyak mezoderm farklılaşması, ardından inhibition24 ve ikinci bir Wnt yolu aktivasyonu22 aracılığıyla proepikardiyal spesifikasyonun sonraki indüksiyonu, tek bir protokolün son derece karmaşık hMO'lar vermesini sağlar. Organoidler 15 günlük farklılaşmadan sonra 1 mm'ye kadar büyür ve canlı veya sabit analizler ve tahliller için kolayca aktarılabilir. Üçüncüsü, organoidlerin büyüklüğü göz önüne alındığında, slayt ve kapak arasında boşluk sağlamak için mikrobeadların veya diğer benzer yapıların kullanılması, organoidlerin 3D yapısını daha iyi koruduğu ve görüntüleme sürecini iyileştirdiği bulunmuştur.
Bu gelişen insan kalp modeli, kalp gelişiminin erişilemeyen aşamalarına erişim sağlar, erken birinci ve ikinci kalp alanı spesifikasyonu gibi- 3 ve 9 gün arasında gözlenen-ve miyokard, endokardyum, epikardiyum, endotel vaskülat ve diferansiyel fibroblastları destekleyen kalp dokularına yol açan kardiyak progenitör hücrelere organizasyon, farklılaşmanın 15. Bu protokolden elde edilen kalp organoidlerinde bulunan doku tipleri, hem kompozisyon33 hem de transkriptomik profilde insan fetal kalbinin son derece temsilcisidir23,34. Bu nedenle, in vivo kalbinkine benzeyen doku-doku ve hücre-hücre yüksek sıra etkileşimlerini kolaylaştırabilirler. Bu protokol, çoğunlukla kardiyomiyositlerden oluşan ve epikardiyal hücreler, endokardiyal hücreler, kardiyak fibroblastlar ve endotel hücreleri gibi miyosit dışı kardiyak hücreleri içeren organoidleri içeren, fizyolojik bileşimi temsil eden organoidleri veren deneyler ve hücre hatları arasında oldukça verimli ve tekrarlanabilirdi23,33,35.
İletim elektron mikroskopisi ile oluşan kardiyomiyositlerin ultrayapısının analizleri ve optik koherens tomografi ve konfokal görüntüleme ile odaların ve vasküler ağın geliştirilmesi önceki çalışmalarda ayrıntılı olarak ele alınmıştır23. Bu kalp organoid protokolünün yakın zamanda yayınlanan diğer mevcut protokollere göre büyük bir avantajı17,18,19,20,36,37 organoid boyunca bir endotel ağının sağlam bir şekilde oluşturulmasıdır ve protokole daha fazla dış indüksiyona gerek kalmadan erken insan kalbinde damar gelişimini ve hastalığı araştırma yeteneğine izin verir. Son olarak, kalp organoidlerinin fonksiyonel analizi, organoid boyunca kardiyomiyositlerdeki kalsiyum geçicilerini izlemek için kalsiyuma duyarlı bir boya kullanımı da dahil olmak üzere çeşitli yaklaşımlarla elde edilebilir. Yüksek çözünürlüklü mikroskopi kullanarak, hücrelere giren ve çıkan kalsiyumun floresan yoğunluğunu kaydettik ve son derece temsili etki potansiyellerini gözlemledik. Diğer olası fonksiyonel analiz yöntemleri arasında kalsiyuma duyarlı bir göstergeye sahip transgenik bir hattın kullanılması veya mikroelekrod dizisi kullanılarak doğrudan kayıt23 sayılamaz.
Burada açıklanan kalp organoidleri gelişmekte olan insan fetal kalbinin rekapitülatifidir, ancak daha olgun, yetişkin benzeri özellikler göstermekle sınırlıdır. Gelecekteki protokoller, bu organoidlerde olgunlaşmayı teşvik etmek ve yetişkin kalbini daha iyi modelleyen yapılar sağlamak için burada açıklanan protokol üzerine inşa edilebilir. Ayrıca, bu protokol insan kalbinin minyatür modellerini oluşturmak için tasarlanmıştır ve kalp gelişimi ve hastalığı araştırma çalışmaları veya farmasötik tarama ile sınırlıdır ve kalp dokusunun transplantasyon yoluyla değiştirilmesi gibi klinik bir müdahale aracı olarak uygun olmayabilir. Genel olarak, burada, insan kalbi gelişimi, hastalık etiyolojisi ve farmakolojik taramada araştırma çalışmalarını kolaylaştırabilecek son derece tekrarlanabilir ve sofistike insan kalbi organoidleri oluşturmak için takip etmesi kolay ve uygun maliyetli bir protokol açıklıyoruz.
Açıklamalar
Yazarların beyan edecekleri bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri Ulusal Kalp, Akciğer ve Kan Enstitüsü tarafından K01HL135464 ve R01HL151505 ödül numaraları altında ve Amerikan Kalp Derneği tarafından 19IPLOI34660342 ödül numarası altında desteklendi. MSU Farmakoloji ve Toksikoloji Bölümü'nden MSU Advanced Microscopy Core ve Dr. William Jackson'a konfokal mikroskoplara erişim için, IQ Mikroskopi Çekirdeğine ve MSU Genomik Çekirdeği'ne sıralama hizmetleri için teşekkür ederiz. Ayrıca Aguirre Lab'in tüm üyelerine değerli yorumları ve tavsiyeleri için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
Referanslar
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593 (2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215 (2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723 (2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098 (2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94 (2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4 (2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140 (2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283 (2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003 (2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142 (2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538 (2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır