Method Article
توليد ذاتية التجميع الأعضاء القلب البشري المستمدة من الخلايا الجذعية متعددة القدرات
In This Article
Summary
هنا، نقوم بوصف بروتوكول لإنشاء أجهزة القلب البشرية ذات الصلة بالتنمية (hHOs) بكفاءة باستخدام الخلايا الجذعية البشرية متعددة القدرات عن طريق التنظيم الذاتي. يعتمد البروتوكول على التنشيط التسلسلي للإشارات التنموية وينتج أنسجة قلب بشرية معقدة للغاية ووثيقة الصلة وظيفيا.
Abstract
القدرة على دراسة تطور القلب البشري في الصحة والمرض محدودة للغاية من خلال القدرة على نمذجة تعقيد القلب البشري في المختبر. إن تطوير منصات أكثر كفاءة تشبه الأعضاء يمكنها نمذجة المجمع في الأنماط الظاهرية في الجسم الحي ، مثل الأعضاء العضوية والأعضاء على الشريحة ، سيعزز القدرة على دراسة نمو القلب البشري والمرض. تصف هذه الورقة بروتوكولا لتوليد أعضاء القلب البشرية المعقدة للغاية (hHOs) من خلال التنظيم الذاتي باستخدام الخلايا الجذعية البشرية متعددة القدرات وتنشيط المسار التنموي التدريجي باستخدام مثبطات الجزيء الصغيرة. يتم إنشاء الأجسام الجنينية (EBs) في لوحة من 96 بئرا مع آبار مرفق مستديرة القاع ومنخفضة للغاية ، مما يسهل ثقافة التعليق للهياكل الفردية.
تخضع EBs للتمايز إلى hHOs من خلال استراتيجية تعديل إشارات Wnt من ثلاث خطوات ، والتي تنطوي على تنشيط مسار Wnt الأولي للحث على مصير mesoderm القلبي ، وخطوة ثانية من تثبيط Wnt لإنشاء أنساب قلبية نهائية ، وخطوة تنشيط Wnt ثالثة للحث على أنسجة الأعضاء البروبيكاردية. هذه الخطوات، التي نفذت في شكل 96 بئرا، هي ذات كفاءة عالية، استنساخها، وتنتج كميات كبيرة من organoids لكل شوط. يكشف التحليل عن طريق التصوير المناعي من اليوم الثالث إلى اليوم الحادي عشر من التمايز عن مواصفات حقل القلب الأول والثاني والأنسجة المعقدة للغاية داخل hHOs في اليوم 15 ، بما في ذلك أنسجة عضلة القلب مع مناطق خلايا القلب الأذينية والبطينية ، وكذلك الغرف الداخلية المبطنة بالأنسجة القلبية. كما تظهر الأجهزة العضوية شبكة الأوعية الدموية المعقدة في جميع أنحاء الهيكل وبطانة خارجية من الأنسجة epicardial. من وجهة نظر وظيفية، فاز hHOs بقوة والحاضر نشاط الكالسيوم العادي كما يحددها التصوير الحي فلو-4. بشكل عام، يشكل هذا البروتوكول منصة صلبة للدراسات المختبرية في الأنسجة القلبية الشبيهة بالأعضاء البشرية.
Introduction
عيوب القلب الخلقية (CHDs) هي النوع الأكثر شيوعا من العيوب الخلقية في البشر وتؤثر على ما يقرب من 1٪ من جميع المواليد الأحياء1،2،3. وفي معظم الظروف، لا تزال أسباب ال CHDs غير معروفة. تشكل القدرة على إنشاء نماذج قلب الإنسان في المختبر التي تشبه إلى حد كبير القلب البشري النامي خطوة هامة إلى الأمام لدراسة الأسباب الكامنة وراء ال CHDs مباشرة في البشر بدلا من النماذج الحيوانية البديلة.
مثال نماذج الأنسجة المزروعة في المختبر هي organoids ، 3D يبني الخلية التي تشبه الجهاز من مصلحة في تكوين الخلايا والوظيفة الفسيولوجية. غالبا ما تستمد الأجهزة العضوية من الخلايا الجذعية أو خلايا السلف وقد استخدمت بنجاح لنمذجة العديد من الأعضاء مثل الدماغ4,5, الكلى6,7, الأمعاء8,9, lung10,11, liver12,13, والبنكرياس14,15 ، على سبيل المثال لا الحصر. وقد ظهرت دراسات حديثة تثبت جدوى إنشاء أجهزة القلب ذاتية التجميع لدراسة نمو القلب في المختبر. وتشمل هذه النماذج استخدام الخلايا الجذعية الجنينية الماوس (mESCs) لنموذج التنمية في وقت مبكر القلب16,17 تصل إلى مواصفات الأذين البطين18 والخلايا الجذعية البشرية متعددة القدرات (hPSCs) لتوليد طبقة متعددة الجراثيم القلبية endoderm organoids19 وcededs20 غرف مع تكوين الخلوية معقدة للغاية.
تقدم هذه الورقة بروتوكول تعديل WNT ثلاثي الخطوات الجديد لتوليد hHOs معقدة للغاية بطريقة فعالة وفعالة من حيث التكلفة. يتم إنشاء الأجهزة العضوية في لوحات 96 بئرا ، مما يؤدي إلى نظام قابل للتطوير وعالي الإنتاجية يمكن أن يكون آليا بسهولة. تعتمد هذه الطريقة على إنشاء مجاميع hPSC وتفعيل الخطوات التنموية لتولد القلب ، بما في ذلك تكوين ميسودرم والفطرية القلبية ، ومواصفات مجال القلب الأولى والثانية ، وتشكيل الجهاز البروباديري ، ومواصفات الأذين البطين. بعد 15 يوما من التمايز، تحتوي hHOs على جميع أنساب الخلايا الرئيسية الموجودة في القلب، والغرف الداخلية المحددة جيدا، والغرف الأذينية والبطينية، وشبكة الأوعية الدموية في جميع أنحاء الجهاز. هذا النظام العضوي القلب متطورة للغاية وقابلة للاستنساخ قابلة للتحقيق في التحليلات الهيكلية والوظيفية والجزيئية، والنسخ في دراسة تطور القلب، والأمراض، والفحص الدوائي.
Protocol
1. ثقافة hPSC والصيانة
ملاحظة: يجب استزراع مركبات PSCs المستحثة بشريا (hiPSCs) أو الخلايا الجذعية الجنينية البشرية (hESCs) لمدة مقطعين متتاليين على الأقل بعد ذوبانها قبل استخدامها لتوليد EBs للتمايز أو لمزيد من حفظ التبريد. يتم استزراع hPSCs في المتوسط PSC (انظر جدول المواد) على مصفوفة الطابق السفلي غشاء خارج الخلية (BM-ECM) المغلفة لوحات الثقافة 6-جيدا. عند إجراء تغييرات متوسطة على hPSCs في لوحات 6-جيدا، إضافة المتوسطة مباشرة إلى الجانب الداخلي من البئر بدلا من مباشرة على رأس الخلايا لمنع انفصال الخلايا غير المرغوب فيها أو الإجهاد. وينبغي أن يكون المستخدمون حذرين من وسائل الإعلام PSC قبل الاحترار التي لا ينبغي أن تكون ساخنة في 37 درجة مئوية؛ وكانت جميع وسائل الإعلام PSC المستخدمة في هذا البروتوكول الحرارية.
- لتغليف لوحات جيدا مع BM-ECM، إذابة واحد aliquot من BM-ECM (المخزنة في -20 درجة مئوية وفقا لتعليمات الشركة المصنعة) على الجليد ومزيج 0.5 ملغ من BM-ECM مع 12 مل من المتوسط النسر المعدلة دولبيكو الباردة (DMEM)/F12 المتوسطة (المخزنة في 4 درجة مئوية). توزيع 2 مل من خليط DMEM/F12-BM-ECM على كل بئر من لوحة 6-جيدا واحتضان في 37 درجة مئوية لمدة 2 ساعة على الأقل.
- لإذابة الخلايا، أولا، إذابة المبرد hPSC في حبة 37 درجة مئوية أو حمام مائي لمدة 1-2 دقيقة حتى كمية صغيرة فقط من الجليد مرئية. نقل الخلايا المذابة إلى أنبوب الطرد المركزي وإضافة ببطء 8-9 مل من المتوسط PSC تستكمل مع 2 ميكرومتر من مثبط ROCK, ثيازوفين (ثياز), والطرد المركزي في 300 × غرام لمدة 5 دقائق. إزالة supernatant وإعادة إنفاق بيليه الخلية في المتوسط PSC تستكمل مع 2 ميكرومتر من ثياز. توزيع الخلايا في وسط الثقافة إلى آبار 1-2 اعتمادا على تركيز الخلايا cryovial والثقافة في 37 درجة مئوية، 5٪ CO2 لمدة 24 ساعة قبل تغيير المتوسط PSC.
- تغيير الوسط على الخلايا على فترات 48 ساعة. إجراء يغسل والتغييرات المتوسطة باستخدام DMEM/F12 (1 مل / بئر) والمتوسطة PSC (2 مل / بئر), على التوالي.
ملاحظة: يساعد Washes في إزالة نفايات الخلايا والحطام بينما توفر التغييرات الجديدة في الوسائط للخلايا مصدرا متجددا للمغذيات. - مرور الخلايا على الالتقاء الفرعي (60-80٪ التقاء) عن طريق أسبيراتينغ المتوسطة، ثم غسل كل بئر مع 1 مل من محلول الفوسفات 1x Dulbecco العازلة (لا الكالسيوم، لا المغنيسيوم؛ DPBS). يستنشق DPBS وإضافة 1 مل من كاشف التفكك لhPSCs (انظر جدول المواد)، تليها طموح جميع ما عدا فيلم رقيقة من الكاشف بعد 10 s.
- احتضان لمدة 2-5 دقيقة مع فيلم رقيقة من كاشف الفصام لhPSCs حتى تتشكل الفجوات بين الخلايا.
ملاحظة: الوقت لإيقاف التفكك تعتمد على خط الخلية. - إضافة 1 مل من المتوسط PSC تستكمل مع 2 ميكرومتر من ثياز (PSC المتوسطة + ثياز) إلى البئر والاستفادة بلطف لوحة للحث على مفرزة الخلية. ماصة الخلايا المنفصلة في المتوسط 1-2 مرات لتفريق أي مستعمرات كبيرة، وإعادة إنفاق الخلايا في PSC المتوسطة + ثياز في نسبة بئر 1:6 (خلايا من 1 إعادة إنفاقها بشكل جيد في 12 مل من متوسط الثقافة). إعادة طلاء الخلايا على الآبار المغلفة ب BM-ECM.
2. جيل من 3D الذاتي تجميع الأعضاء القلب البشري
- تكوين الجسم الجنيني (EB):
ملاحظة: من الضروري الحد من الخلايا المتمايزة التي يمكن ملاحظتها قبل تكوين الجسم الجنيني. اثنين إلى ثلاثة آبار من لوحة 6-جيدا في التقاء 60-80٪ سوف تسفر عن خلايا كافية لوحة واحدة من 96 جيدا من organoids. يجب أن تكون جميع وسائل الإعلام aliquoted وتدفئة في حبة 37 درجة مئوية أو حمام مائي قبل أي تغييرات متوسطة لتقليل صدمة درجة الحرارة إلى EBs أو organoids (وهذا لا يشمل مصابيح فص الخلايا). انظر الشكل 1 ألف، باء.- اليوم -2
- لإنشاء EBs، في اليوم -2، غسل hPSCs الفرعية التقاء (60-80٪ التقاء) مع DPBS لمدة 10 ق على الأقل لغسل أي حطام الخلية واستبخاء DPBS.
- لفصل الخلايا وإطلاقها في حالة خلية واحدة، أضف 1 مل من كاشف فصاحة الخلايا في درجة حرارة الغرفة (انظر جدول المواد) إلى كل بئر لمدة 3-6 دقائق. بلطف اضغط على لوحة ~ 5 مرات كل دقيقة للحث على مفرزة أثناء التحقق تحت المجهر. إضافة 1 مل من PSC المتوسطة + ثياز لوقف رد الفعل.
- لجمع الخلايا وتفتيت أي المجاميع المتبقية، ماصة وسائل الإعلام صعودا وهبوطا في بئر 2-3 مرات لتوليد تعليق خلية واحدة. نقل تعليق خلية واحدة إلى أنبوب الطرد المركزي وتدور لمدة 5 دقائق في 300 × غرام.
- للحصول على تركيز الخلية المطلوب، تجاهل supernatant وإعادة إنفاق الخلايا في 1 مل من PSC المتوسطة + ثياز. عد الخلايا باستخدام عداد الخلية أو مقياس الدم وتمييع الخلايا في PSC المتوسطة + ثياز إلى تركيز 100،000 خلية / مل.
- لتوزيع الخلايا لتشكيل EB، استخدم ماصة متعددة القنوات لإضافة 100 ميكرولتر (10000 خلية) إلى كل بئر من لوحة مرفق 96-well ذات المستوى المنخفض للغاية. طارد مركزي لوحة في 100 × غرام لمدة 3 دقائق واحتضان لمدة 24 ساعة في 37 درجة مئوية، 5٪ CO2.
- اليوم -1
- إزالة بعناية 50 ميكرولتر من المتوسطة من كل بئر وإضافة 200 ميكرولتر من المتوسط PSC الطازجة تدفأ إلى 37 درجة مئوية لتحقيق حجم النهائي من 250 ميكرولتر لكل بئر. احتضان الخلايا لمدة 24 ساعة في 37 درجة مئوية، 5٪ CO2.
ملاحظة: إزالة وإضافة متوسطة بعناية على جانب البئر لتجنب إزعاج EBs في الجزء السفلي من البئر. نظرا للطبيعة الحساسة ل EBs وثقافة التعليق ، فمن الضروري ترك حجم صغير من السائل في كل بئر عند تغيير الوسط لتجنب إزعاج EBs.
- إزالة بعناية 50 ميكرولتر من المتوسطة من كل بئر وإضافة 200 ميكرولتر من المتوسط PSC الطازجة تدفأ إلى 37 درجة مئوية لتحقيق حجم النهائي من 250 ميكرولتر لكل بئر. احتضان الخلايا لمدة 24 ساعة في 37 درجة مئوية، 5٪ CO2.
- اليوم -2
- تمايز القلب البشري (hHO):
ملاحظة: يجب تسخين جميع الوسائط في حبة 37 درجة مئوية أو حمام مائي قبل أي تغييرات في الوسائط. إزالة وإضافة المتوسطة بعناية على جانب البئر لتجنب إزعاج organoids النامية في الجزء السفلي من البئر. لا حاجة إلى غسل بين التغييرات وسائل الإعلام للحد من التحريض والسماح للإزالة التدريجية للمثبطات وعوامل النمو. RPMI مع 2٪ B-27 الملحق (جدول المواد) استخدمت في جميع أنحاء بروتوكول التمايز. يحتوي الملحق B-27 على الأنسولين ما لم يتم تحديده (خالي من الأنسولين في الأيام 0-5). انظر الشكل 1C.- اليوم 0
- لبدء التمايز نحو نسب mesoderm، وإزالة 166 ميكرولتر من المتوسط من كل بئر (~ 2/3rd من إجمالي حجم البئر) وإضافة 166 ميكرولتر من RPMI 1640 التي تحتوي على تكملة B-27 خالية من الأنسولين، 6 ميكرومتر CHIR99021، 1.875 نانوغرام/مل بروتين مورفوجيني عظمي 4 (BMP4)، و1.5 نانوغرام/مل أكتيفين A لتركيز بئر نهائي قدره 4 ميكرومتر CHIR99021، 1.25 نانوغرام/مل BMP4، و1 نانوغرام/مل أكتيفين أ. حضانة لمدة 24 ساعة في 37 درجة مئوية، 5٪ CO2.
- اليوم الأول
- إزالة 166 ميكرولتر من المتوسطة من كل بئر وإضافة 166 ميكرولتر من RPMI الطازجة 1640 مع الأنسولين خالية من B-27 الملحق. حضانة لمدة 24 ساعة في 37 درجة مئوية، 5٪ CO2.
- اليوم الثاني
- للحث على مواصفات mesoderm القلب، وإزالة 166 ميكروغرام من المتوسطة من كل بئر وإضافة 166 ميكرولتر من RPMI 1640 التي تحتوي على تكملة B-27 خالية من الأنسولين و 3 ميكرومتر Wnt-C59 لتركيز بئر النهائي من 2 μM Wnt-C59. حضانة لمدة 48 ساعة في 37 درجة مئوية، 5٪ CO2.
- اليوم الرابع
- إزالة 166 ميكرولتر من المتوسطة من كل بئر وإضافة 166 ميكرولتر من RPMI الطازجة 1640 مع الأنسولين خالية من B-27 الملحق. حضانة لمدة 48 ساعة في 37 درجة مئوية، 5٪ CO2.
- اليوم السادس
- إزالة 166 ميكرولتر من المتوسط من كل بئر وإضافة 166 ميكرولتر من RPMI 1640 مع ملحق B-27. حضانة لمدة 24 ساعة في 37 درجة مئوية، 5٪ CO2.
- اليوم السابع
- للحث على التمايز البروبيكاردي، قم بإزالة 166 ميكرولتر من المتوسط من كل بئر وأضف 166 ميكرولتر من RPMI 1640 الطازجة التي تحتوي على ملحق B-27 و3 ميكرومتر CHIR99021 لتركيز بئر نهائي قدره 2 ميكرومتر CHIR99021. حضانة لمدة ساعة واحدة في 37 درجة مئوية، 5٪ CO2.
- إزالة 166 ميكرولتر من المتوسط من كل بئر وإضافة 166 ميكرولتر من RPMI الطازجة 1640 التي تحتوي على ملحق B-27. حضانة لمدة 48 ساعة في 37 درجة مئوية، 5٪ CO2.
ملاحظة: ينصح الحذر إضافية في هذا التغيير المتوسط الثاني في اليوم 7 كما organoids هي أكثر عرضة للحركة بسبب التغييرات وسائل الإعلام. - من اليوم 7 فصاعدا حتى جمع أو نقل للتحليلات أو التجريب، وإجراء تغييرات متوسطة كل 48 ساعة عن طريق إزالة 166 ميكروغرام من المتوسط من كل بئر وإضافة 166 ميكروغرام من RPMI الطازجة 1640 التي تحتوي على ملحق B-27.
ملاحظة: الأجهزة العضوية جاهزة للتحليلات والتجريب في اليوم 15 ما لم تكن مراحل النمو المبكرة ذات أهمية. ويمكن استزراعها في اليوم الماضي 15 لثقافة طويلة الأجل أو تجارب النضج.
- اليوم 0
3. تحليل الجهازية
- نقل الأجهزة العضوية بأكملها (حية أو ثابتة)
ملاحظة: لنقل العضوية الحية، تأكد من أن نصائح ماصة المستخدمة هي عقيمة.- قطع طرف قبالة تلميح ماصة P200 5-10 ملم من فتح تلميح، مما أدى إلى فتح واسعة من ~ 2-3 مم القطر.
- أدخل الطرف مباشرة في البئر المستدير السفلي الذي يحتوي على الجهاز بحيث تكون المصة عمودية تماما (عمودية على اللوحة). تأكد من أن المكبس ماصة بالفعل الضغط على طول الطريق قبل إدراج طرف في الوسط.
- الإفراج ببطء المكبس ماصة، تناول ما يكفي من المتوسطة (100-200 ميكرولتر) لجمع organoid.
- نقل الجهاز في المتوسط إلى الوجهة المستهدفة (على سبيل المثال، لتحديد، والتصوير الحي، وتسجيل الفيزيولوجيا الكهربية، والثقافة لوحة جديدة).
- إصلاح الأجهزة العضوية
ملاحظة: يمكن إجراء إصلاح وتلطيخ الأجهزة العضوية إما في لوحة الثقافة 96 جيدا أو أنابيب الطرد المركزي الدقيق. يجب التعامل مع البارافورمالديهيد (PFA) فقط في غطاء الدخان.- لتثبيت في أنابيب الطرد المركزي الدقيق، نقل الأجهزة العضوية الحية لفصل أنابيب مع 1-8 organoids لكل أنبوب.
ملاحظة: لا تتجاوز 8 organoids لكل أنبوب. - إزالة بعناية وتجاهل أكبر قدر من المتوسطة من الأنبوب ممكن دون لمس organoids.
- إضافة 4٪ PFA إلى كل أنبوب أو بئر (300-400 ميكرولتر لكل أنبوب طرد ميكروني و100-200 ميكرولتر لكل بئر من لوحة 96 بئر). حضانة في درجة حرارة الغرفة لمدة 30-45 دقيقة.
ملاحظة: قد تتطلب مرات الحضانة التي تزيد عن ساعة واحدة خطوات استرجاع مستضد ولا يوصى بها. - تجاهل بأمان PFA دون إزعاج organoids. قم بإجراء 3 يغسل مع DPBS تكملها مع 1.5 غرام / لتر الجليسين (DPBS / غلي)، وذلك باستخدام نفس الحجم المستخدمة لPFA 4٪، في انتظار 5 دقائق بين يغسل. إزالة DPBS / Gly والمضي قدما في الحصول على المناعة أو غيرها من التحليلات أو إضافة DPBS وتخزينها في 4 درجة مئوية للاستخدام في المستقبل لمدة تصل إلى 2 أسابيع.
ملاحظة: تخزين الأجهزة العضوية الثابتة لفترة أطول من أسبوعين قد يؤدي إلى تدهور الأنسجة والتلوث ولا ينصح.
- لتثبيت في أنابيب الطرد المركزي الدقيق، نقل الأجهزة العضوية الحية لفصل أنابيب مع 1-8 organoids لكل أنبوب.
- تلطيخ مناعة كامل التركيب
- إضافة 100 ميكرولتر من حل حجب / permeabilization (10٪ مصل حمار طبيعي + 0.5٪ ألبوم مصل البقر (BSA) + 0.5٪ تريتون X-100 في 1x DPBS) إلى كل بئر أو أنبوب يحتوي على الأجهزة الثابتة. احتضان في درجة حرارة الغرفة بين عشية وضحاها على شاكر.
ملاحظة: لا تتجاوز 8 organoids لكل أنبوب. - إزالة بعناية وتجاهل أكبر قدر ممكن من حل حجب دون لمس organoids. إجراء 3 يغسل مع DPBS، في انتظار 5 دقائق بين يغسل.
- إعداد الحل الأساسي للأجسام المضادة (1٪ مصل حمار طبيعي + 0.5٪ BSA + 0.5٪ تريتون X-100 في 1x DPBS) مع الأجسام المضادة الأولية المطلوبة بتركيزات الموصى بها. احتضان في 4 درجة مئوية لمدة 24 ساعة على شاكر.
- إزالة بعناية وتجاهل أكبر قدر ممكن من حل الأجسام المضادة دون لمس organoids. إجراء 3 يغسل مع DPBS، في انتظار 5 دقائق بين يغسل.
- إعداد حل الأجسام المضادة الثانوية (1٪ مصل حمار طبيعي + 0.5٪ BSA + 0.5٪ تريتون X-100 في 1x DPBS) مع الأجسام المضادة الثانوية المطلوبة بتركيزات الموصى بها. إذا وصفت الأجسام المضادة فلوريا، واحتضان في 4 درجة مئوية في الظلام (على سبيل المثال، مغطاة رقائق الألومنيوم) لمدة 24 ساعة على شاكر.
- إزالة بعناية وتجاهل أكبر قدر ممكن من حل الأجسام المضادة دون لمس organoids. إجراء 3 يغسل مع DPBS، في انتظار 5 دقائق بين يغسل.
- إعداد الشرائح مع الخرز (90-300 ميكرومتر في القطر) التي شنت في وسط تصاعد (انظر جدول المواد) بالقرب من حواف الشريحة حيث سيتم وضع غطاء مع organoids.
ملاحظة: من المستحسن السماح للوسط المتصاعد حول الخرز بالجفاف قبل المتابعة؛ هذا سيمنع الخرز من التحرك. انظر الشكل 2. - نقل organoids الملون باستخدام تلميح ماصة قطع على الشريحة، بين الخرز، وضمان التباعد لتجنب الاتصال بين organoids مرة واحدة على الشريحة. استخدم زاوية مسح مختبر ملفوف لإزالة السائل الزائد بعناية حول الجهاز العضوي.
- تغطية organoids مع تركيب المقاصة المتوسطة (الفركتوز جلسيرول حل المقاصة هو 60٪ (فول / فول) الجلسرين و 2.5 M الفركتوز)37 باستخدام 120-150 ميكرولتر من تصاعد المقاصة المتوسطة لكل شريحة.
ملاحظة: من المستحسن استخدام تلميح ماصة قطع عند العمل مع وسيطة مقاصة التركيب كما هو لزج جدا. - تحوم فوق الغطاء الشريحة مع organoids مغطاة حل تصاعد المقاصة والضغط ببطء على coverlip على الشريحة ، وضمان organoids بين الخرز شنت.
- ختم محيط coverslip على الشريحة باستخدام أعلى معطف مسمار الورنيش. السماح للشريحة لتجف في الظلام في درجة حرارة الغرفة لمدة 1 ساعة. يخزن عند درجة حرارة 4 درجات مئوية في الظلام لتخزينه على المدى الطويل.
- إضافة 100 ميكرولتر من حل حجب / permeabilization (10٪ مصل حمار طبيعي + 0.5٪ ألبوم مصل البقر (BSA) + 0.5٪ تريتون X-100 في 1x DPBS) إلى كل بئر أو أنبوب يحتوي على الأجهزة الثابتة. احتضان في درجة حرارة الغرفة بين عشية وضحاها على شاكر.
- التصوير العابر للكالسيوم في أعضاء القلب الحية
ملاحظة: وفقا لتعليمات الشركة المصنعة، تم إعادة تشكيل Fluo4-AM في ثنائي ميثيل سلفوإكسيد (DMSO) إلى تركيز محلول المخزون النهائي من 0.5 mM. تمت إضافة Fluo4-AM مباشرة إلى البئر العضوي في لوحة 96 جيدا.- إجراء 2 يغسل على organoids باستخدام RPMI 1640 المتوسطة.
- إزالة 166 ميكرولتر من المتوسطة المستهلكة من البئر.
- إضافة 166 ميكرولتر من RPMI 1640 المتوسطة الدافئة، وإزالة 166 ميكرولتر من المتوسط، وإضافة 166 ميكرولتر من RPMI الطازجة 1640 المتوسطة.
ملاحظة: يتم غسل لإزالة النفايات والمواد الحطام الخلية. تتم إزالة ثلثي المتوسطة من الآبار أثناء الغسل لتجنب إزعاج الأعضاء العضوية في الجزء السفلي من البئر قبل الفحص الوظيفي.
- إضافة Fluo4-AM المتوسطة إلى organoids.
- إضافة Fluo4-AM إعادة تشكيلها في DMSO إلى RPMI 1640 التي تحتوي على ملحق B-27 لإعداد حل 1.5 ميكرومتر.
- إزالة 166 ميكرولتر من المتوسط من البئر.
- إضافة 166 ميكرولتر من 1.5 ميكرومتر Fluo4-AM في RPMI 1640 تحتوي على ملحق B-27 لتركيز بئر النهائي من 1 ميكرومتر.
- نفذ يغسل 2 كما هو الحال في الخطوة 3.4.1.
- إضافة 166 ميكرولتر من RPMI 1640 تحتوي على ملحق B-27 إلى البئر.
- باستخدام طرف قطع من طرف ماصة P200، نقل organoid إلى طبق بيتري الزجاج القاع (على سبيل المثال، 8-جيدا زجاج غطاء مفرفر مع # 1.5 coverglass عالية الأداء) مع 100-200 ميكروغرام من المتوسطة.
ملاحظة: انظر القسم 3.1 حول نقل الأجهزة العضوية بالكامل. - صورة الأجهزة العضوية تعيش تحت المجهر مع درجة الحرارة و ثاني أكسيد الكربون التي تسيطر عليها غرفة في 37 درجة مئوية، 5٪ CO2.
- سجل العديد من مقاطع الفيديو 10-20 ق في مواقع مختلفة عبر الجهاز ، مما يدل على الزيادة والانخفاض في مستويات كثافة الفلورية مع دخول الكالسيوم وخروجه من الخلايا.
ملاحظة: للتسجيلات عالية الدقة، يوصى بالتسجيل بسرعة 10 إطارا في الثانية أو أسرع؛ يوصى ب 50 إطارا في الثانية. - تحليل مقاطع الفيديو باستخدام برنامج تحليل الصور (على سبيل المثال، ImageJ) من خلال تحديد المناطق ذات الاهتمام وقياس مستويات الكثافة بمرور الوقت.
- تطبيع التسجيلات كثافة باستخدام ΔF/F0 مقابل الوقت في ميلي ثانية ومؤامرة.
- إجراء 2 يغسل على organoids باستخدام RPMI 1640 المتوسطة.
النتائج
لتحقيق التنظيم الذاتي hHO في المختبر، قمنا بتعديل والجمع بين بروتوكولات التمايز الموصوفة سابقا لتمايز أحادي الطبقة ثنائية الأبعاد لخلايا القلب وخلايا epicardial22 باستخدام مضواسير مسار WNT وأجهزة التمايز ثلاثية الأبعاد precardiac16 باستخدام عوامل النمو BMP4 وActivin A. باستخدام لوحة 96 جيدا EB وبروتوكول التمايز hHO الموصوف هنا والمبين في الشكل 1 ، تم تحسين تركيزات ومدة التعرض لمفعل مسار WNT CHIR99021 بحيث ينتج hHOs عالية التكاثر والمعقدة المستمدة من PSCs البشرية. hPSCs أو hESCs المستزرعة في PSC المتوسطة إلى 60-80٪ التقاء في تشكيل يشبه المستعمرة مع الحد الأدنى من التمايز المرئي أو عدم وجود مثالية لتوليد EB (الشكل 1B).
وسمح لمركبات ال EBs باحتضان 48 ساعة مع تغيير متوسط بعد 24 ساعة قبل البدء في التفريق في اليوم 0. في اليوم 0، يجب أن تظهر EBs كتجمع كروي داكن في وسط كل بئر تحت المجهر الخفيف (الشكل 1B). يبدأ بروتوكول التمايز في اليوم 0 مع تنشيط مسار Wnt وإضافة عامل النمو لمدة 24 ساعة بالضبط. هذا التعريفي mesoderm تليها التعريفي mesoderm القلب في اليوم 2 باستخدام مثبط مسار Wnt-C59 سيؤدي إلى توسيع كبير من organoid من ~ 200 ميكرومتر في القطر إلى 500-800 ميكرومتر في القطر في اليوم 4 وإلى ما يصل إلى 1 ملم (قد تواجه organoids انخفاضا طفيفا في الحجم بحلول اليوم 15 (الشكل 1C)). سيبدأ hHO الضرب في وقت مبكر من اليوم 6 (فيديو 1) ، مع 100٪ من الأعضاء تظهر الضرب المرئي بحلول اليوم 10 (فيديو 2) (ما لم يخضع للعلاج من المخدرات أو إذا تم استخدام hPSCs غير كافية لتوليد EBs). وقد لوحظ ذلك في 5 خطوط خلايا hPSC متميزة23.
لتقييم قدرة hHOs لتمثيل خطوات مختلفة للتطور الفسيولوجي للقلب ، جمعنا organoids في نقاط زمنية مختلفة في جميع أنحاء بروتوكول التمايز وبحثنا عن وجود والتعبير النسخي لعلامات مجال القلب. كشفت تلطيخ immunofluorescent لأول علامة في مجال القلب (FHF) ، HAND1 ، وعلامة حقل القلب الثاني (SHF) ، HAND2 ، عن وجودها النووي في خلايا السلف القلبية هذه الناشئة في اليوم الثالث واليوم الخامس على التوالي (الشكل 3A).
التعبير عن كل من علامات يحدث في مناطق organoids التي تتضاءل في الحجم بعد يوم 7 لFHF وبعد يوم 9 لSHF. ومن المثير للاهتمام ، كشفت صور عالية التكبير من الأجهزة العضوية اليوم 7 أن معظم الخلايا التي تعبر عن HAND1 كانت خلايا القلب في الأصل (كما هو مبين في علامة خاصة بخلايا القلب TNNT2). في المقابل، لم تعبر العديد من الخلايا المعبرة عن HAND2 عن علامة خلايا القلب (الشكل 3B). هذه الملاحظة هي في اتفاق مع organoids precardiac المستمدة من ESCs الماوس مما يدل على تطوير الخلايا غير myocyte من خلايا السلف SHF16. ومن المهم ملاحظة أن بيانات تسلسل الحمض النووي الريبي تبين أن نصوص الحمض النووي الريبي لكل من HAND1 و HAND2 تم التعبير عنها منذ اليوم الثالث فصاعدا، مع التعبير عن علامة FHF بشكل أكبر بين اليومين 3 و11، ويتم التعبير عن علامة SHF بشكل أكبر بعد اليوم 13 (الشكل 3C).
كشف تلطيخ immunofluorescence وجود علامات من مختلف الأنساب من نوع الخلية التي تشكل قلب الإنسان. أنسجة عضلة القلب (يمكن التعرف عليها باستخدام علامة خاصة بخلايا القلب TNNT2) المجاورة للأنسجة epicardial (تميزت عامل النسخ النووي WT1 وعلامة الغشاء الظهاري TJP1) (الشكل 4A). تم الكشف عن خلايا الشغاف التي تعبر عن NFATC1 بطانة جدران الهياكل الداخلية مثل غرفة داخل organoids (الشكل 4B). يمكن رؤية الخلايا البطانية في شبكة تشبه الأوعية في وقت مبكر من اليوم الثالث عشر من التمايز (الشكل 4C). وأخيرا، فإننا نبلغ عن وجود الخلايا الليفية القلبية المشتتة في جميع أنحاء الجهاز (الشكل 4D). كما لوحظت هذه العلامات من نوع الخلية في ملامح التعبير الجيني RNA-Seq (الشكل 4E). تم العثور على تكوين أنواع الخلايا في organoids ، كما تقاس منطقة الجهازية التي تشغلها ، لتكون ~ 58 ٪ خلايا القلب ، والباقي يتألف من خلايا القلب غير myocyte ، بما في ذلك الخلايا epicardial (~ 15 ٪) ، وخلايا القلب (~ 13 ٪) ، والخلايا الليفية القلبية (~ 12 ٪) ، والخلايا البطانية (~ 1 ٪) (الشكل 4F).
تم قياس الوظيفة الكهربية للعضيات عن طريق تصوير الكالسيوم الحي للخلايا الفردية في الأعضاء الكاملة. تختلف كثافة الفلورية فلو-4 بمرور الوقت بسبب دخول الكالسيوم وخروجه من الخلية، مما يكشف عن إمكانات العمل المنتظم (الشكل 5A). تظهر خرائط الحرارة التي تظهر كثافة الكالسيوم فوق منطقة عالية التكبير في الجهاز العضوي زيادة الكثافة بسبب عابري الكالسيوم في الخلايا الفردية (الشكل 5B والفيديو 3).
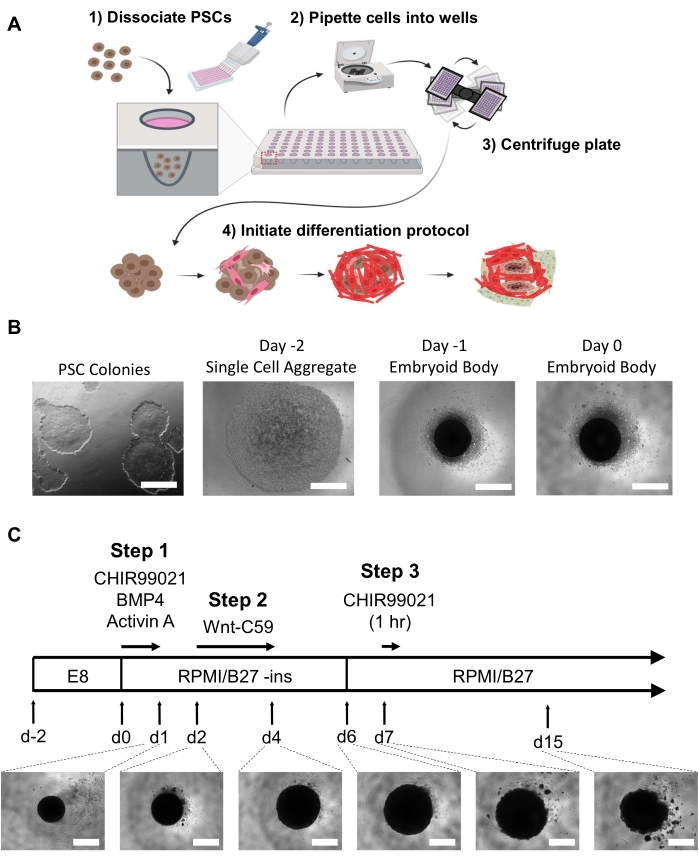
الشكل 1: يتم بذر توليد الجسم الجنيني وخطوات التمايز العضوي للقلب. (أ) (1-2) يتم زرع الخلايا المفككة في آبار لوحة مرفق منخفضة للغاية 96 جيدا عبر ماصة متعددة القنوات. (3) ثم يتم طرد لوحة 96 بئرا ، مما يسمح للخلايا بتجميعها في المركز. (4) مع مرور الوقت، وبعد إضافة عوامل النمو وملطفات المسار، يبدأ الجسم الجنيني في التفريق إلى عدة أنساب قلبية وتشكيل مجموعات خلايا متميزة ذات صلة مكانية وفسيولوجية تحيط بالحرام الدقيقة الداخلية. (ب) صور تمثيلية لتطور توليد الجسم الجنيني، بدءا من ثقافة iPSC ثنائية الأبعاد (يسار) وانتهاء بجسم جنيني في اليوم العاشر (يمين)؛ شريط المقياس = 500 ميكرومتر (C) ملخص بروتوكول التمايز العضوي للقلب البشري ، بما في ذلك تحوير المسار الكيميائي ومثبطات مع النقاط الزمنية والمدد وتطوير الصور العضوية تحت المجهر الخفيف من اليوم 1 إلى اليوم 15 ؛ شريط المقياس = 500 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
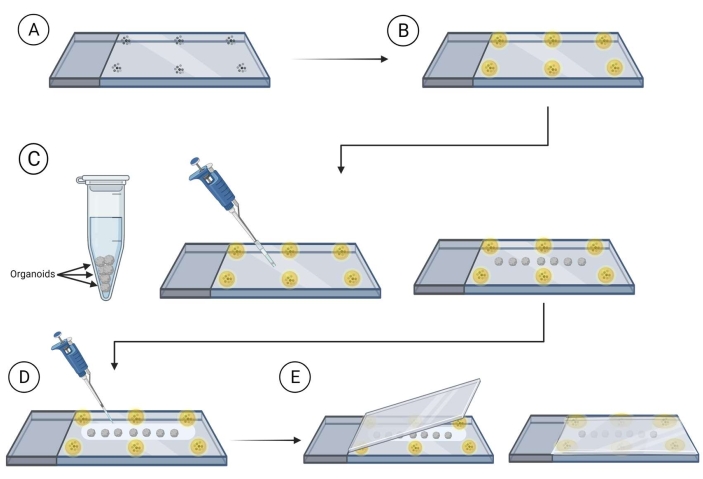
الشكل 2: تركيب الجهازية الكاملة على الشرائح للتصوير. خطوات لإعداد الشرائح وتركيب الأجهزة العضوية للتصوير. (أ) وضع الميكروبات على هامش شريحة زجاجية. (ب) تغطية الميكروبات مع تصاعد المتوسطة. (ج) نقل organoids على الشريحة بين الخرز وإزالة السائل الزائد المحيط organoids. (د) تغطية organoids مع تطهير / تصاعد المتوسطة. (ه) وضع غطاء على رأس الشريحة مع organoids والخرز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: حقل القلب الأول ومواصفة حقل القلب الثاني في hHOs يلخص تطور القلب البشري الفسيولوجي. (أ) صور الفلورة المناعية الكونفولوجية لليوم 3 إلى اليوم 11 hHOs التي تظهر تشكيل FHF (HAND1، أعلى) وSHF (HAND2، أسفل)، وخلايا القلب (TNNT2) والصبغة النووية DAPI؛ أشرطة المقياس = 500 ميكرومتر (ب) صور عالية التكبير من الأجهزة العضوية اليوم 7 تظهر توطين مشترك من HAND1 و HAND2 مع علامة القلبية TNNT2; أشرطة المقياس = 50 ميكرومتر (C) ملامح التعبير الجيني RNA-Seq من علامة FHF HAND1 (أحمر) وعلامة SHF HAND2 (الأزرق) من اليوم 0 إلى اليوم 19. المختصرات: hHOs = أعضاء القلب البشري؛ FHF = حقل القلب الأول; SHF = حقل القلب الثاني; HAND = القلب والمشتقات قمة العصبية أعرب; TNNT2 = تروبونين القلب T2; DAPI = 4'،6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: hHOs تطوير الأنساب القلبية متعددة. (A-D) Confocal immunofluorescence صور اليوم 15 hHOs تظهر تشكيل خلايا القلب (TNNT2) وتلطيخ مع DAPI صبغة نووية في الخلايا القلبية غير myocyte. (أ) الجهازية الكاملة والتكبير العالي لعلامة epicardial WT1 (الأخضر) وعلامة الغشاء الظهاري TJP1 (أبيض) التي تظهر الخلايا epicardial من أصل ظهاري على رأس والمجاورة للأنسجة عضلة القلب؛ شريط مقياس = 500 ميكرومتر، inset = 50 ميكرومتر( B) علامة دقات القلب NFATC1 (الأخضر) التعبير على بطانة الغرف؛ شريط المقياس = 500 ميكرومتر (C) شبكة السفن البطانية في hHOs التي تظهرها PECAM1 (الأخضر). شريط المقياس = 500 ميكرومتر (D) علامات الخلايا الليفية القلبية THY1 و VIM الموضحة باللونين الأخضر والأبيض ، على التوالي ، موزعة في جميع أنحاء الجهاز. شريط المقياس = 500 ميكرومتر (E) ملامح التعبير الجيني RNA-Seq لأنواع الخلايا الرئيسية الموجودة في hHOs من الأيام 0 إلى 19 من التمايز. المختصرات: hHOs = أعضاء القلب البشري؛ TNNT2 = تروبونين القلب T2; DAPI = 4'،6-دياميدينو-2-فينيليندول; WT1 = عامل النسخ الورم 1 ويلم; NFATC1 = العامل النووي السيتوبلازمي للخلية التائية المنشطة؛ PECAM1 = الصفائح الدموية الالتصاق الخلايا البطانية جزيء-1; VIM = فيمنتين. (F) مخطط دائري لمتوسط تكوين نوع الأنسجة في hHOs ، محسوبا كمساحة النسبة المئوية مع علامة الخلية المعنية على عضو كامل عن طريق التلطيخ النووي عبر ثلاث طائرات z في جميع أنحاء الجهاز باستخدام ImageJ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: فلوو-4 يعيش تسجيلات الكالسيوم عابرة في الأعضاء قلب الإنسان الحية. (أ) تسجيلات عابرة الكالسيوم ممثل من خلايا القلب الفردية داخل organoids كله. (ب) خريطة حرارية تبين مستويات منخفضة وذروة من الكالسيوم بين إمكانات العمل كما تحددها كثافة فلوو-4؛ أشرطة المقياس = 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: تصوير حي للأعضاء التمثيلية المشتقة من hPSCs في اليوم السادس من التمايز تحت المجهر الخفيف في درجة حرارة الغرفة. اختصار: hPSC = الخلايا الجذعية البشرية متعددة القدرات. الرجاء الضغط هنا لتحميل هذا الفيديو.
فيديو 2: التصوير الحي للعضوية التمثيلية المستمدة من hPSCs في اليوم 15 من التمايز تحت المجهر الخفيف في درجة حرارة الغرفة. اختصار: hPSC = الخلايا الجذعية البشرية متعددة القدرات. الرجاء الضغط هنا لتحميل هذا الفيديو.
فيديو 3: تسجيل مباشر لليوم 10 organoid يظهر خريطة حرارية للعاببين الكالسيوم تحت المجهر الفلوري. الرجاء الضغط هنا لتحميل هذا الفيديو.
Discussion
وقد استخدمت التطورات الأخيرة في خلايا القلب المشتقة من الخلايا الجذعية البشرية وغيرها من الخلايا ذات الأصل القلبي لنمذجة نمو القلب البشري22,24,25 والمرض26,27,28 وكأدوات لفحص العلاجات29,30 والعوامل السامة31,32 . هنا، نبلغ عن بروتوكول سهل التنفيذ وقابل للاستنساخ للغاية لتوليد وتمييز EBs إلى منظمات hHOs شديدة التعقيد. وقد نجح هذا البروتوكول في خطوط خلايا متعددة، بما في ذلك hPSCs وhESCs23، تظهر ترددات الضرب متسقة وتنظيم نوع الخلية. يستمد هذا البروتوكول جوانب من البروتوكولات الموصوفة سابقا لتمايز خلايا القلب24 ، وتمايز الخلايا epicardial22 ، والأعضاء قبل القلب المستمدة من ESCs16 الماوس ويحسن التشكيل التدريجي للإشارات WNT الكنسي باستخدام مثبطات كيميائية وعوامل النمو في وسط محدد تماما. وقد استخدمت عدة منهجيات للتحسين في وضع هذا البروتوكول.
أولا، تم تحسين تركيزات المثبطات الكيميائية ومدد التعرض، فضلا عن إضافة عوامل النمو، للبيئة ثلاثية الأبعاد وتناقش في العمل السابق23. تم تحسين هذه لتوضيح الهياكل مع التعقيد الفسيولوجي وتمثيل القلب البشري في الجسم الحي ، مع التكوين الفسيولوجي ونسب خلايا القلب إلى أنواع الخلايا القلبية غير الخلايا العضلية (الخلايا الملحمية ، الخلايا الليفية القلبية). ثانيا، تسمح استراتيجية التغيير المتوسطة التي تبلغ الثلثين بالحد الأدنى من التحريض على المركبات/الأجهزة العضوية، لأنها تجلس في تعليق بالقرب من قاع البئر، مع تسهيل التعرض المتدرجة لمثبطات كيميائية وعوامل النمو عند تحديث الوسط. مزيج من التمايز mesoderm القلب من خلال تنشيط مسار WNT، تليها inhibition24، والتعريف اللاحقة من مواصفات proepicardial عن طريق تنشيط مسار WNT الثاني22، يسمح لبروتوكول واحد لتسفر عن hHOs معقدة للغاية. تنمو الأجهزة العضوية حتى 1 مم بعد 15 يوما من التمايز ويمكن نقلها بسهولة للتحليلات والمقاديرات الحية أو الثابتة. ثالثا ، نظرا لحجم كبير من organoids ، تم العثور على استخدام الميكروبات أو غيرها من الهياكل المماثلة للحفاظ على المسافة بين الشريحة و coverslip للحفاظ على نحو أفضل هيكل 3D من organoids وتحسين عملية التصوير.
يسمح نموذج القلب البشري المتطور هذا بالوصول إلى مراحل لا يمكن الوصول إليها من نمو القلب ، مثل مواصفات حقل القلب الأول والثاني المبكرة التي لوحظت بين اليومين 3 و 9 من التمايز والتنظيم إلى خلايا السلف القلبي التي تؤدي إلى أنسجة القلب ، بما في ذلك عضلة القلب ، والشغاف ، والإبيكارديوم ، و الوعائي البطاني ، ودعم الخلايا الليفية القلبية ، والتي لوحظت في اليوم 15 من التمايز. أنواع الأنسجة الموجودة في أعضاء القلب المستمدة من هذا البروتوكول هي ممثلة للغاية لقلب الجنين البشري في كل من composition33 و profileomic23,34. ولذلك فإنها يمكن أن تسهل الأنسجة والخلايا الخلية أعلى ترتيب التفاعلات تشبه تلك الموجودة في قلب الجسم الحي. كان هذا البروتوكول فعالا للغاية وقابلا للاستنساخ عبر التجارب وخطوط الخلايا ، مما أسفر عن عضويات تتكون في معظمها من خلايا القلب وتشمل خلايا القلب غير الخلايا العضلية ، مثل الخلايا القلبية الملحمية ، وخلايا القلب ، والخلايا الليفية القلبية ، والخلايا البطانية ، والتي تمثل التركيب الفسيولوجي233335.
تتم مناقشة تحليلات البنية الفوقية لخلايا القلب التشكيلية عن طريق المجهر الإلكتروني الإرسالي وتطوير الغرف وشبكة الأوعية الدموية عبر التصوير المقطعي للتماسك البصري والتصوير البؤري بالتفصيل في العمل السابق23. ميزة كبيرة لهذا البروتوكول الجهازي القلب على غيرها من البروتوكولات القائمة نشرت مؤخرا17,18,19,20,36,37 هو تشكيل قوي لشبكة البطانية في جميع أنحاء organoid, السماح للقدرة على التحقيق في تطور الأوعية الدموية والمرض في القلب البشري في وقت مبكر, دون الحاجة إلى مزيد من الحث الخارجي للبروتوكول. وأخيرا، يمكن تحقيق التحليل الوظيفي للأعضاء القلبية من خلال أساليب مختلفة، بما في ذلك استخدام صبغة حساسة للكالسيوم لتتبع عابري الكالسيوم في خلايا القلب عبر الجهاز. باستخدام المجهر عالي الدقة، سجلنا كثافة الفلورية لدخول الكالسيوم وخروجه من الخلايا ولاحظنا إمكانات عمل تمثيلية للغاية. وتشمل طرق التحليل الوظيفية الممكنة الأخرى استخدام خط معدل وراثيا مع مؤشر حساس للكالسيوم أو تسجيل مباشر باستخدام صفيف microelectrode23.
إن أعضاء القلب الموصوفة هنا هي خلاصة لقلب الجنين البشري النامي ، ومع ذلك فهي محدودة في إظهار ميزات أكثر نضجا تشبه البالغين. البروتوكولات المستقبلية قد تبني على البروتوكول الموصوف هنا للحث على النضج في هذه الأجهزة والأغلال التي تعطي نموذجا أفضل لقلب الكبار. وعلاوة على ذلك، فإن هذا البروتوكول مصمم لإنشاء نماذج مصغرة للقلب البشري ويقتصر على الدراسات البحثية لتطور القلب وأمراضه أو لفحص الأدوية وقد لا يكون مناسبا كوسيلة للتدخل السريري مثل استبدال أنسجة القلب عن طريق زرعها. بشكل عام، نحن نصف هنا بروتوكولا سهل المتابعة وفعال من حيث التكلفة لتوليد أجهزة قلب بشرية عالية التكاثر ومتطورة يمكن أن تسهل الدراسات البحثية في تطور القلب البشري، ومسببات الأمراض، والفحص الدوائي.
Disclosures
ولا يوجد لدى صاحبي البلاغ تضارب في المصالح يعلنانه.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني للقلب والرئة والدم للمعاهد الوطنية للصحة تحت أرقام الجوائز K01HL135464 و R01HL151505 وجمعية القلب الأمريكية تحت رقم الجائزة 19IPLOI34660342. نود أن نشكر MSU المتقدمة المجهر الأساسية والدكتور وليام جاكسون في قسم MSU لعلم الصيدلة وعلم السموم للوصول إلى المجاهر confocal، وIQ المجهر الأساسية، وMSU الجينوم الأساسية لخدمات التسلسل. ونود أيضا أن نشكر جميع أعضاء مختبر أغيري على تعليقاتهم ونصائحهم القيمة.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
References
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593 (2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215 (2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723 (2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098 (2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94 (2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4 (2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140 (2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283 (2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003 (2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142 (2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538 (2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved