Method Article
Gerando organoides cardíacos humanos auto-montados derivados de células-tronco pluripotentes
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para criar organoides cardíacos humanos relevantes de desenvolvimento (hHOs) usando eficientemente células-tronco pluripotentes humanas por auto-organização. O protocolo conta com a ativação sequencial de pistas de desenvolvimento e produz tecidos cardíacos humanos altamente complexos e funcionalmente relevantes.
Resumo
A capacidade de estudar o desenvolvimento cardíaco humano em saúde e doença é altamente limitada pela capacidade de modelar a complexidade do coração humano in vitro. O desenvolvimento de plataformas mais eficientes semelhantes a órgãos que podem modelar fenótipos complexos in vivo , como organoides e órgãos em um chip, aumentará a capacidade de estudar o desenvolvimento cardíaco humano e doenças. Este artigo descreve um protocolo para gerar organoides cardíacos humanos altamente complexos (hHOs) por auto-organização usando células-tronco pluripotentes humanas e ativação de caminhos de desenvolvimento stepwise usando inibidores de pequenas moléculas. Os corpos embrionários (EBs) são gerados em uma placa de 96 poços com fundo redondo, poços de fixação ultra-baixo, facilitando a cultura de suspensão de construções individualizadas.
Os EBs sofrem diferenciação em hHOs por uma estratégia de modulação de sinalização WNT de três etapas, que envolve uma ativação inicial da via WNT para induzir o destino do mesoderm cardíaco, um segundo passo da inibição de Wnt para criar linhagens cardíacas definitivas, e um terceiro passo de ativação wnt para induzir tecidos proepicardiais de órgãos. Essas etapas, realizadas em formato de 96 poços, são altamente eficientes, reprodutíveis e produzem grandes quantidades de organoides por execução. A análise por imagens de imunofluorescência do dia 3 ao dia 11 de diferenciação revela especificações de campo cardíaco de primeiro e segundo e tecidos de alta complexidade dentro dos HHOs no dia 15, incluindo tecido miocárdio com regiões de cardiomiócitos atrial e ventricular, bem como câmaras internas forradas com tecido endocardial. Os organoides também exibem uma intrincada rede vascular em toda a estrutura e um revestimento externo de tecido epicártico. Do ponto de vista funcional, os HHOs batem robustamente e apresentam atividade normal de cálcio, conforme determinado pela imagem ao vivo fluo-4. No geral, este protocolo constitui uma plataforma sólida para estudos in vitro em tecidos cardíacos semelhantes a órgãos humanos.
Introdução
Os defeitos cardíacos congênitos (CHDs) são o tipo mais comum de defeito congênito em humanos e afetam aproximadamente 1% de todos os nascidos vivos1,2,3. Na maioria das circunstâncias, as razões para os CHDs permanecem desconhecidas. A capacidade de criar modelos de coração humano no laboratório que se assemelham muito ao coração humano em desenvolvimento constitui um passo significativo para estudar diretamente as causas subjacentes dos CHDs em humanos e não em modelos animais substitutos.
O epítome de modelos de tecido cultivados em laboratório são organoides, construções de células 3D que se assemelham a um órgão de interesse na composição celular e função fisiológica. Organoides são frequentemente derivados de células-tronco ou células progenitoras e têm sido usados com sucesso para modelar muitos órgãos como o cérebro4,5, rim6,7, intestino8,9, pulmão10,11, fígado12,13 e pâncreas14,15 , só para citar alguns. Estudos recentes surgiram demonstrando a viabilidade de criar organoides cardíacos auto-montados para estudar o desenvolvimento cardíaco in vitro. Esses modelos incluem o uso de células-tronco embrionárias de camundongos (mESCs) para modelar o desenvolvimento cardíaco precoce16,17 até especificações atrioventriculares18 e células-tronco pluripotentes humanas (hPSCs) para gerar organoides de endoderme de camada plamífica de camada plamícidos 19 e cardiodos de câmara20 com composição celular altamente complexa.
Este artigo apresenta um novo protocolo de modulação WNT de 3 passos para gerar hHOs altamente complexos de forma eficiente e econômica. Organoides são gerados em placas de 96 poços, resultando em um sistema escalável e de alta produtividade que pode ser facilmente automatizado. Este método se baseia na criação de agregados de hPSC e no desencadeamento de etapas de desenvolvimento da cardiogênese, incluindo mesodermia e formação de mesoderm cardíaco, especificação de primeiro e segundo campo cardíaco, formação de órgãos proepicardial e especificação atrioventricular. Após 15 dias de diferenciação, os HHOs contêm todas as principais linhagens celulares encontradas no coração, câmaras internas bem definidas, câmaras atrial e ventricular, e uma rede vascular em todo o organoide. Este sistema organoide cardíaco altamente sofisticado e reprodutível é favorável à investigação de análises estruturais, funcionais, moleculares e transcriômicas no estudo do desenvolvimento cardíaco e doenças e rastreamento farmacológico.
Protocolo
1. cultura e manutenção hPSC
NOTA: Os PSCs induzidos por humanos (hiPSCs) ou células-tronco embrionárias humanas (hESCs) precisam ser cultivados por pelo menos 2 passagens consecutivas após o descongelamento antes de serem usados para gerar EBs para diferenciação ou criopreservação. hPSCs são cultivados em meio PSC (ver a Tabela de Materiais) em placas de cultura de 6 poços revestidos de membrana de porão (BM-ECM) revestidos de 6 poços. Ao realizar alterações médias em hPSCs em placas de 6 poços, adicione o meio diretamente ao lado interno do poço, em vez de diretamente em cima das células para evitar o descolamento ou estresse celular indesejado. Os usuários devem ter cuidado com a mídia PSC pré-aquecimento que não deve ser aquecida a 37 °C; todos os meios de PSC usados neste protocolo eram termoestáveis.
- Para revestir as placas de bem com o BM-ECM, descongele uma alíquota do BM-ECM (armazenado a -20 °C de acordo com as instruções do fabricante) no gelo e misture 0,5 mg do BM-ECM com 12 mL de meio de Águia modificada de Dulbecco (DMEM)/F12 (armazenado a 4 °C). Distribua 2 mL da mistura DMEM/F12-BM-ECM em cada poço de uma placa de 6 poços e incubar a 37 °C por pelo menos 2 h.
- Para descongelar as células, primeiro, descongelar o criovial hPSC em uma pérola de 37 °C ou banho de água por 1-2 min até que apenas uma pequena quantidade de gelo seja visível. Transfira as células descongeladas para um tubo de centrífuga e adicione lentamente 8-9 mL do meio PSC suplementado com 2 μM do inibidor de ROCHA, thiazovivin (Thiaz), e centrífuga a 300 × g por 5 min. Remova o supernatante e resuspense a pelota celular no meio PSC complementado com 2 μM de Thiaz. Distribua as células no meio de cultura em 1-2 poços dependendo da concentração e cultura das células criviais a 37 °C, 5% de CO2 por 24 h antes de mudar o meio PSC.
- Altere o meio nas células em intervalos de 48h. Realizar lavagens e alterações médias utilizando DMEM/F12 (1 mL/bem) e o meio PSC (2 mL/well), respectivamente.
NOTA: As lavagens ajudam a remover resíduos e detritos celulares, enquanto as alterações frescas da mídia fornecem às células uma fonte renovada de nutrientes. - Passar as células sobre a subconfluência (60-80% confluente) aspirando o meio, depois lavando cada poço com 1 mL de solução tamponada de fosfato de 1x Dulbecco (sem cálcio, sem magnésio; DPBS). Aspire o DPBS e adicione 1 mL do reagente de dissociação para hPSCs (ver a Tabela de Materiais), seguido pela aspiração de todos, exceto uma película fina do reagente após os 10 s.
- Incubar por 2-5 min com o filme fino do reagente de dissociação para hPSCs até que as lacunas se formem entre as células.
NOTA: A hora de parar a dissociação é dependente da linha celular. - Adicione 1 mL do meio PSC suplementado com 2 μM de Thiaz (meio PSC+Thiaz) ao poço e toque suavemente na placa para induzir o descolamento celular. Pipetizar as células separadas no meio 1-2 vezes para quebrar quaisquer grandes colônias, e resuspende as células em psc médio+Thiaz em uma proporção de poço de 1:6 (células de 1 poço resuspended em 12 mL de meio de cultura). Replate as células em poços revestidos de BM-ECM.
2. Geração de organoides cardíacos humanos auto-montados em 3D
- Formação do corpo embrionário (EB):
NOTA: É imprescindível limitar as células diferenciadas observáveis antes da formação do corpo embrionário. Dois a três poços de uma placa de 6 poços a uma confluência de 60-80% produzirão células suficientes para uma única placa de 96 poços de organoides. Todas as mídias devem ser aliquoadas e aquecidas em um banho de 37 °C ou água antes de qualquer alteração média para minimizar o choque de temperatura para os EBs ou organoides (isso não inclui reagentes de dissociação celular). Veja a Figura 1A,B.- Dia -2
- Para criar EBs, no dia -2, lave hPSCs subconfluentes (60-80% confluentes) com DPBS por pelo menos 10 s para lavar quaisquer detritos celulares e aspirar o DPBS.
- Para desprender as células e liberá-las em um estado de célula única, adicione 1 mL de reagente de dissociação celular de temperatura ambiente (veja a Tabela de Materiais) a cada poço por 3-6 min. Toque suavemente na placa ~5 vezes por minuto para induzir o desprendimento enquanto verifica sob o microscópio. Adicione 1 mL de PSC médio+Thiaz para parar a reação.
- Para coletar as células e quebrar quaisquer agregados restantes, pipete a mídia para cima e para baixo no poço 2-3 vezes para gerar uma suspensão unicelular. Transfira a suspensão unicelular para um tubo de centrífuga e gire por 5 min a 300 × g.
- Para obter a concentração celular desejada, descarte o sobrenadante e resuspenque as células em 1 mL de PSC médio+Thiaz. Conte as células usando um contador celular ou hemótmetro e dilua as células em PSC médio+Thiaz a uma concentração de 100.000 células/mL.
- Para distribuir as células para formação de EB, use uma pipeta multicanal para adicionar 100 μL (10.000 células) a cada poço de uma placa ultra-baixa de fundo redondo de 96 poços. Centrifugar a placa a 100 × g por 3 min e incubar por 24 h a 37 °C, 5% de CO2.
- Dia -1
- Remova cuidadosamente 50 μL de meio de cada poço e adicione 200 μL de médio PSC fresco aquecido a 37 °C para alcançar um volume final de 250 μL por poço. Incubar as células por 24 h a 37 °C, 5% de CO2.
NOTA: Remova e adicione o meio cuidadosamente na lateral do poço para evitar perturbar os EBs na parte inferior do poço. Devido à natureza delicada dos EBs e à cultura de suspensão, é necessário deixar um pequeno volume de líquido em cada poço ao trocar o meio para evitar perturbar os EBs.
- Remova cuidadosamente 50 μL de meio de cada poço e adicione 200 μL de médio PSC fresco aquecido a 37 °C para alcançar um volume final de 250 μL por poço. Incubar as células por 24 h a 37 °C, 5% de CO2.
- Dia -2
- Diferenciação do Coração Humano (hHO):
NOTA: Todos os meios de comunicação devem ser aquecidos em uma conta de 37 °C ou banho de água antes de qualquer alteração de mídia. Remova e adicione o meio cuidadosamente na lateral do poço para evitar perturbar os organoides em desenvolvimento na parte inferior do poço. As lavagens não são necessárias entre as mudanças de mídia para minimizar a agitação e permitir a remoção gradual de inibidores e fatores de crescimento. O RPMI com 2% de suplemento B-27 (Tabela de Materiais) foi utilizado em todo o protocolo de diferenciação. O suplemento B-27 contém insulina a menos que especificado (sem insulina nos dias 0-5). Veja a Figura 1C.- Dia 0
- Para iniciar a diferenciação em relação a uma linhagem de mesoderm, remova 166 μL de meio de cada poço (~2/3º do volume total do poço) e adicione 166 μL de RPMI 1640 contendo suplemento B-27 sem insulina, 6 μM CHIR99021, 1.875 ng/mL proteína morfogenética óssea 4 (BMP4), e 1,5 ng/mL Activin A para uma concentração final de poço de 4 μM CHIR99021, 1,25 ng/mL BMP4 e 1 ng/mL Activin A. Incubar por 24 h a 37 °C, 5% de CO2.
- Dia 1º
- Remova 166 μL de médio de cada poço e adicione 166 μL de RPMI fresco 1640 com suplemento B-27 sem insulina. Incubar por 24 h a 37 °C, 5% de CO2.
- Dia 2.
- Para induzir a especificação do mesoderme cardíaco, remova 166 μL de médio de cada poço e adicione 166 μL de RPMI 1640 contendo suplemento B-27 sem insulina e 3 μM Wnt-C59 para uma concentração final de 2 μM Wnt-C59. Incubar por 48 h a 37 °C, 5% de CO2.
- Dia 4.
- Remova 166 μL de médio de cada poço e adicione 166 μL de RPMI fresco 1640 com suplemento B-27 sem insulina. Incubar por 48 h a 37 °C, 5% de CO2.
- Dia 6.
- Remova 166 μL de meio de cada poço e adicione 166 μL de RPMI 1640 com suplemento B-27. Incubar por 24 h a 37 °C, 5% de CO2.
- Dia 7.
- Para induzir a diferenciação proepicardial, remova 166 μL de meio de cada poço e adicione 166 μL de RPMI fresco 1640 contendo suplemento B-27 e 3 μM CHIR99021 para uma concentração final de poço de 2 μM CHIR99021. Incubar por 1h a 37 °C, 5% de CO2.
- Remova 166 μL de meio de cada poço e adicione 166 μL de RPMI fresco 1640 contendo suplemento B-27. Incubar por 48 h a 37 °C, 5% de CO2.
NOTA: A cautela extra é aconselhada nesta segunda mudança média no dia 7, pois os organoides são mais propensos ao movimento devido às mudanças na mídia. - A partir do dia 7 até a coleta ou transferência para análises ou experimentações, realize alterações médias a cada 48 h removendo 166 μL de meio de cada poço e adicione 166 μL de RPMI fresco 1640 contendo suplemento B-27.
NOTA: Os organoides estão prontos para análises e experimentações no dia 15, a menos que estágios de desenvolvimento anteriores sejam de interesse. Eles podem ser cultivados no último dia 15 para experimentos de cultura ou maturação de longo prazo.
- Dia 0
3. Análise organoide
- Transferência de organoides inteiros (vivos ou fixos)
NOTA: Para transferência de organoides vivos, certifique-se de que as pontas de pipeta utilizadas são estéreis.- Corte a ponta de uma ponta de pipeta P200 de 5-10 mm da abertura da ponta, resultando em uma ampla abertura de ~2-3 mm de diâmetro.
- Insira a ponta diretamente no poço de fundo redondo contendo o organoide para que a pipeta seja completamente vertical (perpendicular à placa). Certifique-se de que o êmbolo da pipeta já está pressionado até o fim antes de inserir a ponta no meio.
- Solte lentamente o êmbolo da pipeta, ocupando o suficiente médio (100-200 μL) para coletar o organoide.
- Transfisi o organoide em médio para o destino alvo (por exemplo, para fixação, imagem ao vivo, gravação de eletrofisiologia, nova cultura de placa).
- Fixação de organoides
NOTA: Os organoides de fixação e coloração podem ser feitos tanto na placa de cultura de 96 poços quanto nos tubos de microcentrifuuge. Paraformaldeído (PFA) deve ser manuseado apenas em um capô de fumaça.- Para fixação em tubos de microcentrifuge, transfira organoides vivos para tubos separados com 1-8 organoides por tubo.
NOTA: Não exceda 8 organoides por tubo. - Remova e descarte cuidadosamente o máximo possível do tubo sem tocar nos organoides.
- Adicione 4% de PFA a cada tubo ou bem (300-400 μL por tubo de microcentrifus de microcentragem e 100-200 μL por poço de uma placa de 96 poços). Incubar em temperatura ambiente por 30-45 min.
NOTA: Os tempos de incubação acima de 1h podem exigir etapas de recuperação de antígenos e não são recomendados. - Descarte com segurança o PFA sem perturbar os organoides. Realizar 3 lavagens com DPBS suplementada com 1,5 g/L de glycina (DPBS/Gly), utilizando o mesmo volume utilizado para o PFA de 4%, esperando 5 min entre as lavagens. Remova o DPBS/Gly e prossiga para imunossuagem ou outras análises ou adicione DPBS e armazene a 4 °C para uso futuro por até 2 semanas.
NOTA: Armazenar organoides fixos por mais de 2 semanas pode resultar em degradação e contaminação do tecido e não é recomendado.
- Para fixação em tubos de microcentrifuge, transfira organoides vivos para tubos separados com 1-8 organoides por tubo.
- Coloração imunofluorescente de montagem inteira
- Adicione 100 μL de solução de bloqueio/permeabilização (10% de soro normal de burro + 0,5% de albumina de soro bovino (BSA) + 0,5% Triton X-100 em 1x DPBS) em cada poço ou tubo contendo os organoides fixos. Incubar à temperatura ambiente durante a noite em um shaker.
NOTA: Não exceda 8 organoides por tubo. - Remova e descarte cuidadosamente o máximo possível da solução de bloqueio sem tocar nos organoides. Realizar 3 lavagens com DPBS, esperando 5 min entre as lavagens.
- Prepare a solução de anticorpos primários (1% soro normal de burro + 0,5% BSA + 0,5% Triton X-100 em 1x DPBS) com os anticorpos primários desejados nas concentrações recomendadas. Incubar a 4 °C por 24 h em um shaker.
- Remova e descarte cuidadosamente o máximo possível da solução de anticorpos sem tocar nos organoides. Realizar 3 lavagens com DPBS, esperando 5 min entre as lavagens.
- Prepare a solução secundária de anticorpos (1% soro normal de burro + 0,5% BSA + 0,5% Triton X-100 em 1x DPBS) com os anticorpos secundários desejados nas concentrações recomendadas. Se os anticorpos forem rotulados fluorescentemente, incubar a 4 °C no escuro (por exemplo, coberto de papel alumínio) por 24 h em um agitador.
- Remova e descarte cuidadosamente o máximo possível da solução de anticorpos sem tocar nos organoides. Realizar 3 lavagens com DPBS, esperando 5 min entre as lavagens.
- Prepare slides com contas (90-300 μm de diâmetro) montadas em um meio de montagem (ver a Tabela de Materiais) perto das bordas do slide onde o deslizamento de cobertura com os organoides será colocado.
NOTA: Recomenda-se permitir que o meio de montagem ao redor das contas seque antes de prosseguir; isso evitará que as contas se movam. Veja a Figura 2. - Transfira os organoides manchados usando uma ponta de pipeta cortada para o slide, entre as contas, garantindo o espaçamento para evitar o contato entre os organoides uma vez na lâmina. Use o canto de uma limpeza de laboratório enrolada para remover cuidadosamente o excesso de líquido ao redor do organoide.
- Cubra os organoides com meio de compensação de montagem (solução de compensação de frutose-glicerol é 60% (vol/vol) glicerol e 2,5 M de frutose)37 utilizando 120-150 μL do meio de montagem por slide.
NOTA: Recomenda-se usar uma ponta de pipeta cortada ao trabalhar com o meio de limpeza de montagem, pois é muito viscoso. - Passe o deslizamento sobre o slide com os organoides cobertos com solução de limpeza de montagem e pressione lentamente o deslizamento sobre o slide, garantindo que os organoides estejam entre as contas montadas.
- Sele o perímetro da mancha de cobertura no slide usando verniz de unha de casaco superior. Deixe o slide secar no escuro à temperatura ambiente por 1h. Armazene a 4 °C no escuro para armazenamento a longo prazo.
- Adicione 100 μL de solução de bloqueio/permeabilização (10% de soro normal de burro + 0,5% de albumina de soro bovino (BSA) + 0,5% Triton X-100 em 1x DPBS) em cada poço ou tubo contendo os organoides fixos. Incubar à temperatura ambiente durante a noite em um shaker.
- Imagem transitória de cálcio em organoides cardíacos vivos
NOTA: De acordo com as instruções do fabricante, o Fluo4-AM foi reconstituído em sulfóxido de dimetila (DMSO) para uma concentração final de solução de estoque de 0,5 mM. Fluo4-AM foi adicionado diretamente ao poço organoide na placa de 96 poços.- Realize 2 lavagens nos organoides utilizando meio RPMI 1640.
- Remova 166 μL do meio gasto do poço.
- Adicione 166 μL de meio RPMI 1640 aquecido, remova 166 μL de meio e adicione 166 μL de meio RPMI 1640 fresco.
NOTA: As lavagens são feitas para remover o material residuais e os detritos celulares. Dois terços do meio são removidos dos poços durante as lavagens para evitar perturbar os organoides na parte inferior do poço antes do ensaio funcional.
- Adicione fluo4-AM médio aos organoides.
- Adicione Fluo4-AM reconstituído em DMSO ao RPMI 1640 contendo suplemento B-27 para preparar uma solução de 1,5 μM.
- Remova 166 μL de meio do poço.
- Adicione 166 μL de 1,5 μM Fluo4-AM em RPMI 1640 contendo suplemento B-27 para uma concentração final de poço de 1 μM. Incubar a 37 °C, 5% de CO2 por 30 min.
- Realize 2 lavagens como na etapa 3.4.1.
- Adicione 166 μL de RPMI 1640 contendo suplemento B-27 ao poço.
- Usando uma ponta de corte de uma ponta de pipeta P200, transfira o organoide para uma placa de Petri de fundo de vidro (por exemplo, vidro de cobertura de 8 poços com vidro de cobertura de alto desempenho) com 100-200 μL de meio.
NOTA: Consulte a seção 3.1 sobre a transferência de organoides inteiros. - Imagem os organoides vivem sob um microscópio com uma câmara controlada por temperatura e CO2 a 37 °C, 5% de CO2.
- Grave vários vídeos de 10 a 20 em vários locais em todo o organoide, mostrando o aumento e a diminuição dos níveis de intensidade de fluorescência à medida que o cálcio entra e sai das células.
NOTA: Para gravações de alta resolução, recomenda-se gravar a uma velocidade de 10 fps ou mais rápida; Recomenda-se 50 fps. - Analise os vídeos usando software de análise de imagem (por exemplo, ImageJ) selecionando regiões de interesse e medindo níveis de intensidade ao longo do tempo.
- Normalize as gravações de intensidade usando ΔF/F0 vs. tempo em milissegundos e enredo.
- Realize 2 lavagens nos organoides utilizando meio RPMI 1640.
Resultados
Para alcançar a auto-organização hHO in vitro, modificamos e combinamos protocolos de diferenciação previamente descritos para diferenciação de monocamadas 2D de células cardiomiocós-ástica21 e epicárida22 usando moduladores de via Wnt e para organoides pré-cardiaco 3D16 usando os fatores de crescimento BMP4 e Activin A. Utilizando a placa de 96 poços EB e protocolo de diferenciação hHO descritos aqui e mostrados na Figura 11 , as concentrações e as durações de exposição do ativador de vias WNT CHIR99021 foram otimizadas para produzir hHOs altamente reprodutíveis e complexos derivados de PSCs humanos. hPSCs ou hESCs cultivados em psc médio a 60-80% de confluência na formação de colônias com diferenciação mínima a nenhuma visível são ideais para a geração de EB (Figura 1B).
Os EBs foram autorizados a incubar por 48h com uma mudança média após 24 horas antes de iniciar a diferenciação no dia 0. No dia 0, os EBs devem aparecer como um agregado esférico escuro no centro de cada poço sob um microscópio de luz (Figura 1B). O protocolo de diferenciação começa no dia 0 com a ativação da via Wnt e a adição do fator de crescimento por exatamente 24 horas. Esta indução de mesoderm seguida de uma indução de mesodermia cardíaca no dia 2 usando o inibidor da via Wnt Wnt Wnt-C59 resultará em um aumento significativo do organoide de ~200 μm de diâmetro a 500-800 μm de diâmetro no dia 4 e até 1 mm (organoides podem experimentar uma ligeira redução no tamanho até o dia 15 (Figura 1C)). O HHO começará a bater já no dia 6 (Vídeo 1), com 100% dos organoides mostrando batida visível até o dia 10 (Vídeo 2) (a menos que se submetam ao tratamento medicamentoso ou se hPSCs inadequados foram usados para gerar os EBs). Isso foi observado em 5 linhas celulares hPSC distintas23.
Para avaliar a capacidade dos HHOs de representar várias etapas do desenvolvimento fisiológico do coração, coletamos organoides em vários pontos de tempo ao longo do protocolo de diferenciação e buscamos a presença e expressão transcriômica dos marcadores do campo cardíaco. A coloração imunofluorescente para o primeiro marcador do campo cardíaco (FHF), HAND1, e o marcador do segundo campo cardíaco (SHF), HAND2, revelaram sua presença nuclear nessas células progenitoras cardíacas surgidas por volta do dia 3 e 5, respectivamente (Figura 3A).
A expressão de ambos os marcadores acontece em regiões dos organoides que diminuem de tamanho após o dia 7 para a FHF e após o dia 9 para o SHF. Curiosamente, imagens de alta ampliação dos organoides do dia 7 revelaram que a maioria das células que expressam HAND1 eram de origem cardiomiocócica (como mostrado pelo marcador específico de cardiomiócito TNNT2). Em contraste, muitas das células que expressam HAND2 não expressaram o marcador de cardiomiócito (Figura 3B). Esta observação está de acordo com os organoides pré-cardíacos derivados de ESCs de camundongos que demonstram o desenvolvimento de células não miócitos a partir de células progenitoras SHF16. É importante notar que os dados do RNA-Sequencing mostram que as transcrições de RNA tanto para HAND1 quanto HAND2 foram expressas a partir do dia 3, com o marcador FHF sendo mais expresso entre os dias 3 e 11 e o marcador SHF sendo mais expresso após o dia 13 (Figura 3C).
A coloração da imunofluorescência revelou a presença de marcadores de várias linhagens do tipo celular que compõem o coração humano. Tecido miocárdio (identificável usando o marcador específico de cardiomiócito TNNT2) adjacente ao tecido epicárdio (marcado pelo fator de transcrição nuclear WT1 e o marcador de membrana epitelial TJP1) (Figura 4A). Células endocárdicos expressas NFATC1 foram detectadas forrando as paredes de estruturas internas semelhantes a câmaras dentro dos organoides (Figura 4B). As células endoteliais em uma rede semelhante a uma embarcação podem ser vistas já no 13º dia de diferenciação (Figura 4C). Por fim, relatamos a presença de fibroblastos cardíacos misturados em todo o organoide (Figura 4D). Esses marcadores do tipo celular também foram observados nos perfis de expressão genética RNA-Seq (Figura 4E). A composição dos tipos celulares nos organoides, como medido pela área do organoide que ocupam, foram encontrados ~58% cardiomiocócitos, com o restante compreendendo células cardíacas não miótidas, incluindo células epicáridas (~15%), células do endocárdio (~13%), fibroblastos cardíacos (~12%) e células endoteliais (~1%) (Figura 4F).
A função eletrofisiológica dos organoides foi medida por imagens vivas de cálcio de células individuais em organoides inteiros. A intensidade da fluorescência fluo-4 varia ao longo do tempo devido à entrada e saída de cálcio da célula, revelando potenciais de ação regulares (Figura 5A). Os heatmaps que mostram intensidades de cálcio sobre uma região de alta ampliação do organoide mostram o aumento da intensidade por causa de transitórios de cálcio em células individuais (Figura 5B e Vídeo 3).
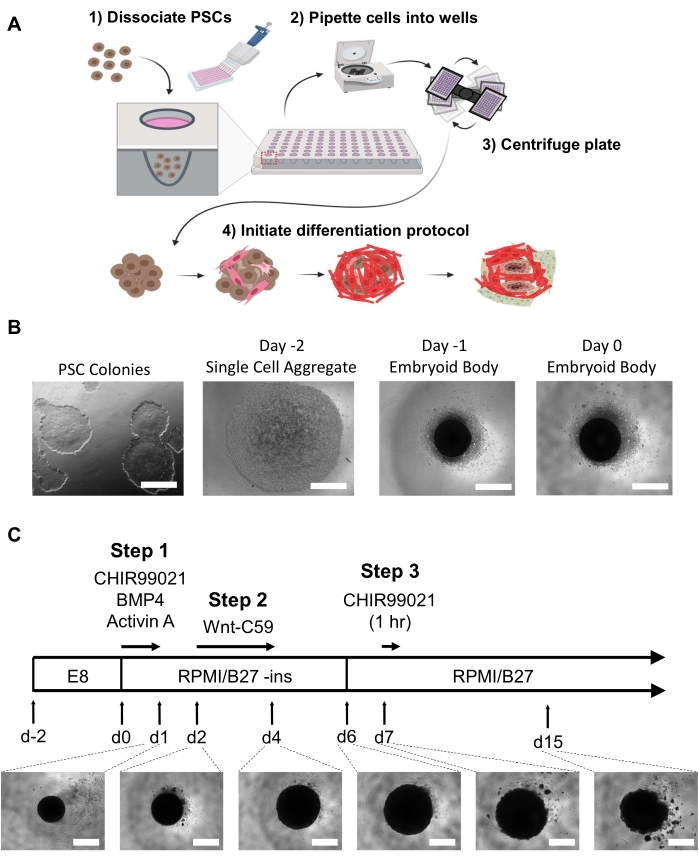
Figura 1: A geração corporal embrionária e os passos de diferenciação organoide do coração. (A) (1-2) As células dissociadas são semeadas em poços de uma placa de fixação ultra-baixa de 96 poços através de uma pipeta multicanal. (3) A placa de 96 poços é então centrifuada, o que permite que as células se agreguem no centro. (4) Com o tempo, após a adição de fatores de crescimento e moduladores de vias, o corpo embrionário começa a se diferenciar em várias linhagens cardíacas e formar populações celulares distintas espacial e fisiologicamente relevantes ao redor de microchambers internos. (B) Imagens representativas da progressão da geração corporal embrionária, começando com a cultura iPSC bidimensional (esquerda) e terminando com um corpo embrionário do dia 0 (à direita); barra de escala = 500 μm. (C) Resumo do protocolo de diferenciação organoide do coração humano, incluindo moduladores de via química e inibidores com respectivos pontos de tempo, durações e imagens organoides em desenvolvimento sob microscopia leve do dia 1 ao dia 15; barra de escala = 500 μm. Clique aqui para ver uma versão maior desta figura.
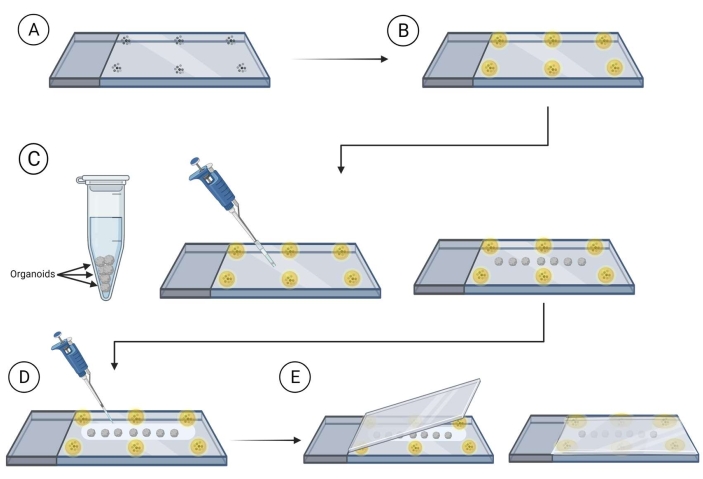
Figura 2: Montagem organoide inteira em lâminas para imagem. Passos para preparar slides e organoides de montagem para imagem. (A) Colocação de microesferas na periferia de um deslizamento de vidro. (B) Cobrir as microesferas com meio de montagem. (C) Transferir organoides para o slide entre as contas e remover o excesso de líquido ao redor dos organoides. (D) Cobrir os organoides com meio de clareira/montagem. (E) Colocar a mancha de cobertura em cima do slide com organoides e contas. Clique aqui para ver uma versão maior desta figura.

Figura 3: Primeira especificação do campo cardíaco e segundo coração em hHOs recapitula desenvolvimento fisiológico do coração humano. (A) Imagens de imunofluorescência confocal do dia 3 ao dia 11 hHOs mostrando a formação de FHF (HAND1, top) e SHF (HAND2, inferior), e cardiomiócitos (TNNT2) e DAPI de corante nuclear; barras de escala = 500 μm. (B) Imagens de alta ampliação dos organoides do dia 7 mostrando co-localização de HAND1 e HAND2 com o marcador de cardiomiócito TNNT2; barras de escala = 50 μm. (C) Perfis de expressão genética RNA-Seq do marcador FHF HAND1 (vermelho) e marcador SHF HAND2 (azul) do dia 0 ao dia 19. Abreviaturas: hHOs = organoides cardíacos humanos; FHF = primeiro campo cardíaco; SHF = segundo campo cardíaco; MÃO = derivados do coração e da crista neural expressos; TNNT2 = troponina cardíaca T2; DAPI = 4',6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.

Figura 4: hHOs desenvolvem linhagens cardíacas multiple. (A-D) Imagens de imunofluorescência confocal do dia 15 hHOs mostrando a formação de cardiomiócitos (TNNT2) e coloração com dapi de corante nuclear em células cardíacas não miócitos. (A) Organoide inteiro e alta ampliação do marcador epicárdio WT1 (verde) e marcador de membrana epitelial TJP1 (branco) mostrando células epictícias de origem epitelial em cima e adjacentes ao tecido miocárdio; barra de escala = 500 μm, inset = 50 μm. (B) Expressão do marcador endocárdia NFATC1 (verde) no revestimento das câmaras; barra de escala = 500 μm. (C) Rede de embarcações endoteliais em hHOs mostrados por PECAM1 (verde). Barra de escala = 500 μm. (D) Marcadores de fibroblastos cardíacos THY1 e VIM mostrados em verde e branco, respectivamente, distribuídos por todo o organoide. Barra de escala = 500 μm. (E) Perfis de expressão genética RNA-Seq dos principais tipos de células presentes nos hHOs dos dias 0 a 19 de diferenciação. Abreviaturas: hHOs = organoides cardíacos humanos; TNNT2 = troponina cardíaca T2; DAPI = 4',6-diamidino-2-fenildole; WT1 = Fator de transcrição tumor-1 de Wilm; NFATC1 = fator nuclear citoplasmado da célula T ativada; PECAM1 = molécula de adesão celular endotelial plaquetária-1; VIM = vimentina. (F) Gráfico de tortas da composição média do tipo de tecido em hHOs, calculado como a área percentual com o respectivo marcador celular sobre um organoide inteiro por coloração nuclear em três z-planes em todo o organoide usando ImageJ. Clique aqui para ver uma versão maior desta figura.

Figura 5: Gravações transitórias de cálcio ao vivo fluo-4 em organoides cardíacos humanos vivos. (A) Registros representativos de cálcio transitórios de cardiomiócitos individuais dentro de organoides inteiros. (B) Mapa de calor mostrando níveis baixos e máximos de cálcio entre potenciais de ação determinados pela intensidade do Fluo-4; barras de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Imagem viva de organoide representativo derivado de hPSCs no dia 6 de diferenciação sob microscopia leve à temperatura ambiente. Abreviação: hPSC = célula-tronco pluripotente humana. Clique aqui para baixar este vídeo.
Vídeo 2: Imagem ao vivo de organoide representativo derivado de hPSCs no dia 15 de diferenciação sob microscopia leve à temperatura ambiente. Abreviação: hPSC = célula-tronco pluripotente humana. Clique aqui para baixar este vídeo.
Vídeo 3: Gravação ao vivo do dia 10 organoide mostrando o mapa de calor de transitórios de cálcio sob um microscópio de fluorescência. Clique aqui para baixar este vídeo.
Discussão
Avanços recentes em cardiomiócitos derivados de células-tronco humanas e outras células de origem cardíaca têm sido usados para modelar o desenvolvimento do coração humano22,24,25 e doenças26,27,28 e como ferramentas para triagem de terapêutica29,30 e agentes tóxicos31,32 . Aqui, reportamos um protocolo fácil de implementar e altamente reprodutível para gerar e diferenciar EBs em HHOs altamente complexos. Este protocolo foi bem sucedido em várias linhas celulares, incluindo hPSCs e hESCs23, mostrando frequências de batida consistentes e organização do tipo celular. Este protocolo retira aspectos de protocolos previamente descritos para diferenciação de cardiomiócito24, diferenciação de células epicárdicas22 e organoides pré-cardiacos derivados de ESCs16 de camundongos e otimiza a modulação stepwise da sinalização canônica do WNT usando inibidores químicos e fatores de crescimento em um meio totalmente definido. Diversas metodologias de otimização foram empregadas na geração deste protocolo.
Em primeiro lugar, as concentrações inibidoras químicas e as durações de exposição, bem como a adição de fatores de crescimento, foram otimizadas para o ambiente 3D e são discutidas em trabalhos anteriores23. Estes foram otimizados para elucidar estruturas com complexidade fisiológica e representação do coração humano in vivo , com composição fisiológica e proporções de cardiomiócitos para tipos de células cardíacas não miócitos (células epicárdicas, fibroblastos cardíacos). Em segundo lugar, a estratégia de mudança média de dois terços permite a agitação mínima dos EBs/organoides, pois eles ficam em suspensão perto da parte inferior do poço, ao mesmo tempo em que facilita uma exposição gradiente a inibidores químicos e fatores de crescimento quando o meio é atualizado. A combinação de diferenciação de mesoderm cardíaco através da ativação da via Wnt, seguida pela inibição24, e a subsequente indução de especificação proepicardial através de uma segunda ativação da via Wnt22, permite que um único protocolo produza hHOs altamente complexos. Os organoides crescem até 1 mm após 15 dias de diferenciação e podem ser facilmente transferidos para análises e ensaios vivos ou fixos. Em terceiro lugar, dado o grande tamanho dos organoides, o uso de microesferas ou outras estruturas semelhantes para manter espaço entre o slide e o deslizamento foi encontrado para preservar melhor a estrutura 3D dos organoides e melhorar o processo de imagem.
Este modelo de coração humano em desenvolvimento permite o acesso a estágios inacessíveis de desenvolvimento cardíaco, como a especificação do primeiro e segundo campo cardíaco observados entre os dias 3 e 9 de diferenciação - e organização em células progenitoras cardíacas que dão origem a tecidos cardíacos, incluindo o miocárdio, endocárdio, epicárdio, vasculatura endotelial, e suporte a fibroblastos cardíacos, que foram observados no dia 15 de diferenciação. Os tipos de tecidos presentes nos organoides cardíacos derivados deste protocolo são altamente representativos do coração fetal humano tanto na composição33 quanto no perfil transcriômico23,34. Eles podem, portanto, facilitar interações de tecido-tecido e células mais altas semelhantes às do coração in vivo. Este protocolo foi altamente eficiente e reprodutível entre experimentos e linhas celulares, produzindo organoides que compreendem principalmente cardiomiócitos e incluem células cardíacas não miócitos, como células epicoardiais, células endocárdicas, fibroblastos cardíacos e células endoteliais, representando a composição fisiológica23,33,35.
Análises da ultraestrutura dos cardiomiócitos formadores por meio da microscopia eletrônica de transmissão e do desenvolvimento de câmaras e de uma rede vascular via tomografia de coerência óptica e imagem confocal são discutidas detalhadamente em trabalhos anteriores23. Uma grande vantagem deste protocolo organoide cardíaco em relação a outros protocolos existentes publicados recentemente17,18,19,20,36,37 é a formação robusta de uma rede endotelial em todo o organoide, permitindo a capacidade de investigar o desenvolvimento vascular e a doença no coração humano primitivo, sem a necessidade de novas induções externas ao protocolo. Por fim, a análise funcional dos organoides cardíacos é alcançável através de várias abordagens, incluindo o uso de um corante sensível ao cálcio para rastrear os transitórios de cálcio nos cardiomiócitos em todo o organoide. Utilizando microscopia de alta resolução, registramos a intensidade de fluorescência de cálcio entrando e saindo das células e observamos potenciais de ação altamente representativos. Outros possíveis métodos de análise funcional incluem o uso de uma linha transgênica com um indicador sensível ao cálcio ou gravação direta usando um array de microeletrodos23.
Os organoides cardíacos descritos aqui são recapitulativos do coração fetal humano em desenvolvimento, mas são limitados em demonstrar características mais maduras e adultas. Protocolos futuros podem se basear no protocolo aqui descrito para induzir o amadurecimento nesses organoides e produzir construções que melhor modelem o coração adulto. Além disso, este protocolo foi projetado para criar modelos em miniatura do coração humano e limita-se a pesquisas de desenvolvimento cardíaco e doenças ou para rastreamento farmacêutico e pode não ser adequado como meio de intervenção clínica, como a substituição do tecido cardíaco por meio de transplante. No geral, descrevemos aqui um protocolo fácil de seguir e econômico para gerar organoides cardíacos humanos altamente reprodutíveis e sofisticados que podem facilitar estudos de pesquisa em desenvolvimento cardíaco humano, etiologia de doenças e rastreamento farmacológico.
Divulgações
Os autores não têm conflitos de interesse para declarar.
Agradecimentos
Este trabalho foi apoiado pelo National Heart, Lung, and Blood Institute dos Institutos Nacionais de Saúde sob os números de premiação K01HL135464 e R01HL15151505 e pela American Heart Association sob o prêmio número 19IPLOI34660342. Agradecemos ao Núcleo avançado de Microscopia da MSU e ao Dr. William Jackson do Departamento de Farmacologia e Toxicologia da MSU pelo acesso aos microscópios confocal, ao Núcleo de Microscopia de QI e ao Núcleo de Genômica da MSU para serviços de sequenciamento. Também queremos agradecer a todos os membros do Laboratório Aguirre por seus valiosos comentários e conselhos.
Materiais
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
Referências
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593 (2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215 (2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723 (2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098 (2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94 (2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4 (2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140 (2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283 (2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003 (2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142 (2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538 (2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados