Method Article
Erzeugung von selbstorganisierenden menschlichen Herzorganoiden aus pluripotenten Stammzellen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll zur effizienten Herstellung entwicklungsrelevanter menschlicher Herzorganoide (hHOs) unter Verwendung menschlicher pluripotenter Stammzellen durch Selbstorganisation. Das Protokoll beruht auf der sequentiellen Aktivierung von Entwicklungshinweisen und produziert hochkomplexes, funktionell relevantes menschliches Herzgewebe.
Zusammenfassung
Die Fähigkeit, die menschliche Herzentwicklung in Gesundheit und Krankheit zu untersuchen, ist durch die Fähigkeit, die Komplexität des menschlichen Herzens in vitro zu modellieren, stark eingeschränkt. Die Entwicklung effizienterer organähnlicher Plattformen, die komplexe In-vivo-Phänotypen wie Organoide und Organe auf einem Chip modellieren können, wird die Fähigkeit verbessern, die Entwicklung und Erkrankung des menschlichen Herzens zu untersuchen. Dieser Artikel beschreibt ein Protokoll zur Erzeugung hochkomplexer menschlicher Herzorganoide (hHOs) durch Selbstorganisation unter Verwendung menschlicher pluripotenter Stammzellen und schrittweise Aktivierung des Entwicklungsweges unter Verwendung von niedermolekularen Inhibitoren. Embryoide Körper (EBs) werden in einer 96-Well-Platte mit runden, extrem niedrigen Befestigungstöpfen erzeugt, was die Suspensionskultur individualisierter Konstrukte erleichtert.
Die EBs werden durch eine dreistufige Wnt-Signalmodulationsstrategie in hHOs differenziert, die eine anfängliche Wnt-Signalwegaktivierung zur Induktion des kardialen Mesodermenschicksals, einen zweiten Schritt der Wnt-Hemmung zur Schaffung definitiver Herzlinien und einen dritten Wnt-Aktivierungsschritt zur Induktion von Proepikardorgangewebe beinhaltet. Diese Schritte, die in einem 96-Well-Format durchgeführt werden, sind hocheffizient, reproduzierbar und produzieren große Mengen an Organoiden pro Lauf. Die Analyse mittels Immunfluoreszenzbildgebung von Tag 3 bis Tag 11 der Differenzierung zeigt erste und zweite Herzfeldspezifikationen und hochkomplexe Gewebe in hHOs an Tag 15, einschließlich Myokardgewebe mit Regionen von atrialen und ventrikulären Kardiomyozyten sowie interne Kammern, die mit Endokardgewebe ausgekleidet sind. Die Organoide weisen auch ein kompliziertes vaskuläres Netzwerk in der gesamten Struktur und eine äußere Auskleidung des epikarden Gewebes auf. Aus funktioneller Sicht schlagen hHOs robust und weisen eine normale Kalziumaktivität auf, wie sie durch Fluo-4-Live-Imaging bestimmt wird. Insgesamt stellt dieses Protokoll eine solide Plattform für In-vitro-Studien in menschlichen organähnlichen Herzgeweben dar.
Einleitung
Angeborene Herzfehler (KHK) sind die häufigste Art von angeborenen Defekten beim Menschen und betreffen etwa 1% aller Lebendgeburten1,2,3. Unter den meisten Umständen bleiben die Gründe für KHK unbekannt. Die Fähigkeit, menschliche Herzmodelle im Labor zu erstellen, die dem sich entwickelnden menschlichen Herzen sehr ähnlich sind, stellt einen bedeutenden Schritt nach vorne dar, um die zugrunde liegenden Ursachen von KHK beim Menschen und nicht in Leihtiermodellen direkt zu untersuchen.
Der Inbegriff von im Labor gezüchteten Gewebemodellen sind Organoide, 3D-Zellkonstrukte, die einem Organ ähneln, das für die Zellzusammensetzung und physiologische Funktion von Interesse ist. Organoide werden oft aus Stammzellen oder Vorläuferzellen gewonnen und wurden erfolgreich verwendet, um viele Organe wie Gehirn4,5, Niere6,7, Darm8,9, Lunge10,11, Leber12,13 und Bauchspeicheldrüse zu modellieren14,15 , um nur einige zu nennen. Jüngste Studien haben die Machbarkeit der Herstellung von selbstorganisierenden Herzorganoiden zur Untersuchung der Herzentwicklung in vitro gezeigt. Diese Modelle umfassen die Verwendung von embryonalen Stammzellen der Maus (mESCs) zur Modellierung der frühen Herzentwicklung16,17 bis zur atrioventrikulären Spezifikation18 und humaner pluripotenter Stammzellen (hPS-Zellen) zur Erzeugung von Multikeimschicht-Herz-Endoderm-Organoiden19 und Kammernnieren20 mit hochkomplexer zellulärer Zusammensetzung.
Dieser Beitrag stellt ein neuartiges 3-stufiges WNT-Modulationsprotokoll vor, um hochkomplexe hHOs effizient und kostengünstig zu erzeugen. Organoide werden in 96-Well-Platten erzeugt, was zu einem skalierbaren Hochdurchsatzsystem führt, das leicht automatisiert werden kann. Diese Methode beruht auf der Erstellung von hPSC-Aggregaten und der Auslösung von Entwicklungsschritten der Kardiogenese, einschließlich der Mesoderm- und Herzmesodermbildung, der ersten und zweiten Herzfeldspezifikation, der Proepikardorganbildung und der atrioventrikulären Spezifikation. Nach 15 Tagen der Differenzierung enthalten hHOs alle wichtigen Zelllinien im Herzen, gut definierte innere Kammern, vorhofische und ventrikuläre Kammern und ein vaskuläres Netzwerk im gesamten Organoid. Dieses hochentwickelte und reproduzierbare Herzorganoidsystem ist für die Untersuchung struktureller, funktioneller, molekularer und transkriptomischer Analysen bei der Untersuchung der Herzentwicklung und von Krankheiten sowie des pharmakologischen Screenings geeignet.
Protokoll
1. hPSC-Kultur und -Wartung
HINWEIS: Die humanen induzierten PSCs (hiPS-Zellen) oder humanen embryonalen Stammzellen (hES-Zellen) müssen nach dem Auftauen für mindestens 2 aufeinanderfolgende Passagen kultiviert werden, bevor sie zur Erzeugung von EBs zur Differenzierung oder weiteren Kryokonservierung verwendet werden. hPS-Zellen werden in PSC-Medium (siehe Materialtabelle) auf Basalmembran-extrazellulären Matrix (BM-ECM)-beschichteten 6-Well-Kulturplatten kultiviert. Wenn Sie Mediumwechsel an hPSCs in 6-Well-Platten durchführen, fügen Sie das Medium direkt auf der Innenseite des Wells hinzu und nicht direkt auf den Zellen, um unerwünschte Zellablösung oder Stress zu verhindern. Benutzer sollten sich vor der Vorwärmung von PSC-Medien hüten, die nicht bei 37 ° C erwärmt werden sollten. Alle in diesem Protokoll verwendeten PSC-Medien waren thermostabil.
- Um die Well-Platten mit dem BM-ECM zu beschichten, tauen Sie einen Aliquot des BM-ECM (gemäß Herstellerangaben bei -20 °C gelagert) auf Eis auf und mischen Sie 0,5 mg des BM-ECM mit 12 ml kaltem Dulbecco's modifiziertem Eagle's Medium (DMEM)/F12 Medium (gelagert bei 4 °C). Verteilen Sie 2 ml des DMEM/F12-BM-ECM-Gemisches auf jede Vertiefung einer 6-Well-Platte und inkubieren Sie bei 37 °C für mindestens 2 h.
- Um die Zellen aufzutauen, tauen Sie zunächst das hPSC-Kryovial in einem 37 °C warmen Perlen- oder Wasserbad für 1-2 min auf, bis nur noch eine geringe Menge Eis sichtbar ist. Übertragen Sie die aufgetauten Zellen in ein Zentrifugenröhrchen und geben Sie langsam 8-9 ml des PSC-Mediums hinzu, das mit 2 μM des ROCK-Inhibitors Thiazovivin (Thiaz) ergänzt wird, und zentrifugieren Sie bei 300 × g für 5 min. Entfernen Sie den Überstand und resuspenieren Sie das Zellpellet im PSC-Medium, das mit 2 μM Thiaz ergänzt wird. Verteilen Sie die Zellen im Kulturmedium in 1-2 Vertiefungen in Abhängigkeit von der kryovialen Zellkonzentration und Kultur bei 37 °C, 5% CO2 für 24 h, bevor das PSC-Medium gewechselt wird.
- Wechseln Sie das Medium auf den Zellen in 48-Stunden-Intervallen. Führen Sie Waschungen und Mediumwechsel mit DMEM/F12 (1 ml/Well) bzw. dem PSC-Medium (2 ml/Well) durch.
HINWEIS: Waschungen helfen, Zellabfälle und -ablagerungen zu entfernen, während frische Medienwechsel die Zellen mit einer erneuerten Nährstoffquelle versorgen. - Passieren Sie die Zellen bei Unterfluenz (60-80% Konfluent) durch Absaugen des Mediums und waschen Sie dann jede Vertiefung mit 1 ml 1x Dulbecco's phosphatgepufferter Lösung (kein Kalzium, kein Magnesium; DPBS). Aspirieren Sie das DPBS und geben Sie 1 ml des Dissoziationsreagenzes für hPS-Zellen hinzu (siehe Tabelle der Materialien), gefolgt von der Aspiration aller bis auf einen dünnen Film des Reagenzes nach 10 s.
- 2-5 min mit dem dünnen Film des Dissoziationsreagenzes für hPS-Zellen inkubieren, bis sich Lücken zwischen den Zellen bilden.
HINWEIS: Der Zeitpunkt, um die Dissoziation zu stoppen, ist zelllinienabhängig. - 1 ml des PSC-Mediums, ergänzt mit 2 μM Thiaz (PSC-Medium + Thiaz), in die Vertiefung geben und vorsichtig auf die Platte klopfen, um eine Zellablösung zu induzieren. Pipettieren Sie die abgelösten Zellen im Medium 1-2 mal, um große Kolonien aufzubrechen, und resuspenieren Sie die Zellen in PSC-Medium + Thiaz in einem 1: 6-Well-Verhältnis (Zellen aus 1 Well resuspendiert in 12 ml Kulturmedium). Replatieren Sie die Zellen auf BM-ECM-beschichteten Vertiefungen.
2. Erzeugung von 3D-selbstorganisierenden menschlichen Herzorganoiden
- Embryoide Körperbildung (EB):
HINWEIS: Es ist unerlässlich, beobachtbare differenzierte Zellen vor der embryonalen Körperbildung zu begrenzen. Zwei bis drei Vertiefungen einer 6-Well-Platte mit einer Konfluenz von 60-80% ergeben genügend Zellen für eine einzelne 96-Well-Platte mit Organoiden. Alle Medien sollten aliquotediert und in einem 37 °C-Perlen- oder Wasserbad erwärmt werden, bevor sich das Medium ändert, um den Temperaturschock auf die EBs oder Organoide zu minimieren (dies gilt nicht für Zelldissoziationsreagenzienz). Siehe Abbildung 1A,b.- Tag -2
- Um EBs zu erzeugen, waschen Sie am Tag -2 subkonfluente hPSCs (60-80% konfluent) mindestens 10 s lang mit DPBS, um Zellabfälle zu waschen und das DPBS abzusaugen.
- Um die Zellen zu lösen und in einen Einzelzellzustand zu entlassen, geben Sie 1 ml Zelldissoziationsreagenz bei Raumtemperatur (siehe Materialtabelle) für 3-6 min in jede Vertiefung. Klopfen Sie vorsichtig ~ 5 Mal pro Minute auf die Platte, um eine Ablösung zu induzieren, während Sie unter dem Mikroskop nachsehen. Fügen Sie 1 ml PSC-Medium + Thiaz hinzu, um die Reaktion zu stoppen.
- Um die Zellen zu sammeln und alle verbleibenden Aggregate aufzubrechen, pipettieren Sie das Medium 2-3 Mal in der Vertiefung auf und ab, um eine Einzelzellsuspension zu erzeugen. Die Einzelzellsuspension in ein Zentrifugenröhrchen geben und 5 min bei 300 × g drehen.
- Um die gewünschte Zellkonzentration zu erhalten, verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 1 ml PSC-Medium + Thiaz. Zählen Sie die Zellen mit einem Zellzähler oder Hämozytometer und verdünnen Sie die Zellen in PSC-Medium + Thiaz auf eine Konzentration von 100.000 Zellen / ml.
- Um die Zellen für die EB-Bildung zu verteilen, verwenden Sie eine Mehrkanalpipette, um 100 μL (10.000 Zellen) zu jeder Vertiefung einer runden, extrem niedrigen Befestigungsplatte mit 96 Well hinzuzufügen. Zentrifugieren Sie die Platte bei 100 × g für 3 min und inkubieren Sie für 24 h bei 37 °C, 5% CO2.
- Tag -1
- Entfernen Sie vorsichtig 50 μL Medium aus jeder Vertiefung und fügen Sie 200 μL frisches PSC-Medium hinzu, das auf 37 ° C erwärmt wurde, um ein Endvolumen von 250 μL pro Vertiefung zu erhalten. Inkubieren Sie die Zellen für 24 h bei 37 °C, 5% CO2.
HINWEIS: Entfernen Sie das Medium und fügen Sie es vorsichtig an der Seite des Bohrlochs hinzu, um die EBs am Boden des Brunnens nicht zu stören. Aufgrund der empfindlichen Natur der EBs und der Suspensionskultur ist es notwendig, beim Wechsel des Mediums ein kleines Flüssigkeitsvolumen in jeder Vertiefung zu belassen, um eine Störung der EBs zu vermeiden.
- Entfernen Sie vorsichtig 50 μL Medium aus jeder Vertiefung und fügen Sie 200 μL frisches PSC-Medium hinzu, das auf 37 ° C erwärmt wurde, um ein Endvolumen von 250 μL pro Vertiefung zu erhalten. Inkubieren Sie die Zellen für 24 h bei 37 °C, 5% CO2.
- Tag -2
- Human Heart Organoid (hHO) Differenzierung:
HINWEIS: Alle Medien sollten vor einem Medienwechsel in einem 37 °C warmen Perlen- oder Wasserbad erwärmt werden. Entfernen und fügen Sie Medium vorsichtig auf der Seite des Brunnens hinzu, um die sich entwickelnden Organoide am Boden des Brunnens nicht zu stören. Zwischen den Medienwechseln sind keine Wäschen erforderlich, um die Unruhe zu minimieren und die allmähliche Entfernung von Inhibitoren und Wachstumsfaktoren zu ermöglichen. RPMI mit 2% B-27 Ergänzung (Tabelle der Materialien) wurde während des gesamten Differenzierungsprotokolls verwendet. B-27 Ergänzung enthält Insulin, sofern nicht angegeben (insulinfrei in den Tagen 0-5). Siehe Abbildung 1C.- Tag 0
- Um die Differenzierung in Richtung einer Mesodermlinie einzuleiten, entfernen Sie 166 μL Medium aus jedem Bohrloch (~ 2/3 des gesamten Bohrlochvolumens) und fügen Sie 166 μL RPMI 1640 hinzu, das insulinfreies B-27-Präparat, 6 μM CHIR99021, 1,875 ng / ml knochenmorphogenetisches Protein 4 (BMP4) und 1,5 ng / ml Activin A für eine endgültige Bohrlochkonzentration von 4 μM CHIR99021 enthält. 1,25 ng/ml BMP4 und 1 ng/ml Activin A. 24 h bei 37 °C, 5 % CO2, inkubieren.
- Tag 1
- Entfernen Sie 166 μL Medium aus jeder Vertiefung und fügen Sie 166 μL frische RPMI 1640 mit insulinfreiem B-27-Präparat hinzu. 24 h bei 37 °C inkubieren, 5% CO2.
- Tag 2
- Um die Spezifikation des Herzmesosderms zu induzieren, entfernen Sie 166 μL Medium aus jeder Vertiefung und fügen Sie 166 μL RPMI 1640 mit insulinfreiem B-27-Präparat und 3 μM Wnt-C59 für eine endgültige Well-Konzentration von 2 μM Wnt-C59 hinzu. Inkubieren Sie für 48 h bei 37 °C, 5% CO2.
- Tag 4
- Entfernen Sie 166 μL Medium aus jeder Vertiefung und fügen Sie 166 μL frische RPMI 1640 mit insulinfreiem B-27-Präparat hinzu. 48 h bei 37 °C inkubieren, 5% CO2.
- Tag 6
- Entfernen Sie 166 μL Medium aus jeder Vertiefung und fügen Sie 166 μL RPMI 1640 mit B-27 Ergänzung hinzu. 24 h bei 37 °C inkubieren, 5% CO2.
- Tag 7
- Um die proepikardiale Differenzierung zu induzieren, entfernen Sie 166 μL Medium aus jeder Vertiefung und fügen Sie 166 μL frische RPMI 1640 mit B-27 Ergänzung und 3 μM CHIR99021 für eine endgültige Bohrlochkonzentration von 2 μM CHIR99021 hinzu. 1 h bei 37 °C, 5% CO2 inkubieren.
- Entfernen Sie 166 μL Medium aus jeder Vertiefung und fügen Sie 166 μL frische RPMI 1640 mit B-27 Ergänzung hinzu. 48 h bei 37 °C inkubieren, 5% CO2.
HINWEIS: Bei diesem zweiten Mediumwechsel an Tag 7 ist besondere Vorsicht geboten, da die Organoide aufgrund der Medienwechsel anfälliger für Bewegungen sind. - Führen Sie ab Tag 7 bis zur Entnahme oder Übertragung für Analysen oder Experimente alle 48 h Mittelwechsel durch, indem Sie 166 μL Medium aus jeder Vertiefung entfernen und 166 μL frische RPMI 1640 mit B-27-Ergänzung hinzufügen.
HINWEIS: Organoide sind am Tag 15 für Analysen und Experimente bereit, es sei denn, frühere Entwicklungsstadien sind von Interesse. Sie können nach Tag 15 für langfristige Kultur- oder Reifungsexperimente kultiviert werden.
- Tag 0
3. Organoidanalyse
- Übertragung ganzer Organoide (lebend oder fixiert)
HINWEIS: Stellen Sie bei der Übertragung von Live-Organoiden sicher, dass die verwendeten Pipettenspitzen steril sind.- Schneiden Sie die Spitze von einer P200-Pipettenspitze 5-10 mm von der Spitzenöffnung ab, was zu einer breiten Öffnung von ~ 2-3 mm Durchmesser führt.
- Führen Sie die Spitze gerade in den runden Bodenschacht ein, der das Organoid enthält, so dass die Pipette vollständig vertikal (senkrecht zur Platte) ist. Stellen Sie sicher, dass der Pipettenkolben bereits vollständig gedrückt ist, bevor Sie die Spitze in das Medium einführen.
- Lassen Sie den Pipettenkolben langsam los und nehmen Sie genügend Medium (100-200 μL) auf, um das Organoid zu sammeln.
- Übertragen Sie das Organoid im Medium zum Zielort (z. B. zur Fixierung, Live-Bildgebung, elektrophysiologischen Aufzeichnung, neuen Plattenkultur).
- Fixierung von Organoiden
HINWEIS: Das Fixieren und Färben von Organoiden kann entweder in der 96-Well-Kulturplatte oder in den Mikrozentrifugenröhrchen erfolgen. Paraformaldehyd (PFA) sollte nur in einem Abzug gehandhabt werden.- Zur Fixierung in Mikrozentrifugenröhrchen werden lebende Organoide in separate Röhrchen mit 1-8 Organoiden pro Röhrchen übertragen.
HINWEIS: Überschreiten Sie nicht 8 Organoide pro Röhrchen. - Entfernen und entsorgen Sie vorsichtig so viel Medium wie möglich aus der Röhre, ohne die Organoide zu berühren.
- Fügen Sie 4% PFA zu jedem Röhrchen oder Bohrloch hinzu (300-400 μL pro Mikrozentrifugenröhrchen und 100-200 μL pro Vertiefung einer 96-Well-Platte). Bei Raumtemperatur 30-45 min inkubieren.
HINWEIS: Inkubationszeiten über 1 h können Antigenentnahmeschritte erfordern und werden nicht empfohlen. - Entsorgen Sie die PFA sicher, ohne die Organoide zu stören. Führen Sie 3 Wäschen mit DPBS durch, ergänzt mit 1,5 g / L Glycin (DPBS / Gly), wobei Sie das gleiche Volumen verwenden, das für die 4% PFA verwendet wird, und warten Sie 5 Minuten zwischen den Wäschen. Entfernen Sie DPBS/Gly und fahren Sie mit Immunostaining oder anderen Analysen fort oder fügen Sie DPBS hinzu und lagern Sie es bei 4 °C für die zukünftige Verwendung für bis zu 2 Wochen.
HINWEIS: Die Lagerung fester Organoide länger als 2 Wochen kann zu Gewebeabbau und Kontamination führen und wird nicht empfohlen.
- Zur Fixierung in Mikrozentrifugenröhrchen werden lebende Organoide in separate Röhrchen mit 1-8 Organoiden pro Röhrchen übertragen.
- Immunfluoreszenzfärbung am gesamten Anbau
- 100 μL Blockierungs-/Permeabilisierungslösung (10% normales Eselserum + 0,5% Rinderserumalbumin (BSA) + 0,5% Triton X-100 in 1x DPBS) in jedes Bohrloch oder Röhrchen, das die fixierten Organoide enthält, gegeben. Bei Raumtemperatur über Nacht auf einem Shaker inkubieren.
HINWEIS: Überschreiten Sie nicht 8 Organoide pro Röhrchen. - Entfernen und verwerfen Sie vorsichtig so viel wie möglich von der blockierenden Lösung, ohne die Organoide zu berühren. Führen Sie 3 Wäschen mit DPBS durch und warten Sie 5 Minuten zwischen den Wäschen.
- Die primäre Antikörperlösung (1% normales Eselserum + 0,5% BSA + 0,5% Triton X-100 in 1x DPBS) mit den gewünschten primären Antikörpern in den empfohlenen Konzentrationen herstellen. Bei 4 °C für 24 h auf einem Shaker inkubieren.
- Entfernen und verwerfen Sie vorsichtig so viel wie möglich von der Antikörperlösung, ohne die Organoide zu berühren. Führen Sie 3 Wäschen mit DPBS durch und warten Sie 5 Minuten zwischen den Wäschen.
- Sekundäre Antikörperlösung (1% normales Eselserum + 0,5% BSA + 0,5% Triton X-100 in 1x DPBS) mit den gewünschten sekundären Antikörpern in den empfohlenen Konzentrationen herstellen. Wenn die Antikörper fluoreszierend markiert sind, inkubieren Sie bei 4 °C im Dunkeln (z. B. mit Aluminiumfolie bedeckt) für 24 h auf einem Shaker.
- Entfernen und verwerfen Sie vorsichtig so viel wie möglich von der Antikörperlösung, ohne die Organoide zu berühren. Führen Sie 3 Wäschen mit DPBS durch und warten Sie 5 Minuten zwischen den Wäschen.
- Bereiten Sie Dias mit Perlen (90-300 μm Durchmesser) vor, die in einem Montagemedium (siehe Materialtabelle) in der Nähe der Kanten des Objektträgers montiert sind, wo der Deckglas mit den Organoiden platziert wird.
HINWEIS: Es wird empfohlen, das Montagemedium um die Perlen trocknen zu lassen, bevor Sie fortfahren. Dadurch wird verhindert, dass sich die Perlen bewegen. Siehe Abbildung 2. - Übertragen Sie die gefärbten Organoide mit einer geschnittenen Pipettenspitze zwischen den Perlen auf den Objektträger, um den Abstand zu gewährleisten, um den Kontakt zwischen den Organoiden auf dem Objektträger zu vermeiden. Verwenden Sie die Ecke eines aufgerollten Labortuchs, um überschüssige Flüssigkeit um das Organoid vorsichtig zu entfernen.
- Bedecken Sie die Organoide mit einem Montage-Clearing-Medium (Fructose-Glycerin-Clearing-Lösung ist 60% (vol/vol) Glycerin und 2,5 M Fructose)37 unter Verwendung von 120-150 μL des Mounting-Clearing-Mediums pro Objektträger.
HINWEIS: Es wird empfohlen, eine geschnittene Pipettenspitze zu verwenden, wenn Sie mit dem Montage-Clearing-Medium arbeiten, da es sehr viskos ist. - Bewegen Sie den Deckglas über den Objektträger, wobei die Organoide mit einer Montage-Clearing-Lösung bedeckt sind, und drücken Sie den Deckglas langsam über den Objektträger, um sicherzustellen, dass sich die Organoide zwischen den montierten Perlen befinden.
- Versiegeln Sie den Umfang des Deckglases auf dem Objektträger mit Top-Coat-Nagellack. Lassen Sie den Objektträger 1 h im Dunkeln bei Raumtemperatur trocknen. Zur Langzeitlagerung bei 4 °C im Dunkeln lagern.
- 100 μL Blockierungs-/Permeabilisierungslösung (10% normales Eselserum + 0,5% Rinderserumalbumin (BSA) + 0,5% Triton X-100 in 1x DPBS) in jedes Bohrloch oder Röhrchen, das die fixierten Organoide enthält, gegeben. Bei Raumtemperatur über Nacht auf einem Shaker inkubieren.
- Transiente Kalziumbildgebung in lebenden Herzorganoiden
HINWEIS: Gemäß den Anweisungen des Herstellers wurde Fluo4-AM in Dimethylsulfoxid (DMSO) zu einer endgültigen Stammlösungskonzentration von 0,5 mM rekonstituiert. Fluo4-AM wurde direkt in die Organoidbohrung in der 96-Well-Platte gegeben.- Führen Sie 2 Wäschen an den Organoiden mit RPMI 1640 Medium durch.
- Entfernen Sie 166 μL des verbrauchten Mediums aus dem Brunnen.
- Fügen Sie 166 μL erwärmtes RPMI 1640-Medium hinzu, entfernen Sie 166 μL Medium und fügen Sie 166 μL frisches RPMI 1640-Medium hinzu.
HINWEIS: Die Wäschen werden durchgeführt, um Abfallmaterial und Zellabfälle zu entfernen. Zwei Drittel des Mediums werden während der Wäsche aus den Vertiefungen entfernt, um eine Störung der Organoide am Boden des Bohrlochs vor dem funktionellen Assay zu vermeiden.
- Fügen Sie Fluo4-AM Medium zu den Organoiden hinzu.
- Fügen Sie Fluo4-AM, rekonstituiert in DMSO, zu RPMI 1640 hinzu, das B-27-Präparat enthält, um eine 1,5 μM-Lösung herzustellen.
- Entfernen Sie 166 μL Medium aus dem Brunnen.
- 166 μL 1,5 μM Fluo4-AM in RPMI 1640 enthaltend B-27 Supplement für eine Endbohrlochkonzentration von 1 μM hinzufügen. Inkubieren bei 37 °C, 5% CO2 für 30 min.
- Führen Sie 2 Wäschen wie in Schritt 3.4.1 durch.
- Fügen Sie 166 μL RPMI 1640 enthaltende B-27-Ergänzung in die Vertiefung hinzu.
- Übertragen Sie das Organoid mit einer geschnittenen Spitze einer P200-Pipettenspitze in eine Glasboden-Petrischale (z. B. 8-Well-Kammer-Deckglas mit # 1.5 Hochleistungs-Deckglas) mit 100-200 μL Medium.
ANMERKUNG: Siehe Abschnitt 3.1 zur Übertragung ganzer Organoide. - Bild die Organoide leben unter einem Mikroskop mit einer temperatur- und CO2-gesteuerten Kammer bei 37 °C, 5% CO2.
- Nehmen Sie mehrere 10-20 s-Videos an verschiedenen Stellen im Organoid auf, die die Zunahme und Abnahme der Fluoreszenzintensität zeigen, wenn das Kalzium in die Zellen ein- und austritt.
HINWEIS: Für hochauflösende Aufnahmen wird empfohlen, mit einer Geschwindigkeit von 10 fps oder schneller aufzunehmen. 50 fps werden empfohlen. - Analysieren Sie die Videos mit einer Bildanalysesoftware (z. B. ImageJ), indem Sie Interessengebiete auswählen und die Intensität im Laufe der Zeit messen.
- Normalisieren Sie die Intensitätsaufzeichnungen mit ΔF/F0 im Vergleich zur Zeit in Millisekunden und plotten Sie.
- Führen Sie 2 Wäschen an den Organoiden mit RPMI 1640 Medium durch.
Ergebnisse
Um eine selbstorganisierende hHO in vitro zu erreichen, haben wir die zuvor beschriebenen Differenzierungsprotokolle für die 2D-Monolayer-Differenzierung von Kardiomyozyten21 und epikardialen Zellen22 unter Verwendung von Wnt-Signalwegmodulatoren und für präkardiale 3D-Organoide16 unter Verwendung der Wachstumsfaktoren BMP4 und Activin A modifiziert und kombiniert. wurden die Konzentrationen und Expositionsdauern des Wnt-Signalwegaktivators CHIR99021 optimiert, um hochreproduzierbare und komplexe hHOs aus menschlichen PSCs zu erhalten. hPS-Zellen oder hES-Zellen, die in PSC-Medium bis zu 60-80% Konfluenz in kolonieähnlicher Bildung mit minimaler bis keiner sichtbaren Differenzierung kultiviert wurden, sind ideal für die EB-Erzeugung (Abbildung 1B).
EBs durften 48 h lang mit einem mittleren Wechsel nach 24 h inkubieren, bevor sie am Tag 0 mit der Differenzierung begannen. Am Tag 0 sollten die EBs als dunkles sphärisches Aggregat in der Mitte jeder Vertiefung unter einem Lichtmikroskop erscheinen (Abbildung 1B). Das Differenzierungsprotokoll beginnt am Tag 0 mit der Aktivierung des Wnt-Signalwegs und der Zugabe des Wachstumsfaktors für genau 24 h. Diese Mesoderm-Induktion, gefolgt von einer kardialen Mesoderm-Induktion an Tag 2 unter Verwendung des Wnt-Signalweg-Inhibitors Wnt-C59, führt zu einer signifikanten Vergrößerung des Organoids von ~ 200 μm Durchmesser auf 500-800 μm Durchmesser an Tag 4 und auf bis zu 1 mm (Organoide können bis Tag 15 eine leichte Verringerung der Größe erfahren (Abbildung 1C)). Der hHO beginnt bereits am Tag 6 mit dem Schlagen (Video 1), wobei 100% der Organoide bis Tag 10 sichtbare Schläge zeigen (Video 2) (es sei denn, sie werden einer medikamentösen Behandlung unterzogen oder wenn unzureichende hPS-Zellen zur Erzeugung der EBs verwendet wurden). Dies wurde in 5 verschiedenen hPSC-Zelllinien beobachtet23.
Um die Fähigkeit der hHOs zu bewerten, verschiedene Schritte der physiologischen Entwicklung des Herzens darzustellen, sammelten wir Organoide zu verschiedenen Zeitpunkten während des Differenzierungsprotokolls und suchten nach dem Vorhandensein und der transkriptomischen Expression von Herzfeldmarkern. Die Immunfluoreszenzfärbung für den marker des ersten Herzfeldes (FHF), HAND1, und den zweiten Herzfeldmarker (SHF), HAND2, zeigte ihre kernare Präsenz in diesen kardialen Vorläuferzellen, die um Tag 3 bzw. Tag 5 entstanden (Abbildung 3A).
Die Expression beider Marker erfolgt an Regionen der Organoide, die nach Tag 7 für die FHF und nach Tag 9 für die SHF an Größe verlieren. Interessanterweise zeigten Bilder mit hoher Vergrößerung von Organoiden des Tages 7, dass die meisten HAND1-exprimierenden Zellen Kardiomyozyten im Ursprung waren (wie der Kardiomyozyten-spezifische Marker TNNT2 zeigt). Im Gegensatz dazu exprimierten viele der HAND2-exprimierenden Zellen den Kardiomyozytenmarker nicht (Abbildung 3B). Diese Beobachtung stimmt mit den präkardialen Organoiden überein, die von Maus-ES-Zellen abgeleitet wurden und die Entwicklung von Nicht-Myozytenzellen aus SHF-Vorläuferzellen zeigen16. Es ist wichtig zu beachten, dass die RNA-Sequenzierungsdaten zeigen, dass die RNA-Transkripte für HAND1 und HAND2 ab Tag 3 exprimiert wurden, wobei der FHF-Marker zwischen Tag 3 und 11 höher exprimiert wurde und der SHF-Marker nach Tag 13 höher exprimiert wurde (Abbildung 3C).
Die Immunfluoreszenzfärbung zeigte das Vorhandensein von Markern verschiedener zellartiger Linien, aus denen das menschliche Herz besteht. Myokardgewebe (identifizierbar mit dem Kardiomyozyten-spezifischen Marker TNNT2) angrenzend an epikardes Gewebe (markiert durch den nuklearen Transkriptionsfaktor WT1 und den Epithelmembranmarker TJP1) (Abbildung 4A). Endokardzellen, die NFATC1 exprimieren, wurden nachgewiesen, die die Wände von inneren kammerartigen Strukturen innerhalb der Organoide auskleiden (Abbildung 4B). Endothelzellen in einem gefäßartigen Netzwerk sind bereits am Tag 13 der Differenzierung zu sehen (Abbildung 4C). Schließlich berichten wir über das Vorhandensein von kardialen Fibroblasten, die im gesamten Organoid vermischt sind (Abbildung 4D). Diese Zelltypmarker wurden auch in den RNA-Seq-Genexpressionsprofilen beobachtet (Abbildung 4E). Die Zusammensetzung der Zelltypen in den Organoiden, gemessen nach Fläche des von ihnen besetzten Organoids, bestand aus ~ 58% Kardiomyozyten, wobei der Rest aus Nicht-Myozyten-Herzzellen bestand, einschließlich Epikardzellen (~ 15%), Endokardzellen (~ 13%), Herzfibroblasten (~ 12%) und Endothelzellen (~ 1%) (Abbildung 4F).
Die elektrophysiologische Funktion der Organoide wurde durch Live-Calcium-Bildgebung einzelner Zellen in ganzen Organoiden gemessen. Die Fluo-4-Fluoreszenzintensität variiert im Laufe der Zeit aufgrund des Eintritts und Austritts von Kalzium aus der Zelle und zeigt regelmäßige Aktionspotentiale (Abbildung 5A). Heatmaps, die Kalziumintensitäten über einem Bereich des Organoids mit hoher Vergrößerung zeigen, zeigen die erhöhte Intensität aufgrund von Kalziumtransienten in einzelnen Zellen (Abbildung 5B und Video 3).
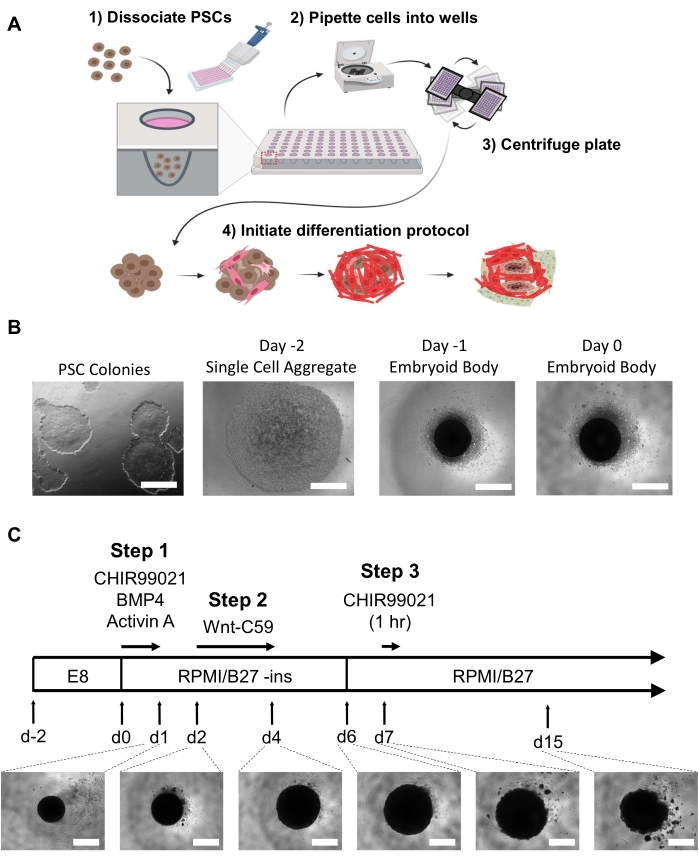
Abbildung 1: Embryoide Körpererzeugung und Herzorganoid-Differenzierungsschritte. (A) (1-2) Dissoziierte Zellen werden über eine Mehrkanalpipette in Vertiefungen einer 96-Well-Ultra-Low-Attachment-Platte ausgesät. (3) Die 96-Well-Platte wird dann zentrifugiert, wodurch die Zellen in der Mitte aggregieren können. (4) Im Laufe der Zeit beginnt sich der embryoide Körper nach Zugabe von Wachstumsfaktoren und Signalwegmodulatoren in mehrere Herzlinien zu differenzieren und räumlich und physiologisch relevante unterschiedliche Zellpopulationen zu bilden, die interne Mikrokammern umgeben. (B) Repräsentative Bilder des Fortschreitens der embryoiden Körpererzeugung, beginnend mit der 2-dimensionalen iPSC-Kultur (links) und endend mit einem embryoiden Körper des Tages 0 (rechts); Skalenbalken = 500 μm. (C) Zusammenfassung des Protokolls zur Differenzierung der Organoide des menschlichen Herzens, einschließlich Modulatoren und Inhibitoren des chemischen Signalwegs mit den jeweiligen Zeitpunkten, Laufzeiten und der Entwicklung von Organoidbildern unter Lichtmikroskopie von Tag 1 bis Tag 15; Maßstabsleiste = 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
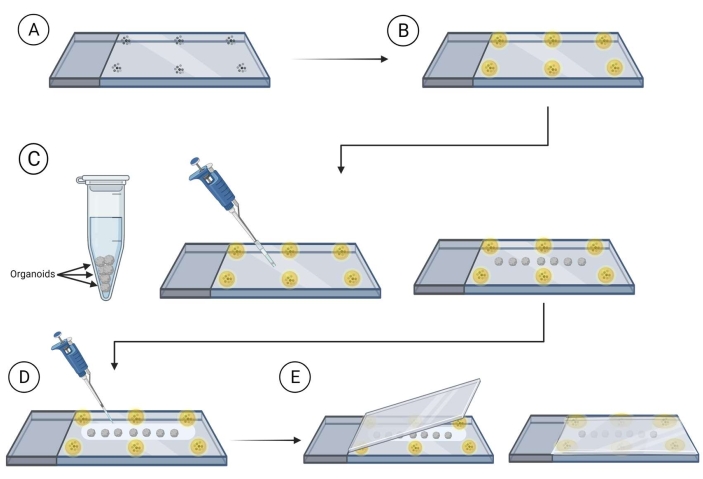
Abbildung 2: Gesamte Organoidmontage auf Objektträgern für die Bildgebung. Schritte zur Vorbereitung von Objektträgern und Zur Montage von Organoiden für die Bildgebung. (A) Platzierung von Mikrokügelchen auf der Peripherie eines Objektträgers aus Glas. (B) Abdecken der Mikrokügelchen mit Montagemedium. (C) Übertragung von Organoiden auf den Objektträger zwischen den Kügelchen und Entfernen überschüssiger Flüssigkeit, die die Organoide umgibt. (D) Abdeckung der Organoide mit Clearing-/Montagemedium. (E) Platzieren des Deckglases auf dem Objektträger mit Organoiden und Perlen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Erstes Herzfeld und zweites Herzfeldspezifikation in hHOs rekapituliert die physiologische entwicklung des menschlichen Herzens. (A) Konfokale Immunfluoreszenzbilder von Tag 3 bis Tag 11 hHOs, die die Bildung von FHF (HAND1, oben) und SHF (HAND2, unten) und Kardiomyozyten (TNNT2) und Kernfarbstoff DAPI zeigen; Skalenbalken = 500 μm. (B) Bilder mit hoher Vergrößerung von Organoiden des Tages 7, die die Kolokalisation von HAND1 und HAND2 mit dem Kardiomyozytenmarker TNNT2 zeigen; Skalenbalken = 50 μm. (C) RNA-Seq-Genexpressionsprofile des FHF-Markers HAND1 (rot) und des SHF-Markers HAND2 (blau) von Tag 0 bis Tag 19. Abkürzungen: hHOs = humane Herzorganoide; FHF = erstes Herzfeld; SHF = zweites Herzfeld; HAND = Herz- und Neuralleistenderivate exprimiert; TNNT2 = kardiales Troponin T2; DAPI = 4',6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: hHOs entwickeln mehrere Herzlinien. (A-D) Konfokale Immunfluoreszenzbilder von Tag 15 hHOs, die die Bildung von Kardiomyozyten (TNNT2) und die Färbung mit dem Kernfarbstoff DAPI in Nicht-Myozyten-Herzzellen zeigen. (A) Ganzes Organoid und hohe Vergrößerung des Epikardenmarkers WT1 (grün) und des Epithelmembranmarkers TJP1 (weiß), der epikardiale Zellen epithelialen Ursprungs auf und neben Myokardgewebe zeigt; Maßstabsbalken = 500 μm, Einschub = 50 μm. (B) Endokardmarker NFATC1 (grün) Ausdruck auf der Auskleidung von Kammern; Maßstabsbalken = 500 μm. (C) Endothelgefäßnetzwerk in hHOs dargestellt durch PECAM1 (grün). Maßstabsbalken = 500 μm. (D) Kardiale Fibroblastenmarker THY1 und VIM in Grün bzw. Weiß dargestellt, verteilt auf das Organoid. Skalenbalken = 500 μm. (E) RNA-Seq-Genexpressionsprofile der wichtigsten Zelltypen, die in den hHOs von Den Tagen 0 bis 19 der Differenzierung vorhanden sind. Abkürzungen: hHOs = humane Herzorganoide; TNNT2 = kardiales Troponin T2; DAPI = 4',6-Diamidino-2-phenylindol; WT1 = Wilms Tumor-1-Transkriptionsfaktor; NFATC1 = zytoplasmatischer Kernfaktor der aktivierten T-Zelle; PECAM1 = Thrombozyten-Endothelzelladhäsionsmolekül-1; VIM = Vimentin. (F) Kreisdiagramm der durchschnittlichen Gewebetypzusammensetzung in hHOs, berechnet als die prozentuale Fläche mit dem jeweiligen Zellmarker über ein gesamtes Organoid durch Kernfärbung über drei Z-Ebenen im gesamten Organoid unter Verwendung von ImageJ. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Fluo-4 Live Calcium Transient Recordings in Live Human Heart Organoids. (A) Repräsentative transiente Calciumaufnahmen einzelner Kardiomyozyten in ganzen Organoiden. (B) Heatmap mit niedrigen und maximalen Calciumspiegeln zwischen den Aktionspotentialen, bestimmt durch die Fluo-4-Intensität; Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Live-Bildgebung von repräsentativem Organoid aus hPS-Zellen am Tag 6 der Differenzierung unter Lichtmikroskopie bei Raumtemperatur. Abkürzung: hPSC = human pluripotente Stammzelle. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Live-Bildgebung von repräsentativem Organoid aus hPS-Zellen am Tag 15 der Differenzierung unter Lichtmikroskopie bei Raumtemperatur. Abkürzung: hPSC = human pluripotente Stammzelle. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 3: Live-Aufnahme von Tag 10 Organoid mit Heatmap von Kalziumtransienten unter einem Fluoreszenzmikroskop. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Jüngste Fortschritte bei aus menschlichen Stammzellen gewonnenen Kardiomyozyten und anderen Zellen kardialen Ursprungs wurden verwendet, um die menschliche Herzentwicklung zu modellieren22,24,25 und Krankheit26,27,28 und als Werkzeuge zum Screening von Therapeutika29,30 und toxischen Wirkstoffen31,32 . Hier berichten wir über ein einfach zu implementierendes, hochgradig reproduzierbares Protokoll zur Generierung und Differenzierung von EBs zu hochkomplexen hHOs. Dieses Protokoll war in mehreren Zelllinien, einschließlich hPSCs und hESCs23, erfolgreich und zeigte konsistente Schlagfrequenzen und Zelltyporganisation. Dieses Protokoll bezieht Aspekte aus zuvor beschriebenen Protokollen für die Kardiomyozytendifferenzierung24, epikardiale Zelldifferenzierung22 und präkardiale Organoide, die von Maus-ESCs16 abgeleitet wurden, und optimiert die schrittweise Modulation der kanonischen WNT-Signalgebung unter Verwendung chemischer Inhibitoren und Wachstumsfaktoren in einem vollständig definierten Medium. Bei der Erstellung dieses Protokolls wurden mehrere Optimierungsmethoden verwendet.
Erstens wurden die chemischen Inhibitorkonzentrationen und Expositionsdauern sowie die Zugabe von Wachstumsfaktoren für die 3D-Umgebung optimiert und in früheren Arbeiten23 diskutiert. Diese wurden optimiert, um Strukturen mit physiologischer Komplexität und Repräsentation des menschlichen In-vivo-Herzens aufzuklären, mit physiologischer Zusammensetzung und Verhältnissen von Kardiomyozyten zu nicht-myozyten Herzzelltypen (epikardiale Zellen, kardiale Fibroblasten). Zweitens ermöglicht die Zweidrittel-Mittelwechselstrategie eine minimale Bewegung der EBs / Organoide, da sie in der Nähe des Bodens des Bohrlochs in Suspension sitzen, und erleichtert gleichzeitig eine Gradientenexposition gegenüber chemischen Inhibitoren und Wachstumsfaktoren, wenn das Medium aufgefrischt wird. Die Kombination der kardialen Mesodermdifferenzierung durch Wnt-Signalwegaktivierung, gefolgt von Inhibition24, und der anschließenden Induktion der proepikarden Spezifikation über eine zweite Wnt-Signalwegaktivierung22 ermöglicht ein einziges Protokoll, um hochkomplexe hHOs zu erhalten. Die Organoide wachsen nach 15 Tagen Differenzierung bis zu 1 mm und können leicht für lebende oder stationäre Analysen und Assays übertragen werden. Drittens wurde angesichts der größe der Organoide die Verwendung von Mikrokügelchen oder anderen ähnlichen Strukturen zur Aufrechterhaltung des Raums zwischen dem Objektträger und dem Deckglas gefunden, um die 3D-Struktur der Organoide besser zu erhalten und den Bildgebungsprozess zu verbessern.
Dieses sich entwickelnde menschliche Herzmodell ermöglicht den Zugang zu ansonsten unzugänglichen Stadien der Herzentwicklung, wie z. B. der frühen ersten und zweiten Herzfeldspezifikation, die zwischen den Tagen 3 und 9 der Differenzierung beobachtet wurde, und der Organisation in kardiale Vorläuferzellen, die Herzgewebe hervorbringen, einschließlich Myokard, Endokard, Epikard, Endothelgefäße und unterstützende Herzfibroblasten, die am Tag 15 der Differenzierung beobachtet wurden. Die Gewebetypen, die in den aus diesem Protokoll abgeleiteten Herzorganoiden vorhanden sind, sind sowohl in der Zusammensetzung33 als auch im transkriptomischen Profil sehr repräsentativ für das menschliche fetale Herz23,34. Sie können daher Gewebe-Gewebe- und Zell-Zell-Interaktionen höherer Ordnung ermöglichen, die denen des in vivo-Herzens ähneln. Dieses Protokoll war hocheffizient und reproduzierbar über Experimente und Zelllinien hinweg und ergab Organoide, die hauptsächlich aus Kardiomyozyten bestehen und Nicht-Myozyten-Herzzellen wie Epikardzellen, Endokardzellen, Herzfibroblasten und Endothelzellen umfassen, die die physiologische Zusammensetzung darstellen23,33,35.
Analysen der Ultrastruktur der sich bildenden Kardiomyozyten mittels Transmissionselektronenmikroskopie und die Entwicklung von Kammern und einem vaskulären Netzwerk mittels optischer Kohärenztomographie und konfokaler Bildgebung werden in früheren Arbeiten ausführlich diskutiert23. Ein großer Vorteil dieses Herzorganoid-Protokolls gegenüber anderen kürzlich veröffentlichten bestehenden Protokollen17,18,19,20,36,37 ist die robuste Bildung eines Endothelnetzwerks im gesamten Organoid, das die Fähigkeit ermöglicht, die vaskuläre Entwicklung und Krankheit im frühen menschlichen Herzen zu untersuchen, ohne dass weitere externe Induktionen des Protokolls erforderlich sind. Schließlich ist die funktionelle Analyse der Herzorganoide durch verschiedene Ansätze erreichbar, einschließlich der Verwendung eines kalziumempfindlichen Farbstoffs, um die Kalziumtransienten in den Kardiomyozyten über das Organoid zu verfolgen. Mittels hochauflösender Mikroskopie haben wir die Fluoreszenzintensität von Kalzium, das in Zellen ein- und austritt, aufgezeichnet und hoch repräsentative Aktionspotentiale beobachtet. Weitere mögliche Methoden der Funktionsanalyse sind die Verwendung einer transgenen Linie mit einem Calcium-sensitiven Indikator oder die direkte Aufzeichnung mit einem Mikroelektrodenarray23.
Die hier beschriebenen Herzorganoide rekapitulativ für das sich entwickelnde menschliche fetale Herz, sind jedoch nur begrenzt in der Demonstration reiferer, erwachsenenähnlicher Merkmale. Zukünftige Protokolle können auf dem hier beschriebenen Protokoll aufbauen, um die Reifung dieser Organoide zu induzieren und Konstrukte zu liefern, die das Herz des Erwachsenen besser modellieren. Darüber hinaus ist dieses Protokoll darauf ausgelegt, Miniaturmodelle des menschlichen Herzens zu erstellen, und beschränkt sich auf Forschungsstudien zur Entwicklung und Erkrankung des Herzens oder für das pharmazeutische Screening und ist möglicherweise nicht als Mittel zur klinischen Intervention wie dem Ersatz von Herzgewebe durch Transplantation geeignet. Insgesamt beschreiben wir hier ein einfach zu befolgendes und kostengünstiges Protokoll zur Erzeugung hochreproduzierbarer und hochentwickelter menschlicher Herzorganoide, die Forschungsstudien in den Bereichen menschliche Herzentwicklung, Krankheitsätiologie und pharmakologisches Screening erleichtern können.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Diese Arbeit wurde vom National Heart, Lung, and Blood Institute der National Institutes of Health unter den Award-Nummern K01HL135464 und R01HL151505 und von der American Heart Association unter der Award-Nummer 19IPLOI34660342 unterstützt. Wir danken dem MSU Advanced Microscopy Core und Dr. William Jackson von der MSU Abteilung für Pharmakologie und Toxikologie für den Zugang zu konfokalen Mikroskopen, dem IQ Microscopy Core und dem MSU Genomics Core für Sequenzierungsdienste. Wir möchten uns auch bei allen Mitgliedern des Aguirre Lab für ihre wertvollen Kommentare und Ratschläge bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
Referenzen
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593 (2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215 (2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723 (2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098 (2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94 (2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4 (2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140 (2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283 (2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003 (2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142 (2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538 (2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten