Method Article
产生来自多能干细胞的自组装人心脏类器官
摘要
在这里,我们描述了一种方案,通过自组织有效地使用人类多能干细胞来创建与发育相关的人类心脏类器官(hHO)。该协议依赖于发育线索的顺序激活,并产生高度复杂,功能相关的人体心脏组织。
摘要
研究人类心脏在健康和疾病中发育的能力受到 在体外模拟人类心脏复杂性的能力的高度限制。开发更有效的器官样平台,可以模拟复杂的 体内 表型,如类器官和器官芯片,将增强研究人类心脏发育和疾病的能力。本文描述了一种方案,通过使用人类多能干细胞的自组织和使用小分子抑制剂逐步激活发育途径来产生高度复杂的人心脏类器官(hHO)。胚胎体(EB)在具有圆底,超低附着孔的96孔板中产生,促进个体化结构的悬浮培养。
EB通过三步Wnt信号调节策略分化为hHO,该策略涉及初始Wnt通路激活以诱导心脏中胚层命运,第二步Wnt抑制以创建确定的心脏谱系,以及第三个Wnt激活步骤以诱导心前器官组织。这些步骤以96孔的形式进行,效率高,可重复,每次运行产生大量类器官。通过免疫荧光成像从第3天到第11天的分化分析揭示了第15天hHO内的第一和第二心场规格和高度复杂的组织,包括具有心房和心室心肌细胞区域的心肌组织,以及衬有心内膜组织的内腔。类器官还在整个结构和心外膜组织的外衬里中表现出复杂的血管网络。从功能的角度来看,hHO具有强大的水平,并表现出由Flu-4活体成像确定的正常钙活性。总体而言,该协议构成了人体器官样心脏组织 体外 研究的坚实平台。
引言
先天性心脏缺陷(CHDs)是人类最常见的先天性缺陷类型,影响约1%的活产1,2,3。在大多数情况下,冠心病的原因仍然未知。在实验室中创建与发育中的人类心脏非常相似的人类心脏模型的能力是直接研究人类而不是代孕动物模型中CHDs的根本原因的重要一步。
实验室培养的组织模型的缩影是类器官,类似于细胞组成和生理功能中感兴趣的器官的3D细胞结构。类器官通常来自干细胞或祖细胞,并已成功用于模拟许多器官,如脑4,5,肾6,7,肠8,9,肺10,11,肝脏12,13和胰腺14,15,仅举几例。最近的研究表明,创造自组装心脏类器官在体外研究心脏发育是可行的。这些模型包括使用小鼠胚胎干细胞(mESCs)对早期心脏发育进行建模16,17直至房室规格18,并使用人类多能干细胞(hPSCs)来生成具有高度复杂细胞组成的多生殖层心内胚类器官19和腔室心形体20。
本文提出了一种新颖的3步WNT调制方案,以高效且具有成本效益的方式生成高度复杂的hHO。类器官在96孔板中生成,从而形成一个可扩展的高通量系统,可以轻松自动化。该方法依赖于创建hPSC聚集体并触发心脏发生的发育步骤,包括中胚层和心脏中胚层形成,第一和第二心场规范,心前器官形成和房室规范。分化15天后,hHO包含心脏中发现的所有主要细胞谱系,明确定义的内腔,心房和心室腔以及整个类器官的血管网络。这种高度复杂且可重复的心脏类器官系统适合在心脏发育,疾病和药理学筛查研究中研究结构,功能,分子和转录组学分析。
研究方案
1. hPSC培养与维护
注意:人诱导的PSCs(hiPSCs)或人胚胎干细胞(hESCs)在解冻后需要培养至少连续传代2次,然后才能用于产生EB进行分化或进一步冷冻保存。hPSCs在PSC培养基(见 材料表)中基底膜 - 细胞外基质(BM-ECM)包被的6孔培养板上培养。当在6孔板中的hPSCs上进行培养基更换时,将培养基直接添加到孔的内侧,而不是直接在细胞顶部,以防止不必要的细胞脱离或应激。用户应警惕不应在37°C下加热的预热PSC介质;该协议中使用的所有PSC介质都是耐高温的。
- 要用BM-ECM涂覆孔板,请在冰上解冻一个等分试样的BM-ECM(根据制造商的说明储存在-20°C),并将0.5mg的BM-ECM与12 mL冷的Dulbecco改性Eagle培养基(DMEM)/ F12培养基(储存在4°C下)混合。将2mL的DMEM / F12-BM-ECM混合物分配到6孔板的每个孔上,并在37°C下孵育至少2小时。
- 为了解冻细胞,首先,在37°C的珠子或水浴中解冻hPSC冷冻管1-2分钟,直到只有少量的冰可见。将解冻的细胞转移到离心管中,缓慢加入8-9mL补充有2μMROCK抑制剂噻唑维素(噻唑嗪)的PSC培养基,并以300× g 离心5分钟。除去上清液并将细胞沉淀重悬于补充有2μM噻唑的PSC培养基中。根据冷冻细胞浓度将培养基中的细胞分配到1-2个孔中,并在37°C,5%CO 2 下培养24小时,然后更换PSC培养基。
- 每隔48小时更换细胞上的培养基。分别使用 DMEM/F12(1 mL/孔)和 PSC 培养基(2 mL/孔)进行洗涤和培养基更换。
注意:洗涤有助于去除细胞废物和碎屑,而新鲜的培养基变化为细胞提供了新的营养来源。 - 通过吸气培养基在亚汇合(60-80%汇合)时使细胞通过,然后用1mL的1x Dulbecco的磷酸盐缓冲溶液(无钙,无镁;DPBS)。吸出DPBS并加入1mL用于hPSCs的解离试剂(见 材料表),然后在10秒后抽吸除试剂薄膜以外的所有试剂。
- 用hPSCs解离试剂的薄膜孵育2-5分钟,直到细胞之间形成间隙。
注意:停止解离的时间取决于细胞系。 - 向孔中加入1mL补充有2μM噻唑(PSC培养基+噻唑)的PSC培养基,轻轻敲击板以诱导细胞脱离。将分离的细胞移液至培养基中1-2次以分解任何大菌落,并以1:6孔比例将细胞重悬于PSC培养基+噻嗪中(来自1孔的细胞重悬于12mL培养基中)。将细胞重新放在BM-ECM包被的孔上。
2. 生成3D自组装人心脏类器官
- 胚胎体(EB)形成:
注意:在胚胎样体形成之前,必须限制可观察到的分化细胞。汇合度为60-80%的6孔板的两到三孔将产生足够的细胞用于单个96孔类器官板。在进行任何培养基变化之前,所有培养基均应等分并在37°C的微珠或水浴中加热,以尽量减少对EB或类器官的温度冲击(这不包括细胞解离试剂)。参见 图1A,B。- 第-2天
- 为了产生EB,在第-2天,将亚汇合的hPSCs(60-80%汇合)与DPBS洗涤至少10秒,以洗涤任何细胞碎片并吸出DPBS。
- 为了分离细胞并将其释放到单细胞状态,向每个孔中加入1mL室温细胞解离试剂(见 材料表)3-6分钟。每分钟轻轻敲击板约5次,以诱导脱离,同时在显微镜下检查。加入1 mL PSC培养基+噻唑以停止反应。
- 为了收集细胞并分解任何剩余的聚集体,在孔中上下移取培养基2-3次以产生单细胞悬浮液。将单细胞悬浮液转移到离心管中,并在300× g下旋转5分钟。
- 为了获得所需的细胞浓度,弃去上清液并将细胞重悬于1mL PSC培养基+噻嗪中。使用细胞计数器或血细胞计数器计数细胞,并将PSC培养基+噻唑中的细胞稀释至100,000个细胞/ mL的浓度。
- 为了分配细胞以形成EB,使用多通道移液器向圆底超低连接96孔板的每个孔中加入100μL(10,000个细胞)。将板以100× g 离心3分钟,并在37°C,5%CO 2下孵育24小时。
- 第-1天
- 小心地从每个孔中取出50μL培养基,并加入200μL升温至37°C的新鲜PSC培养基,以达到每孔250μL的最终体积。将细胞在37°C,5%CO 2下孵育24小时。
注意:小心地取出并添加孔侧的介质,以避免干扰孔底部的EB。由于EB的微妙性质和悬浮培养物,在更换培养基时,有必要在每个孔中留下少量液体,以避免干扰EB。
- 小心地从每个孔中取出50μL培养基,并加入200μL升温至37°C的新鲜PSC培养基,以达到每孔250μL的最终体积。将细胞在37°C,5%CO 2下孵育24小时。
- 第-2天
- 人心脏类器官 (hHO) 分化:
注:在更换任何介质之前,所有培养基均应在37°C的珠子或水浴中加热。小心地取出并在孔的侧面添加培养基,以避免干扰孔底部发育中的类器官。在介质更换之间不需要洗涤,以尽量减少搅拌并允许逐渐去除抑制剂和生长因子。在整个分化方案中使用含有2%B-27补充剂的RPMI(材料表)。除非另有说明,否则B-27补充剂含有胰岛素(第0-5天无胰岛素)。参见 图1C。- 第 0 天
- 为了开始向中胚层谱系的分化,从每个孔中除去166μL培养基(约占总孔体积的2/3), 并加入166μL含有无胰岛素B-27补充剂的RPMI 1640,6μM CHIR99021,1.875ng / mL骨形态发生蛋白4(BMP4)和1.5ng / mL Activin A,最终孔浓度为4μM CHIR99021, 1.25 ng / mL BMP4和1 ng / mL Activin A.在37°C,5%CO 2下孵育24小时。
- 第 1 天
- 从每个孔中取出166μL培养基,加入166μL新鲜RPMI 1640和无胰岛素B-27补充剂。在37°C,5%CO 2下孵育24小时。
- 第 2 天
- 为了诱导心脏中胚层规格,从每个孔中取出166μL培养基,并加入166μL含有无胰岛素B-27补充剂的RPMI 1640和3μM Wnt-C59,最终孔浓度为2μM Wnt-C59。
- 第 4 天
- 从每个孔中取出166μL培养基,加入166μL新鲜RPMI 1640和无胰岛素B-27补充剂。在37°C,5%CO 2下孵育48小时。
- 第 6 天
- 从每个孔中取出166μL培养基,加入166μLRPMI 1640和B-27补充剂。在37°C,5%CO 2下孵育24小时。
- 第 7 天
- 为了诱导心前分化,从每个孔中取出166μL培养基,并加入166μL含有B-27补充剂的新鲜RPMI 1640和3μM CHIR99021,最终孔浓度为2μM CHIR99021。在37°C,5%CO 2下孵育1小时。
- 从每个孔中取出166μL培养基,并加入166μL含有B-27补充剂的新鲜RPMI 1640。在37°C,5%CO 2下孵育48小时。
注意:在第7天的第二次培养基更换时,建议格外小心,因为由于培养基的变化,类器官更容易运动。 - 从第7天开始,直到收集或转移用于分析或实验,每48小时进行一次培养基更换,从每个孔中取出166μL培养基,并加入166μL含有B-27补充剂的新鲜RPMI 1640。
注意:类器官在第15天准备好进行分析和实验,除非对早期发育阶段感兴趣。它们可以在第15天之后培养,用于长期培养或成熟实验。
- 第 0 天
3. 类器官分析
- 转移整个类器官(活的或固定的)
注意:对于活体类器官移植,请确保使用的移液器吸头是无菌的。- 将吸头从 P200 移液器吸头上切下,距吸头开口 5-10 mm,从而产生直径约为 2-3 mm 的宽开口。
- 将尖端直接插入含有类器官的圆底孔中,使移液器完全垂直(垂直于板)。在将吸头插入介质之前,请确保移液器柱塞已经完全按压。
- 缓慢释放移液器柱塞,吸收足够的培养基(100-200μL)以收集类器官。
- 将培养基中的类器官转移到目标目的地(例如,用于固定,实时成像,电生理学记录,新板培养)。
- 固定类器官
注意:固定和染色类器官可以在96孔培养板或微量离心管中进行。多聚甲醛(PFA)只能在通风橱中处理。- 为了固定在微量离心管中,将活体类器官转移到每管1-8个类器官的分离管中。
注意:每管不超过8个类器官。 - 小心地从管中取出并丢弃尽可能多的培养基,不要接触类器官。
- 向每个试管或孔中加入4%PFA(每个微量离心管300-400μL,96孔板每孔100-200μL)。在室温下孵育30-45分钟。
注意:孵育时间超过1小时可能需要抗原检索步骤,不建议这样做。 - 安全地丢弃PFA而不干扰类器官。使用补充有1.5克/升甘氨酸(DPBS/Gly)的DPBS进行3次洗涤,使用与4%PFA相同的体积,在洗涤之间等待5分钟。除去DPBS / Gly并进行免疫染色或其他分析,或加入DPBS并在4°C下储存以备将来使用长达2周。
注意:储存固定的类器官超过2周可能会导致组织退化和污染,不建议这样做。
- 为了固定在微量离心管中,将活体类器官转移到每管1-8个类器官的分离管中。
- 全贴合免疫荧光染色
- 向含有固定类器官的每个孔或管中加入100μL封闭/透化溶液(10%正常驴血清+ 0.5%牛血清白蛋白(BSA)+ 0.5%Triton X-100,1x DPBS)。在室温下在摇摇杯上孵育过夜。
注意:每管不超过8个类器官。 - 小心地去除并丢弃尽可能多的封闭溶液,不要触摸类器官。用DPBS进行3次洗涤,两次洗涤之间等待5分钟。
- 以推荐浓度制备一抗溶液(1%正常驴血清+ 0.5%BSA + 0.5%Triton X-100,1x DPBS)和所需的一抗。在摇床上在4°C孵育24小时。
- 小心地取出并丢弃尽可能多的抗体溶液,不要接触类器官。用DPBS进行3次洗涤,两次洗涤之间等待5分钟。
- 以推荐浓度制备二抗溶液(1%正常驴血清+ 0.5%BSA + 0.5%Triton X-100,1x DPBS)和所需的二抗。如果抗体是荧光标记的,则在4°C的黑暗中(例如,用铝箔覆盖)在振荡器上孵育24小时。
- 小心地取出并丢弃尽可能多的抗体溶液,不要接触类器官。用DPBS进行3次洗涤,两次洗涤之间等待5分钟。
- 准备载玻片,将微珠(直径90-300μm)安装在安装介质(参见 材料表)中,靠近将放置带有类器官的盖玻片的边缘。
注意:建议在继续之前让珠子周围的安装介质干燥;这将防止珠子四处移动。参见 图2。 - 使用切割的移液器尖端将染色的类器官转移到载玻片上,在磁珠之间,确保间距以避免在载玻片上一旦类器官之间接触。使用卷起的实验室湿巾的一角小心地去除类器官周围的多余液体。
- 用安装清除介质(果糖 - 甘油清除溶液为60%(体积/体积)甘油和2.5M果糖)37 覆盖类器官,每张载玻片使用120-150μL的安装清除介质。
注意:使用安装清除介质时,建议使用切割的移液器吸头,因为它非常粘稠。 - 将盖玻片悬停在载玻片上,用安装清除溶液覆盖的类器官,然后将盖玻片缓慢地压在载玻片上,确保类器官位于安装的珠子之间。
- 使用面漆指甲油密封幻灯片上盖玻片的周边。让载玻片在室温下在黑暗中干燥1小时。在4°C的黑暗中储存以长期储存。
- 向含有固定类器官的每个孔或管中加入100μL封闭/透化溶液(10%正常驴血清+ 0.5%牛血清白蛋白(BSA)+ 0.5%Triton X-100,1x DPBS)。在室温下在摇摇杯上孵育过夜。
- 活心脏类器官中的钙瞬时成像
注:根据制造商的说明,将Fluo4-AM在二甲基亚砜(DMSO)中重组至最终储备溶液浓度为0.5mM。将Fluo4-AM直接添加到96孔板中的类器官孔中。- 使用RPMI 1640培养基对类器官进行2次洗涤。
- 从孔中取出166μL用过的培养基。
- 加入166μL加热的RPMI 1640培养基,除去166μL培养基,并加入166μL新鲜的RPMI 1640培养基。
注意:洗涤是为了去除废料和细胞碎屑。在洗涤过程中,从孔中除去三分之二的培养基,以避免在功能测定之前干扰孔底部的类器官。
- 将Fluo4-AM培养基加入类器官中。
- 将DMSO中复构的Fluo4-AM加入含有B-27补充剂的RPMI 1640中,以制备1.5μM溶液。
- 从孔中取出166μL培养基。
- 在含有B-27补充剂的RPMI 1640中加入166μL1.5μM氟4-AM,最终孔浓度为 1μM。
- 按照步骤3.4.1进行2次洗涤。
- 向孔中加入166μL含有B-27补充剂的RPMI 1640。
- 使用P200移液器吸头的切割尖端,将类器官转移到玻璃底培养皿(例如,带有#1.5高性能盖玻片的8孔盖玻片)中,并含有100-200μL培养基。
注意:参见关于转移整个类器官的第3.1节。 - 图像类器官生活在显微镜下,在37°C,5%CO2的温度和CO2控制室下。
- 在类器官的不同位置录制几个10-20秒的视频,显示钙进入和离开细胞时荧光强度水平的增加和减少。
注意:对于高分辨率录制,建议以10 fps或更快的速度录制;建议使用 50 fps。 - 使用图像分析软件(例如,ImageJ)通过选择感兴趣区域并测量随时间变化的强度水平来分析视频。
- 使用 ΔF/F0 与时间(以毫秒为单位)和绘图对强度记录进行归一化。
- 使用RPMI 1640培养基对类器官进行2次洗涤。
结果
为了在体外实现自组织hHO,我们使用Wnt通路调节剂修改和组合了先前描述的心肌细胞21和心外膜细胞22的2D单层分化方案,以及使用生长因子BMP4和Activin A的3D心前类器官16。,优化了Wnt途径激活剂CHIR99021的浓度和暴露持续时间,以产生来自人类PSC的高度可重复性和复杂的hHO.hPSCs或hESCs在PSC培养基中培养至60-80%的融合在集落样形成中,几乎没有可见的分化,是EB产生的理想选择(图1B)。
允许EB在24小时后更换培养基,孵育48小时,然后在第0天开始分化。在第0天,EB应在光学显微镜下在每个孔的中心显示为深色球形聚集体(图1B)。分化方案从第0天开始,Wnt途径激活和生长因子添加正好24小时。这种中胚层诱导,然后在第2天使用Wnt途径抑制剂Wnt-C59进行心脏中胚层诱导,将导致类器官在第4天从直径约200μm显着扩大到直径500-800μm,并高达1mm(类器官可能在第15天略微减小(图1C))。hHO最早将在第6天开始跳动(视频1),100%的类器官在第10天显示出可见的跳动(视频2)(除非接受药物治疗或如果使用不充分的hPSCs来产生EB)。这已经在5个不同的hPSC细胞系中观察到23。
为了评估hHO代表心脏生理发育各个步骤的能力,我们在整个分化方案中收集了不同时间点的类器官,并寻找心场标志物的存在和转录组表达。第一心场(FHF)标志物HAND1和第二心场(SHF)标志物HAND2的免疫荧光染色显示,它们分别存在于第3天和第5天左右的这些心脏祖细胞中(图3A)。
两种标志物的表达都发生在类器官的区域,FHF在第7天后和SHF的第9天后大小减小。有趣的是,第7天类器官的高放大图像显示,大多数表达HAND1的细胞起源于心肌细胞(如心肌细胞特异性标志物TNNT2所示)。相反,许多表达HAND2的细胞没有表达心肌细胞标志物(图3B)。这一观察结果与源自小鼠ESC的心前类器官一致,证明了SHF祖细胞中非肌细胞的发育16。值得注意的是,RNA测序数据显示,HAND1和HAND2的RNA转录本从第3天开始表达,FHF标记在第3天和第11天之间表达得更高,SHF标记在第13天后表达得更高(图3C)。
免疫荧光染色揭示了构成人类心脏的各种细胞类型谱系的标志物的存在。心肌组织(可使用心肌细胞特异性标志物TNNT2识别)与心外膜组织(由核转录因子WT1和上皮膜标志物TJP1标记)相邻(图4A)。检测到表达NFATC1的心内膜细胞衬里在类器官内腔室样结构壁上(图4B)。血管样网络中的内皮细胞早在分化的第13天就可以看到(图4C)。最后,我们报告了在整个类器官中混合的心脏成纤维细胞的存在(图4D)。在RNA-Seq基因表达谱中也观察到这些细胞类型标记(图4E)。通过它们所占据的类器官面积测量的类器官中细胞类型的组成发现约58%的心肌细胞,其余由非肌细胞心脏细胞组成,包括心外膜细胞(〜15%),心内膜细胞(〜13%),心脏成纤维细胞(〜12%)和内皮细胞(〜1%)(图4F)。
通过整个类器官中单个细胞的活钙成像测量类器官的电生理功能。由于钙从细胞中进入和退出,Flu-4荧光强度随时间而变化,揭示了规律的动作电位(图5A)。显示类器官高放大倍率区域钙强度的热图显示,由于单个细胞中的钙瞬变,强度增加(图5B 和 视频3)。
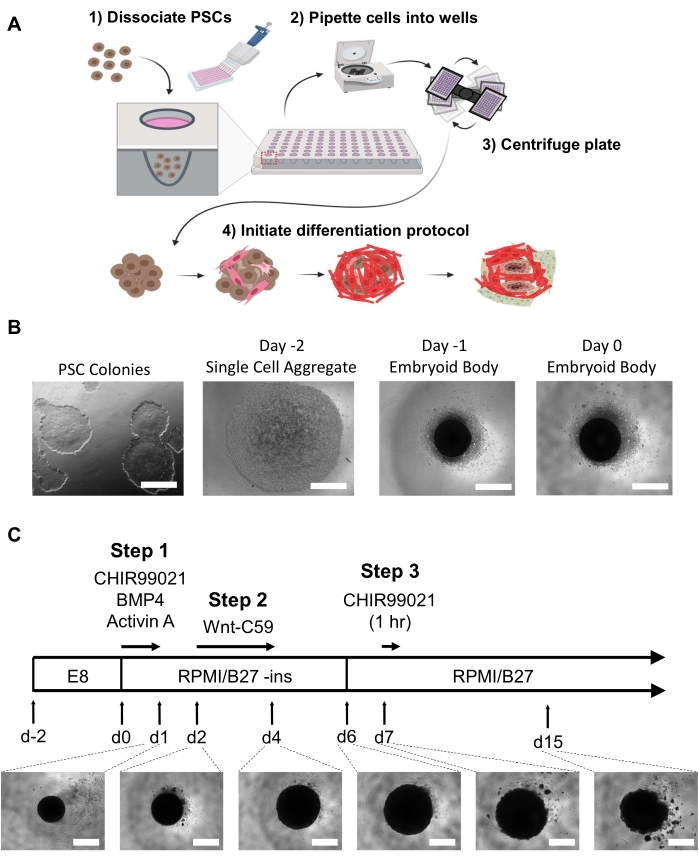
图1:胚胎体生成和心脏类器官分化步骤(A)(1-2)解离的细胞通过多通道移液器接种到96孔超低连接板的孔中。(3)然后将96孔板离心,这允许细胞在中心聚集。(4)随着时间的推移,在添加生长因子和通路调节剂后,胚状体开始分化成几个心脏谱系,并在内部微室周围形成空间和生理上相关的不同细胞群。(B)胚状体生成进展的代表性图像,从2维iPSC培养(左)开始,以第0天的胚状体(右)结束;(C)人心脏类器官分化方案摘要,包括化学途径调节剂和抑制剂,具有各自的时间点,持续时间和从第1天到第15天的光学显微镜下发育的类器官图像;比例尺 = 500 μm。请单击此处查看此图的放大版本。
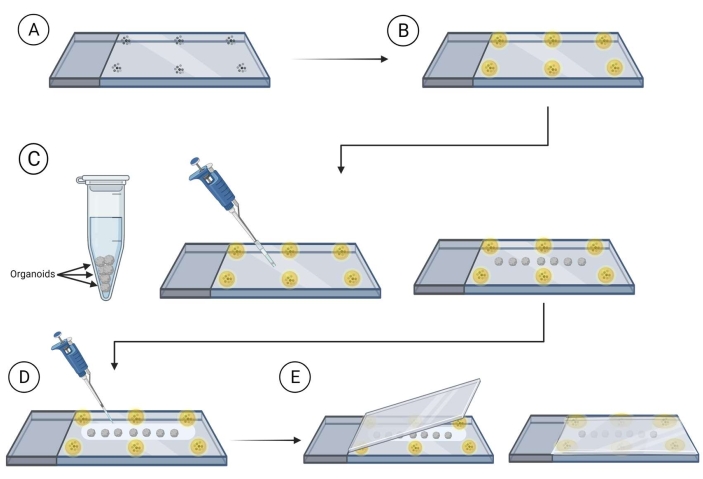
图2:整个类器官安装在载玻片上以进行成像。 准备载玻片和安装用于成像的类器官的步骤。(A)将微珠放置在载玻片的外围。(B)用安装介质覆盖微珠。(C)将类器官转移到珠子之间的载玻片上,并除去类器官周围的多余液体。(D)用清除/安装介质覆盖类器官。(E)将盖玻片放在载玻片顶部,上面有类器官和珠子。 请点击此处查看此图的放大版本。

图3:hHO中的第一心场和第二心场规格概括了人类心脏的生理发育。 (A)第3天至第11天的hHO的共聚焦免疫荧光图像显示FHF(HAND1,顶部)和SHF(HAND2,底部)的形成,以及心肌细胞(TNNT2)和核染料DAPI;比例尺= 500μm.(B)第7天类器官的高放大倍率图像显示HAND1和HAND2与心肌细胞标志物TNNT2共定位;比例尺 = 50 μm. (C) 从第0天到第19天FHF标记HAND1(红色)和SHF标记HAND2(蓝色)的RNA-Seq基因表达谱。缩写:hHO=人心脏类器官;FHF = 第一心场;SHF = 第二心场;HAND = 表达的心脏和神经嵴衍生物;TNNT2 = 心脏肌钙蛋白 T2;DAPI = 4',6-二氨基-2-苯基吲哚。 请点击此处查看此图的放大版本。

图 4:hHO 发展出多个心脏谱系。 (A-D)第15天hHO的共聚焦免疫荧光图像显示非肌细胞心脏细胞中心肌细胞(TNNT2)的形成和核染料DAPI染色。(A)整个类器官和高倍率的心外膜标志物WT1(绿色)和上皮膜标志物TJP1(白色),显示心肌组织顶部和邻近的上皮来源的心外细胞;比例尺= 500μm,嵌入= 50μm. (B)心内膜标记物NFATC1(绿色)表达在腔室衬里;比例尺= 500μm.(C)PECAM1显示的hHO中的内皮血管网络(绿色)。比例尺= 500μm.(D)心脏成纤维细胞标志物THY1和VIM分别以绿色和白色显示,分布在整个类器官中。比例尺 = 500 μm. (E) RNA-Seq 基因表达谱,从分化的第 0 天到第 19 天,hHO 中存在的主要细胞类型。缩写:hHO=人心脏类器官;TNNT2 = 心脏肌钙蛋白 T2;DAPI = 4',6-二氨基-2-苯基吲哚;WT1 = Wilm的肿瘤-1转录因子;NFATC1 =活化T细胞的细胞质核因子;PECAM1 =血小板内皮细胞粘附分子-1;VIM = vimentin。(F)hHO中平均组织类型组成的饼图,通过使用ImageJ在整个类器官的三个z平面上进行核染色,计算为在整个类器官上具有相应细胞标记物的百分比面积。请点击此处查看此图的放大版本。

图5:活体人心脏类器官中的Flu-4活钙瞬时记录。 (A)整个类器官中单个心肌细胞的代表性钙瞬时记录。(B)热图显示由Flu-4强度确定的动作电位之间的低钙水平和峰值;比例尺 = 10 μm。 请单击此处查看此图的放大版本。
视频1:在室温下光学显微镜下分化的第6天,对来自hPSCs的代表性类器官进行实时成像。 缩写:hPSC =人类多能干细胞。 请点击此处下载此视频。
视频2:在室温下光学显微镜下分化的第15天,对来自hPSCs的代表性类器官进行实时成像。 缩写:hPSC =人类多能干细胞。 请点击此处下载此视频。
视频3:现场记录第10天类器官,在荧光显微镜下显示钙瞬变的热图。请点击此处下载此视频。
讨论
人类干细胞衍生的心肌细胞和其他心脏来源的细胞的最新进展已被用于模拟人类心脏发育22,24,25 和疾病26,27,28 ,并作为筛选治疗药物的工具29,30 和有毒物质31,32.在这里,我们报告了一种易于实施,高度可重复的方案,用于生成和区分EB为高度复杂的hHO。该方案在多种细胞系中取得了成功,包括hPSCs和hESCs23,显示出一致的跳动频率和细胞类型组织。该协议从先前描述的心肌细胞分化方案24,心外膜细胞分化22和源自小鼠ESCs16的心前类器官中提取了各个方面, 并在完全定义的培养基中使用化学抑制剂和生长因子优化了规范WNT信号传导的逐步调节。在生成该协议时采用了几种优化方法。
首先,化学抑制剂浓度和暴露持续时间,以及生长因子的添加,已经针对3D环境进行了优化,并在之前的工作中进行了讨论23。这些被优化以阐明具有生理复杂性和 体内 人心脏表征的结构,具有心肌细胞与非肌细胞心脏类型(心外膜细胞,心脏成纤维细胞)的生理组成和比例。其次,三分之二的培养基变化策略允许EB/类器官的最小搅拌,因为它们悬浮在靠近井底的地方,同时也促进了培养基刷新时对化学抑制剂和生长因子的梯度暴露。通过Wnt通路激活进行心脏中胚层分化,然后抑制24,以及随后通过第二种Wnt通路激活22诱导心前规范的组合,允许单一方案产生高度复杂的hHO。类器官在分化15天后生长至1 mm,可以很容易地转移到活体或固定分析和测定中。第三,鉴于类器官的大尺寸,发现使用微珠或其他类似结构来保持载玻片和盖玻片之间的空间可以更好地保留类器官的3D结构并改善成像过程。
这种发展中的人类心脏模型允许进入心脏发育的其他不可及的阶段,例如在分化的第3天和第9天之间观察到的早期第一和第二心场规范 - 并组织成心脏祖细胞,产生心脏组织,包括心肌,心内膜,表心包,内皮脉管系统和辅助心脏成纤维细胞,这些细胞在分化的第15天被观察到。从该协议衍生的心脏类器官中存在的组织类型在组成33 和转录组学谱中高度代表人类胎儿心脏23,34。因此,它们可以促进组织 - 组织和细胞 - 细胞的高阶相互作用,类似于 体内 心脏的相互作用。该协议在实验和细胞系中非常有效且可重复,产生主要由心肌细胞组成并包括非肌细胞心脏细胞的类器官,例如心外膜细胞,心内膜细胞,心脏成纤维细胞和内皮细胞,代表生理组成23,33,35。
通过透射电子显微镜分析形成心肌细胞的超微结构,以及通过光学相干断层扫描和共聚焦成像发展腔室和血管网络,在以前的工作中详细讨论了23。与最近发表的其他现有方案相比,这种心脏类器官方案的一大优势是17,18,19,20,36,37是在整个类器官中形成强大的内皮网络,允许能够研究早期人类心脏的血管发育和疾病,而无需进一步的外部诱导方案。最后,心脏类器官的功能分析可以通过各种方法实现,包括使用钙敏感染料来跟踪整个类器官心肌细胞中的钙瞬变。使用高分辨率显微镜,我们记录了钙进入和退出细胞的荧光强度,并观察到高度代表性的动作电位。其他可能的功能分析方法包括使用具有钙敏感指示剂的转基因品系或使用微电极阵列直接记录23。
这里描述的心脏类器官是发育中的人类胎儿心脏的概括,但在表现出更成熟的成人特征方面受到限制。未来的方案可能建立在这里描述的协议之上,以诱导这些类器官的成熟,并产生更好地模拟成人心脏的结构。此外,该协议旨在创建人类心脏的微型模型,仅限于心脏发育和疾病的研究或药物筛查,可能不适合作为临床干预的手段,例如通过移植替换心脏组织。总体而言,我们在这里描述了一种易于遵循且具有成本效益的方案,以产生高度可重复和复杂的人心脏类器官,可以促进人类心脏发育,疾病病因学和药理学筛查的研究。
披露声明
作者没有利益冲突要声明。
致谢
这项工作得到了美国国立卫生研究院国家心脏,肺和血液研究所的支持,奖项编号为K01HL135464和R01HL151505,美国心脏协会的奖项编号为19IPLOI34660342。我们要感谢MSU高级显微镜核心和密歇根州立大学药理学和毒理学系的William Jackson博士获得共聚焦显微镜,IQ显微镜核心和密歇根州立大学基因组学核心的测序服务。我们还要感谢阿吉雷实验室的所有成员的宝贵意见和建议。
材料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
参考文献
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593 (2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215 (2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723 (2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098 (2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94 (2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4 (2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140 (2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283 (2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003 (2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142 (2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538 (2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。