Method Article
多能性幹細胞由来の自己組織化ヒト心臓オルガノイドの生成
要約
ここでは、自己組織化によってヒト多能性幹細胞を用いて、発達的に関連するヒト心臓オルガノイド(hH)を効率的に作成するためのプロトコルについて述べた。このプロトコルは、発達的手がかりの逐次活性化に依存し、非常に複雑で機能的に関連するヒト心臓組織を生成する。
要約
健康と病気におけるヒト心臓の発達を研究する能力は、 インビトロでのヒト心臓の複雑さをモデル化する能力によって非常に制限される。オルガノイドやオルガンオンチップなどの複雑な 生体内 表現型をモデル化できる、より効率的な臓器のようなプラットフォームを開発することは、人間の心臓の発達と病気を研究する能力を高めるでしょう。本論文では、ヒト多能性幹細胞を用いた自己組織化と、低分子阻害剤を用いた段階的発達経路活性化により、非常に複雑なヒト心臓オルガノイド(hH)を生成するプロトコルについて述べている。胚体(EBs)は、ラウンドボトム、超低付着ウェルを備えた96ウェルプレートで生成され、個別の構築物の懸濁培養を促進します。
EBsは、心臓中皮運命を誘導するための最初のWnt経路活性化、決定的な心臓系統を作成するためのWnt阻害の第2ステップ、および前EPICAR組織を誘導する第3のWnt活性化ステップを含む3段階のWntシグナル伝達変調戦略によってhHOsへの分化を受ける。これらのステップは、96ウェル形式で行われ、非常に効率的で再現性が高く、1回の実行ごとに大量のオルガノイドを生成します。分化の3日目から11日目までの免疫蛍光イメージングによる分析は、心房および心室心筋細胞の領域を有する心筋組織および内腔内の内膜組織を含む、15日目のhHOs内の第1および第2の心臓フィールド仕様および非常に複雑な組織を明らかにする。オルガノイドはまた、構造全体に複雑な血管ネットワークを示し、外膜組織の外部内層を示す。機能的な観点から、hHOsは強く打ち負かし、Fluo-4ライブイメージングによって決定される正常なカルシウム活性を示す。全体として、このプロトコルは、ヒト臓器様心臓組織 におけるインビトロ 研究のための強固なプラットフォームを構成する。
概要
先天性心不全(CHD)は、ヒトにおける先天性欠損の最も一般的なタイプであり、全ての出生の約1%に影響を及ぼす1,2,3。ほとんどの場合、CHD の理由は不明のままです。開発中の人間の心臓に近いヒトの心臓モデルを実験室で作成する能力は、代理動物モデルではなく、ヒトにおけるCHDの根本的な原因を直接研究するための重要な前進を構成する。
実験室で成長した組織モデルの縮図は、細胞組成および生理機能に関心のある器官に似たオルガノイド、3D細胞構築物である。オルガノイドは幹細胞や前駆細胞に由来することが多く、脳4,5、腎臓6、7、腸8、9、肺10、11、肝臓12,13、膵臓などの多くの臓器のモデル化に成功しています14,15、ちょうどいくつかの名前を付けるために。最近の研究は、体外で心臓の発達を研究するために自己集合性心臓オルガノイドを作成する実現可能性を実証することが明らかになってきました。これらのモデルには、マウス胚性幹細胞(mESC)を使用して、房室仕様18までの初期心臓発達16,17、ヒト多能性幹細胞(hPSC)をモデル化し、多発層心内膜オルガノイド19および非常に複雑な細胞組成を有するチャンバードカーディオイド20を生成することを含む。
本論文は、高い複雑なhHOsを効率的かつ費用対効果の高い方法で生成するための、新しい3段階のWNT変調プロトコルを紹介する。オルガノイドは96ウェルプレートで生成され、容易に自動化できるスケーラブルでハイスループットなシステムをもたらします。この方法は、中皮および心中皮形成、第1および第2の心臓フィールド仕様、前EPICAR器官形成、および房室仕様を含む、hPSC凝集体を作成し、心新生の発達段階を引き起こすことに依存する。分化の15日後、hhOsは、心臓に見られるすべての主要な細胞系統、明確に定義された内部チャンバー、心房および心室室、およびオルガノイド全体の血管ネットワークを含む。この高度で再現性の高い心臓オルガノイドシステムは、心臓の発達、疾患、薬理学的スクリーニングの研究において、構造的、機能的、分子的、および転写学的分析を調査するのに適しています。
プロトコル
1. hPSCの文化とメンテナンス
注:ヒト誘導PSC(hiPSC)またはヒト胚性幹細胞(hESC)は、分化またはさらなる凍結保存のためにEBを生成するために使用される前に、解凍後に少なくとも2回連続した通路のために培養する必要があります。hPSCは、基質膜外細胞マトリックス(BM-ECM)コーティングされた6ウェル培養プレート上のPSC培地( 材料表参照)で培養される。6ウェルプレートでhPSCにメディアチェンジを行う場合は、細胞の上に直接置かずにウェルの内側に直接培地を追加して、不要な細胞の剥離やストレスを防ぎます。ユーザーは、37 °Cで温めてはならないPSCメディアを温める前に警戒する必要があります。このプロトコルで使用されるすべてのPSCメディアは耐熱性であった。
- BM-ECMでウェルプレートをコーティングするには、BM-ECMのアリコート(メーカーの指示に従って-20°Cで保存)を氷上で解凍し、BM-ECMの0.5mgを冷たいダルベックの改変イーグル培地(DMEM)/F12培地(DMEM)/F12培地(4°Cで保存)と12mL混合します。DMEM/F12-BM-ECM混合物の2 mLを6ウェルプレートの各ウェルに分配し、37°Cで少なくとも2時間インキュベートします。
- 細胞を解凍するには、まず、37°Cビーズまたは水浴中のhPSC cryovialを1〜2分間解凍し、少量の氷のみが見えるまで行う。解凍した細胞を遠心分離管に移し、2μMのROCK阻害剤、チアゾビビン(チアズ)、遠心分離機を300× g で5分間ゆっくりと添加してPSC培地を8〜9mL加えます。上清を取り除き、チアズの2 μMを補充したPSC培地の細胞ペレットを再懸濁します。培養液中の細胞を37°Cでの凍結細胞濃度および培養に応じて1〜2ウェルに分配し、PSC培地を変える前に24時間のCO2 を5%とする。
- 48時間間隔でセル上の媒体を変更します。DMEM/F12(1 mL/well)およびPSC培地(2mL/ウェル)を使用して、それぞれ、スケッシュと培地の変更を行います。
注:新しいメディアの変更は、栄養素の新たな供給源を細胞に提供しながら、ワッシュは、細胞の廃棄物や破片を除去するのに役立ちます。 - 培地を吸引し、1xダルベッコのリン酸緩衝溶液(カルシウムなし、マグネシウムなし)の1mLで各ウェルを洗浄することにより、亜合流(60〜80%コンフルエント)で細胞を通過させる。DPBS)。DPBSを吸引し、hPSC用解離試薬の1mLを加え( 材料表参照)、10s後の試薬の薄膜以外の全ての吸引を続ける。
- 細胞間に隙間が形成されるまでhPSC用解離試薬の薄膜で2〜5分間インキュベートする。
注: 解離を停止する時間はセル行に依存します。 - 2 μM のチアズ (PSC 培地 +チアズ) を添加した PSC 培地 1 mL をウェルに加え、プレートを軽くタップして細胞の剥離を誘導します。分離した細胞を培地に1〜2回ピペットして大きなコロニーを分割し、PSC培地+チアズの細胞を1:6ウェル比で再懸濁した(1から12mLの培養培地に再懸濁した細胞)。BM-ECMコーティングされた井戸の細胞を再プレートします。
2. 3D自己集合型ヒト心臓オルガノイドの生成
- 胚体(EB)形成:
注:胚の体形成前に観察可能な分化細胞を制限することが不可欠です。60-80%の合流度で6ウェルプレートの2〜3つの井戸は、オルガノイドの単一の96ウェルプレートのための十分な細胞を得る。すべての媒体は、EBまたはオルガノイドへの温度ショックを最小限に抑えるために、媒体が変化する前に37°Cビーズまたはウォーターバスでアリクォートされ、温めるべきである(これは細胞解離試薬を含まない)。図 1A,B を参照してください。- 日 -2
- EBを作成するには、-2日目に、サブコンフルエントhPSC(60〜80%コンフルエント)を少なくとも10 sのDPBSで洗浄し、細胞の破片を洗浄し、DPBSを吸引します。
- 細胞を取り外して単一細胞状態に放出するには、1 mLの室温細胞解離試薬( 材料表を参照)を各ウェルに3〜6分間加えます。顕微鏡下でチェックしながら剥離を誘発するために、毎分〜5回プレートを軽くタップします。PSC培地+チアズを1 mL加えた反応を止める。
- 細胞を収集し、残りの凝集体を分割するには、ウェル2〜3回でメディアを上下にピペットし、単一細胞懸濁液を生成する。単一細胞懸濁液を遠心管に移し、300×gで5分間回転 させる。
- 所望の細胞濃度を得るために、上清を捨て、PSC培地+チアズの1mLで細胞を再懸濁する。細胞カウンターまたはヘモサイトメーターを使用して細胞を数え、PSC培地+チアズの細胞を10万細胞/mLの濃度に希釈します。
- EB形成のために細胞を分配するには、マルチチャンネルピペットを使用して、ラウンドボトム超低アタッチメント96ウェルプレートの各ウェルに100 μL(10,000細胞)を加えます。プレートを100× g で3分間遠心し、37°Cで24時間、5%CO2でインキュベートします。
- 1日目
- 各ウェルから50μLの培地を慎重に取り出し、37°Cに温めた新鮮なPSC培地200μLを加えて、井戸あたり250μLの最終容積を達成します。37°C、5%CO2で24時間培養します。
注:井戸の底部にあるEBを邪魔しないように、井戸の側面に慎重に媒体を取り外して追加してください。EBの繊細な性質と懸濁液培養のために、EBsを乱さないように培地を交換する際には、各ウェルに少量の液体を残す必要があります。
- 各ウェルから50μLの培地を慎重に取り出し、37°Cに温めた新鮮なPSC培地200μLを加えて、井戸あたり250μLの最終容積を達成します。37°C、5%CO2で24時間培養します。
- 日 -2
- ヒト心臓オルガノイド(hHO)分化:
注:すべてのメディアは、メディアの変更前に37°Cビーズまたはウォーターバスで温める必要があります。井戸の底部にあるオルガノイドの発生を妨げないように、井戸の側面に慎重に媒体を取り除き、追加します。撹拌を最小限に抑え、阻害剤や成長因子を徐々に除去するために、メディアの変更の間に、スヒールは必要ありません。2%B-27サプリメント(材料表)を有するRPMIは、分化プロトコル全体にわたって使用された。B-27サプリメントは、指定されない限りインスリンを含む(0-5日目にインスリンフリー)。 図 1C を参照してください。- 0日目
- 中皮系に対する分化を開始するには、 各ウェルから培地の166 μLを除去し(総ウェル体積の2/3) 、インスリンフリーB-27サプリメント、6 μM CHIR99021、1.875 ng/mL骨形態形成タンパク質4(BMP4)、および1.5 ng/mL Activin Aを加えて4900μRの最終濃度を得る 1.25 ng/mL BMP4、および1 ng/mLアクティビンA.インキュベート37°C、5%CO2で24時間インキュベート。
- 1日目
- 各ウェルから培地の166 μLを取り除き、インスリンフリーB-27サプリメントで新鮮なRPMI 1640の166 μLを追加します。37°Cで24時間、5%CO2でインキュベートする。
- 2日目
- 心臓中皮質の仕様を誘導するには、各ウェルから166μLの培地を取り出し、インスリンフリーB-27サプリメントを含むRPMI 1640の166 μLと3 μM Wnt-C59を加え、37°Cで48時間インキュベートします。
- 4日目
- 各ウェルから培地の166 μLを取り除き、インスリンフリーB-27サプリメントで新鮮なRPMI 1640の166 μLを追加します。37°Cで48時間、5%CO2でインキュベートする。
- 6日目
- 各ウェルから166 μLの培地を取り出し、B-27サプリメントで166 μLのRPMI 1640を追加します。37°Cで24時間、5%CO2でインキュベートする。
- 7日目
- プロエピカルジアル分化を誘導するには、各ウェルから166μLの培地を取り出し、B-27サプリメントを含む新鮮なRPMI 1640の166 μLを加え、2 μM CHIR99021の最終ウェル濃度を3μM CHIR99021に加えます。37°Cで1時間、5%CO2でインキュベートする。
- 各ウェルから166 μLの培地を取り出し、B-27サプリメントを含む新鮮なRPMI 1640を166 μL加えます。37°Cで48時間、5%CO2でインキュベートする。
注:オルガノイドはメディアの変更のために動きやすいので、7日目にこの2番目の中程度の変更には特別な注意が必要です。 - 7日目以降から分析または実験のために収集または転送まで、各ウェルから166 μLの培地を取り除き、B-27サプリメントを含む166 μLの新鮮なRPMI 1640を加えて、48時間ごとに培地変更を行います。
注:オルガノイドは、以前の発達段階が興味を持っていない限り、15日目に分析と実験の準備ができています。それらは、長期培養または成熟実験のために15日目を過ぎて培養することができる。
- 0日目
3. オルガノイド解析
- オルガノイド全体の転送(生きているかまたは固定される)
注:生きたオルガノイドの転写のために、使用されるピペットの先端が無菌であることを確認してください。- チップ開口部からP200ピペットチップを5~10mm切り落とし、直径2~3mmの広い開口部を得ます。
- ピペットが完全に垂直(プレートに垂直)になるように、オルガノイドを含む丸底のウェルに先端をまっすぐに挿入します。チップを媒体に挿入する前に、ピペットプランジャーが既に押されていることを確認してください。
- ピペットプランジャーをゆっくりと放出し、オルガノイドを収集するのに十分な媒体(100〜200 μL)を取り上げます。
- オルガノイドを培地中の標的宛先に移す(例えば、固定用、ライブイメージング、電気生理学記録、新しいプレート培養)。
- オルガノイドの固定
注:オルガノイドの固定と染色は、96ウェル培養プレートまたはマイクロ遠心チューブのいずれかで行うことができます。パラホルムアルデヒド(PFA)は、ヒュームフードでのみ取り扱う必要があります。- マイクロ遠心チューブの固定のために、チューブあたり1〜8オルガノイドでチューブを分離するために生きたオルガノイドを移管する。
注:チューブあたり8オルガノイドを超えないようにしてください。 - オルガノイドに触れることなく、できるだけ多くの媒体をチューブから慎重に取り出し、廃棄してください。
- 各チューブまたはウェルに4%PFAを加えます(マイクロ遠心分離チューブあたり300〜400 μL、96ウェルプレートのウェルあたり100〜200 μL)。室温で30~45分間インキュベートします。
注:1時間を超えるインキュベーション時間は、抗原の取得手順を必要とし、推奨されません。 - オルガノイドを邪魔することなく、PFAを安全に廃棄してください。4%PFAに使用した同じ体積を使用して、1.5 g/Lグリシン(DPBS/Gly)を加えたDPBSで3つのスリーチを行い、5分間の間に5分間待つ。DPBS/Glyを除去し、免疫染色またはその他の分析に進むか、DPBSを追加し、最大2週間の将来の使用のために4°Cで保存します。
注:固定オルガノイドを2週間以上保存すると、組織の劣化や汚染が発生する可能性があり、推奨されません。
- マイクロ遠心チューブの固定のために、チューブあたり1〜8オルガノイドでチューブを分離するために生きたオルガノイドを移管する。
- 全マウント免疫蛍光染色
- 100 μLのブロッキング/パーメアビライゼーション溶液(10%正常ロバ血清+ 0.5% ウシ血清アルブミン(BSA)+ 0.5%トリトンX-100(1x DPBS)を、固定オルガノイドを含む各ウェルまたはチューブに加えます。シェーカーで一晩室温でインキュベートします。
注:チューブあたり8オルガノイドを超えないようにしてください。 - オルガノイドに触れることなく、できるだけ多くのブロッキング溶液を慎重に除去し、廃棄してください。DPBSで3つのスッシュを行い、5分の間にスミを待つ。
- 一次抗体溶液(1%正常ロバ血清+ 0.5%BSA + 0.5%トリトンX-100 1x DPBS)を推奨濃度で調製します。シェーカーで4°Cで24時間インキュベートします。
- オルガノイドに触れることなく、できるだけ多くの抗体溶液を慎重に除去し、廃棄してください。DPBSで3つのスッシュを行い、5分の間にスミを待つ。
- 推奨される濃度で目的の二次抗体を用いて、二次抗体溶液(1%正常ロバ血清+0.5%BSA+0.5%トリトンX-100(1x DPBS)を調製します。抗体が蛍光標識されている場合は、シェーカー上で24時間、暗闇の中で4°C(例えば、アルミ箔で覆われている)でインキュベートする。
- オルガノイドに触れることなく、できるだけ多くの抗体溶液を慎重に除去し、廃棄してください。DPBSで3つのスッシュを行い、5分の間にスミを待つ。
- オルガノイドを含むカバースリップが配置されるスライドの端近くに、取り付け媒体( 材料表を参照)に取り付けたビーズ(直径90~300 μm)でスライドを準備します。
注:続行する前に、ビーズの周りの取り付け媒体を乾燥させることをお勧めします。これによりビーズが動き回るのを防ぐことができます。 図 2 を参照してください。 - 切られたピペットチップを使用して染色されたオルガノイドをスライドに移し、ビーズの間で、スライド上でオルガノイド間の接触を避けるために間隔を確保する。ロールアップされた実験室のワイプのコーナーを使用して、オルガノイドの周りの余分な液体を慎重に除去します。
- オルガノイドを取り付け清算媒体(フルクトースグリセロールクリアリング溶液は60%(vol/vol)グリセロール、2.5 Mフルクトース)37 で覆い、1スライド当たり120-150μLの取り付け用媒体を使用します。
注:それは非常に粘性であるため、取り付けクリアメディアで作業するときはカットピペットチップを使用することをお勧めします。 - 取り付けクリアソリューションで覆われたオルガノイドでスライドの上にカバースリップを置き、スライド上のカバースリップをゆっくりと押し、オルガノイドが取り付けられたビーズの間であることを確認します。
- トップコートネイルニスを使用して、スライド上のカバースリップの周囲をシールします。スライドを室温で1時間乾燥させます。暗闇の中で4°Cで長期保存を行います。
- 100 μLのブロッキング/パーメアビライゼーション溶液(10%正常ロバ血清+ 0.5% ウシ血清アルブミン(BSA)+ 0.5%トリトンX-100(1x DPBS)を、固定オルガノイドを含む各ウェルまたはチューブに加えます。シェーカーで一晩室温でインキュベートします。
- 生きた心臓オルガノイドにおけるカルシウム過渡イメージング
注:メーカーの指示によると、Fluo4-AMは、0.5 mMの最終ストック溶液濃度にジメチルスルホキシド(DMSO)で再構成されました。フルー4-AMは、96ウェルプレートでオルガノイドウェルに直接添加した。- RPMI 1640培地を用いてオルガノイドに2本の打ち込みを行う。
- 使用済みの培地を166μL取り出します。
- 166 μLの加温 RPMI 1640 培地を加え、166 μL の培地を取り出し、166 μL の新鮮な RPMI 1640 培地を追加します。
注:廃棄物や細胞の破片を除去するために、このスワッシュを行います。媒体の3分の2は、機能的アッセイの前に井戸底のオルガノイドを乱さないように、打ち上げ中に井戸から取り除かれる。
- オルガノイドにフルー4-AM培地を加えます。
- B-27サプリメントを含むRPMI 1640にDMSOで再構成されたフル4-AMを加え、1.5 μMの溶液を調製します。
- ウェルから166μLの培地を取り出します。
- B-27サプリメントを含むRPMI 1640に1.5 μM Fluo4-AMの166 μLを加え、最終ウェル濃度1 μMを含み、37°Cでインキュベートし、30分間5%CO2 をインキュベートします。
- ステップ 3.4.1 のように 2 つのス述を行います。
- B-27サプリメントを含むRPMI 1640の166 μLをウェルに加えます。
- P200ピペットチップのカットチップを使用して、オルガノイドをガラス底のペトリ皿(例えば、#1.5高性能カバーグラス付き8ウェルチャンバーカバーガラス)に100-200 μLの培地で移します。
注:オルガノイド全体の転送に関するセクション3.1を参照してください。 - 画像オルガノイドは、37°C、5%CO2の温度およびCO2制御チャンバーを備えた顕微鏡下で生きています。
- オルガノイドの様々な場所でいくつかの10〜20 sのビデオを記録し、カルシウムが細胞に出入りするにつれて蛍光強度レベルの増加と減少を示す。
注: 高解像度の録画の場合は、10 fps 以上の速度で録音することをお勧めします。50 fps を推奨します。 - 対象領域を選択し、時間の経過に伴う強度レベルを測定することにより、画像解析ソフトウェア(ImageJなど)を使用してビデオを解析します。
- ΔF/F0 と時間(ミリ秒)とプロットを使用して、強度記録を正規化します。
- RPMI 1640培地を用いてオルガノイドに2本の打ち込みを行う。
結果
インビトロで自己組織化hHOを達成するために、我々は、Wnt経路モジュレーターを使用した心筋細胞21および心外細胞22の2D単層分化および成長因子BMP4およびアクチビンAを用いた3D前心臓オルガノイド16に関して以前に説明した分化プロトコルを修正し、組み合わせた図Wnt経路活性化因子CHIR99021の濃度と曝露期間は、ヒトPSCに由来する高度に再現性の高い複雑なhHHOsを得るように最適化された。
EBは、0日目に分化を開始する前に、24時間後に培地変化で48時間インキュベートした。0日目には、各ウェルの中心にある黒色球状の凝集体として、光顕微鏡下で見える必要があります(図1B)。分化プロトコルは、ちょうど24時間のWnt経路活性化および成長因子の追加で0日目に開始されます。この中皮誘導に続いて、Wnt経路阻害剤Wnt-C59を使用して2日目に心臓中膜誘導を行うと、オルガノイドは直径約200μmから直径500〜800μmまで、直径は4日目に約1mmまで有意に拡大する(オルガノイドは15日目までにわずかにサイズが縮小する可能性がある(図1C)。hHOは早ければ6日目(ビデオ1)で打ち始め、オルガノイドの100%が10日目までに目に見える拍動を示します(薬物治療を受けている場合、または不十分なhPSCを使用してEBを生成した場合)。これは、5つの異なるhPSC細胞株23において観察されている。
hHOsの能力を評価して、心臓の生理的発達の様々な段階を表すために、分化プロトコル全体の様々な時点でオルガノイドを採取し、心臓フィールドマーカーの存在と転写発現を探った。第1の心臓フィールド(FHF)マーカー、HAND1、および第2の心臓フィールド(SHF)マーカーHAND2に対する免疫蛍光染色は、それぞれ3日目および5日目頃に生じるこれらの心臓前駆細胞における核存在を明らかにした(図3A)。
両方のマーカーの発現は、FHFの7日目以降、SHFの9日目以降にサイズが減少するオルガノイドの領域で起こる。興味深いことに、7日目のオルガノイドの高倍率画像は、ほとんどのHAND1発現細胞が起源の心筋細胞であることを明らかにした(心筋細胞特異的マーカーTNNT2によって示されるように)。これに対し、HAND2発現細胞の多くは心筋細胞マーカーを発現しなかった(図3B)。この観察は、マウスESCに由来する心臓前オルガノイドと一致し、SHF前駆細胞16からの非筋細胞細胞の発達を示す。RNA-シーケンシングデータは、HAND1とHAND2の両方のRNA転写物が3日目から3日目以降に発現し、FHFマーカーは3日目から11日目の間により高く発現され、SHFマーカーは13日目以降により高く発現されることを示しています(図3C)。
免疫蛍光染色は、ヒトの心臓を構成する様々な細胞型系統のマーカーの存在を明らかにした。心筋組織(心筋細胞特異的マーカーTNNT2を用いて識別可能)は、心筋組織に隣接する(核転写因子WT1および上皮膜マーカーTJP1によって示される)(図4A)。NFATC1を発現する心筋細胞は、オルガノイド内の内部チャンバー状構造の壁を裏打ちして検出された(図4B)。血管様ネットワーク内の内皮細胞は、分化の13日目に早くも見ることができる(図4C)。最後に、オルガノイド全体に混合された心臓線維芽細胞の存在を報告する(図4D)。これらの細胞型マーカーは、RNA-Seq遺伝子発現プロファイルにおいても観察された(図4E)。オルガノイド中の細胞型の組成は、それらが占めるオルガノイドの面積によって測定されたとおり、心筋細胞〜58%であり、残りは心外膜細胞(〜15%)、心内心細胞(〜13%)、心筋線維芽細胞(〜12%)、内皮細胞(図1F)を含む。
オルガノイドの電気生理学的機能を、オルガノイド全体の個々の細胞の生きたカルシウムイメージングによって測定した。蛍光4蛍光強度は、カルシウムの出入りにより時間の経過とともに変化し、定期的な作用電位を明らかにする(図5A)。オルガノイドの高倍率領域に対するカルシウム強度を示すヒートマップは、個々の細胞におけるカルシウム過渡性による強度の増加を示す(図5B および ビデオ3)。
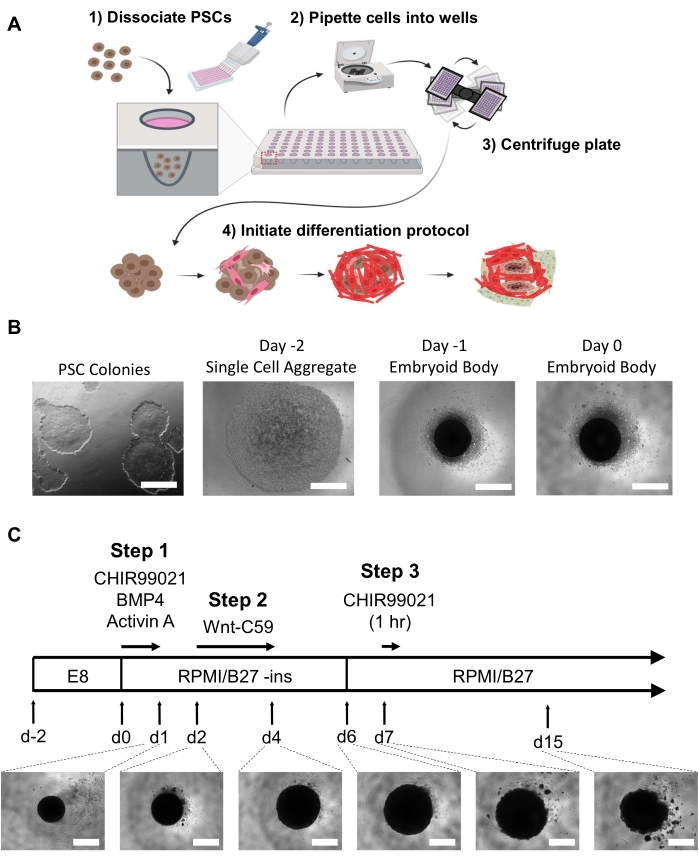
図1:胚発生体生成および心臓オルガノイド分化工程(A)(1-2)解約細胞は、マルチチャネルピペットを介して96ウェル超低接続プレートのウェルに播種される。(3)96ウェルプレートを遠心分離し、細胞を中央に凝集させます。(4)経時的に、成長因子および経路変調器の添加に続いて、胚体は複数の心臓系統に分化し始め、内部マイクロチャンバーを取り巻く空間的および生理学的に関連する異なる細胞集団を形成する。(B)胚性体生成の進行の代表的な画像、2次元iPSC培養(左)から始まり、0日目の胚体で終わる(右)。スケールバー= 500 μm(C)ヒト心臓オルガノイド分化プロトコルの要約, それぞれの時点を持つ化学経路変調器および阻害剤を含む, 期間, 光顕微鏡下でオルガノイド画像を開発 1 日目から日 15;スケールバー = 500 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
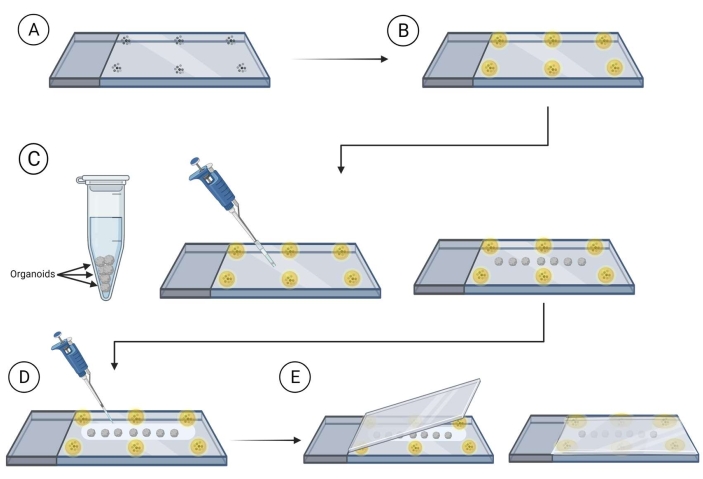
図2:イメージング用スライド上の全オルガノイド取り付け。 画像撮影用のスライドとオルガノイドの取り付け手順。(A) ガラススライドの周囲にマイクロビーズを配置する。(B)マイクロビーズを取り付け媒体で覆う。(C)ビーズ間のスライドにオルガノイドを移し、オルガノイドを取り巻く余分な液体を除去する。(D) オルガノイドをクリア/取り付け媒体で覆う。(E) オルガノイドとビーズでスライドの上にカバースリップを置く。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:hHOsにおける第1の心臓フィールドおよび第2の心臓フィールド仕様は、生理学的ヒト心臓の発達を再現する。 (A)FHF(HAND1、上)およびSHF(HAND2、下部)および心筋細胞(TNNT2)および核色素DAPIの形成を示す3日目から11日目のhHの共焦点免疫蛍光画像。スケールバー= 500 μm. (B) 7日目のオルガノイドの高倍率画像は、心筋細胞マーカーTNNT2とHAND1とHAND2の共局在化を示す。スケールバー=50μm(C)のRNA-Seq遺伝子発現プロファイルのFHFマーカーHAND1(赤)およびSHFマーカーHAND2(青)は0日目から19日目まで。略語: hH= ヒト心臓オルガノイド;FHF =最初の心臓フィールド;SHF = 第二の心臓フィールド;HAND = 心臓および神経堤誘導体が発現;TNNT2 = 心臓トロポニン T2;DAPI = 4',6-ジミディノ-2-フェニリンドール. この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:hHHは複数の心臓系統を発症する。 (A-D)非筋細胞心臓細胞における心筋細胞(TNNT2)の形成および核染色DAPIによる染色を示す15日目のhHの共焦点免疫蛍光画像。(A)全オルガノイドと上皮マーカーWT1(緑色)と上皮膜マーカーTJP1(白)の全臓器化および高倍率は、上および心筋組織に隣接する上皮起源の上皮細胞を示す。スケールバー=500 μm、インセット=50μm(B)室の内層上の心内膜マーカーNFATC1(緑)の表現;スケールバー= 500 μm(C) PECAM1(緑)で示されたhHHでの内皮容器ネットワーク。スケールバー=500μm(D)心臓線維芽細胞マーカーTHY1とVIMはそれぞれ緑色と白で示され、オルガノイド全体に分布する。スケールバー=500μm(E)hHHに存在する主要な細胞型のRNA-Seq遺伝子発現プロファイルは、0日から19日目の分化までである。略語: hH= ヒト心臓オルガノイド;TNNT2 = 心臓トロポニン T2;DAPI = 4',6-ジミディノ-2-フェニリンドール;WT1 = ウィルムの腫瘍-1転写因子;NFATC1 = 活性化T細胞の細胞質核因子;PECAM1 = 血小板内皮細胞接着分子-1;VIM = ヴィメンチン。(F)hHOsにおける平均組織型組成の円グラフは、ImageJを用いてオルガノイド全体の3つのZ面にわたって核染色によってオルガノイド全体にわたるそれぞれの細胞マーカーを有するパーセンテージ面積として計算する。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:ヒトの生きた心臓オルガノイドにおけるFluo-4生きたカルシウム過渡的記録。 (A) オルガノイド内の個々の心筋細胞のカルシウム過渡的記録を代表する。(B) Fluo-4 強度で決定される作用電位間の低カルシウムレベルとピークカルシウムレベルを示すヒートマップ。スケールバー= 10 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
ビデオ1:室温での光顕微鏡下での分化の6日目にhPSCに由来する代表的なオルガノイドのライブイメージング。 略語: hPSC = ヒト多能性幹細胞. こちらをクリックして、このビデオをダウンロードしてください。
ビデオ2:室温での光顕微鏡下での分化の15日目にhPSCに由来する代表的なオルガノイドのライブイメージング。 略語: hPSC = ヒト多能性幹細胞. こちらをクリックして、このビデオをダウンロードしてください。
ビデオ3:蛍光顕微鏡下でカルシウム過渡症のヒートマップを示す10日目のオルガノイドのライブ記録。こちらをクリックして、このビデオをダウンロードしてください。
ディスカッション
ヒト幹細胞由来心筋細胞および心臓由来の他の細胞の最近の進歩は、ヒト心臓の発達22,24,25および疾患26,27,28をモデル化し、治療をスクリーニングするためのツールとして使用されています29,30および有毒物質31,32.ここでは、EJB を生成して高度に複雑な hHOs に分け込める、実装が容易で、非常に再現性の高いプロトコルを報告します。このプロトコルは、hPSCやhESCs23を含む複数の細胞株で成功しており、一貫した拍動周波数と細胞タイプの組織を示しています。このプロトコルは、前に説明した心筋細胞分化24、心筋細胞分化22、およびマウスESCs16に由来する心臓前オルガノイドのプロトコルから側面を引き出し、完全に定義された培地中の化学阻害剤および成長因子を使用して正規WNTシグナル伝達の段階的変調を最適化する。このプロトコルの生成には、いくつかの最適化方法論が採用されました。
まず、化学インヒビター濃度と曝露期間、および成長因子の添加は、3D環境に最適化されており、前の研究23で議論されています。これらは、非筋細胞型(心外膜細胞、心臓線維芽細胞)に対する心筋細胞の生理学的組成および比率を有する、生体 内 ヒト心臓の生理学的複雑さと表現を有する構造を解明するために最適化された。第二に、3分の2の中規模変化戦略は、ウェルの底付近の懸濁液に座る一方で、培地がリフレッシュされたときに化学阻害剤および成長因子への勾配暴露を促進する一方で、EB/オルガノイドの最小の攪拌を可能にする。Wnt経路活性化を介した心臓中皮分化の組み合わせ、続いて阻害24、および第2Wnt経路活性化を介した前エピカルジアル仕様のその後の誘導により、単一のプロトコルが非常に複雑なhHOsを得ることを可能にする。オルガノイドは15日間分化した後、1mmまで成長し、生きた分析や固定分析やアッセイのために簡単に転送することができます。第三に、オルガノイドの大きなサイズを考えると、スライドとカバースリップの間のスペースを維持するためにマイクロビーズまたは他の同様の構造を使用することで、オルガノイドの3D構造をよりよく維持し、イメージングプロセスを改善することが分かった。
この発達中のヒト心臓モデルは、心筋、心内心、上心、内皮性血管系、心臓線維芽細胞を含む心臓組織を生じさせる心臓前駆細胞の3日目から9日目の間に観察された初期の第1および第2の心臓フィールド仕様、および心臓線維芽細胞のサポートなど、心臓発達の他のアクセス不能な段階へのアクセスを可能にする。このプロトコルに由来する心臓オルガノイドに存在する組織タイプは、組成33および転写プロファイル23,34の両方においてヒト胎児心臓を高く代表する。したがって、生体内心臓に似た組織組織および細胞と細胞の高次相互作用を促進することができる。このプロトコルは、実験および細胞株を越えて高効率かつ再現性が高く、心筋細胞を主体とするオルガノイドを生じ、外心細胞、心筋細胞、心筋線維芽細胞、内皮細胞などの非筋細胞を含み、生理学的組成23,33,35を表す。
透過電子顕微鏡による形成心筋細胞の超構造解析と、光コヘレンス断層撮影と共焦点イメージングによるチャンバーと血管ネットワークの発達を前作23で詳細に検討する。最近発表された他の既存のプロトコルに対するこの心臓オルガノイドプロトコルの大きな利点は、オルガノイド全体の内皮ネットワークの堅牢な形成であり、初期のヒト心臓における血管の発達および疾患を調査する能力を可能にする。最後に、心臓オルガノイドの機能解析は、カルシウム感受性色素を使用して、オルガノイド全体の心筋細胞のカルシウム過渡を追跡するなど、様々なアプローチを通じて達成可能である。高解像度顕微鏡を用いて、カルシウムの細胞の出入り量の蛍光強度を記録し、高い代表的な作用電位を観察した。その他の可能な機能解析法には、カルシウム感受性指標を有するトランスジェニックラインの使用、または微小電極アレイ23を用いた直接記録が含まれる。
ここで説明する心臓オルガノイドは、発達中のヒト胎児の心臓の再現性であるが、より成熟した大人のような特徴を示すには限られている。将来のプロトコルは、これらのオルガノイドの成熟を誘導し、成人の心臓をよりよくモデル化する構築物を降伏するために、ここで説明するプロトコルに基づいて構築される可能性があります。さらに、このプロトコルは、ヒト心臓のミニチュアモデルを作成するように設計されており、心臓の発達や疾患の研究や医薬品スクリーニングに限定されており、移植による心臓組織の置換などの臨床介入の手段としては適さない可能性があります。全体として、人間の心臓開発、疾患病因学、薬理学的スクリーニングの研究を容易にする、再現性の高い洗練されたヒト心臓オルガノイドを生成するための、簡単で費用対効果の高いプロトコルをここに記述します。
開示事項
著者は宣言する利害の対立を持っていません。
謝辞
この研究は、国立衛生研究所の国立心臓、肺、血液研究所の賞番号K01HL135464とR01HL151505の下で、および賞番号19IPLOI34660342の下で米国心臓協会によってサポートされました。MSU薬理毒性学科のMSUアドバンスト顕微鏡コアとウィリアム・ジャクソン博士は、コンフォーカル顕微鏡、IQ顕微鏡コア、シーケンシングサービスのためのMSUゲノミクスコアへのアクセスに感謝したいと思います。また、アギーレラボのメンバーの皆様の貴重なコメントやアドバイスに感謝申し上げたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
参考文献
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593 (2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215 (2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723 (2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098 (2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94 (2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4 (2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140 (2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283 (2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003 (2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142 (2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538 (2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved