Method Article
יצירת אורגנוידים של לב אנושי המורכבים בעצמם המופקים מתאי גזע פלוריפוטנטיים
In This Article
Summary
כאן, אנו מתארים פרוטוקול ליצירת אורגנוידים לב אנושי רלוונטיים להתפתחות (hHOs) ביעילות באמצעות תאי גזע פלוריפוטנטים אנושיים על ידי ארגון עצמי. הפרוטוקול מסתמך על הפעלה רציפה של רמזים התפתחותיים ומייצר רקמות לב אנושיות מורכבות ורלוונטיות מאוד מבחינה תפקודית.
Abstract
היכולת לחקור את התפתחות הלב האנושי בבריאות ובמחלות מוגבלת מאוד על ידי היכולת לדגמן את המורכבות של הלב האנושי במבחנה. פיתוח פלטפורמות יעילות יותר דמויי איברים שיכולות לדגמן פנוטיפים מורכבים ב- vivo , כגון organoids ואיברים על שבב, ישפר את היכולת לחקור התפתחות הלב האנושי ומחלות. מאמר זה מתאר פרוטוקול ליצירת אורגנוידים מורכבים מאוד של הלב האנושי (hHOs) על ידי ארגון עצמי באמצעות תאי גזע פלוריפוטנטיים אנושיים והפעלה של מסלול התפתחותי צעד באמצעות מעכבי מולקולות קטנות. גופים עובריים (EBs) נוצרים בצלחת 96 באר עם בארות התקשרות עגולות, אולטרה נמוכות, המקלה על תרבות ההשעיה של מבנים בודדים.
ה- EBs עוברים בידול ל- hHOs על ידי אסטרטגיית אפנון איתות Wnt בת שלושה שלבים, הכוללת הפעלת מסלול Wnt ראשונית כדי לגרום לגורל mesoderm לב, צעד שני של עיכוב Wnt כדי ליצור שושלות לב מוחלטות, וצעד הפעלה Wnt שלישי כדי לגרום לרקמות איברים פרו-אפיקרדיאליים. שלבים אלה, המתבצעים בפורמט של 96 בארות, יעילים מאוד, ניתנים לשחזור ומייצרים כמויות גדולות של אורגנוידים לריצה. ניתוח על ידי הדמיית immunofluorescence מהיום 3 ליום 11 של בידול מגלה מפרט שדה הלב הראשון והשני ורקמות מורכבות מאוד בתוך hHOs ביום 15, כולל רקמת שריר הלב עם אזורים של cardiomyocytes פרזדורים וחדריים, כמו גם תאים פנימיים מרופדים ברקמת אנדוקרדית. האורגנוידים מציגים גם רשת כלי דם מורכבת בכל המבנה ובטנה חיצונית של רקמה אפיקרדיאלית. מנקודת מבט פונקציונלית, hHOs להכות בחוזקה ולהציג פעילות סידן נורמלית כפי שנקבע על ידי Fluo-4 הדמיה חיה. בסך הכל, פרוטוקול זה מהווה פלטפורמה מוצקה למחקרי במבחנה ברקמות לב דמויי איברים אנושיים.
Introduction
מומים מולדים בלב (CHDs) הם הסוג הנפוץ ביותר של פגם מולד בבני אדם ומשפיעים על כ -1% מכלל הלידות החיות1,2,3. ברוב הנסיבות, הסיבות ל- CHDs עדיין אינן ידועות. היכולת ליצור מודלים של לב אנושי במעבדה הדומים מאוד ללב האנושי המתפתח מהווה צעד משמעותי קדימה כדי לחקור ישירות את הגורמים הבסיסיים של CHDs בבני אדם ולא במודלים של בעלי חיים פונדקאיים.
התגלמות מודלים של רקמות שגודלו במעבדה הם אורגנוידים, מבני תאים תלת-ממדיים הדומים לאיבר בעל עניין בהרכב התא ובתפקוד הפיזיולוגי. אורגנואידים נגזרים לעתים קרובות מתאי גזע או מתאי אבות ונעשה בהם שימוש מוצלח לדגמן איברים רבים כגון המוח4,5, כליות6,7, מעיים8,9, ריאה10,11, כבד12,13 ולבלב14,15 רק כדי להזכיר כמה., מחקרים אחרונים הופיעו מדגים את ההיתכנות של יצירת organoids לב להרכיב עצמית ללמוד התפתחות הלב במבחנה. מודלים אלה כוללים שימוש בתאי גזע עובריים של עכבר (mESCs) כדי לדגמן פיתוח לב מוקדם16,17 עד מפרט atrioventricular18 ותאי גזע פלוריפוטנטים אנושיים (hPSCs) כדי ליצור organoids לב-אנדודרם שכבת רב-נבט19 וקרדיואידים תאיים20 עם הרכב תאי מורכב מאוד.
מאמר זה מציג פרוטוקול אפנון WNT חדשני בן 3 שלבים כדי ליצור hHOs מורכבים מאוד באופן יעיל וחסכוני. Organoids נוצרים לוחות 96-well, וכתוצאה מכך מערכת מדרגית, תפוקה גבוהה שניתן להפוך לאוטומטית בקלות. שיטה זו מסתמכת על יצירת אגרגטים hPSC והפעלת צעדים התפתחותיים של cardiogenesis, כולל היווצרות mesoderm ו mesoderm לב, מפרט שדה הלב הראשון והשני, היווצרות איברים proepicardial, מפרט atrioventricular. לאחר 15 ימים של בידול, hHOs מכילים את כל שושלות התא העיקריות שנמצאו בלב, תאים פנימיים מוגדרים היטב, תאי פרזדורים וחדריים, ורשת כלי דם ברחבי האורגנויד. מערכת אורגנויד לב מתוחכמת ורבייה זו מקובלת לחקור ניתוחים מבניים, פונקציונליים, מולקולריים ותעתיקומיים בחקר התפתחות הלב, מחלות, והקרנה פרמקולוגית.
Protocol
1. תרבות ותחזוקה של hPSC
הערה: מחשבי PC המושרה האנושי (hiPSCs) או תאי גזע עובריים אנושיים (hESCs) צריכים להיות מתורבתים לפחות 2 מעברים רצופים לאחר הפשרה לפני השימוש כדי ליצור EBs עבור בידול או הזעקה נוספת. h hPSCs מתורבתים במדיום PSC (ראה טבלת החומרים) על מטריצה חוץ-תאית במרתף (BM-ECM) מצופה 6-בארות צלחות תרבות. בעת ביצוע שינויים בינוניים ב- hPSCs בלוחות של 6 בארות, הוסף את המדיום ישירות לצד הפנימי של הבאר ולא ישירות על גבי התאים כדי למנוע ניתוק תאים לא רצויים או מתח. משתמשים צריכים להיזהר מראש התחממות PSC מדיה כי לא צריך להיות מחומם ב 37 °C (50 °F); כל מדיית PSC המשמשת בפרוטוקול זה הייתה תרמוס-ניתנת לתרמוס.
- כדי לצפות את הצלחות היטב עם BM-ECM, להפשיר aliquot אחד של BM-ECM (מאוחסן ב -20 °C על פי הוראות היצרן) על קרח ולערבב 0.5 מ"ג של BM-ECM עם 12 מ"ל של מדיום הנשר שונה של Dulbecco קר (DMEM)/ F12 בינוני (מאוחסן ב 4 °C (C). יש להפיץ 2 מ"ל מתערובת DMEM/F12-BM-ECM על כל באר של צלחת 6-בארות ולדגירה ב-37 מעלות צלזיוס לפחות.
- כדי להפשיר את התאים, ראשית, להפשיר את hPSC cryovial ב 37 °C חרוז או אמבט מים במשך 1-2 דקות עד רק כמות קטנה של קרח גלוי. העבר את התאים המופשרים לצינור צנטריפוגה לאט להוסיף 8-9 מ"ל של מדיום PSC בתוספת 2 מיקרומטר של מעכב ROCK, thiazovivin (Thiaz), וצנטריפוגה ב 300 × גרם במשך 5 דקות. הסר את supernatant ו resuspend את גלולה התא במדיום PSC בתוספת 2 מיקרומטר של Thiaz. להפיץ את התאים במדיום תרבית לתוך 1-2 בארות בהתאם ריכוז התא cryovial ותרבות ב 37 °C (5 °F), 5% CO2 עבור 24 שעות לפני שינוי מדיום PSC.
- שנה את המדיום בתאים במרווחי זמן של 48 שעות. בצע כביסות ושינויים בינוניים באמצעות DMEM / F12 (1 מ"ל / טוב) ואת PSC בינוני (2 מ"ל / טוב), בהתאמה.
הערה: השטיפה מסייעת בהסרת פסולת תאים ופסולת בזמן ששינויים טריים במדיה מספקים לתאים מקור מחודש של חומרים מזינים. - מעבר התאים על תת-השפעה (60-80% confluent) על ידי שאיפה למדיום, ולאחר מכן לשטוף כל טוב עם 1 מ"ל של 1x תמיסה פוספט-חוצץ דולבק (ללא סידן, ללא מגנזיום; DPBS). שאפו את ה- DPBS והוסיפו 1 מ"ל של ריאגנט הניתוק עבור hPSCs (ראה טבלת החומרים), ואחריו השאיפה של כל אבל סרט דק של ריאגנט לאחר 10s.
- דגירה במשך 2-5 דקות עם הסרט הדק של ריאגנט דיסוציאציה עבור hPSCs עד פערים טופס בין תאים.
הערה: הזמן להפסיק את הניתוק תלוי בקו התא. - הוסף 1 מ"ל של מדיום PSC בתוספת 2 מיקרומטר של Thiaz (PSC בינוני + Thiaz) לבאר בעדינות הקש על הצלחת כדי לגרום ניתוק התא. Pipette התאים המנותקים במדיום 1-2 פעמים כדי לשבור את כל המושבות הגדולות, ול resuspend התאים PSC בינוני + Thiaz ביחס 1:6 טוב (תאים מ 1 resuspended היטב ב 12 מ"ל של מדיום תרבות). יש לשתול מחדש את התאים על בארות מצופות BM-ECM.
2. דור של אורגנוידים של לב אנושי תלת-ממדי
- היווצרות גוף עוברי (EB):
הערה: חובה להגביל תאים מובחנים ניתנים לצפייה לפני היווצרות הגוף העוברי. שתיים עד שלוש בארות של צלחת 6-well במפגש של 60-80% יניבו מספיק תאים לצלחת אחת של 96 בארות של organoids. כל המדיה צריכה להיות aliquoted וחימום 37 °C חרוז או אמבט מים לפני כל שינויים בינוניים כדי למזער את הלם הטמפרטורה EBs או organoids (זה אינו כולל ריאגנטים דיסוציאציה התא). ראה איור 1A, B.- יום -2
- כדי ליצור EBs, ביום -2, לשטוף hPSCs תת-מפגש (60-80% confluent) עם DPBS לפחות 10 s לשטוף כל פסולת התא ושאיפה DPBS.
- כדי לנתק את התאים ולשחרר אותם למצב של תא בודד, הוסף מ"ל אחד של ריאגנט דיסוציאציה של תאים בטמפרטורת החדר (ראה טבלת החומרים) לכל באר למשך 3-6 דקות. הקש בעדינות על הצלחת ~ 5 פעמים בכל דקה כדי לגרום ניתוק תוך כדי בדיקה מתחת למיקרוסקופ. הוסף 1 מ"ל של PSC בינוני + Thiaz כדי לעצור את התגובה.
- כדי לאסוף את התאים ולפרק את כל האגרגטים הנותרים, pipette התקשורת למעלה ולמטה בבאר 2-3 פעמים כדי ליצור השעיה של תא אחד. מעבירים את ההשעיה של תא בודד לצינור צנטריפוגה ומסתובבים במשך 5 דקות ב-300 × גרם.
- כדי להשיג את ריכוז התא הרצוי, להשליך את supernatant ול resuspend התאים ב 1 מ"ל של PSC בינוני + Thiaz. לספור את התאים באמצעות מונה תאים או hemocytometer לדלל את התאים PSC בינוני + Thiaz לריכוז של 100,000 תאים / מ"ל.
- כדי להפיץ את התאים להיווצרות EB, השתמש בצינור רב-ערוצי כדי להוסיף 100 μL (10,000 תאים) לכל באר של צלחת אולטרה-נמוכה תחתית עגולה 96-well. צנטריפוגות את הצלחת ב 100 × גרם במשך 3 דקות ודגורה במשך 24 שעות ב 37 °C (5°F), 5% CO2.
- יום -1
- בזהירות להסיר 50 μL של בינוני מכל באר ולהוסיף 200 μL של PSC בינוני טרי מחומם ל 37 °C (55 °F) כדי להשיג נפח סופי של 250 μL לכל טוב. לדגור על התאים עבור 24 שעות ב 37 °C (5°F), 5% CO2.
הערה: הסר והוסף בינוני בזהירות בצד הבאר כדי למנוע הפרעה ל- EBs בתחתית הבאר. בשל האופי העדין של EBs ותרבות ההשעיה, יש צורך להשאיר נפח קטן של נוזל בכל באר בעת שינוי המדיום כדי למנוע הפרעה EBs.
- בזהירות להסיר 50 μL של בינוני מכל באר ולהוסיף 200 μL של PSC בינוני טרי מחומם ל 37 °C (55 °F) כדי להשיג נפח סופי של 250 μL לכל טוב. לדגור על התאים עבור 24 שעות ב 37 °C (5°F), 5% CO2.
- יום -2
- הבחנה בין לב האדם (hHO):
הערה: יש לחמם את כל המדיה באמבט חרוזים או מים של 37 מעלות צלזיוס לפני שינויים בתקשורת. הסר ולהוסיף בינוני בזהירות בצד של הבאר כדי למנוע הפרעה organoids המתפתח בתחתית הבאר. אין צורך בשטיפה בין שינויים בתקשורת כדי למזער את התסיסה ולאפשר הסרה הדרגתית של מעכבים וגורמי גדילה. RPMI עם תוספת 2% B-27 (טבלת חומרים) שימש לאורך פרוטוקול הבידול. תוסף B-27 מכיל אינסולין אלא אם צוין (ללא אינסולין בימים 0-5). ראה איור 1C.- יום 0
- כדי ליזום בידול לקראת שושלת מסודרם, הסר 166 μL של בינוני מכל באר (~ 2/3 של נפח טוב הכולל) ולהוסיף 166 μL של RPMI 1640 המכיל תוסף B-27 ללא אינסולין, 6 μM CHIR99021, 1.875 ng / mL חלבון מורפגנטי עצם 4 (BMP4), ו 1.5 ng / mL Activin A לריכוז באר סופי של 4 μM CHIR99021, 1.25 ננוגרם /mL BMP4, ו 1 ng / mL Activin A. דגירה עבור 24 שעות ב 37 °C (5°F), 5% CO2.
- יום 1
- הסר 166 μL של בינוני מכל באר ולהוסיף 166 μL של RPMI טרי 1640 עם תוסף B-27 ללא אינסולין. דגירה עבור 24 שעות ב 37 °C (5°F), 5% CO2.
- יום 2
- כדי לגרום מפרט mesoderm לב, להסיר 166 μL של בינוני מכל באר ולהוסיף 166 μL של RPMI 1640 המכיל תוסף B-27 ללא אינסולין ו 3 μM Wnt-C59 עבור ריכוז באר סופית של 2 μM Wnt-C59. דגירה עבור 48 שעות ב 37 °C , 5% CO2.
- יום 4
- הסר 166 μL של בינוני מכל באר ולהוסיף 166 μL של RPMI טרי 1640 עם תוסף B-27 ללא אינסולין. דגירה עבור 48 שעות ב 37 °C (5°F), 5% CO2.
- יום 6
- הסר 166 μL של בינוני מכל באר ולהוסיף 166 μL של RPMI 1640 עם תוספת B-27. דגירה עבור 24 שעות ב 37 °C (5°F), 5% CO2.
- יום 7
- כדי לגרום לבידול פרו-פיקטיבי, הסר 166 μL של בינוני מכל באר ולהוסיף 166 μL של RPMI 1640 טרי המכיל תוספת B-27 ו 3 μM CHIR99021 עבור ריכוז באר סופית של 2 μM CHIR99021. דגירה עבור 1 שעות ב 37 °C (5°F), 5% CO2.
- הסר 166 μL של בינוני מכל באר ולהוסיף 166 μL של RPMI 1640 טרי המכיל תוספת B-27. דגירה עבור 48 שעות ב 37 °C (5°F), 5% CO2.
הערה: זהירות נוספת מומלץ בשינוי בינוני שני זה ביום 7 כמו organoids נוטים יותר תנועה בגלל השינויים בתקשורת. - מיום 7 ואילך עד איסוף או העברה עבור ניתוחים או ניסויים, לבצע שינויים בינוניים כל 48 שעות על ידי הסרת 166 μL של בינוני מכל באר ולהוסיף 166 μL של RPMI טרי 1640 המכיל תוספת B-27.
הערה: Organoids מוכנים ניתוחים וניסויים ביום 15 אלא אם כן שלבים התפתחותיים מוקדמים יותר הם עניין. הם יכולים להיות תרבותיים היום האחרון 15 לתרבות ארוכת טווח או לניסויי התבגרות.
- יום 0
3. ניתוח אורגנויד
- העברת אורגנוידים שלמים (חיים או קבועים)
הערה: עבור העברה אורגנויד חי, ודא כי טיפים פיפטה בשימוש הם סטריליים.- חותכים את הקצה של טיפ פיפטה P200 5-10 מ"מ מפתיחת הקצה, וכתוצאה מכך פתח רחב של ~ 2-3 מ"מ קוטר.
- הכנס את הקצה ישר לתוך הבאר העגולה התחתונה המכילה את האורגנויד, כך pipette הוא אנכי לחלוטין (מאונך לצלחת). ודא כי בוכנה pipette כבר לחוץ כל הדרך לפני החדרת הקצה לתוך המדיום.
- לאט לאט לשחרר את בוכנה pipette, לוקח מספיק בינוני (100-200 μL) כדי לאסוף את organoid.
- העבר את האורגנויד בינוני ליעד היעד (למשל, לתיקון, הדמיה חיה, הקלטה אלקטרופיזיולוגית, תרבות צלחת חדשה).
- תיקון אורגנוידים
הערה: תיקון והכתמה organoids יכול להיעשות או בצלחת התרבות 96-well או צינורות microcentrifuge. Paraformaldehyde (PFA) צריך להיות מטופל רק במכסה אדים.- לקיבעון בצינורות microcentrifuge, להעביר organoids חי צינורות נפרדים עם 1-8 organoids לכל צינור.
הערה: אין לחרוג מ-8 אורגנואידים לכל צינור. - הסר בזהירות ולהשליך מדיום רב ככל האפשר מן הצינור מבלי לגעת organoids.
- הוסף 4% PFA לכל צינור או טוב (300-400 μL לכל צינור microcentrifuge ו 100-200 μL לכל באר של צלחת 96 טוב). דגירה בטמפרטורת החדר במשך 30-45 דקות.
הערה: זמני הדגירה מעל 1 שעה עשויים לדרוש שלבי אחזור אנטיגן ואינם מומלצים. - להשליך בבטחה את PFA מבלי להפריע organoids. בצע 3 שטיפות עם DPBS בתוספת 1.5 גרם / ליטר גליצין (DPBS / Gly), באמצעות אותו נפח המשמש עבור 4% PFA, מחכה 5 דקות בין כביסות. הסר DPBS/Gly והמשיך לחיסון או ניתוחים אחרים או להוסיף DPBS ולאחסן ב 4 °C לשימוש עתידי עד 2 שבועות.
הערה: אחסון organoids קבוע במשך יותר מ 2 שבועות עלול לגרום השפלת רקמות וזיהום ולא מומלץ.
- לקיבעון בצינורות microcentrifuge, להעביר organoids חי צינורות נפרדים עם 1-8 organoids לכל צינור.
- כתמים אימונופלואורסצנטיים בהר שלם
- הוסף 100 μL של פתרון חסימה/פרמביליזציה (10% סרום חמור רגיל + 0.5% אלבומין סרום בקר (BSA) + 0.5% Triton X-100 ב- 1x DPBS) לכל באר או צינור המכיל את האורגנוידים הקבועים. דגירה בטמפרטורת החדר לילה על שייקר.
הערה: אין לחרוג מ-8 אורגנואידים לכל צינור. - הסר בזהירות ולהשליך כמה שיותר של פתרון חסימה ככל האפשר מבלי לגעת organoids. בצע 3 שטיפות עם DPBS, מחכה 5 דקות בין כביסות.
- הכן את פתרון הנוגדנים העיקרי (1% סרום חמור רגיל + 0.5% BSA + 0.5% טריטון X-100 ב- 1x DPBS) עם הנוגדנים העיקריים הרצויים בריכוזים המומלצים. דגירה ב 4 °C (55 °F) במשך 24 שעות על שייקר.
- יש להסיר ולהשליך בזהירות כמה שיותר מתמיסת הנוגדנים מבלי לגעת באורגנוידים. בצע 3 שטיפות עם DPBS, מחכה 5 דקות בין כביסות.
- הכן פתרון נוגדנים משני (1% סרום חמור רגיל + 0.5% BSA + 0.5% טריטון X-100 ב- 1x DPBS) עם הנוגדנים המשניים הרצויים בריכוזים המומלצים. אם הנוגדנים מסומנים באופן פלואורסצנטי, דגירה ב 4 °C (4 °F) בחושך (למשל, מכוסה בנייר אלומיניום) במשך 24 שעות על שייקר.
- יש להסיר ולהשליך בזהירות כמה שיותר מתמיסת הנוגדנים מבלי לגעת באורגנוידים. בצע 3 שטיפות עם DPBS, מחכה 5 דקות בין כביסות.
- הכן שקופיות עם חרוזים (בקוטר 90-300 מיקרומטר) המותקנות במדיום הרכבה (ראה טבלת החומרים) ליד קצות השקופית שבה יוצב כיסוי עם האורגנוידים.
הערה: מומלץ לאפשר למדיום הרכבה סביב החרוזים להתייבש לפני שתמשיך; זה ימנע מה חרוזים לנוע. ראו איור 2. - מעבירים את האורגנוידים המוכתמים באמצעות קצה פיפטה חתוך לשקופית, בין החרוזים, ומבטיחים ריווח כדי למנוע מגע בין האורגנוידים פעם אחת בשקופית. השתמש בפינה של מנגב מעבדה מגולגל כדי להסיר בזהירות נוזל עודף סביב organoid.
- לכסות את organoids עם בינוני ניקוי הרכבה (פתרון סליקה פרוקטוז-גליצל הוא 60% (vol/vol) גלצל ו 2.5 M פרוקטוז)37 באמצעות 120-150 μL של מדיום ניקוי הרכבה לכל שקופית.
הערה: מומלץ להשתמש קצה pipette לחתוך בעת עבודה עם מדיום הרכבה-ניקוי כפי שהוא מאוד צמיג. - רחף מעל כיסוי מעל השקופית עם organoids מכוסה פתרון ניקוי הרכבה ולאט לאט לחץ על כיסוי מעל השקופית, להבטיח את organoids הם בין החרוזים המותקנים.
- אוטמים את היקף כיסויי המכסה במגלשה באמצעות לכה בציפורניים מעיל עליון. אפשר למגלשה להתייבש בחושך בטמפרטורת החדר למשך שעה אחת. יש לאחסן ב-4 °C (75°F) בחושך לאחסון לטווח ארוך.
- הוסף 100 μL של פתרון חסימה/פרמביליזציה (10% סרום חמור רגיל + 0.5% אלבומין סרום בקר (BSA) + 0.5% Triton X-100 ב- 1x DPBS) לכל באר או צינור המכיל את האורגנוידים הקבועים. דגירה בטמפרטורת החדר לילה על שייקר.
- סידן ארעי הדמיה באורגנוידים לב חי
הערה: על פי הוראות היצרן, Fluo4-AM הוחזר בדימתיל סולפוקסיד (DMSO) לריכוז פתרון מלאי סופי של 0.5 מ"מ. Fluo4-AM נוספה ישירות לבאר האורגנויד בצלחת 96-well.- בצע 2 שטיפות על organoids באמצעות RPMI 1640 בינוני.
- הסר 166 μL של המדיום בילה מהבאר.
- הוסף 166 μL של RPMI 1640 בינוני מחומם, להסיר 166 μL של בינוני, ולהוסיף 166 μL של RPMI טרי 1640 בינוני.
הערה: הכביסות נעשות כדי להסיר חומר פסולת ופסולת תאים. שני שלישים מהמדיום מוסרים מהבארות במהלך הכביסה כדי למנוע הפרעה לאורגנואידים בתחתית הבאר לפני ההסתה התפקודית.
- הוסף פלואו-4-AM מדיום לאורגנואידים.
- הוסף Fluo4-AM מחדש ב- DMSO ל- RPMI 1640 המכיל תוספת B-27 להכנת פתרון 1.5 מיקרומטר.
- הסר 166 μL של בינוני מהבאר.
- הוסף 166 μL של 1.5 μM Fluo4-AM ב RPMI 1640 המכיל תוספת B-27 לריכוז באר סופית של 1 מיקרומטר. דגירה ב 37 °C (5°F), 5% CO2 במשך 30 דקות.
- בצע 2 שטיפות כמו בשלב 3.4.1.
- הוסף 166 μL של RPMI 1640 המכיל תוספת B-27 לבאר.
- בעזרת קצה חתוך של קצה פיפטה P200, העבר את האורגנויד לצלחת פטרי עם תחתית זכוכית (למשל, כיסוי עם 8 בארות עם משקפת בעלת ביצועים גבוהים מס' 1.5) עם 100-200 מיקרול בינוני.
הערה: ראה סעיף 3.1 על העברת organoids שלם. - תמונה האורגנוידים חיים תחת מיקרוסקופ עם תא מבוקר טמפרטורה ופחמן דו חמצני ב 37 °C (5°F), 5% CO2.
- להקליט כמה קטעי וידאו 10-20 s במקומות שונים ברחבי organoid, מראה את העלייה והירידה ברמות עוצמת פלואורסצנטיות כמו הסידן נכנס ויוצא התאים.
הערה: להקלטות ברזולוציה גבוהה, מומלץ להקליט במהירות של 10 fps או מהר יותר; מומלץ 50 fps. - נתח את הסרטונים באמצעות תוכנת ניתוח תמונה (למשל, ImageJ) על-ידי בחירת אזורי עניין ומדידת רמות עוצמת לאורך זמן.
- לנרמל את הקלטות האינטנסיביות באמצעות ΔF / F0 לעומת זמן באלפיות שניה ועלילה.
- בצע 2 שטיפות על organoids באמצעות RPMI 1640 בינוני.
תוצאות
כדי להשיג ארגון עצמי hHO במבחנה, שינינו ושילבנו פרוטוקולי בידול שתוארו בעבר עבור הבחנה דו-שכבתית של קרדיומיוציטים21 ותאים אפיקרדיים22 באמצעות אפננים מסלול Wnt עבור 3D אורגנוידים טרום לב16 באמצעות גורמי גדילה BMP4 ו Activin A. באמצעות לוח 96-well EB ו- hHO פרוטוקול בידול המתואר כאן ומוצג איור 1 הריכוזים ומשכי החשיפה של מפעיל מסלול Wnt CHIR99021 היו מותאמים להפקת hHOs רב-ניתן לשחזור ומורכבים ביותר שמקורם במחשבים אנושיים. hPSCs או hESCs מתורבתים ב- PSC בינוני עד 60-80% השפעה במבנה דמוי מושבה עם הבחנה מינימלית עד ללא הבחנה נראית לעין אידיאליים עבור דור EB (איור 1B).,
EBs הורשו לדגור במשך 48 שעות עם שינוי בינוני לאחר 24 שעות לפני תחילת בידול ביום 0. ביום 0, ה-EBs אמור להופיע כצבירה כדורית כהה במרכז כל באר תחת מיקרוסקופ בהיר (איור 1B). פרוטוקול הבידול מתחיל ביום 0 עם הפעלת מסלול Wnt ותוספת גורם גדילה עבור בדיוק 24 שעות. אינדוקציה זו mesoderm ואחריו אינדוקציה mesoderm לב ביום 2 באמצעות מעכב מסלול Wnt Wnt-C59 יגרום הגדלה משמעותית של organoid מ ~ 200 מיקרומטר בקוטר ל 500-800 מיקרומטר בקוטר ביום 4 ועד ככל 1 מ"מ (organoids עלול לחוות ירידה קלה בגודל ביום 15 (איור 1C)). ה- hHO יתחיל להכות כבר ביום 6 (וידאו 1), כאשר 100% מהאורגנוידים מראים מכות גלויות ביום 10 (וידאו 2) (אלא אם כן נעשה טיפול תרופתי או אם hPSCs לקוי שימשו ליצירת ה- EBs). זה נצפתה ב 5 קווי תא hPSC נפרדים23.
כדי להעריך את היכולת של hHOs לייצג שלבים שונים של ההתפתחות הפיזיולוגית של הלב, אספנו organoids בנקודות זמן שונות לאורך פרוטוקול הבידול וחיפשנו את הנוכחות ואת הביטוי התמלול של סמני שדה הלב. כתמים אימונופלואורסצנטיים עבור סמן שדה הלב הראשון (FHF), HAND1, וסמן שדה הלב השני (SHF), HAND2, חשפו את נוכחותם הגרעינית בתאי אבות הלב האלה הנובעים בסביבות היום השלישי והיום החמישי, בהתאמה (איור 3A).
הביטוי של שני הסמנים קורה באזורים של organoids כי להקטין בגודל לאחר יום 7 עבור FHF ואחרי יום 9 עבור SHF. מעניין, תמונות הגדלה גבוהה של אורגנוידים יום 7 גילו כי רוב התאים HAND1-מבטא היו cardiomyocyte במקור (כפי שמוצג על ידי סמן ספציפי cardiomyocyte TNNT2). לעומת זאת, רבים מהתאים מבטאי HAND2 לא הביעו את סמן הקרדיומיוצייט (איור 3B). תצפית זו היא בהסכמה עם organoids טרום לב נגזר ESCs עכבר מדגים את ההתפתחות של תאים שאינם myocyte מתאי האב SHF16. חשוב לציין שנתוני ריצוף הרנ"א מראים שתמלילי הרנ"א עבור HAND1 ו-HAND2 התבטאו מהיום השלישי ואילך, כאשר סמן ה-FHF בא לידי ביטוי גבוה יותר בין הימים 3-11 וסמן ה-SHF בא לידי ביטוי גבוה יותר לאחר היום ה-13 (איור 3C).
כתמי אימונופלואורסצנטיות חשפו את נוכחותם של סמנים של שושלות תאים שונות המרכיבות את הלב האנושי. רקמת שריר הלב (ניתנת לזיהוי באמצעות הסמן הספציפי לקרדיומיוציטים TNNT2) בסמוך לרקמת אפיקרדיה (המסומנת על ידי גורם התמלול הגרעיני WT1 וסמן קרום האפיתל TJP1) (איור 4A). תאים אנדוקרדיים המביעים את NFATC1 זוהו מרפדים את קירות המבנים הפנימיים דמויי התא בתוך האורגנוידים (איור 4B). ניתן לראות תאים אנדותל ברשת דמוית כלי שיט כבר ביום 13 של בידול (איור 4C). לבסוף, אנו מדווחים על נוכחות של פיברובלסטים לב מעורבבים ברחבי האורגנויד (איור 4D). סמנים מסוג תאים אלה נצפו גם בפרופילי ביטוי הגנים RNA-Seq (איור 4E). הרכב סוגי התאים באורגנוידים, כפי שהוא נמדד לפי אזור האורגנויד שהם תופסים, נמצאו כ- ~ 58% קרדיומיוציטים, כאשר השאר מורכב מתאי לב שאינם מיוציטים, כולל תאים אפיקרדיאליים (~ 15%), תאי אנדוקרדיים (~ 13%), פיברובלסטים לב (~ 12%), ותאי אנדותל (~ 1%) (איור 4F).
התפקוד האלקטרופיזיולוגי של האורגנוידים נמדד על ידי הדמיית סידן חיה של תאים בודדים באורגנוידים שלמים. עוצמת הפלואורסצנטיות של פלואו-4 משתנה עם הזמן עקב כניסת סידן ויציאה מהתא, מה שמחשוף פוטנציאל פעולה קבוע (איור 5A). מפת חום המציגה עוצמות סידן מעל אזור הגדלה גבוהה של האורגנויד מראות את העוצמה המוגברת בגלל סידן ארעי בתאים בודדים (איור 5B ו-Video 3).
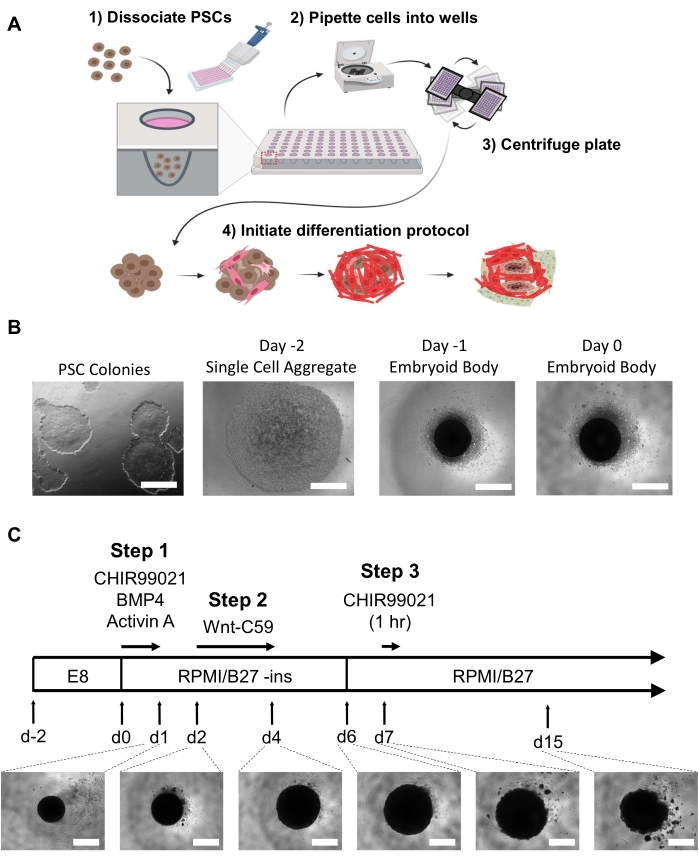
איור 1: דור גוף עוברי ושלבי בידול אורגנוידים ללב. (A) (1-2) תאים מנותקים נזרעים לבארות של צלחת התקשרות אולטרה-נמוכה בעלת 96 בארות באמצעות פיפטה רב-ערוצית. (3) הלוח 96-באר הוא אז צנטריפוגה, אשר מאפשר לתאים לצבור במרכז. (4) עם הזמן, בעקבות הוספת גורמי גדילה ומאפננים מסלול, הגוף העוברי מתחיל להתבדל למספר שושלות לב וליצור אוכלוסיות תאים נפרדות מרחביות ופיזיולוגיות המקיפות מיקרוצ'מברים פנימיים. (B) תמונות מייצגות של התקדמות ייצור הגוף העוברי, החל מתרבות iPSC דו-ממדית (משמאל) וכלה בגוף עוברי יום 0 (מימין); סרגל קנה מידה = 500 מיקרומטר. (C) סיכום פרוטוקול בידול אורגנויד לב האדם, כולל אפננים ומעכבי מסלול כימיים עם נקודות זמן, משכי זמן ופיתוח תמונות organoid תחת מיקרוסקופיה אור מיום 1 עד יום 15; סרגל קנה מידה = 500 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
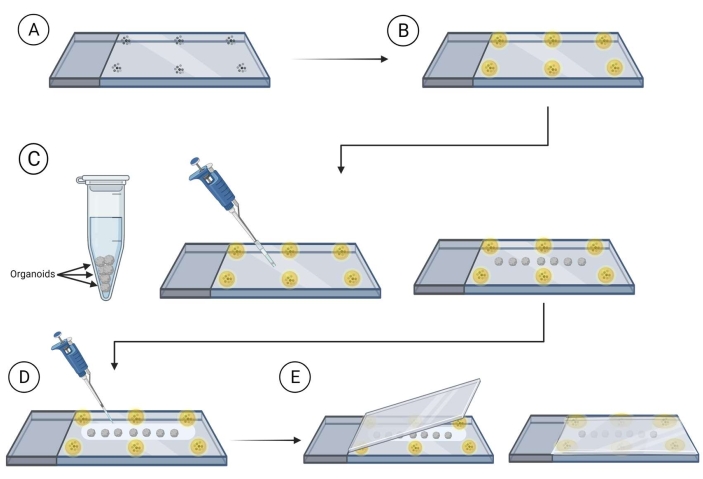
איור 2: הרכבה אורגנויד שלם על שקופיות להדמיה. שלבים להכנת שקופיות והרכבת אורגנוידים להדמיה. (א) מיקום חיידקים בשולי מגלשת זכוכית. (B) מכסה את החיידקים עם בינוני הרכבה. (ג) העברת organoids על השקופית בין החרוזים והסרת נוזל עודף סביב organoids. (ד) מכסה את האורגנוידים עם מדיום ניקוי/הרכבה. (ה) הצבת כיסוי על גבי השקופית עם organoids וחרוזים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: שדה הלב הראשון ומפרט שדה הלב השני ב- hHOs מסכם את התפתחות הלב האנושי הפיזיולוגי. (A) תמונות אימונופלואורסצנטיות קונפוקליות של היום השלישי עד היום 11 hHOs המציגות את היווצרות FHF (HAND1, top) ו- SHF (HAND2, למטה) וקרדיומיוציטים (TNNT2) וצבע גרעיני DAPI; מוטות קנה מידה = 500 מיקרומטר. (B) תמונות הגדלה גבוהה של יום 7 organoids המציגים לוקליזציה משותפת של HAND1 ו HAND2 עם סמן cardiomyocyte TNNT2; סרגלי קנה מידה = 50 מיקרומטר. (C) פרופילי ביטוי גנים RNA-Seq של סמן FHF HAND1 (אדום) וסמן SHF HAND2 (כחול) מיום 0 ועד יום 19. קיצורים: hHOs = אורגנוידים לב אנושי; FHF = שדה לב ראשון; SHF = שדה לב שני; יד = נגזרות לב ופסגה עצבית לידי ביטוי; TNNT2 = טרופונין לב T2; DAPI = 4',6-דיאמידינו-2-פנילינדול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: hHOs מפתחים שושלות לב. (א-ד) תמונות אימונופלואורסצנטיות קונפוקליות של יום 15 hHOs המציגות היווצרות של קרדיומיוציטים (TNNT2) וכתמים עם DAPI צבע גרעיני בתאי לב שאינם מיוציטים. (A) אורגנויד שלם והגדלה גבוהה של סמן אפיקרדיאלי WT1 (ירוק) וסמן קרום אפיתל TJP1 (לבן) מראה תאים אפיקרדיאליים ממוצא אפיתל על גבי ובסמוך לרקמת שריר הלב; סרגל קנה מידה = 500 מיקרומטר, כניסה = 50 מיקרומטר. (B) סמן אנדוקרדי NFATC1 (ירוק) ביטוי על בטנה של תאים; סרגל קנה מידה = 500 מיקרומטר. (C) רשת כלי אנדותל ב hHOs המוצגת על ידי PECAM1 (ירוק). סרגל קנה מידה = 500 מיקרומטר. (D) סמני פיברובלסטים לבאיים THY1 ו- VIM המוצגים בירוק ולבן, בהתאמה, מופצים ברחבי האורגנויד. סרגל קנה מידה = 500 מיקרומטר. (E) פרופילי ביטוי גנים RNA-Seq של סוגי התאים העיקריים הקיימים ב- hHOs מימים 0 עד 19 של בידול. קיצורים: hHOs = אורגנוידים לב אנושי; TNNT2 = טרופונין לב T2; DAPI = 4',6-דיאמידינו-2-פנילינדול; WT1 = גורם התמלול של וילם-1; NFATC1 = גורם גרעיני ציטופלסמי של תא T מופעל; PECAM1 = מולקולת הידבקות תאי אנדותל טסיות דם-1; VIM = vimentin. (ו) תרשים עוגה של הרכב סוג הרקמה הממוצע ב- hHOs, המחושב כאזור האחוז עם סמן התא המתאים על פני אורגנויד שלם על ידי כתמים גרעיניים על פני שלושה z-מישורים ברחבי organoid באמצעות ImageJ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: Fluo-4 הקלטות חולפות סידן חי באורגנוידים חיים של לב אנושי. (A) הקלטות חולפות סידן מייצגות של קרדיומיוציטים בודדים בתוך organoids שלם. (B) מפת חום המציגה רמות סידן נמוכות ופסגות בין פוטנציאל פעולה כפי שנקבע על ידי עוצמת Fluo-4; סרגלי קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
וידאו 1: הדמיה חיה של אורגנויד מייצג המופק hPSCs ביום 6 של בידול תחת מיקרוסקופיה קלה בטמפרטורת החדר. קיצור: hPSC = תא גזע פלוריפוטנטי אנושי. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 2: הדמיה חיה של אורגנויד מייצג המופק hPSCs ביום 15 של בידול תחת מיקרוסקופיה קלה בטמפרטורת החדר. קיצור: hPSC = תא גזע פלוריפוטנטי אנושי. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 3: הקלטה חיה של יום 10 organoid מראה מפת חום של ארעי סידן תחת מיקרוסקופ פלואורסצנטיות. אנא לחץ כאן כדי להוריד וידאו זה.
Discussion
ההתקדמות האחרונה בקרדיומיוציטים שמקורם בתאי גזע אנושיים ובתאים אחרים ממוצא לבבי שימשו למודל התפתחות הלב האנושי22,24,25 ומחלות26,27,28 וכלים לבדיקת טיפולים29,30 וסוכנים רעילים31,32 . כאן, אנו מדווחים על פרוטוקול קל ליישום, רב לשחזור כדי ליצור ולהבדיל EBs לתוך hHOs מורכב מאוד. פרוטוקול זה הצליח בשורות תאים מרובות, כולל hPSCs ו- hESCs23, המציגים תדרי פעימה עקביים וארגון סוג תא. פרוטוקול זה שואב היבטים מפרוטוקולים שתוארו בעבר עבור בידול קרדיומיוציטים24, בידול תאים אפיקרדיאלי22, ואורגנוידים טרום לב הנגזרים מ- ESCs16 עכבר ומייעל את אפנון הצעדים של איתות WNT קנוני באמצעות מעכבים כימיים וגורמי גדילה במדיום מוגדר במלואו. מספר מתודולוגיות אופטימיזציה הופעלו ביצירת פרוטוקול זה.
ראשית, ריכוזי מעכב כימי ומשכי חשיפה, כמו גם תוספת של גורמי גדילה, עברו אופטימיזציה לסביבה 3D והם נדונים בעבודה קודמת23. אלה היו ממוטבים כדי להדגיש מבנים עם מורכבות פיזיולוגית וייצוג של הלב האנושי in vivo , עם הרכב פיזיולוגי ויחסים של cardiomyocytes לסוגי תאי לב שאינם מיוציטים (תאים אפיקרדיים, פיברובלסטים לב). שנית, אסטרטגיית השינוי הבינוני של שני שלישים מאפשרת תסיסה מינימלית של EBs / organoids, כפי שהם יושבים בהשעיה ליד החלק התחתון של הבאר, תוך גם להקל על חשיפה הדרגתית מעכבים כימיים וגורמי גדילה כאשר המדיום מתרענן. השילוב של בידול mesoderm לב באמצעות הפעלת מסלול Wnt, ואחריו עיכוב24, ואת האינדוקציה הבאה של מפרט פרו-אפיקרדיאלי באמצעות הפעלת מסלול Wnt שני22, מאפשר פרוטוקול יחיד להניב hHOs מורכב מאוד. האורגנוידים גדלים עד 1 מ"מ לאחר 15 ימים של בידול וניתן להעביר אותם בקלות עבור ניתוחים ובוחות חיים או קבועים. שלישית, בהתחשב בגודל הגדול של organoids, השימוש microbeads או מבנים דומים אחרים כדי לשמור על רווח בין השקופית כיסוי נמצא כדי לשמר טוב יותר את המבנה 3D של organoids ולשפר את תהליך ההדמיה.
מודל לב אנושי מתפתח זה מאפשר גישה לשלבים בלתי נגישים אחרים של התפתחות הלב, כגון מפרט שדה הלב הראשון והשני מוקדם והשני- נצפה בין ימים 3 ו -9 של בידול - וארגון לתאי אבות לב המעוררים רקמות לב, כולל שריר הלב, אנדוקרדיום, אפיקרדיום, vasculature אנדותל, ותמיכה פיברובלסטים לב, אשר נצפו ביום 15 של בידול. סוגי הרקמות הנמצאים באורגנוידים של הלב הנגזרים מפרוטוקול זה מייצגים מאוד את הלב העוברי האנושי הן בקומפוזיציה33 והן בפרופיל התמלול23,34. לכן הם יכולים להקל על רקמת רקמות ואינטראקציות מסדר גבוה יותר של תאי תא הדומה לזה של הלב in vivo. פרוטוקול זה היה יעיל מאוד ושחזור על פני ניסויים וקווי תאים, מניב organoids המרכיבים בעיקר של cardiomyocytes וכוללים תאי לב שאינם myocyte, כגון תאים epicardial, תאי אנדוקרדיים, פיברובלסטים לב, ותאי אנדותל, המייצגים את הרכב פיזיולוגי23,33,35.
ניתוחים של ההשמדה האולטרה-מבנית של הקרדיומיוציטים היוצרים באמצעות מיקרוסקופיית אלקטרונים שידור ופיתוח תאים ורשת כלי דם באמצעות טומוגרפיה קוהרנטית אופטית והדמיה קונפוצלית נדונים בפירוט בעבודה הקודמת23. יתרון גדול של פרוטוקול organoid לב זה על פרוטוקולים קיימים אחרים שפורסמו לאחרונה17,18,19,20,36,37 הוא היווצרות חזקה של רשת אנדותל ברחבי organoid, המאפשר את היכולת לחקור התפתחות כלי דם ומחלות בלב האדם המוקדם, ללא צורך אינדוקציה חיצונית נוספת לפרוטוקול. לבסוף, ניתוח פונקציונלי של organoids הלב הוא בר השגה באמצעות גישות שונות, כולל שימוש בצבע רגיש לסידן כדי לעקוב אחר החולף סידן בקרדיומיוציטים על פני organoid. באמצעות מיקרוסקופיה ברזולוציה גבוהה, רשמנו את עוצמת הפלואורסצנטיות של סידן הנכנס ויוצא מתאים ונצפו בפוטנציאל פעולה מייצג מאוד. שיטות ניתוח פונקציונליות אפשריות אחרות כוללות שימוש בקו מהונדס עם מחוון רגיש לסידן או הקלטה ישירה באמצעות מערך microelectrode23.
האורגנוידים הלב המתוארים כאן הם recapitulative של הלב העוברי המתפתח, אך מוגבלים בהדגמת תכונות בוגרות יותר, כמו מבוגר. פרוטוקולים עתידיים עשויים לבנות על הפרוטוקול המתואר כאן כדי לגרום להבשלה באורגנוידים אלה ולהניב מבנים שמדגמים טוב יותר את הלב הבוגר. יתר על כן, פרוטוקול זה נועד ליצור מודלים זעירים של הלב האנושי ומוגבל למחקרים על התפתחות הלב ומחלות או לבדיקת תרופות וייתכן שאינו מתאים כאמצעי להתערבות קלינית כגון החלפת רקמת לב באמצעות השתלה. בסך הכל, אנו מתארים כאן פרוטוקול קל למעקב וחסכוני ליצירת אורגנוידים לב אנושיים ניתנים לשחזור ומתוחכם ביותר שיכולים להקל על מחקרים בהתפתחות הלב האנושי, אטיולוגיה של מחלות והקרנה פרמקולוגית.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי מכון הלב, הריאות והדם הלאומי של המכונים הלאומיים לבריאות תחת מספרי הפרסים K01HL135464 ו- R01HL151505 ועל ידי איגוד הלב האמריקאי תחת פרס מספר 19IPLOI3660342. אנו מבקשים להודות לליבת המיקרוסקופיה המתקדמת של MSU וד"ר ויליאם ג'קסון במחלקת MSU לפרמקולוגיה וטוקסיקולוגיה על גישה למיקרוסקופים קונפוקליים, לליבת המיקרוסקופיה של IQ ולליבה הגנומית של MSU עבור שירותי רצף. אנו גם רוצים להודות לכל חברי מעבדת אגירה על הערותיהם ועצותיהם החשובות.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
References
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593(2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514(2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215(2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723(2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098(2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94(2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4(2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140(2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283(2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003(2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142(2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538(2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , Sinauer Associates. Sunderland (MA). 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved