Method Article
다능성 줄기 세포에서 파생된 자가 조립 인간 심장 오르가노이드 생성
요약
여기서, 우리는 자기 조직에 의하여 인간 다능성 줄기 세포를 사용하여 발달적으로 관련있는 인간 심장 오르가노이드 (hHOs)를 만드는 프로토콜을 기술합니다. 이 프로토콜은 발달 단서의 순차적 활성화에 의존하고 매우 복잡하고 기능적으로 관련된 인간 심장 조직을 생성합니다.
초록
건강과 질병에서 인간의 심장 발달을 연구하는 능력은 체외에서 인간의 심장의 복잡성을 모델링하는 능력에 의해 매우 제한됩니다. 오르가노이드 및 장기 온 칩과 같은 생체 내 표현형에서 복합체를 모델링할 수 있는 보다 효율적인 장기 와 같은 플랫폼을 개발하면 인간의 심장 발달과 질병을 연구하는 능력이 향상됩니다. 이 논문은 인간 만능 줄기 세포를 사용하여 자기 조직에 의해 매우 복잡한 인간 심장 오르가노이드 (hHOs)를 생성하고 작은 분자 억제제를 사용하여 단계별 발달 경로 활성화를 생성하는 프로토콜을 설명합니다. 배아 체(EB)는 둥근 바닥, 초저 부착 우물이 있는 96웰 플레이트에서 생성되어 개별화된 구조의 현탁액 배양을 용이하게 합니다.
EB는 심장 중피 운명을 유도하기 위한 초기 Wnt 통로 활성화, 결정적인 심장 혈통을 만들기 위한 Wnt 억제의 두 번째 단계, 그리고 미원성 장기 조직을 유도하는 세 번째 Wnt 활성화 단계를 포함하는 3단계 Wnt 신호 변조 전략에 의해 hHOs로 분화를 거칩니다. 96웰 형식으로 수행되는 이 단계는 매우 효율적이고 재현 가능하며 실행당 다량의 오르가노이드를 생성합니다. 3일부터 11일까지 11일째에 면역형광 영상에 의한 분석은 심방 및 심실 심근세포의 영역을 가진 심근 조직뿐만 아니라 내시경 조직으로 늘어선 내부 챔버를 포함하여 15일째에 hHOs 내부의 첫 번째 및 두 번째 심장 장 사양 및 매우 복잡한 조직을 보여줍니다. 오르가노이드는 또한 구조 전반에 걸쳐 복잡한 혈관 네트워크와 상피 조직의 외부 안대기를 나타낸다. 기능적 관점에서 hHSo는 플루오-4 라이브 이미징에 의해 결정된 정상 칼슘 활성을 견고하게 이길 수 있습니다. 전반적으로, 이 프로토콜은 인간 장기 같이 심장 조직에 있는 체외 연구를 위한 단단한 플랫폼을 구성합니다.
서문
선천성 심장 결함 (CHDs)은 인간에 있는 선천적인 결함의 일반적인 모형이고 모든 살아있는 출생의 대략 1%에 영향을 미칩니다1,2,3. 대부분의 상황에서 CHD의 이유는 아직 알려지지 않았습니다. 발달하는 인간 심장과 밀접하게 유사한 실험실에서 인간 심장 모델을 만드는 능력은 대리 동물 모델보다는 인간에서 CHDs의 근본 원인을 직접 연구하는 중요한 단계를 구성합니다.
실험실에서 자란 조직 모델의 전형은 세포 조성 및 생리 기능에 대한 관심기관과 유사한 오르가노이드, 3D 세포 구조입니다. 오르가노이드는 종종 줄기 세포 또는 전구 세포에서 파생되며 성공적으로 뇌4,5, 신장6,7, 장8,9, lung10,11, liver12,13 및 췌장14,15와 같은 많은 장기를 모델링하는 데 성공적으로 사용되었습니다. , 그냥 몇 가지 이름을 지정합니다. 최근 연구는 체외에서 심장 발달을 연구하기 위해 자기 조립 심장 오르가노이드를 만드는 타당성을 입증 등장했다. 이러한 모델은 마우스 배아 줄기 세포 (mESC)를 사용하여 초기 심장 발달을 모델링16,17 최대 대상반성 사양18 및 인간 다능성 줄기 세포 (hPSCs)를 사용하여 다발성 층 심장 엔데데름 오르노이드19 및 매우 복잡한 세포 구성을 가진 챔버 심장 근막 20을 생성합니다.
이 논문은 효율적이고 비용 효율적인 방식으로 매우 복잡한 hHOS를 생성하는 새로운 3 단계 WNT 변조 프로토콜을 제공합니다. 오가노이드는 96웰 플레이트에서 생성되어 쉽게 자동화할 수 있는 확장 가능한 고처리량 시스템을 생성합니다. 이 방법은 hPSC 골재를 생성하고 심근 및 심장 중구 형성, 제 1 및 두 번째 심장 필드 사양, 미상동맥 기관 형성 및 대상 동맥 사양을 포함한 심장 발생의 발달 단계를 유발하는 데 의존합니다. 분화 후, hHOs는 심장에서 발견 되는 모든 주요 세포 혈통을 포함, 잘 정의 된 내부 챔버, 심방 및 심실 챔버, 그리고 오르가노이드 에 걸쳐 혈관 네트워크. 이 매우 정교하고 재현 가능한 심장 오르가노이드 시스템은 심장 발달, 질병 및 약리학적 스크리닝의 연구에서 구조적, 기능적, 분자 및 전사 적 분석을 조사할 수 있습니다.
프로토콜
1. hPSC 문화 및 유지 보수
참고: 인간 유도 된 PSC (hiPSCs) 또는 인간 배아 줄기 세포 (hESC)는 분화 또는 추가 극저온 보존을 위해 EB를 생성하는 데 사용되기 전에 해동 후 적어도 2 개의 연속 된 구절을 배양해야합니다. hPSC는 지하 막 세포 매트릭스 (BM-ECM)-코팅 된 6 웰 배양 판에 PSC 배지 ( 재료의 표 참조)에서 배양된다. 6웰 플레이트에서 hPSC에 대한 중간 변화를 수행할 때, 원치 않는 세포 분리 또는 스트레스를 방지하기 위해 세포 위에 직접 붙이지 않고 우물 의 내부 측면에 직접 배지를 추가합니다. 사용자는 37 °C에서 따뜻하게해서는 안되는 사전 온난화 PSC 미디어를 주의해야합니다. 이 프로토콜에 사용된 모든 PSC 미디어는 열불안정이었습니다.
- BM-ECM로 잘 플레이트를 코팅하려면 BM-ECM의 알리쿼트 1개(제조업체의 지침에 따라 -20°C에 저장됨)를 얼음에 해동하고 BM-ECM의 0.5 mg을 12mL의 콜드 덜벡코의 수정된 이글 매체(DMEM)/F12 매체(4°C에 저장)로 혼합한다. DMEM/F12-BM-ECM 혼합물을 6웰 플레이트의 각 웰에 분배하고 37°C에서 적어도 2시간 동안 배양한다.
- 세포를 해동하려면 먼저, 소량의 얼음만 보일 때까지 37°C 비드 또는 수조에서 hPSC 극저온을 1-2분 동안 해동한다. 해동된 세포를 원심분리기 튜브로 옮기고 록 억제제, 티아조빈(Thiaz) 및 원심분리기를 5분 × 300g 에 2μM로 보충된 PSC 배지의 8-9mL를 천천히 첨가한다. 상체를 제거하고 티아즈의 2 μM으로 보충된 PSC 배지의 세포 펠릿을 다시 분리한다. 배양 배지내의 세포를 37°C에서 극저온 세포 농도 및 배양에 따라 1-2 웰로 분배하고, PSC 배지를 변경하기 전에 24시간 동안 5% CO2 를 한다.
- 세포의 배지를 48시간 간격으로 변경합니다. DMEM/F12(1mL/웰) 및 PSC 배지(2mL/웰)를 사용하여 세서및 중간 변화를 각각 수행합니다.
참고: 세싱은 세포 폐기물과 이물질을 제거하는 데 도움이 되며 신선한 미디어 변화는 세포에 영양분을 새롭게 공급합니다. - 배지를 달아서 소급(60-80% 컨서블)에 세포를 통과한 다음, 덜벡코의 인산염 완충액 1mL(칼슘 없음, 마그네슘 없음)로 각각 잘 세척합니다. DPBS). DPBS를 흡기하고 hPSC에 대한 해리 시약1mL을 추가합니다( 재료표 참조), 10s 이후 시약의 박막을 제외한 모든 사람의 포부를 포부한다.
- 세포 간 간격이 형성될 때까지 hPSC용 해리 시약의 박막으로 2-5분 동안 배양한다.
참고: 해리를 중지하는 시간은 세포 선에 따라 다릅니다. - 티아즈(PSC 매체+티아즈)의 2μM로 보충된 PSC 배지 1mL을 우물에 넣고 부드럽게 플레이트를 눌러 세포 분리를 유도합니다. 배지에서 분리된 세포를 1-2배 배혈하여 임의의 큰 식민지를 분해하고, PSC 배지+티아즈에서 세포를 1:6 의 음비로 재보종(12mL에서 잘 재장매된 12mL의 세포). BM-ECM 코팅 된 우물에 세포를 다시 플레이트.
2. 3D 자체 조립 인간 심장 오르가노이드의 세대
- 배아 체 (EB) 형성:
참고: 배아 체 형성 전에 관찰 가능한 분화 세포를 제한하는 것이 필수적입니다. 60-80%의 합류로 6웰 플레이트의 2~3개의 우물은 단일 96웰 의 오르가노이드 플레이트에 충분한 세포를 산출합니다. 모든 매체는 EB 또는 오르가노이드에 대한 온도 충격을 최소화하기 위해 중간 변화가 일어나기 전에 37°C 비드 또는 수조에서 알리인용 및 따뜻하게 해야 합니다(이것은 세포 해리 시약을 포함하지 않음). 그림 1A, B를 참조하십시오.- 일 -2
- EB를 만들려면- 2일째에 DPBS로 서브 컨셀릭 hPSC(60-80% 컨셀)를 세척하여 세포 잔해를 씻고 DPBS를 흡인시합니다.
- 세포를 분리하고 단일 셀 상태로 방출하려면 실온 셀 해리 시약 1mL( 재료 표 참조)을 각 웰에 3-6분 동안 추가합니다. 부드럽게 플레이트를 ~5회 탭하여 현미경으로 검사하는 동안 분리를 유도합니다. 반응을 중지PSC 중간 + 티아즈의 1 mL을 추가합니다.
- 세포를 수집하고 남은 골재를 분해하기 위해, 미디어를 2-3배 위아래로 피펫하여 단일 셀 서스펜션을 생성합니다. 단일 셀 서스펜션을 원심분리관으로 옮기고 300 ×g에서 5분 동안 회전 합니다.
- 원하는 세포 농도를 얻으려면, 상체를 버리고 PSC 배지+티아즈의 1mL에서 세포를 재보선한다. 세포 카운터 또는 혈류계를 사용하여 세포를 계산하고 PSC 배지+티아즈의 세포를 100,000세포/mL 의 농도로 희석시다.
- EB 형성을 위해 세포를 분배하려면 멀티채널 파이펫을 사용하여 라운드 바닥 초저 부착 96웰 플레이트의 각 웰에 100 μL(10,000개의 셀)을 추가합니다. 플레이트를 100 × g 에서 3분 동안 원심분리하고 37°C, 5% CO2에서 24시간 동안 배양합니다.
- 일 -1
- 각 우물에서 50 μL의 매체를 조심스럽게 제거하고 37°C로 데온 신선한 PSC 배지 200 μL을 추가하여 우물당 250 μL의 최종 부피를 달성합니다. 37°C, 5% CO2에서 24시간 동안 세포를 배양한다.
참고: 우물 하단의 EB가 방해되지 않도록 우물 측면에 매체를 조심스럽게 제거하고 추가합니다. EB의 섬세한 특성과 서스펜션 배양으로 인해, 심계를 변경할 때 소량의 액체를 각 우물에 두어 EB를 방해하지 않도록 해야 합니다.
- 각 우물에서 50 μL의 매체를 조심스럽게 제거하고 37°C로 데온 신선한 PSC 배지 200 μL을 추가하여 우물당 250 μL의 최종 부피를 달성합니다. 37°C, 5% CO2에서 24시간 동안 세포를 배양한다.
- 일 -2
- 인간 심장 오르가노이드 (hHO) 차별화:
참고: 모든 미디어는 미디어가 변경되기 전에 37°C 비드 또는 수조에서 데워져야 합니다. 웰 의 바닥에 개발 오르가노이드를 방해하지 않도록 우물의 측면에 배지를 조심스럽게 제거하고 추가합니다. 동요를 최소화하고 억제제와 성장 인자의 점진적 제거를 허용하기 위해 미디어 변화 사이에 는 과세가 필요하지 않습니다. 2% B-27 보충제(재료표)를 가진 RPMI는 분화 프로토콜 전반에 걸쳐 사용되었다. B-27 보충 명시 하지 않는 한 인슐린을 포함 (일 0-5 일에 인슐린 무료). 그림 1C를 참조하십시오.- 0일차
- 중피 혈통을 향한 차별화를 시작하려면, 각 우물에서 166 μL의 배지를 제거하고 (총 우물 부피의 ~ 2/3rd ) 인슐린없는 B-27 보충제를 포함하는 RPMI 1640의 166 μL을 추가, 6 μM CHIR99021, 1.875 ng / mL 뼈 형태 호르몬 4 (BMP4), 및 1.5 ng / mL 법 49 의 최종 CHIM 에 대한 1.5 ng / mL 1.25 ng/mL BMP4, 및 1 ng/mL 액티빈 A. 37°C에서 24시간, 5% CO2에 대한 인큐베이션.
- 1일차
- 각 우물에서 166 μL의 매체를 제거하고 인슐린이없는 B-27 보충제로 신선한 RPMI 1640의 166 μL을 추가하십시오. 37°C에서 24시간, 5% CO2에 대한 배양.
- 2일차
- 심장 중피 사양을 유도하기 위해 각 우물에서 166 μL의 매체를 제거하고 인슐린이 없는 B-27 보충제를 함유한 RPMI 1640의 166 μL과 3μM Wnt-C59의 최종 웰 농도를 37°C에서 48시간 동안 인큐베이트합니다.
- 4일차
- 각 우물에서 166 μL의 매체를 제거하고 인슐린이없는 B-27 보충제로 신선한 RPMI 1640의 166 μL을 추가하십시오. 37°C에서 48시간, 5% CO2에 대한 배양.
- 6일차
- 각 우물에서 166 μL의 매체를 제거하고 B-27 보충제로 RPMI 1640의 166 μL을 추가합니다. 37°C에서 24시간, 5% CO2에 대한 배양.
- 7일차
- 미원기 분화를 유도하기 위해 각 우물에서 166 μL의 배지를 제거하고 B-27 보충제를 함유한 신선한 RPMI 1640과 3 μM CHIR99021의 최종 웰 농도2 μM CHIR99021을 추가한다. 37°C에서 1시간, 5% CO2에 대한 인큐베이션을 사용할 수 있습니다.
- 각 우물에서 166 μL의 매체를 제거하고 B-27 보충제를 함유한 신선한 RPMI 1640의 166 μL을 추가합니다. 37°C에서 48시간, 5% CO2에 대한 배양.
참고: 오가노이드가 미디어 변경으로 인해 이동하기 쉽기 때문에 7일째에 두 번째 중간 변경사항에 주의해야 합니다. - 7일째부터 분석 또는 실험을 위한 수집 또는 전송까지 각 우물에서 166 μL의 배지를 제거하고 B-27 보충제를 함유한 166μL의 신선한 RPMI 1640을 추가하여 48시간마다 중간 변화를 수행합니다.
참고: 오르가노이드는 이전 발달 단계가 관심이 없는 한 15일째에 분석 및 실험을 할 준비가 되어 있습니다. 그들은 장기 문화 또는 성숙 실험을 위해 15 일 전을 배양 할 수 있습니다.
- 0일차
3. 오르가노이드 분석
- 전체 오르가노이드 전송(라이브 또는 고정)
참고: 라이브 오가노이드 전송의 경우 사용되는 파이펫 팁이 멸균되었는지 확인합니다.- 팁 개구부에서 P200 파이펫 팁 5-10mm를 잘라 서 직경이 2~3mm 넓어지게 됩니다.
- 파이펫이 완전히 수직(플레이트에 수직)되도록 오르가노이드를 포함하는 둥근 바닥에 팁을 직접 삽입합니다. 팁을 매체에 삽입하기 전에 파이펫 플런저가 이미 모든 방법을 누른지 확인합니다.
- 파이펫 플런저를 천천히 방출하여 유기체를 수집하기에 충분한 매체(100-200 μL)를 차지합니다.
- 표적 대상으로 배지로 오르가노이드를 전송합니다(예: 고정, 라이브 이미징, 전기생리학 기록, 새로운 플레이트 배양).
- 오가노이드 고정
참고: 96웰 배양판 또는 미세원심분리기 튜브에서 유기노이드를 고정하고 염색할 수 있습니다. 파라포름데히드(PFA)는 연기 후드에서만 처리해야 합니다.- 마이크로센티립후이 튜브의 고정을 위해 라이브 오가노이드를 튜브당 1-8개의 오르가노이드로 분리하여 이송합니다.
참고: 튜브당 8개의 오르가노이드를 초과하지 마십시오. - 유기체를 건드리지 않고 튜브에서 가능한 한 많은 매체를 조심스럽게 제거하고 폐기하십시오.
- 각 튜브 또는 웰에 4% PFA를 추가합니다(마이크로센심분리기 튜브당 300-400 μL, 96웰 플레이트의 웰당 100-200 μL). 실온에서 30-45분 동안 배양하십시오.
참고: 1h 이상의 잠복기에는 항원 검색 단계가 필요할 수 있으며 권장되지 않습니다. - 유기체를 방해하지 않고 PFA를 안전하게 폐기하십시오. 1.5g/L 글리신(DPBS/Gly)으로 보충된 DPBS로 3개의 세차를 수행하여 4% PFA에 사용되는 동일한 부피를 사용하여 세차 사이에 5분 간 대기합니다. DPBS/Gly를 제거하고 면역 염색 또는 기타 분석을 진행하거나 DPBS를 추가하고 4°C에 저장하여 최대 2주 동안 사용할 수 있습니다.
참고: 고정 된 오르가노이드를 2 주 이상 보관하면 조직 분해 및 오염이 발생할 수 있으며 권장되지 않습니다.
- 마이크로센티립후이 튜브의 고정을 위해 라이브 오가노이드를 튜브당 1-8개의 오르가노이드로 분리하여 이송합니다.
- 전산 면역형광 염색
- 블로킹/투과성화 용액 100μL(일반 당나귀 혈청 + 0.5% 소 세럼 알부민(BSA) + 1x DPBS에 0.5% 트리톤 X-100을 각각 웰 또는 고정 오르간로이드를 함유한 튜브에 추가합니다. 셰이커에서 하룻밤 동안 실온에서 배양하십시오.
참고: 튜브당 8개의 오르가노이드를 초과하지 마십시오. - 오가노이드를 건드리지 않고 가능한 한 많은 차단 용액을 조심스럽게 제거하고 폐기하십시오. DPBS로 3번 의 헤이시를 수행하여 5분 간 세동을 대기합니다.
- 권장 농도에서 원하는 1차 항체 항체와 함께 1차 항체 용액(1% 정상 당나귀 혈청 + 0.5% BSA + 0.5% Triton X-100 1x DPBS)을 준비한다. 셰이커에서 24시간 동안 4°C에서 배양합니다.
- 유기체를 건드리지 않고 가능한 한 많은 항체 용액을 조심스럽게 제거하고 폐기하십시오. DPBS로 3번 의 헤이시를 수행하여 5분 간 세동을 대기합니다.
- 권장 농도에서 원하는 이차 항체 항체와 함께 이차 항체 용액(일반 당나귀 혈청 + 0.5% BSA + 0.5% Triton X-100 1x DPBS)을 권장농도에서 원하는 이차 항체와 준비한다. 항체가 형광으로 표시되면, 어둠 속에서 4°C에서 배양(예를 들어, 알루미늄 호일로 덮여 있음)에 대해 셰이커에 24시간 동안 배양한다.
- 유기체를 건드리지 않고 가능한 한 많은 항체 용액을 조심스럽게 제거하고 폐기하십시오. DPBS로 3번 의 헤이시를 수행하여 5분 간 세동을 대기합니다.
- 비드(직경 90-300 μm)가 장착된 슬라이드를 슬라이드 가장자리 근처에 장착( 재료 표 참조)하여 오르가노이드로 커버슬립을 배치합니다.
참고: 진행 하기 전에 구슬 주위 마운팅 매체 건조 를 허용 하는 것이 좋습니다.; 이렇게 하면 구슬이 움직이지 못하게 됩니다. 그림 2를 참조하십시오. - 컷 파이펫 팁을 사용하여 스테인드 오르가노이드를 슬라이드에 옮기고, 비드 사이에, 슬라이드에서 오르가노이드 사이의 접촉을 피하기 위해 간격을 확보합니다. 압연 실험실 닦기의 모서리를 사용하여 유기성 주위의 과도한 액체를 조심스럽게 제거하십시오.
- 미끄럼방지 매체(과당-글리세롤 클리어링 액은 60%(vol/vol) 글리세롤과 2.5M 과당)37 을 사용하여 슬라이드당 마운팅 클리어링 매체의 120-150 μL을 사용하여 오르가노이드를 덮는다.
참고: 매우 점성이 있기 때문에 장착 클리어링 매체로 작업할 때 절단 파이펫 팁을 사용하는 것이 좋습니다. - 마운팅 클리어링 솔루션으로 덮인 오르가노이드로 슬라이드 위에 커버슬립을 마우스로 가져가서 슬라이드 위로 커버슬립을 천천히 눌러 오르가노이드가 장착된 구슬 사이에 있는지 확인합니다.
- 탑 코트 네일 바니시를 사용하여 슬라이드의 커버 슬립 둘레를 밀봉하십시오. 1 시간 동안 실온에서 어둠 속에서 슬라이드를 건조할 수 있습니다. 장기간 보관할 수 있는 어둠 속에서 4°C에 보관하십시오.
- 블로킹/투과성화 용액 100μL(일반 당나귀 혈청 + 0.5% 소 세럼 알부민(BSA) + 1x DPBS에 0.5% 트리톤 X-100을 각각 웰 또는 고정 오르간로이드를 함유한 튜브에 추가합니다. 셰이커에서 하룻밤 동안 실온에서 배양하십시오.
- 살아있는 심장 오르가노이드에 있는 칼슘 과도 화상 진찰
참고: 제조업체의 지시에 따르면, 플루오4-AM은 디메틸 설산화물(DMSO)으로 재구성되어 최종 재고 용액 농도가 0.5mM로 재구성되었습니다. 플루오4-AM은 96웰 플레이트에서 오르가노이드에 직접 첨가되었다.- RPMI 1640 배지를 사용하여 오르가노이드에 2개의 세차장을 수행합니다.
- 우물에서 소비된 매체의 166μL을 제거합니다.
- 온난한 RPMI 1640 배지 166 μL을 추가하고, 166 μL의 매체를 제거하고, 신선한 RPMI 1640 배지166 μL을 추가합니다.
참고: 세정은 폐기물과 세포 이물질을 제거하기 위해 수행됩니다. 배지의 3분의 2는 기능적 분석 전에 우물의 바닥에 있는 오르가노이드를 방해하지 않도록 세차하는 동안 우물에서 제거된다.
- 불소4-AM 배지를 오르가노이드에 추가합니다.
- 1.5 μM 용액을 준비하기 위해 B-27 보충제를 함유한 RPMI 1640에 DMSO에서 재구성된 플루오4-AM을 추가합니다.
- 우물에서 166 μL의 매체를 제거합니다.
- RPMI 1640에 1.5 μM 플루오4-AM의 166 μL을 추가하여 B-27 보충제를 함유하여 37°C에서 1μM. 인큐베이션, 30분 동안 5% CO2 의 최종 웰 농도를 제공합니다.
- 3.4.1 단계에서와 같이 2 개의 헤이즈를 수행합니다.
- 우물에 B-27 보충제를 함유한 RPMI 1640의 166μL을 추가합니다.
- P200 파이펫 팁의 컷 팁을 사용하여 오르가노이드를 유리 바닥 페트리 접시(예: #1.5 고성능 커버글래스가 있는 8웰 챔버 커버 글래스)로 전달하여 100-200μL의 중간 크기로 전달합니다.
참고: 전체 오르가노이드 를 전송할 때 섹션 3.1을 참조하십시오. - 이미지 오르가노이드는 37 °C, 5 % CO2에서 온도 및 CO2 제어 챔버와 현미경 아래에 살고 있습니다.
- 오르가노이드 전역의 다양한 위치에서 10-20s 비디오를 여러 번 기록하여 칼슘이 세포로 들어오고 나갈 때 형광 강도 수준이 증가하고 감소함을 보여 주습니다.
참고: 고해상도 레코딩의 경우 10fps 이상의 속도로 기록하는 것이 좋습니다. 50 fps를 권장합니다. - 관심 영역을 선택하고 시간이 지남에 따라 강도 수준을 측정하여 이미지 분석 소프트웨어(예: ImageJ)를 사용하여 비디오를 분석합니다.
- ΔF/F0과 밀리초 및 플롯의 시간을 사용하여 강도 레코딩을 정규화합니다.
- RPMI 1640 배지를 사용하여 오르가노이드에 2개의 세차장을 수행합니다.
결과
시험관 내 자가 조직 hHO를 달성하기 위해, 우리는 이전에 Wnt 통로 변조기를 사용하여 심근 세포21 및 상복부 세포의 2D 단층 분화에 대해 설명된 2D 단층 분화 프로토콜을 수정하고 결합하고 성장 인자 BMP4 및 Activin A. 96 웰 플레이트 EB 및 hHOi 프로토콜을 사용하여 여기에 설명된 피규어 1을 사용하여 설명된 피규어 1 , Wnt 통로 활성제 CHIR99021의 농도 및 노출 지속 시간은 인간 PsC에서 파생된 매우 재현 가능하고 복잡한 hHSo를 산출하도록 최적화되었습니다.
EB는 0일째에 차별화를 시작하기 전에 24시간 이후에 중간 변경으로 48h에 대한 배양이 허용되었습니다. 0일째에, EB는 빛 현미경의 밑에 각 우물의 중앙에 어두운 구형 골합체로 나타나야 합니다 (그림 1B). 분화 프로토콜은 정확히 24h에 대한 Wnt 경로 활성화 및 성장 인자 추가와 함께 0일째에 시작됩니다. 이 중소 감 유도는 Wnt 통로 억제제 Wnt-C59를 사용하여 2 일째에 심장 중구성 유도에 따라 직경 ~200 μm에서 직경 500-800 μm까지 오르가노이드의 상당한 확대를 초래하고 15일째에 직경이 500-800 μm까지 상당한 확대를 초래할 것이며 15일(오르가노이드크기15일)까지 의 크기가 약간 감소할 수 있다. hHO는 6일째 (비디오 1)로 일찍 치기 시작하며, 10일(비디오 2)까지 가시적인 구타를 보이는 오르가노이드의 100%를(약물 치료를 받지 않는 한 또는 부적절한 hPSC가 EB를 생성하는 데 사용됨). 이는 5개의 별개의 hPSC 세포주에서 관찰되었다23.
hHOs의 능력을 평가하기 위해 심장의 생리적 발달의 다양한 단계를 나타내기 위해 분화 프로토콜 전반에 걸쳐 다양한 시점에서 오르가노이드를 수집하고 심장 필드 마커의 존재와 전사적 발현을 모색했습니다. 제1심장필드(FHF) 마커, HAND1 및 제2심장구(SHF) 마커인 HAND2에 대한 면역형염색은 각각 3일 및 5일째경에 발생하는 이러한 심장 전구 세포에서 핵 존재를 밝혔다(그림 3A).
두 마커의 발현은 FHF에 대한 7일 이후 및 SHF를 위한 9일 이후 크기가 감소하는 오르가노이드의 영역에서 발생합니다. 흥미롭게도, 7일 의 고배율 이미지는 대부분의 HAND1 발현 세포가 원점에서 심근세포(심근세포 특이적 마커 TNNT2에 의해 도시됨)인 것으로 나타났다. 대조적으로, HAND2 발현 세포의 대부분은 심근세포 마커를 발현하지 않았다(도 3B). 이러한 관찰은 SHF 전구 세포로부터 비근구 세포의 발달을 보여주는 마우스 ESC로부터 유래된 프리심장 오르가노이드와 일치한다16. RNA-시퀀싱 데이터는 HAND1과 HAND2 모두에 대한 RNA 전사체가 3일째부터 발현되었음을 나타내며, FHF 마커는 3일과 11일 사이에 더 높게 표현되고 SHF 마커가 13일(도 3C)에 더 높게 발현됨을 주목하는 것이 중요하다.
면역 형광 염색은 인간의 심혼을 구성하는 각종 세포 형 혈통의 마커의 존재를 밝혔습니다. 심근 조직(심근 세포특이적 마커 TNNT2를 사용하여 식별 가능) 상피 조직(핵 전사 인자 WT1 및 상피 막 마커 TJP1에 의해 표시) (도 4A). NFATC1을 발현하는 내경 세포는 오르가노이드 내의 내부 챔버 와 같은 구조물의 벽을 일렬로 세우는 것을 검출하였다(도 4B). 혈관과 같은 네트워크에서 내피 세포는 분화의 13일 초부터 볼 수 있다(도 4C). 마지막으로, 우리는 오르가노이드 (도 4D)를 통해 혼합 된 심장 섬유 아세포의 존재를보고합니다. 이들 세포형 마커는 또한 RNA-Seq 유전자 발현 프로파일에서 관찰되었다(도 4E). 오가노이드의 세포 유형의 조성물은, 그들이 차지하는 오르간구의 면적에 의해 측정된 바와 같이, 에피카르칼 세포(~15%), 내피세포(~13%), 심장 섬유아세포(~12%), 내피세포(~12%), 내피세포(~12%), 내피세포(~12%) 등 비심세포 심장세포를 포함하는 나머지와 함께 ~58%의 심근세포로 밝혀졌다.
오르가노이드의 전기 생리적 기능은 전체 오르가노이드에서 개별 세포의 살아있는 칼슘 이미징에 의해 측정되었다. 플루오-4 형광 강도는 칼슘 입구와 세포에서 빠져 나가기 때문에 시간이 지남에 따라 달라지므로 정기적인 작용 잠재력을 드러냅니다(그림 5A). 오르가노이드의 고배율 영역에 걸쳐 칼슘 강도를 보여주는 히트맵은 개별 세포에서 칼슘 과도로 인한 강도 증가를 보여줍니다(그림 5B 및 비디오 3).
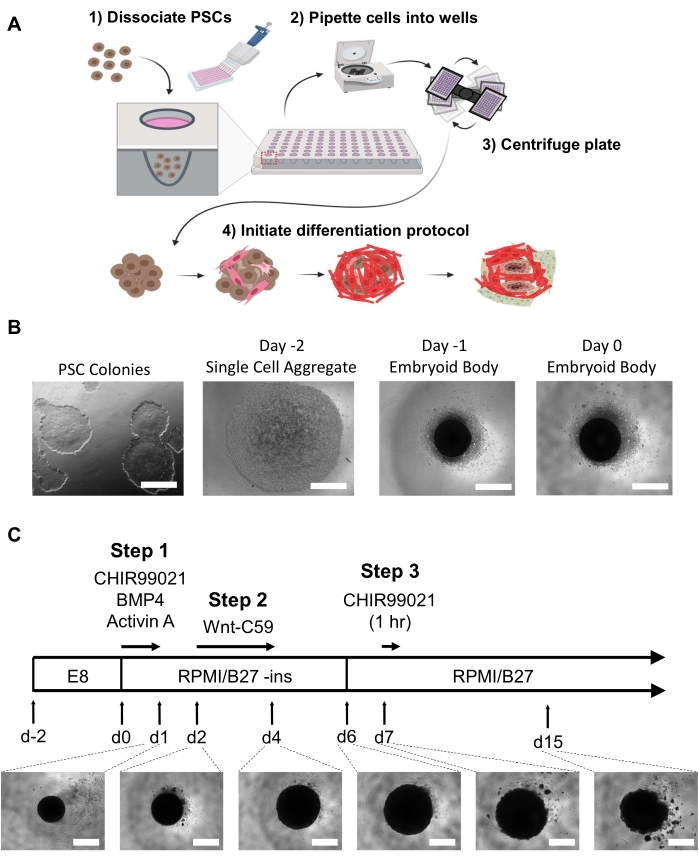
도 1: 배아체 생성 및 심장 오르가노이드 분화 단계. (A) (1-2) 해리된 세포는 멀티채널 파이펫을 통해 96웰의 초저 부착 플레이트의 우물로 시드된다. (3) 96웰 플레이트는 원심 분리되어 세포가 중앙에 집계될 수 있게 한다. (4) 시간이 지남에 따라, 성장 인자와 통로 변조기의 추가에 따라, 배아 몸은 여러 심장 혈통으로 분화하고 내부 마이크로 챔버를 둘러싼 공간및 생리학적으로 관련된 뚜렷한 세포 집단을 형성하기 시작합니다. (B) 2차원 iPSC 배양(왼쪽)으로 시작하여 0일째 배아체로 끝나는 배아 체생성의 진행에 대한 대표적인 이미지(오른쪽); 스케일 바 = 500 μm. (C) 1일째부터 15일까지 경현미경검사하에 각각의 시간 점, 지속시간, 및 오르가노이드 이미지 개발을 포함하는 화학 경로 변조기 및 억제제를 포함한 인간 심장 오르가노이드 분화 프로토콜의 요약; 스케일 바 = 500 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.
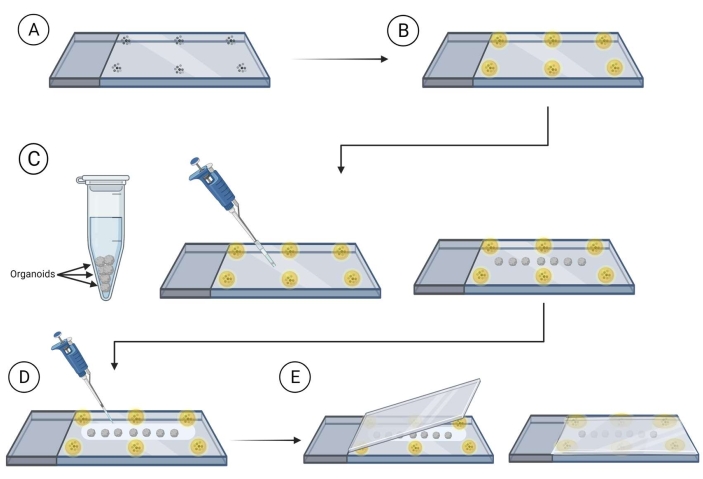
그림 2: 이미징을 위한 슬라이드에 전체 오르가노이드 장착. 슬라이드를 준비하고 이미징을 위한 오르가노이드장착 단계를 수행합니다. (A) 유리 슬라이드의 주변에 마이크로비드를 배치합니다. (B) 마운팅 매체로 마이크로비드를 덮는다. (C) 구슬 사이의 슬라이드에 오르가노이드를 옮기고 오르가노이드를 둘러싼 과도한 액체를 제거합니다. (D) 유기체를 지우기/마운팅 매체로 덮습니다. (E) 오가노이드와 구슬을 넣은 슬라이드 위에 커버슬립을 놓습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: hHOs의 첫 번째 심장 필드 및 제2 심장 필드 사양은 생리적 인간의 심장 발달을 재구성합니다. (A) 3일째부터 11일째의 공초점 면역 형광 이미지FHF (HAND1, 상단) 및 SHF (HAND2, 아래), 및 심근 세포 (TNNT2) 및 핵 염료 DAPI; 스케일 바 = 500 μm. (B) 심장 근막 마커 TNNT2와 HAND1 및 HAND2의 공동 국소화를 보여주는 7 일 의 고배도 이미지; 스케일 바 = 50 μm. (C) RNA-Seq 유전자 발현 프로파일FHF 마커 HAND1(빨간색) 및 SHF 마커 HAND2(파란색)가 0일부터 19일까지이다. 약어: hHOs = 인간의 심장 오르가노이드; FHF = 첫 번째 심장 필드; SHF = 제2 심장 필드; HAND = 심장 및 신경 문장 유도체 발현; TNNT2 = 심장 트로포닌 T2; DAPI = 4',6-디아미드노-2-페닐린돌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: hHOs는 여러 심장 혈통을 개발합니다. (A-D) 15일의 공초점 면역형화 영상은 심근세포(TNNT2)의 형성을 보여주고 비근구세포 심장 세포에서 핵염료 DAPI로 염색한다. (A) 전체 오르가노이드 및 상피막 마커 WT1 (녹색) 및 상피 막 마커 TJP1 (흰색)의 높은 배율 은 상피 기원의 상피 기원의 상피 세포를 상부및 심근 조직에 인접; 스케일 바 = 500 μm, 인셋 = 50 μm. (B) 내경 마커 NFATC1 (녹색) 챔버의 안감에 발현; 축척 바 = 500 μm. (C) 내피 혈관 네트워크는 PECAM1(녹색)에 의해 도시된 hHOs에서. 스케일 바 = 500 μm. (D) 심장 섬유아세포 마커 는 각각 녹색과 흰색으로 표시된 THY1 및 VIM마커, 오르가노이드 전체에 분포한다. 스케일 바 = 500 μm. (E) RNA-Seq 유전자 발현 프로파일은 0에서 19일까지 hHOs에 존재하는 주요 세포 유형의 분화이다. 약어: hHOs = 인간의 심장 오르가노이드; TNNT2 = 심장 트로포닌 T2; DAPI = 4',6-디아미드노-2-페닐린돌; WT1 = Wilm의 종양-1 전사 인자; NFATC1 = 활성 T 세포의 세포질 핵 인자; PECAM1 = 혈소판 내피 세포 접착 분자-1; VIM = 바이멘틴. (F) hHOs에서 평균 조직 형 조성물의 원형 차트는 ImageJ를 사용하여 오르가노이드 전반에 걸쳐 3개의 z-평면을 통해 핵 염색에 의해 전체 오르가노이드에 대한 각 세포 마커를 가진 백분율 영역으로 계산된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: Fluo-4 살아있는 인간 심장 오르가노이드에 있는 살아있는 칼슘 일시적인 기록. (A) 전체 오르가노이드 내에서 개별 심근세포의 대표적인 칼슘 과도 기록. (B) Fluo-4 강도에 의해 결정된 행동 잠재력 사이에서 저칼슘 및 피크 칼슘 수준을 보여주는 히트맵; 스케일 바 = 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1: 실온에서 가벼운 현미경 검사의 밑에 분화의 6일에 hPSCs에서 파생된 대표적인 오르가노이드의 라이브 화상 진찰. 약어 : hPSC = 인간의 다능성 줄기 세포. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 2: 15일째에 hPSC에서 파생된 대표적인 오르가노이드의 라이브 이미징이 실온에서 가벼운 현미경 검사하에 분화합니다. 약어 : hPSC = 인간의 다능성 줄기 세포. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 3: 형광 현미경으로 칼슘 과도의 히트맵을 보여주는 10일 오르가노이드의 라이브 녹화. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
최근 인간 줄기세포 유래 심근세포 및 심장 기원의 다른 세포에서 의기유는 인간 심장 발달을 모델링하는 데 사용되어 왔으며, 26,27,28및 치료학적 29,30및 독성제를 선별하는 도구로 사용되었습니다31,32 . 여기서는 구현하기 쉽고 재현가능한 프로토콜을 보고하여 EB를 생성하고 매우 복잡한 hHSo로 분화합니다. 이 프로토콜은 hPSC 및 hESCs23을 포함하여 다중 세포주에서 성공적이었으며, 일관된 박동 주파수 및 세포 유형 조직을 보여주고 있습니다. 이 프로토콜은 심근세포 분화에 대한 이전에 설명된 프로토콜에서 측면을 끌어들이고, 상피 세포 분화22, 마우스 ESCs16에서 유래한 프리심장 오르가노이드를 완전히 정의된 매체에서 화학 억제제 및 성장인자를 사용하여 표준 WNT 신호의 단계별 변조를 최적화한다. 이 프로토콜의 생성에 몇 가지 최적화 방법론이 사용되었습니다.
첫째, 화학억제제 농도 및 노출 지속시간뿐만 아니라 성장인자의 첨가는 3D 환경에 최적화되어 있으며 이전 작업23에서 논의되고 있다. 이들은 생리적 복잡성과 생체 내 인간의 심장의 표현을 가진 구조를 해명하도록 최적화되었으며, 비심낭세포(상복부 세포, 심장 섬유아세포)에 대한 심근세포의 생리적 구성 및 비율으로. 둘째, 2/3 중간 변화 전략은 심형지리기 새로 고칠 때 화학 억제제 및 성장 인자에 대한 그라데이션 노출을 용이하게하면서, 우물의 바닥 근처에 서스펜션에 앉아 있는 동안, EBs/organoids의 최소한의 동요를 허용합니다. Wnt 통로 활성화를 통한 심장 중피 분화의 조합, 억제24, 및 제2 Wnt 통로 활성화를 통한 미원성 사양의 후속 유도22, 단일 프로토콜이 매우 복잡한 hHOs를 산출할 수 있게 한다. 오르가노이드는 분화 15일 후에 최대 1mm까지 자라며 라이브 또는 고정 분석 및 분석을 위해 쉽게 전송할 수 있습니다. 셋째, 오르가노이드의 큰 크기를 감안할 때, 슬라이드와 커버슬립 사이의 공간을 유지하기 위해 마이크로비드 또는 기타 유사한 구조물을 사용하여 오르가노이드의 3D 구조를 더 잘 보존하고 이미징 과정을 개선하는 것으로 나타났다.
이러한 개발된 인간 심장 모델은 심근, 내카르듐, 에피카르듐, 내피혈관증, 내피 혈관 분기, 심장 아세포 섬유증 을 지원하는 심장 전구 세포로 분화 및 조직의 3 일과 9일 사이에 관찰된 초기 1및 제2 심장 필드 사양과 같은 심장 발달의 접근이 불가능한 단계에 접근할 수 있게 해줍니다. 이 프로토콜에서 유래된 심장 오르가노이드에 존재하는 조직 유형은 조성33 및 전사 성 프로파일 23,34 모두에서 인간 태아 심장을 매우 대표한다. 그(것)들은 그러므로 생체 내 심혼의 것과 유사한 조직 조직 및 세포 세포 고차 상호 작용을 촉진할 수 있습니다. 이 프로토콜은 실험과 세포주 전반에 걸쳐 매우 효율적이고 재현 가능했으며, 주로 심근세포를 구성하고 상근 세포, 내심 세포, 심장 섬유아세포 및 내피 세포와 같은 비심낭세포 심장 세포를 포함하는 유기체를 산출하여 생리학적 조성물을 나타내는 23,33,35.
전염 전자 현미경 검사법을 통한 형성 심근세포의 초구조와 광학 응고 단층 촬영 및 공초점 이미징을 통한 챔버 및 혈관 네트워크의 개발에 대한 분석은 이전 작업23에서 자세히 논의된다. 최근 발표된 다른 기존 프로토콜에 비해 이 심장 오르가노이드 프로토콜의 큰 장점은 장기형 전체에 걸쳐 내피 네트워크의 견고한 형성이며, 프로토콜에 대한 추가 외부 유도가 필요 없이 초기 인간의 심장에서 혈관 발달과 질병을 조사할 수 있게 한다. 마지막으로, 심장 오르가노이드의 기능적 분석은 오르가노이드 를 가로지르는 심근세포에서 칼슘 과도를 추적하는 칼슘에 민감한 염료를 사용하는 것을 포함하여 다양한 접근법을 통해 달성할 수 있습니다. 고해상도 현미경 검사를 사용하여, 우리는 세포를 입력하고 나가는 칼슘의 형광 강도를 기록하고 높게 대표적인 행동 잠재력을 관찰했습니다. 다른 기능성 분석 방법은 칼슘에 민감한 지표또는 마이크로 전극 어레이23을 사용하여 직접 기록한 트랜스제닉 라인의 사용을 포함한다.
여기에 설명 된 심장 오르가노이드는 발달 중인 인간 태아 심장의 재구성이지만 더 성숙하고 성인과 같은 특징을 보여주는 데 제한이 있습니다. 미래의 프로토콜은 이러한 오르가노이드의 성숙을 유도하고 성인 심장을 더 잘 모델링하는 항복 구조를 유도하기 위해 여기에 설명된 프로토콜을 기반으로 구축 될 수 있습니다. 더욱이, 본 프로토콜은 인간의 심장의 소형 모델을 생성하도록 설계되었으며 심장 발달 및 질병 또는 의약품 스크리닝에 대한 연구 연구에 국한되어 이식을 통한 심장 조직의 교체와 같은 임상 적 개입 수단으로 적합하지 않을 수 있습니다. 전반적으로, 우리는 인간 적인 심장 발달, 질병 병인학 및 약리학 검열에 있는 연구 연구를 촉진할 수 있는 높게 재현가능하고 정교한 인간 적인 심장 오르가노이드를 생성하는 것을 보기 쉽고 비용 효과적인 프로토콜을 여기에서 기술합니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 작품은 수여 번호 K01HL135464 및 R01HL151505 및 수상 번호 19IPLOI34660342에서 미국 심장 협회에 의해 국립 건강 연구소의 국립 심장, 폐 및 혈액 연구소에 의해 지원되었다. 우리는 MSU 고급 현미경 검사법과 공초점 현미경, IQ 현미경 코어 및 시퀀싱 서비스에 대한 MSU 유전체학 코어에 대한 액세스에 대한 약리학 및 독성학의 MSU 부서에서 박사 윌리엄 잭슨에게 감사드립니다. 우리는 또한 그들의 귀중한 의견과 조언에 대한 Aguirre 연구소의 모든 구성원에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Alexa Fluor 488 Donkey anti- mouse | Invitrogen | A-21202 | 1:200 |
| Alexa Fluor 488 Donkey anti- rabbit | Invitrogen | A-21206 | 1:200 |
| Alexa Fluor 594 Donkey anti- mouse | Invitrogen | A-21203 | 1:200 |
| Alexa Fluor 594 Donkey anti- rabbit | Invitrogen | A-21207 | 1:200 |
| Alexa Fluor 647 Donkey anti- goat | Invitrogen | A32849 | 1:200 |
| HAND1 | Abcam | ab196622 | Rabbit; 1:200 |
| HAND2 | Abcam | ab200040 | Rabbit; 1:200 |
| NFAT2 | Abcam | ab25916 | Rabbit; 1:100 |
| PECAM1 | DSHB | P2B1 | Rabbit; 1:50 |
| TNNT2 | Abcam | ab8295 | Mouse; 1:200 |
| THY1 | Abcam | ab133350 | Rabbit; 1:200 |
| TJP1 | Invitrogen | PA5-19090 | Goat; 1:250 |
| VIM | Abcam | ab11256 | Goat; 1:250 |
| WT1 | Abcam | ab89901 | Rabbit; 1:200 |
| Media and Reagents | |||
| Accutase | Innovative Cell Technologies | NC9464543 | cell dissociation reagent |
| Activin A | R&D Systems | 338AC010 | |
| B-27 Supplement (Minus Insulin) | Gibco | A1895601 | insulin-free cell culture supplement |
| B-27 Supplement | Gibco | 17504-044 | cell culture supplement |
| BMP-4 | Gibco | PHC9534 | |
| Bovine Serum Albumin | Bioworld | 50253966 | |
| CHIR-99021 | Selleck | 442310 | |
| D-(-)-Fructose | Millipore Sigma | F0127 | |
| DAPI | Thermo Scientific | 62248 | 1:1000 |
| Dimethyl Sulfoxide | Millipore Sigma | D2650 | |
| DMEM/F12 | Gibco | 10566016 | |
| Essential 8 Flex Medium Kit | Gibco | A2858501 | pluripotent stem cell (PSC) medium containing 1% penicillin-streptomycin |
| Fluo4-AM | Invitrogen | F14201 | |
| Glycerol | Millipore Sigma | G5516 | |
| Glycine | Millipore Sigma | 410225 | |
| Matrigel GFR | Corning | CB40230 | Basement membrane extracellular matrix (BM-ECM) |
| Normal Donkey Serum | Millipore Sigma | S30-100mL | |
| Paraformaldehyde | MP Biomedicals | IC15014601 | Powder dissolved in PBS Buffer – use at 4% |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphate Buffer Solution | Gibco | 10010049 | |
| Phosphate Buffer Solution (10x) | Gibco | 70011044 | |
| Polybead Microspheres | Polysciences, Inc. | 73155 | 90 µm |
| ReLeSR | Stem Cell Technologies | NC0729236 | dissociation reagent for hPSCs |
| RPMI 1640 | Gibco | 11875093 | |
| Thiazovivin | Millipore Sigma | SML1045 | |
| Triton X-100 | Millipore Sigma | T8787 | |
| Trypan Blue Solution | Gibco | 1525006 | |
| VECTASHIELD Vibrance Antifade Mounting Medium | Vector Laboratories | H170010 | |
| WNT-C59 | Selleck | NC0710557 | |
| Other | |||
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 02682002 | |
| 15 mL Falcon Tubes | Fisher Scientific | 1495970C | |
| 2 mL Cryogenic Vials | Corning | 13-700-500 | |
| 50 mL Reagent Reservoirs | Fisherbrand | 13681502 | |
| 6-Well Flat Bottom Cell Culture Plates | Corning | 0720083 | |
| 8 Well chambered cover Glass with #1.5 high performance cover glass | Cellvis | C8-1.5H-N | |
| 96-well Clear Ultra Low Attachment Microplates | Costar | 07201680 | |
| ImageJ | NIH | Image processing software | |
| Kimwipes | Kimberly-Clark Professional | 06-666 | laboratory wipes |
| Micro Cover Glass | VWR | 48393-241 | 24 x 50 mm No. 1.5 |
| Microscope Slides | Fisherbrand | 1255015 | |
| Moxi Cell Counter | Orflo Technologies | MXZ001 | |
| Moxi Z Cell Count Cassette – Type M | Orflo Technologies | MXC001 | |
| Multichannel Pipettes | Fisherbrand | FBE1200300 | 30-300 µL |
| Olympus cellVivo | Olympus | For Caclium Imaging, analysis with Imagej | |
| Sorvall Legend X1 Centrifuge | ThermoFisher Scientific | 75004261 | |
| Thermal Mixer | ThermoFisher Scientific | 13-687-717 | |
| Top Coat Nail Varish | Seche Vite | Can purchase from any supermarket |
참고문헌
- Hoffman, J. I. E., Kaplan, S. The incidence of congenital heart disease. Journal of the American College of Cardiology. 39 (12), 1890-1900 (2002).
- Wu, W., He, J., Shao, X. Incidence and mortality trend of congenital heart disease at the global, regional, and national level, 1990-2017. Medicine. 99 (23), 20593 (2020).
- Fahed, A. C., Gelb, B. D., Seidman, J. G., Seidman, C. E. Genetics of congenital heart disease: the glass half empty. Circulation Research. 112 (4), 707-720 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36, 432-441 (2018).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nature Methods. 16 (3), 255-262 (2019).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Serra, D., et al. Self-organization and symmetry breaking in intestinal organoid development. Nature. 569, 66-72 (2019).
- Mithal, A., et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nature Communications. 11, 215 (2020).
- Porotto, M., et al. Authentic modeling of human respiratory virus infection in human pluripotent stem cell-derived lung organoids. mBio. 10 (3), 00723 (2019).
- Dye, B. R., et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife. 4, 05098 (2015).
- Mun, S. J., et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of Hepatology. 71 (5), 970-985 (2019).
- Vyas, D., et al. Self-assembled liver organoids recapitulate hepatobiliary organogenesis in vitro. Hepatology. 67 (2), 750-761 (2018).
- Dossena, M., et al. Standardized GMP-compliant scalable production of human pancreas organoids. Stem Cell Research & Therapy. 11, 94 (2020).
- Georgakopoulos, N., et al. Long-term expansion, genomic stability and in vivo safety of adult human pancreas organoids. BMC Developmental Biology. 20 (1), 4 (2020).
- Andersen, P., et al. Precardiac organoids form two heart fields via Bmp/Wnt signaling. Nature Communications. 9, 3140 (2018).
- Rossi, G., et al. Capturing cardiogenesis in gastruloids. Cell Stem Cell. 28 (2), 230-240 (2021).
- Lee, J., et al. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nature Communications. 11 (1), 4283 (2020).
- Drakhlis, L., et al. Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology. 39 (6), 737-746 (2021).
- Hofbauer, P., et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell. 184 (12), 3299-3317 (2021).
- Bao, X., et al. Directed differentiation and long-term maintenance of epicardial cells derived from human pluripotent stem cells under fully defined conditions. Nature Protocols. 12 (9), 1890-1900 (2017).
- Bao, X., et al. Long-term self-renewing human epicardial cells generated from pluripotent stem cells under defined xeno-free conditions. Nature Biomedical Engineering. 1, 0003 (2016).
- Lewis-Israeli, Y., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12, 5142 (2021).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- Burridge, P. W., Keller, G., Gold, J. D., Wu, J. C. Production of de novo cardiomyocytes: Human pluripotent stem cell differentiation and direct reprogramming. Cell Stem Cell. 10 (1), 16-28 (2012).
- Hashem, S. I., et al. Impaired mitophagy facilitates mitochondrial damage in Danon disease. Journal of Molecular and Cellular Cardiology. 108, 86-94 (2017).
- Sun, N., et al. Patient-specific induced pluripotent stem cells as a model for familial dilated cardiomyopathy. Science Translational Medicine. 4 (130), (2012).
- Stroud, M. J., et al. Luma is not essential for murine cardiac development and function. Cardiovascular Research. 114 (3), 378-388 (2018).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Mills, R. J., et al. Functional screening in human cardiac organoids reveals a metabolic mechanism for cardiomyocyte cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America. 114 (40), 8372-8381 (2017).
- Braam, S. R., et al. Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes. Stem Cell Research. 4 (2), 107-116 (2010).
- Burridge, P. W., et al. Human induced pluripotent stem cell-derived cardiomyocytes recapitulate the predilection of breast cancer patients to doxorubicin-induced cardiotoxicity. Nature Medicine. 22 (5), 547-556 (2016).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2017).
- Bertero, A., et al. Dynamics of genome reorganization during human cardiogenesis reveal an RBM20-dependent splicing factory. Nature Communications. 10 (1), 1538 (2019).
- Gilbert, S. F. Lateral plate mesoderm: Heart and Circulatory System. Developmental Biology. 6th edition. , 591-610 (2000).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Lewis-Israeli, Y. R., Wasserman, A. H. Heart Organoids and Engineered Heart Tissues: Novel Tools for Modeling Human Cardiac Biology and Disease. Biomolecules. 1277, (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유