Method Article
Hemodinamik Stresin Dolaşımdaki Tümör Hücreleri Üzerindeki Etkilerini şırınga ve İğne Kullanarak Modelleme
Bu Makalede
Özet
Burada hemodinamik stresin dolaşımdaki tümör hücreleri üzerindeki etkilerini modellemek için süspansiyondaki kanser hücrelerine sıvı kesme stresi uygulamak için bir yöntem gösteriyoruz.
Özet
Metastaz sırasında, epitel de dahil olmak üzere katı dokulardan gelen kanser hücreleri, hemodinamik akış nedeniyle mekanik strese maruz kaldıkları lenfatik ve hematojen dolaşıma erişerler. Dolaşımdaki tümör hücrelerinin (CTC) yaşadığı bu streslerden biri sıvı kesme stresidir (FSS). Kanser hücreleri interstisyel akış nedeniyle tümör içinde düşük FSS seviyeleri yaşayabilirken, CPC'ler hücre dışı matris eki olmadan çok daha yüksek FSS seviyelerine maruz kalır. Fizyolojik olarak, FSS 3-4 büyüklük sırası üzerinde değişir, lenfatikte düşük seviyeler bulunur (<1 dinane /cm2)ve hücreler kalpten ve kalp kapaklarının etrafından geçerken kısaca en yüksek seviyeler bulunur (>500 dinaz/cm2). Çeşitli zaman dilimlerinde farklı fizyolojik kesme stresini modellemek için tasarlanmış birkaç in vitro model vardır. Bu makalede, basit bir şırınga ve iğne sistemi kullanarak üst düzey FSS'nin kısa (milisaniye) darbelerinin kanser hücre biyolojisi üzerindeki sonuçlarını araştırmak için bir model açıklanmaktadır.
Giriş
Metastaz veya kanserin ilk tümör bölgesinin ötesine yayılması, kanser mortalitesinin altında kalan önemli bir faktördür1. Metastaz sırasında, kanser hücreleri dolaşım sistemini vücuttaki uzak bölgelere yaymak için bir otoyol olarak kullanır2,3. Bu bölgelere giderken, dolaşımdaki tümör hücreleri (CTC'ler) orijinal primertümörlerinin aksinedinamik bir sıvı mikroçevrim içinde bulunur 3,4,5. Bu sıvı mikroçevresinin metastaz4'ünönündeki birçok engelden biri olduğu önerilmiştir. Metastatik verimsizlik kavramında, yani dolaşıma giren çoğu CTC'nin yok olduğu veya üretken metastatik koloniler oluşturmadığı konusunda geniş bir anlaşmavardır 6,7,8. Bununla birlikte, metastazın neden bireysel bir CTC açısından verimsiz olduğu daha az kesindir ve aktif bir araştırma alanı olmaya devam etmektedir. CTC'ler hücre dışı matristen ayrılır, primer tümörde bulunabilecek çözünür büyüme ve sağkalım faktörlerinden mahrum kalır ve birincil tümörden çok daha farklı bir şekilde bağışıklık sistemine ve hemodinamik güçlere maruz kalır4. Bu faktörlerin her biri CPC'lerin zayıf hayatta kalmasına katkıda bulunabilir, ancak göreceli katkıları belirsizdir. Bu makale, hemodinamik güçlerin CTC'leri nasıl etkilediği sorusunu ele alıyor.
Hemodinamik kuvvetlerin CTC'ler üzerindeki etkilerini incelemek oldukça zordur. Şu anda, insan damar sisteminin tüm mekansal dinamiklerini (kalpten kılcal damarlara) ve reolojik özelliklerini çoğaltabilen tasarlanmış in vitro sistemler yoktur. Ayrıca, CTC'lerin dolaşım sistemini nasıl deneyimlediği tam olarak açık değildir. Deneysel kanıtlar, çoğu kanser hücresinin kan hücreleri gibi sürekli dolaşımda olmadığını göstermektedir. Bunun yerine, nispeten büyük boyutları (10-20 μm çapında) nedeniyle, çoğu CTC, ölebilecekleri, ekstravaze olabilecekleri veya bir sonraki kılcal yatak 8,9 , 10,11'eyer değiştirebilecekleri değişken süreler boyunca (6-8 μm çapında) kılcal yataklara(6-8μmçapında) kaplanır. Bununla birlikte, CTC boyutunun daha heterojen in vivo olabileceğine ve daha küçük CTC'lerin tespit edilebilir olduğuna dair bazı kanıtlar vardır12. Bu nedenle, mesafeye ve kan akışı hızına bağlı olarak, CTC'ler bu tuzak dönemleri arasında sadece birkaç saniye serbestçe dolaşabilir, ancak bu davranışın nicel bir açıklaması13.
Ayrıca, CTC'lerin dolaşıma girdiği yere bağlı olarak, akciğer ve diğer çevre bölgelerindeki birden fazla kılcal yataktan ve son hedeflerine ulaşmadan önce hem sağ hem de sol kalpten geçebilirler. Yol boyunca, CTC'ler sıvı kesme stresi (FSS), mikro sirkülasyona hapsedilmesi sırasında basınç kuvvetleri ve potansiyel olarak, kan damarı duvarları boyunca yuvarlanan lökosit benzeri yuvarlanmalar sergileyebilecekleri koşullar altında çekiş kuvvetleri de dahil olmak üzere çeşitli hemodinamik streslere maruz kalır14. Böylece hem dolaşımı modelleme yeteneği hem de modellenecek CTC davranışının anlaşılması sınırlıdır. Bu belirsizlik nedeniyle, in vitro model sistemlerden elde edilen herhangi bir bulgu deneysel bir omurgalı organizmada ve nihayetinde kanser hastalarında doğrulanmalıdır.
Yukarıda belirtilen uyarılarla, bu makale FSS'nin ilk olarak 201215'teaçıklanan CTC'ler üzerindeki etkilerini araştırmak için süspansiyondaki hücrelere FSS uygulamak için nispeten basit bir model göstermektedir. FSS, daha büyük damarlarda laminer akış koşullarında parabolik hız gradyanı üreten damar duvarına karşı kan akışının sürtünmesiyle sonuçlanır. Hücreler, damar duvarlarına yakın daha yüksek FSS seviyelerine ve kan damarının merkezine yakın daha düşük seviyelere sahiptir. Hagen-Poiseuille denklemi tarafından açıklandığı gibi, akış hızının ve akışın meydana geldiği kanalın boyutları FSS'yi etkiler. Bu, Newton sıvıları gibi davranan kan akışları için geçerlidir, ancak mikrosekülasyon için tutmaz. Fizyolojik FSS, lenfatiklerde en düşük seviyelere (<1 dyn/cm2)ve kalp kapakçıkları ve aterosklerotik plaklar (>500 dyn/cm2)çevresindekibölgelerde en yüksek olan çeşitli büyüklük sıraları üzerinde değişmektedir. Arterlerde ortalama duvar kesme stresi 10-70 dyn/cm2 ve damarlarda 1-6 dyn/cm2 16,17 'dir.
Kalpte, hücreler çok üst düzey, ancak çok kısa süreli FSS yaşanabilecek kapak broşürleri etrafında türbülanslı akışlara maruz kalabilir18,19. Biyoişlem alanı uzun zamandır FSS'nin süspansiyondaki memeli hücreleri üzerindeki etkilerini incelemiş olsa da, bu bilgiler genellikle uzun bir süre boyunca uygulanan çok daha düşük FSS seviyelerine odaklandığı için FSS'nin CTC'ler üzerindeki etkilerini anlamak için sınırlı değerde olabilir20. Aşağıda açıklandığı gibi, bir şırınga ve iğne kullanarak, bir hücre süspansiyonu için nispeten kısa (milisaniye) bir süre için nispeten yüksek (on ila binlerce dyn / cm2) FSS uygulanabilir. Bu modelin ilk açıklamasından bu yana15, diğerleri FSS'nin kanser hücreleri üzerindeki etkilerini incelemek için onu çalıştırmıştır21,22,23. Aşağı akış deneysel analizlerini kolaylaştırmak için hücre süspansiyonlarına kısa sürede birden fazla FSS "darbesi" uygulanabilir. Örneğin, bu model, uygulanan darbe sayısının bir işlevi olarak hücre canlılığını ölçerek hücrelerin FSS tarafından mekanik yıkıma karşı koyma yeteneğini ölçmek için kullanılabilir. Alternatif olarak, FSS maruziyetinin kanser hücrelerinin biyolojisi üzerindeki etkileri, çeşitli aşağı akış analizleri için hücreler toplanarak araştırılabilir. Daha da önemlisi, hücre süspansiyonunun bir kısmı, FSS'nin hücre müfrezesi ve süspansiyonda tutulan süre ile ilişkili olabilecek etkilerini karşılaştırmak için statik bir denetim olarak ayrılmıştır.
Protokol
1. Hücre hazırlığı
- Kullanılan hücre hattı için önerilen yönergeleri izleyerek % 70-90 birleştiğinde doku kültürü çanağındaki hücreleri serbest bırakın.
- Örneğin, PC-3 hücreleri için büyüme ortamını emiş edin ve 10 cm'lik hücre kabını 5 mL kalsiyum ve magnezyum içermeyen fosfat tamponlu salin (PBS) ile yıkayın.
- Üreticinin protokolünü kullanarak %0,25 trypsin'in 1 mL'sini eklemeden önce PBS'i aspire edin.
- Ters bir mikroskop altında hücrelerin kopuşu gözlemlendikten sonra, tripsini inhibe etmek için% 10 fetal sığır serumu içeren 5 mL DMEM:F12 ortamı ekleyin.
- Hücre süspansiyonu konik bir tüpe yerleştirin.
- Hücre konsantrasyonu ve toplam hücre sayısını belirleyin.
- Santrifüjleme ile pelet hücreleri (3 dakika için 300 × g), süpernatantı aspirasyon ve serumsuz doku kültüründeki hücreleri 5 × 105 hücre / mL'ye kadar yeniden biriktirir.
NOT: Test ortamının en az 1,17 mM Ca++ içermesi kritik öneme sahiptir, çünkü hücre dışı Ca++ FSS15'ehücresel direnç için gerekli olduğu gösterilmiştir.
2. Sıvı kesme stresine maruz kalma
- Hücreleri FSS'ye maruz kalmadan önce, 7 mL çizgisinde yuvarlak tabanlı 14 mL polistiren tüp kesin. Hücre süspansiyonu karıştırın, süspansiyonun 5 mL'lik kısmını kesme tüpüne yerleştirin ve statik kontrol örneklerini toplayın.
NOT: Statik numune için toplanması gereken hacim, kullanılan canlılık testine bağlıdır (bkz. adım 3). - Hücre süspansiyonu 5 mL şırıngaya çekin ve 30 G 1/2" iğne takın. İğneyi çözün, şırıngayı bir şırınga pompasına yerleştirin, şırıngayı sabitleyin ve istenen FSS seviyesine ulaşmak için akış hızını ayarlayın.
NOT: Tablo 1, farklı iğneler ve akış hızları için maksimum duvar kesme gerilmesinin yanı sıra hücre boyutuna (10, 15 ve 20 μm) bağlı olarak minimum FSS seviyesini gösterir. Bükülmediğine emin olmak için kullanmadan önce iğneyi inceleyin; belirsizse, iğneyi yenisiyle değiştirin. İğne bütünlüğü uygulanan FSS seviyesi üzerinde önemli bir etkiye sahip olabilir. - Şırınd pompasını çalıştırın ve köpürmeyi azaltmak için kesilmiş numuneyi kesme tüpünde yaklaşık 45° açıyla toplayın. Canlılık testinin türüne veya aşağı akış test ihtiyaçlarına bağlı olarak bir örnek toplayın.
- Şırıngayı ve iğneyi şırınga pompasından dikkatlice çıkarın ve iğneye dokunmamaya dikkat ederek iğneyi şırıngadan çıkarmak için pense kullanın.
NOT: Eğimli olmayan iğneler, ek bir güvenlik önlemi olarak eğimli iğnelerle birbirinin yerine kullanılabilir.
- Şırıngayı ve iğneyi şırınga pompasından dikkatlice çıkarın ve iğneye dokunmamaya dikkat ederek iğneyi şırıngadan çıkarmak için pense kullanın.
- Makaslı süspansiyonu şırıngaya geri çekin, pense kullanarak iğneyi dikkatlice yeniden takın ve şırınga pompasına geri yerleştirin.
- Hücre süspansiyonu istenen sayıda FSS darbesine maruz kalana kadar 2.3 ve 2.4 adımlarını yineleyin.
NOT: Hücrelerin FSS maruziyetinden kaynaklanan mekanik tahribata karşı koyma kapasitesini değerlendirmek için hücre süspansiyonu tipik olarak 10 darbe FSS'ye tabi tutulur. Bununla birlikte, hücrelerin 2 darbe24'densonra FSS'ye yanıt olarak biyolojik adaptasyonlara maruz almaya başladıkları gösterilmiştir.
3. Canlılık ölçümü
NOT: Canlılık, enzimatik tahliller (luciferaz, resazurin ve WST-1), bozulmamış hücreleri sayma, akış sitometrisi veya klonojenik tahliller kullanılarak değerlendirilebilir.
- Tüm canlılık ölçüleri için, hücreleri FSS'ye maruz kalmadan önce bir örnek toplayın.
- Enzymatic tahliller için, yinelenen 100 μL aliquots alın ve 96 kuyulu bir tabağa yerleştirin.
- Akış sitometrisi için bir adet 500 μL aliquot alın ve 1,5 mL'lik bir tüpe yerleştirin.
- Klonojenik test için 100 μL aliquot toplayın.
- Enzymatic tahlil
- 1, 2, 4, 6, 8 ve 10 darbeli FSS maruziyetinin ardından 100 μL numune toplayın ve bunları 96 kuyulu bir tabağa yerleştirin.
- İstediğiniz alt tabakayı ekleyin ve kullanılan test için protokolü izleyin:
- Resazurin için, her kuyuya 0,15 mg/ mL çözeltinin 20 μL'sini ekleyin. Sadece 100 μL orta içeren kuyulara 20 μL 0,15 mg/mL resazurin çözeltisi ekleyin. 37 °C doku kültürü inkübatöründe 2 saat kuluçkaya yatırın. Floresan okuma yeteneğine sahip bir plaka okuyucu kullanarak emiciliği ölçün (579 heyecan/ 584 emisyon).
- Luciferaz eksprese eden hücreler için, 5 mL orta ila 15 mg/ mL D-luciferin 100 μL ekleyin. Bu çözeltinin 100 μL'lik kısmını her iyi içeren hücreye ekleyin. 5 dakika bekleyin ve ardından lüminesansla uyumlu bir okuyucu kullanarak plakayı okuyun.
- WST-1 için, yalnızca orta içeren kuyular da dahil olmak üzere her kuyuya 10 μL WST-1 ekleyin. 4 saat kuluçkaya yaslanın ve ardından bir plaka okuyucu kullanarak 420 ila 480 nm arasındaki emiciliği okuyun.
- Uygulanabilir hücrelerin yüzdesini elde etmek için FSS'ye maruz kalan örneklerin her birinden gelen ortalama sinyali ortalama statik kontrol örneğiyle karşılaştırın.
- Akış sitometrisi24
- 500 μL numuneleri toplayın ve 1, 2, 5 ve 10 darbeli FSS'den sonra 1,5 mL santrifüj tüplerine yerleştirin.
- Santrifüj örnekleri (3 dakika boyunca 500 × g) ve süpernatantları atın.
- Peletleri 1 mL kalsiyum ve magnezyum içermeyen PBS ile yeniden biriktirin ve numuneleri santrifüj haline (3 dakika boyunca 300 × g).
- Peletleri 500 μL floresanla aktive edilmiş hücre sıralama (FACS) tamponu (%0,5 sığır serum albümin ve %0,1 sodyum azit ile PBS) ile boncukları ve propidium iyodür (1,75 μg/mL) gibi zar geçirimsiz veya canlı boyalarla askıya alın.
- Yamaçlı numunelerde boncuk sayma ile normalleştirilen canlı hücrelerin oranını statik numuneninkiyle karşılaştırarak canlılığı belirleyin.
- Klonojenik tahlil
- Statik numuneden 100 μL alın ve 1:10 seyreltme yapmak için 900 μL büyüme ortamı ekleyin.
- 1:10 seyreltilmiş numunenin 100 μL'sini alın ve son 1:100 seyreltme yapmak için 900 μL büyüme ortamı ekleyin.
- 2 mL büyüme ortamı içeren 6 kuyulu bir kabın 3 kuyusunun her birine 1:100 seyreltme örneğinin 100 μL'sini ekleyin.
- 3.4.1-3.4.3 adımlarını 10 darbeye maruz kalmış örneklerle tekrarlayın.
- Hücrelerin ortamı değiştirmeden 7-10 gün boyunca büyümesine izin verin ve koloni oluşumunu kontrol edin. ≥50 hücre kolonileri oluştuktan sonra, büyüme ortamını epire edin, her birini 1 mL PBS ile durulayın, PBS'yi epire edin ve 1 mL buz gibi% 70 etanol (EtOH) kullanarak 5 dakika sabitlayın. Daha da önemlisi, hem yamyun hem de statik numuneleri aynı anda sabitle
- Numuneleri sabitledikten sonra EtOH'yi aspire edin ve 5 dakika boyunca 1 ila 2 mL kristal mor çözeltisi (%90 H2O'da %0,1 kristal mor, %10 EtOH) ekleyin.
- Fazla su ile durulayın ve plakanın kurumasına izin verin
- Hem statik hem de yamtulan örnekler için kolonileri (≥50 hücre kümeleri) sayın. Canlılığı belirlemek için yamaçlı numuneden ortalama koloni sayısının statik numuneden ortalama koloni sayısına oranını karşılaştırın.
Sonuçlar
FSS kaynaklı mekanik yıkıma karşı yüksek direncin daha önce birden fazla kanser hücresi hattında ve kanser hücrelerinde, dönüştürülmemiş epitel hücre karşılaştırıcılarına göre tümörlerden yeni izole edilmiş korunmuş bir fenotip olduğu gösterilmiştir15,24. Burada, çeşitli doku kökenlerinden ek kanser hücresi çizgileri ( Tablo 2 ) bu hücrelerin çoğunluğunun250 μL/ s'de 10 FSS darbesinden sonra% 20'≥ canlılık gösterdiğini göstermek için test edilmiştir. Bunun bir istisnası, FSS'den mekanik yıkıma nispeten duyarlı olan MiaPaCa2 hücreleridir (canlılık ≤% 10). Bir hücre hattının FSS direnç profilini yeterince tanımlamak için n ≥ 3 biyolojik replika önerilir.
Karşılaştırma yoluyla, incelenen dönüştürülmemiş epitel hücrelerinin tümü bu koşullar altında% 10'< canlılığa sahiptir15,24. Bu nedenle, FSS direncinde gözlenen bir aralık olmakla birlikte, test edilen kanser hücre hatlarının çoğunluğu dönüştürülmemiş hücrelere göre daha fazla FSS direnci sergiler. Kanser hücre hatları hem primer tümör dokularından hem de metastazlardan elde edilebilir. Metastazlardan türetilen hücrelerin, bu fenotip metastatik yayılma sırasında seçilmiş olabileceğinden daha fazla FSS direnci sergileyebileceğini varsayabiliriz. Bununla birlikte, FSS direnç düzeyinin hücrelerin primer tümörlerden mi yoksa metastazlardan mı türetildiğine bağlı olmadığı gösterilmiştir15,24. Ayrıca, FSS direnci seviyeleri bir dizi insan prostat kanseri hücre hattında metastatik potansiyel ile ilişkili değildi15.
Bunu daha fazla test etmek için, değişen metastatik potansiyele sahip BALB/c meme epitel hücreleri (4T1 = yüksek metastatik, 4T07 = zayıf ila orta metastatik potansiyel, 67NR = düşük metastatik potansiyele hayır25,26) kullanılmıştır. Bu deney, FSS direncinin metastatik potansiyel ile ilişkili olmadığını ortaya koydu (Şekil 1). Ayrıca, hem 4T1 hem de 4T07 hücreleri bifazik hücre canlılığı kaybı-nabızlarda 1-2 daha fazla canlılık kaybı daha sonraki nabızlarda gözlenenden daha fazla. Bu, bu grup tarafından araştırılan çoğu kanser hücresi hattının tipik bir üyesidir. Buna karşılık, 67NR FSS'nin bir işlevi olarak hücre canlılığının daha doğrusal bir kaybını sergiler. Toplu olarak, Tablo 2 ve Şekil 1'den elde edilen veriler FSS direncinin dönüştürülmüş hücrelerin bir özelliği olduğunu göstermektedir.
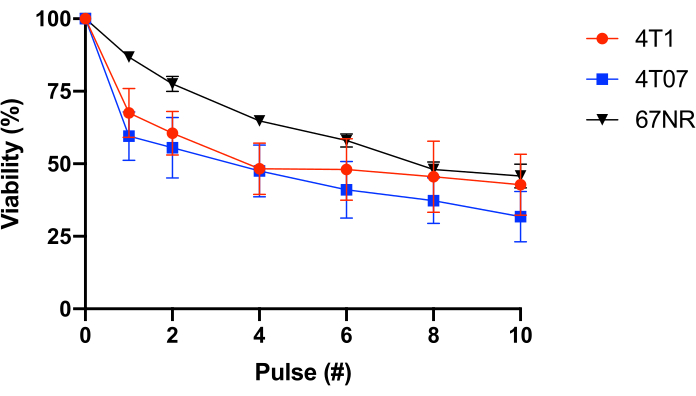
Şekil 1: Singeneik BALB/c meme epitel kanseri hücrelerinin sıvı kesme stres direnci. Hücreler FSS'ye (30 G iğne, 10 pulses@250 mL/s) maruz kaldı ve resazurin dönüşümü (n = 4/hücre hattı) kullanılarak canlılık ölçüldü. FSS maruziyeti canlı hücre sayısını azaltırken (p < 0.0001, 2 yönlü ANOVA) ve her hücre hattında farklı direnç profilleri (p = 0.0446, 2 yönlü ANOVA) görüntülenirken, 10 darbe FSS maruziyeti (p = 0.2833, 2 yönlü ANOVA) sonrası hücre hatları arasında anlamlı bir fark yoktu. Kısaltmalar: FSS = sıvı kesme stresi; ANOVA = varyans analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Kesme (φ): | duvar (maksimum) | asgari | |||||||||||
| Hücre Çapı: | YOK | 10 μm | 15 μm | 20 μm | |||||||||
| İğne Ölçer: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| Akış Hızı (μL/s) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
Tablo 1: Maksimum kesme gerilmesi (φduvar)seviyeleri. Tablo, 20, 50, 100, 150,200 ve 250 μL/s akış hızlarında 30 G, 27 G ve 25 G iğneler için dyn/cm 2'deki maksimum duvar FSS seviyelerini listeler. Kesme gerilme düzeyleri, poiseuille denklemi ( 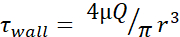 ), her iğne göstergesinin iç çapı için mevcut bilgilerin yanı sıra μ = 0,01 dyn·s/cm2varsayımı kullanılarak hesaplanmıştır. Her boyut için minimum FSS
), her iğne göstergesinin iç çapı için mevcut bilgilerin yanı sıra μ = 0,01 dyn·s/cm2varsayımı kullanılarak hesaplanmıştır. Her boyut için minimum FSS 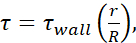 düzeyleri, r hücre yarıçapı ve R iğnenin yarıçapı kullanılarak hesaplanır. Kısaltma: FSS = sıvı kesme stresi; δ = kesme; δ duvar = maksimum kesme; μ = viskozite; Q = hacimsel akış hızı.
düzeyleri, r hücre yarıçapı ve R iğnenin yarıçapı kullanılarak hesaplanır. Kısaltma: FSS = sıvı kesme stresi; δ = kesme; δ duvar = maksimum kesme; μ = viskozite; Q = hacimsel akış hızı.
| Hücre Satırı | Doku Kaynağı | Tür | 10 darbeden sonra ortalama canlılık (%) |
| TRAMPC1 | Prostat | Fare | 40 |
| 4T01 | Meme | Fare | 32 |
| 4T7 | Meme | Fare | 43 |
| 67NR | Meme | Fare | 46 |
| 66CL4 | Meme | Fare | 28 |
| RT4 | Mesane | İnsan | 62 |
| W17-266-4 | Melanom | İnsan | 46 |
| HS852 | Melanom | İnsan | 41 |
| HS695 | Melanom | İnsan | 41 |
| A2058 | Melanom | İnsan | 37 |
| A375 | Melanom | İnsan | 37 |
| RPMI-7951 | Melanom | İnsan | 35 |
| SKMEL2 | Melanom | İnsan | 29 |
| A101D | Melanom | İnsan | 28 |
| MiaPaCa | Pankreas | İnsan | 7 |
Tablo 2: Çeşitli kanser hücre hatlarının sıvı kesme stres direnci. Her kanser hücresi hattı şırınga ve iğne modelinden (30 G iğne, 10 pulses@250 mL/s) sıvı kesme stresine maruz kaldı (n ≥ 3/hücre hattı) ve canlılık luciferaz aktivitesi veya resazurin dönüşümü ile ölçüldü.
Tartışmalar
Bu makale, FSS'nin bir şırınga ve iğne kullanarak süspansiyondaki kanser hücrelerine uygulanmasını göstermektedir. Bu modeli kullanarak, kanser hücrelerinin dönüştürülmemiş epitel hücrelerine göre üst düzey FSS'nin kısa darbelerine karşı daha dirençli olduğu gösterilmiştir15,22,24. Ayrıca, bu modeli kullanarak FSS'ye maruz kalmak hücre sertliğinde hızlı bir artışa, RhoA'nın aktivasyonuna ve kortikal F-aktinin ve miyozin II tabanlı kontrtinalitenin artmasına neden olur24,27. Hızlı mekano adaptasyonu (CTC'lerin koşullara bağlı olarak az ya da çok sertleşme yeteneği) CTC'lerin mekanik yıkımını önleyebilir ve metastatik kolonizasyonun diğer yönlerini kolaylaştırabilir24,28. Gerçekten de, bu in vitro model kullanılarak yapılan bulgular, hayvan modellerinde deneysel CTC'ler kullanılarak doğrulanmıştır24. Bu hızlı mekano adaptasyonu muhtemelen bu modelde tipik olarak gözlenen hücre canlılığının iki fazlı kaybını açıklar (Şekil 1), yani FSS-naif hücreler, FSS'nin tek bir nabzına bile maruz kalan hücrelere göre yıkıma daha duyarlıdır. Birlikte ele alındığında, bu, FSS'nin kanser hücrelerinde hızlı hücre sertleştirmesine neden olduğunu ve onları sonraki FSS darbelerinden koruduğunu gösterir.
RhoA-actomyosin ekseni FSS direncinin önemli bir sürücüsü olmasına rağmen15,21,24, muhtemelen29ile ilgili başka mekanizmalar da vardır. Hücre sertliğinin FSS direncinin önemli bir belirleyicisi olduğuna dair daha fazla kanıt, çekirdeğin yapısal bütünlüğünü kontrol eden lamin A'nın bozulması-hücrenin en sert bileşeni, bu modeli kullanarak kanser hücrelerinde FSS direncini azaltır22. Bu modeli kanser hücrelerindeki FSS direncinin mekanizmalarını daha fazla araştırmak için kullanıyoruz. Burada, bu model, hücreleri yüksek FSS seviyelerinin kısa darbelerine maruz kalarak mekanik yıkıma karşı koymak için çeşitli kanser hücre hatlarının kapasitesini ölçmek için kullanılmıştır. Bu, laboratuvarda geliştirilecek nispeten ucuz, basit bir model olmasına rağmen, en pahalı unsur şırıngır pompası olmasına rağmen, tekrarlanabilir sonuçlar elde etmek için protokolü sadık bir şekilde takip etmeye özen gösterilmelidir. FSS'nin birden fazla darbesi hücrelere çok kısa sürede, <10 dakika içinde uygulanabilir. Deneme için geçen toplam süre süspansiyon hacmine, akış hızına, nabız sayısına ve süspansiyonu darbeler arasında aktaran kullanıcının el becerisine bağlıdır. Deneyimle, 10 pulses@250 μL / s için 30 G iğne ile FSS'ye maruz kalan 5 mL süspansiyon ~ 10 dakikada işlenebilir. Çoğu hücre hattı için, bu süre boyunca süspansiyonda tutulması nedeniyle minimum canlılık kaybı vardır.
FSS'ye maruz kalma nispeten hızlı bir şekilde gerçekleştiğinden, FSS tipik olarak numunelerin köpürmesini azaltmak için serumsuz ortamdaki hücre süspansiyonlarına uygulanır. %0-10 fetal sığır serumu arasındaki viskozite farkı bu testte ihmal edilebilir. Bununla birlikte, hücrelerin yamuma edildiği ortamda fizyolojik kalsiyum seviyelerinin sağlanması kritik öneme sahiptir. Ayrıca, FSS maruziyeti öncesinde hücre ayrışması yöntemleri ile ilgili olarak, tripnizasyon veya enzimmatik olmayan ayrışma ajanları ile tedavi ile hazırlanan PC-3 hücre süspansiyonlarında FSS direncinde bir fark tespit edilmemiştir15. Hücre konsantrasyonu, aşağı akış uygulama ihtiyaçlarına bağlı olarak 5 ×10 5 hücre/mL'den büyük veya daha az olabilir. PC-3 prostat kanseri hücrelerinin yanıtı 5 × 10 4 ila5 × 105,15arasında benzerdir. Bununla birlikte, FSS maruziyeti sonrası hücre konsantrasyonunun canlılık üzerindeki etkileri ampirik olarak belirlenmelidir.
Kültürlü hücrelerle öngörülen çoğu uygulama için, hücre yoğunluğu viskoziteyi ve dolayısıyla uygulanan FSS miktarını önemli ölçüde etkilememelidir. FSS maruziyeti öncesinde hücrelerin süspansiyonda tutulduğu zaman gibi değişkenler deneysel kopyalar arasında sabit tutulmalıdır. Yukarıda belirtildiği gibi, iğne bütünlüğü de kritiktir. Zaman içinde bu teste göre iğnelerde lot varyasyonları not edilmiştir. Hipodermik iğneler klinik kullanım için tasarlandı, burada kullanılan akış hızları için değil. Nadir durumlarda, iğnenin göbeği kısmen tıkanabilir, bu da sonraki darbeler sırasında süspansiyonun iğneden geçişini ve nihayetinde şırınga pistonunun etrafında geri akışı tıkar. Ayrıca, ölü / ölmekte olan hücrelerin daha önce gösterildiği gibi FSS'ye karşı son derece hassas olduğunu anlamak çokönemlidir 24. Bu nedenle, belirli bir hücre hattı, rutin bir karakteristik veya deneysel manipülasyonlar (örneğin, ilaç tedavileri) olarak yüksek düzeyde ölmekte olan hücrelere sahipse, bu statik kontrole kıyasla tamamen normalleştirilmeyebilecek çok dik bir hücre canlılığı kaybına neden olacaktır.
FSS uygulaması, FSS'nin kanser hücre biyolojisi üzerindeki etkisini incelemek için immünofluoresans, çekme tahlilleri ve batı şişkinliği gibi diğer tahlillerle eşlenebilir 24. Prensip olarak, bu model üst düzey, kısa süreli FSS'nin kan hücreleri de dahil olmak üzere diğer hücre tipleri üzerindeki etkilerini araştırmak için de kullanılabilir. Normal kırmızı kan hücreleri ve lökositler, fizyolojik olarak15nedene dayanabilen kanser hücrelerinden bile bu şekilde uygulanan FSS'ye karşı çok daha dirençlidir. Aslında, uygulanan FSS seviyesi, 250 mL / s akış hızında 30 G 1/2" iğne kullanarak, kırmızı hücre zarının bozulması için gereken aralığı basamaklar (milisaniyelik kuvvet uygulamasına dayanarak)30,31. Bu modelin veya bir kanaldan sıvı geçirmeyi içeren herhangi bir sınırlama, hücrelerin maksimum duvar kesme stresinden ve kanalın merkezindeki minimum değere kadar aralıkta deneyimlediği FSS'nin kesin seviyesinin bilinmemesidir. Böylece, her nabızda, tüm hücreler aynı FSS seviyesini yaşamaz ve tekrarlanan darbeler üzerinden, tek tek hücrelerin belirtilen aralıktaki her nabızda farklı FSS seviyeleri yaşaması beklenir.
Bununla birlikte, bu modelde kullanılan koşullar altında hidrodinamik odaklama, hücrelerin akışın merkezine, duvardan uzağa ve böylece daha düşük FSS maruziyetine yönlendirilmesine neden olur32. Koni ve plaka viskometreleri veya Couette odaları gibi diğer modeller, FSS'nin hücre süspansiyonu için sabit seviyelerde uygulanması için daha uygundur. Yukarıda belirtildiği gibi, CTC'lerin FSS maruziyetini modellemek zor olmaya devam ediyor in vitro. Bu model, kalbi geçerken olabileceği gibi FSS'ye yüksek, ancak kısa bir şekilde maruz kalmanın etkilerini test etmek için en uygun olanıdır. Arterler ve damarlar boyunca akış, daha düşük FSS seviyelerine daha uzun süre maruz kalma ile sonuçlanır. Bununla birlikte, belirtildiği gibi, CTC'lerin dolaşımda ne kadar süre sürekli akışta kaldığı belirsizdir ve bugüne kadarki çoğu deneysel kanıt, mikro sirkülasyonda daha uzun tuzak süreleri ile noktalanan kısa serbest akış süreleri (saniye) ile tutarlıdır.
Süspansiyondaki kanser hücrelerini daha uzun süre (dakika-gün) daha düşük FSS seviyelerine (0,5-60 dyn/cm2)maruz bırakan modeller arasında koni ve plaka viskometreleri, Couette odaları, sürekli akış döngüleri, tüp uzantılı şırınga ve mikroakışkan cihazlar33 , 34,35,36,37bulunur. Bunlar ayrıca FSS'nin CTC'leri nasıl etkileyebileceğine dair içgörüler elde etmek için kullanılmıştır ve FSS'ye maruz kalmanın çeşitli kanser hücre hatlarında oksidatif stresi, hücre çoğalmasını ve istilasını ve kök hücre benzeri özellikleri artırdığını tespit etmeye yol açmıştır. Bu modellerden elde edilen sonuçları burada açıklananla karşılaştırmak ilginç olacaktır. Örneğin, sürekli bir akış döngüsü modeli kullanan Xin ve ark. ROCK-actomyosin ekseninin, 38'inüzerinde açıklanan verilerin aksine 2-12 saat boyunca FSS'ye(20dyn/cm 2) maruz kalan kanser hücre hatlarında hücre canlılığı kaybını teşvik ettiğini buldu. Bu nedenle, biyolojik bağlamın tüm bu in vitro modeller için önemli olması çok muhtemeldir, bu da CTC'lerle ilgili bulguları in vivo modellere ve nihayetinde kanser hastalarına çevirme ihtiyacını güçlendirir.
Açıklamalar
MDH, SynderBio, Inc.'in kurucu ortağı, Başkanı ve hissedarıdır.
Teşekkürler
Burada gösterilen modelin geliştirilmesi, DOD hibe W81XWH-12-1-0163, NIH R21 CA179981 ve R21 CA196202 ve Sato Metastaz Araştırma Fonu tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
Referanslar
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031(2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973(2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), Pt 2 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126(2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399(1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649(2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711(2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073(2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır