Method Article
Моделирование влияния гемодинамического стресса на циркулирующие опухолевые клетки с помощью шприца и иглы
В этой статье
Резюме
Здесь мы демонстрируем метод применения напряжения сдвига жидкости к раковым клеткам в суспензии для моделирования воздействия гемодинамического стресса на циркулирующие опухолевые клетки.
Аннотация
Во время метастазирования раковые клетки из твердых тканей, включая эпителий, получают доступ к лимфатической и гематогенной циркуляции, где они подвергаются механическому воздействию из-за гемодинамического потока. Одним из таких стрессов, который испытывают циркулирующие опухолевые клетки (CTC), является напряжение сдвига жидкости (FSS). В то время как раковые клетки могут испытывать низкие уровни FSS в опухоли из-за интерстициального потока, CTC подвергаются, без прикрепления внеклеточного матрикса, гораздо более высоким уровням FSS. Физиологически FSS колеблется более 3-4 порядков величины, с низкими уровнями, присутствующими в лимфатических системах (<1 дин /см2),а самые высокие уровни присутствуют кратковременно, когда клетки проходят через сердце и вокруг сердечных клапанов (>500 дин /см2). Существует несколько моделей in vitro, предназначенных для моделирования различных диапазонов физиологического напряжения сдвига в течение различных временных интервалов. В данной работе описывается модель для исследования последствий коротких (миллисекундных) импульсов ФСС высокого уровня на биологию раковых клеток с использованием простой системы шприцев и игл.
Введение
Метастазирование, или распространение рака за пределы исходного участка опухоли, является основным фактором, лежащим в основе смертности от рака1. Во время метастазирования раковые клетки используют кровеносную систему в качестве магистрали для распространения в отдаленные участки по всему телу2,3. На пути к этим участкам циркулирующие опухолевые клетки (ЦОК) существуют в динамическом микроокружении жидкости, в отличие от их исходной первичной опухоли3,4,5. Было высказано предположение, что эта микроокружение жидкости является одним из многих барьеров для метастазирования4. Существует широкое согласие в концепции метастатической неэффективности, т. е. что большинство КТК, поступающих в циркуляцию, либо погибает, либо не образуют продуктивных метастатических колоний6,7,8. Однако вопрос о том, почему метастазирование является неэффективным с точки зрения отдельного КТК, менее определенно и остается активной областью расследования. ЦОК отделяются от внеклеточного матрикса, лишены растворимых факторов роста и выживания, которые могут присутствовать в первичной опухоли, и подвергаются воздействию иммунной системы и гемодинамических сил совершенно иначе, чем в первичной опухоли4. Каждый из этих факторов может способствовать плохому выживанию ЦОД, но их относительный вклад неясен. В данной статье рассматривается вопрос о том, как гемодинамические силы влияют на ЦОК.
Изучение влияния гемодинамических сил на ЦОК является довольно сложной задачей. В настоящее время не существует инженерных систем in vitro, которые могли бы воспроизвести всю пространственно-високоритную динамику (от сердца к капиллярам) и реологические свойства сосудистой системы человека. Более того, как ЦОК воспринимают кровеносную систему, не совсем ясно. Экспериментальные данные показывают, что большинство раковых клеток не циркулируют непрерывно, как клетки крови. Скорее, из-за их относительно большого размера (10-20 мкм в диаметре) большинство ЦОК застревают в капиллярных пластах (6-8 мкм в диаметре) в течение переменных промежутков времени (от дней до дней), где они могут умереть, экстравазироваться или быть смещены в следующее капиллярноерусло 8,9,10,11. Тем не менее, есть некоторые доказательства того, что размер CTC может быть более неоднородным in vivo, и что меньшие CTC обнаруживаются12. Поэтому, исходя из расстояния и скорости кровотока, ЦОК могут свободно циркулировать только в течение нескольких секунд между этими периодами ловушки, хотя количественного описания этого поведения не хватает13.
Кроме того, в зависимости от того, где ЦОК входят в кровообращение, они могут проходить через несколько капиллярных лож в легких и других периферических участках, а также через правое и левое сердце до достижения конечного пункта назначения. По пути CTC подвергаются различным гемодинамическим нагрузкам, включая напряжение сдвига жидкости (FSS), сжимающие силы во время их ловушки в микроциркуляции и, возможно, силы тяги в обстоятельствах, когда они могут проявлять лейкоцитарное катание вдоль стенок кровеносных сосудов14. Таким образом, как способность моделировать циркуляцию, так и понимание моделируемого поведения КТК ограничены. Из-за этой неопределенности любые результаты из модельных систем in vitro должны быть проверены в экспериментальном организме позвоночных и, в конечном счете, у больных раком.
С вышеупомянутыми оговорками в этой статье демонстрируется относительно простая модель применения FSS к клеткам в суспензии для исследования влияния FSS на CTC, впервые описанную в 2012году 15. FSS возникает в результате трения кровотока о стенку сосуда, что приводит к градиенту параболической скорости в условиях ламинарного потока в более крупных сосудах. Клетки испытывают более высокие уровни FSS вблизи стенок сосудов и более низкие уровни вблизи центра кровеносного сосуда. Вязкость жидкости, скорость потока и размеры трубопровода, через который происходит поток, влияют на FSS, как описано уравнением Хагена-Пуазёя. Это относится к потокам крови, которые ведут себя как ньютоновские жидкости, но не удерживают микроциркуляции. Физиологический FSS колеблется на несколько порядков величины с самыми низкими уровнями в лимфатических системах (<1 дин /см2)и самыми высокими в областях вокруг сердечных клапанов и атеросклеротических бляшек (>500 дин /см2)5. Среднее напряжение сдвига стенки в артериях составляет 10-70дин/см2 и 1-6 дин/см2 в венах16,17.
В сердце клетки могут подвергаться воздействию турбулентных потоков вокруг клапанных листочков, где очень высокий уровень, но очень кратковременный FSS можетнаблюдаться 18,19. Хотя область биообработки уже давно изучает влияние FSS на клетки млекопитающих в суспензии, эта информация может быть ограниченной ценностью для понимания влияния FSS на CTC, поскольку она обычно фокусируется на гораздо более низких уровнях FSS, применяемых в течение длительноговремени 20. Как описано ниже, с помощью шприца и иглыможноприменять относительно высокий (от десятков до тысяч дин/см2) FSS на относительно короткую (миллисекунды) продолжительность к клеточной суспензии. Начиная с первоначального описания этой модели15,другие использовали ее для изучения влияния FSS на раковые клетки21,22,23. Множественные «импульсы» FSS могут быть применены к клеточным суспензиям за короткий период времени для облегчения последующего экспериментального анализа. Например, эта модель может быть использована для измерения способности клеток противостоять механическому разрушению FSS путем измерения жизнеспособности клеток в функции от количества примененных импульсов. В качестве альтернативы, влияние воздействия FSS на биологию раковых клеток может быть изучено путем сбора клеток для различных последующих анализов. Важно отметить, что часть клеточной суспензии зарезервирована в качестве статического контроля для сравнения эффектов FSS с теми, которые могут быть связаны с отслойкой клетки и временем, проведенным в приостановке.
протокол
1. Клеточная подготовка
- Высвобождайте клетки из чашки для посева тканей при слиянии 70-90%, следуя рекомендуемым рекомендациям для клеточной линии в использовании.
- Например, аспирировать питательную среду для клеток PC-3 и промыть 10-сантиметровую чашку клеток 5 мл безкальций- и магния фосфатно-буферного физиологического раствора (PBS).
- Аспирировать PBS перед добавлением 1 мл 0,25% трипсина с использованием протокола производителя.
- После наблюдения за отслойками клеток под инвертным микроскопом добавьте 5 мл среды DMEM:F12, содержащей 10% фетальной бычий сыворотки, чтобы ингибировать трипсин.
- Поместите клеточную суспензию в коническую трубку.
- Определите концентрацию клеток и общее количество клеток.
- Грануляционные клетки путем центрифугирования (300 × г в течение 3 мин), аспирируют супернатант и повторно суспендируют клетки в безсыворочной тканевой культурной среде до 5 × 105 клеток/мл.
ПРИМЕЧАНИЕ: Крайне важно, чтобы среда для анализа содержала не менее 1,17 мМCa++, поскольку было продемонстрировано, что внеклеточныйCa++ необходим для клеточной резистентности к FSS15.
2. Воздействие напряжения сдвига жидкости
- Перед тем, как подвергнуть ячейки воздействию FSS, вырежьте полистирольную трубку с круглым дном 14 мл на линии 7 мл. Смешайте клеточную суспензию, поместите 5 мл суспензии в разрезаемую трубку и соберите статические контрольные образцы.
ПРИМЕЧАНИЕ: Объем, необходимый для сбора статического образца, зависит от используемого анализа жизнеспособности (см. шаг 3). - Втяните клеточную суспензию в шприц 5 мл и прикрепите иглу 30 Г 1/2 дюйма. Отстегните иглу, поместите шприц на шприцевой насос, закрепите шприц и установите скорость потока для достижения желаемого уровня FSS.
ПРИМЕЧАНИЕ: В таблице 1 показано максимальное напряжение сдвига стенки для различных игл и скоростей потока, а также минимальный уровень FSS в зависимости от размера ячейки (10, 15 и 20 мкм). Осмотрите иглу перед использованием, чтобы убедиться, что она не согнута; если неуверенно, замените иглу новой. Целостность иглы может оказывать значительное влияние на уровень применяемого ФСС. - Запустите шприцевой насос и соберите срезанный образец в разрезанной трубке под углом 45°, чтобы уменьшить вспенивание. Соберите образец в зависимости от типа анализа жизнеспособности или потребностей в анализе ниже по течению.
- Осторожно извлеките шприц и иглу из шприцевого насоса и используйте плоскогубцы, чтобы удалить иглу из шприца, заботясь о том, чтобы не коснуться иглы.
ПРИМЕЧАНИЕ: Нескошенные иглы могут использоваться взаимозаменяемо со скошенными иглами в качестве дополнительной меры безопасности.
- Осторожно извлеките шприц и иглу из шприцевого насоса и используйте плоскогубцы, чтобы удалить иглу из шприца, заботясь о том, чтобы не коснуться иглы.
- Втяните среженную суспензию обратно в шприц, аккуратно прикрепите иглу плоскогубцами и поместите ее обратно в шприцевой насос.
- Повторяйте шаги 2.3 и 2.4 до тех пор, пока клеточная суспензия не подверглась воздействию требуемого количества импульсов ФСС.
ПРИМЕЧАНИЕ: Для оценки способности клеток противостоять механическому разрушению от воздействия FSS клеточная суспензия обычно подвергается 10 импульсам FSS. Однако было продемонстрировано, что клетки начинают подвергаться биологическим адаптациям в ответ на FSS после 2 импульсов24.
3. Измерение жизнеспособности
ПРИМЕЧАНИЕ: Жизнеспособность может быть оценена с помощью ферментативных анализов (люциферазы, ресазурина и WST-1), подсчета интактных клеток, проточной цитометрии или клоногенных анализов.
- Для всех показателей жизнеспособности соберите образец перед воздействием FSS клеток.
- Для ферментативных анализов возьмите дубликаты 100 мкл аликвот и поместите их в 96-скважинную пластину.
- Для проточной цитометрии возьмите одну аликвоту 500 мкл и поместите ее в трубку 1,5 мл.
- Для клоногенного анализа собирают 100 мкл аликвоты.
- Ферментативный анализ
- Соберите образцы 100 мкл после 1, 2, 4, 6, 8 и 10 импульсов воздействия FSS и поместите их в 96-скважинную пластину.
- Добавьте желаемый субстрат и следуйте протоколу для используемого анализа:
- Для ресазурина добавляют 20 мкл раствора 0,15 мг/мл в каждую скважину. Добавьте 20 мкл 0,15 мг/мл раствора ресазурина в скважины, содержащие 100 мкл только среды. Инкубировать в течение 2 ч в инкубаторе культуры тканей при 37 °C. Измерьте поглощение с помощью пластинчатого считывателя, способного считывать флуоресценцию (579 возбуждения / 584 излучения).
- Для люцифераз-экспрессивных клеток добавьте 100 мкл 15 мг/мл D-люциферина к 5 мл среды. Добавьте 100 мкл этого раствора к каждой скважине, содержащей клетки. Подождите 5 минут, а затем прочитайте пластину с помощью считывателя, совместимого с люминесценцией.
- Для WST-1 добавить 10 мкл WST-1 в каждую скважину, включая скважины, содержащие только среду. Инкубировать в течение 4 ч, а затем считывать поглощение между 420 и 480 нм с помощью пластинчатого считывателя.
- Сравните усредненный сигнал от каждого из образцов, подвергшихся воздействию FSS, со усредненным статическим контрольным образцом, чтобы получить процент жизнеспособных клеток.
- Проточная цитометрия24
- Соберите образцы 500 мкл и поместите их в центрифужные трубки по 1,5 мл после 1, 2, 5 и 10 импульсов FSS.
- Центрифуги пробы (500 × г в течение 3 мин) и выбрасывают супернатанты.
- Повторно суспендировать гранулы 1 мл ПБС без кальция и магния и центрифугировать образцы (300 × г в течение 3 мин).
- Присушать гранулы с 500 мкл буфера флуоресцентно-активированной сортировки клеток (FACS) (PBS с 0,5% бычим сывороточным альбумином и 0,1% азида натрия) с счетными шариками и мембранно-непроницаемыми или жизнеспособными красителями, такими как йодид пропидия (1,75 мкг/мл).
- Определить жизнеспособность путем сравнения соотношения жизнеспособных клеток, нормализованных к подсчету шариков, в сстриженных образцах с соотношением статических образцов.
- Клоногенный анализ
- Возьмите 100 мкл статического образца и добавьте 900 мкл питательной среды, чтобы сделать разбавление 1:10.
- Возьмите 100 мкл разбавленного образца 1:10 и добавьте 900 мкл питательной среды, чтобы получить окончательное разведение 1:100.
- Добавьте 100 мкл образца разбавления 1:100 в каждую из 3 скважин 6-скважинной посуды, содержащей 2 мл питательной среды.
- Повторите шаги 3.4.1-3.4.3 с образцами, подвергаемыми воздействию 10 импульсов ФСС.
- Дайте клеткам расти в течение 7-10 дней без изменения среды и проверьте образование колоний. Как только колонии клеток ≥50 сформированы, аспирируйте питательную среду, промывайте каждую скважину 1 мл PBS, аспирируйте PBS и фиксируйте в течение 5 минут, используя 1 мл ледяного 70% этанола (EtOH). Важно отметить, что одновременно фиксируются как сеженные, так и статические образцы.
- После фиксации образцов аспирируют EtOH и добавляют от 1 до 2 мл кристаллического фиолетового раствора (0,1% кристаллической фиалки в 90%H2O,10% EtOH) в течение 5 мин.
- Промойте избытком воды, и дайте тарелке высохнуть
- Подсчитайте колонии (кластеры ≥50 клеток) как для статических, так и для среженных образцов. Сравните отношение среднего числа колоний из сброшенного образца к среднему числу колоний из статического образца для определения жизнеспособности.
Результаты
Ранее было показано, что повышенная устойчивость к механическому разрушению, вызванному FSS, является сохраненным фенотипом через несколько линий раковых клеток и раковых клеток, недавно выделенных из опухолей по сравнению с непереобранными компараторами эпителиальных клеток15,24. Здесь были протестированы дополнительные линии раковых клеток из различных тканевых источников(таблица 2),чтобы продемонстрировать, что большинство этих клеток демонстрируют жизнеспособность ≥ 20% после 10 импульсов FSS со скоростью 250 мкл / с. Единственным исключением являются клетки MiaPaCa2, которые были относительно чувствительны к механическому разрушению от FSS (жизнеспособность ≤ 10%). Для адекватного описания профиля резистентности FSS клеточной линии рекомендуется n ≥ 3 биологических реплик.
Для сравнения, все исследованные непереформированные эпителиальные клетки имеют жизнеспособность < 10% в этих условиях15,24. Таким образом, хотя существует диапазон наблюдаемой резистентности к FSS, большинство протестированных линий раковых клеток демонстрируют большую резистентность к FSS, чем непереформированные клетки. Линии раковых клеток могут быть получены как из первичных опухолевых тканей, так и из метастазов. Можно постулировать, что клетки, полученные из метастазов, могут проявлять большую резистентность к FSS, поскольку этот фенотип мог быть выбран во время метастатической диссеминирования. Однако было показано, что уровень резистентности к FSS не зависит от того, были ли клетки получены из первичных опухолей или метастазов15,24. Более того, уровни резистентности к ФСС не коррелировали с метастатическим потенциалом в серии клеточных линий рака предстательной железы человека15.
Для дальнейшей проверки этого использовали эпителиальные клетки молочной железы BALB/c с изменяющимся метастатическим потенциалом (4T1 = высокий метастатический, 4T07 = слабый или умеренный метастатический потенциал, 67NR = от no до низкого метастатического потенциала25,26). Этот эксперимент показал, что сопротивление FSS не коррелирует с метастатическим потенциалом(рисунок 1). Более того, как клетки 4T1, так и 4T07 демонстрируют двухфазную потерю жизнеспособности клеток - большую потерю жизнеспособности в импульсах 1-2, чем наблюдалось при последующих импульсах. Это характерно для большинства линий раковых клеток, исследованных этой группой. Напротив, 67NR демонстрирует более линейную потерю жизнеспособности клеток в зависимости от FSS. В совокупности данные из таблицы 2 и рисунка 1 демонстрируют, что сопротивление FSS является свойством преобразованных ячеек.
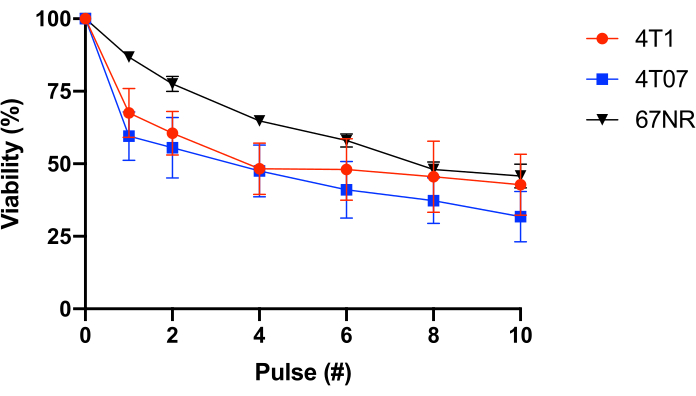
Рисунок 1:Устойчивость к напряжению сдвига жидкости сингенных клеток эпителия молочной железы BALB/c. Клетки подвергались воздействию FSS (игла 30 г, 10 pulses@250 мл / с), и жизнеспособность измеряли с использованием конверсии ресазурина (n = 4 / клеточная линия). В то время как воздействие FSS уменьшало количество жизнеспособных клеток (p < 0,0001, 2-полосная ANOVA), и каждая клеточная линия отображала различные профили сопротивления (p = 0,0446, 2-полосная ANOVA), не было значимой разницы между клеточными линиями после 10 импульсов воздействия FSS (p = 0,2833, 2-полосная ANOVA). Сокращения: FSS = напряжение сдвига жидкости; ANOVA = дисперсионный анализ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Сдвиг (τ): | стена (максимум) | минимум | |||||||||||
| Диаметр ячейки: | Н/Д | 10 мкм | 15 мкм | 20 мкм | |||||||||
| Игольчатый калибр: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| Расход (мкл/с) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
Таблица 1: Максимальные уровни напряжения сдвига (τстенки). В таблице приведены максимальные уровни FSS вдин/см2 для игл 30 G, 27 G и 25 G при скорости потока 20, 50, 100, 150, 200 и 250 мкл/с. Уровни напряжения сдвига были рассчитаны с использованием уравнения Пуазёй ( 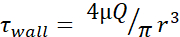 ), доступной информации для внутреннего диаметра каждой иглы, а также предположения, что μ = 0,01 дин·с/см2. Минимальные уровни FSS для каждого размера были рассчитаны с
), доступной информации для внутреннего диаметра каждой иглы, а также предположения, что μ = 0,01 дин·с/см2. Минимальные уровни FSS для каждого размера были рассчитаны с 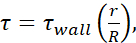 использованием, где r - радиус ячейки, а R - радиус иглы. Аббревиатура: FSS = напряжение сдвига жидкости; τ = сдвиг; τстенка = максимальный сдвиг; μ = вязкость; Q = объемный расход.
использованием, где r - радиус ячейки, а R - радиус иглы. Аббревиатура: FSS = напряжение сдвига жидкости; τ = сдвиг; τстенка = максимальный сдвиг; μ = вязкость; Q = объемный расход.
| Клеточная линия | Источник ткани | Вид | Средняя жизнеспособность (%) после 10 импульсов |
| ТРАМПК1 | Простата | Мышь | 40 |
| 4Т01 | Грудь | Мышь | 32 |
| 4Т7 | Грудь | Мышь | 43 |
| 67НР | Грудь | Мышь | 46 |
| 66CL4 | Грудь | Мышь | 28 |
| РТ4 | Пузырь | Человеческий | 62 |
| В17-266-4 | Меланома | Человеческий | 46 |
| HS852 | Меланома | Человеческий | 41 |
| HS695 | Меланома | Человеческий | 41 |
| А2058 | Меланома | Человеческий | 37 |
| А375 | Меланома | Человеческий | 37 |
| РПИ-7951 | Меланома | Человеческий | 35 |
| СКМЕЛ2 | Меланома | Человеческий | 29 |
| А101Д | Меланома | Человеческий | 28 |
| МиаПаКа | Панкреатический | Человеческий | 7 |
Таблица 2: Устойчивость к напряжению сдвига жидкости различных линий раковых клеток. Каждая линия раковых клеток подвергалась воздействию напряжения сдвига жидкости от модели шприца и иглы (игла 30 Г, 10 pulses@250 мл / с) (n ≥ 3 / клеточная линия), и жизнеспособность измерялась либо активностью люциферазы, либо конверсией ресазурина.
Обсуждение
В данной работе демонстрируется применение ФСС к раковым клеткам в суспензии с использованием шприца и иглы. Используя эту модель, было показано, что раковые клетки более устойчивы к коротким импульсам FSS высокого уровня относительно непереформированных эпителиальных клеток15,22,24. Кроме того, воздействие FSS с использованием этой модели приводит к быстрому увеличению жесткости клеток, активации RhoA и увеличению кортикального F-актина и сократимости на основе миозина II24,27. Быстрая механоадаптация (способность ЦОК становиться более или менее жесткими в зависимости от обстоятельств) может предотвратить механическое разрушение ЦОК и облегчить другие аспекты метастатической колонизации24,28. Действительно, результаты, сделанные с использованием этой модели in vitro, были подтверждены с использованием экспериментальных CTC на животных моделях24. Эта быстрая механоадаптация, вероятно, объясняет двухфазную потерю жизнеспособности клеток, обычно наблюдаемую в этой модели(рисунок 1),то есть FSS-наивные клетки более восприимчивы к разрушению, чем клетки, которые подвергались воздействию даже одного импульса FSS. Взятые вместе, это указывает на то, что FSS индуцирует быструю жесткость клеток в раковых клетках, что защищает их от последующих импульсов FSS.
Хотя ось RhoA-актомиозина является важным фактором сопротивления FSS15,21,24,вероятно, есть и другие механизмы, участвующие29. Еще одним доказательством того, что жесткость клеток является ключевым фактором, определяющим устойчивость к FSS, является то, что нарушение ламина А, который контролирует структурную целостность ядра - самого жесткого компонента клетки, снижает резистентность к FSS в раковых клетках с использованием этой модели22. Мы используем эту модель для дальнейшего исследования механизмов резистентности к FSS в раковых клетках. Здесь эта модель была использована для измерения способности различных линий раковых клеток противостоять механическому разрушению путем воздействия на клетки коротких импульсов высокого уровня FSS. Хотя это относительно недорогая, простая модель для разработки в лаборатории, причем самым дорогим элементом является шприцевой насос, необходимо позаботиться о том, чтобы добросовестно следовать протоколу для получения воспроизводимых результатов. Множественные импульсы FSS могут быть применены к клеткам за очень короткое время, <10 минут. Общее время, затраченное на эксперимент, зависит от объема суспензии, расхода, числа импульсов и ловкости пользователя, перемещающего суспензию между импульсами. С опытом, 5 мл суспензии, подвергаемой воздействию FSS с иглой 30 Г в течение 10 pulses@250 мкл / с, может быть обработана за ~ 10 минут. Для большинства клеточных линий существует минимальная потеря жизнеспособности из-за того, что они удерживаются во суспензии в течение этого периода времени.
Поскольку воздействие FSS происходит относительно быстро, FSS обычно применяют к клеточным суспензиям в среде, свободной от сыворотки, чтобы уменьшить вспенивание образцов. Разница в вязкости между 0-10% фетальной бычий сывороткой незначительна в этом анализе. Тем не менее, крайне важно обеспечить физиологический уровень кальция в среде, в которой клетки срежены. Кроме того, что касается способов диссоциации клеток до воздействия ФСС, то в клеточных суспензиях PC-3, приготовленных трипсинизацией или лечением неферментативными диссоциационными агентами15,не было обнаружено различий в резистентности к ФСС. Концентрация в клетках может быть больше или меньше 5 × 105 клеток/мл в зависимости от последующих потребностей применения. Реакция клеток рака предстательной железы PC-3 аналогична в диапазоне от 5 × 104 до 5 × 105,15. Однако влияние концентрации клеток на жизнеспособность после воздействия ФСС должно быть определено эмпирически.
Для большинства применений, предусмотренных с культивируемыми клетками, плотность клеток не должна существенно влиять на вязкость и, следовательно, на количество применяемого FSS. Переменные, такие как время, в течение которого клетки удерживаются во суспензии до воздействия FSS, должны быть постоянными на экспериментальных репликах. Как упоминалось выше, целостность иглы также имеет решающее значение. Различия партии были отмечены в иглах в отношении этого анализа с течением времени. Иглы для подкожных процедур были разработаны для клинического использования, а не для скоростей потока, используемых здесь. В редких случаях ступица иглы может быть частично закупорена, что во время последующих импульсов закупоривает прохождение суспензии через иглу и, в конечном счете, обратный поток вокруг плунжера шприца. Кроме того, очень важно понимать, что мертвые / умирающие клетки исключительно чувствительны к FSS, как показаноранее 24. Поэтому, если конкретная клеточная линия имеет высокий уровень умирающих клеток, либо в качестве обычной характеристики, либо в качестве экспериментальных манипуляций (например, медикаментозного лечения), это приведет к очень резкой потере жизнеспособности клеток, которая не может быть полностью нормализована по сравнению со статическим контролем.
Применение FSS может быть сопряжено с другими анализами, такими как иммунофлуоресценция, вытягивающие анализы и вестерн-блоттинг, для изучения влияния FSS на биологию раковых клеток 24. В принципе, эта модель может также использоваться для изучения влияния высокоуровневого, кратковременные FSS на другие типы клеток, включая клетки крови. Нормальные эритроциты и лейкоциты гораздо более устойчивы к ФСС, применяемым таким образом, чем даже раковые клетки, что физиологически15. Фактически, уровень FSS применяется, используя иглу 30 G 1/2" со скоростью потока 250 мл/с, брекетки диапазона, необходимого для разрушения мембраны эритроцитов (на основе миллисекундного приложения силы)30,31. Одним из ограничений этой модели или любой, которая включает в себя прохождение жидкости через канал, является то, что точный уровень FSS, который клетки испытывают в диапазоне от максимального напряжения сдвига стенки до минимального в центре трубопровода, неизвестен. Таким образом, на каждом импульсе все клетки не испытывают одинаковый уровень FSS, и при повторных импульсах ожидается, что отдельные клетки будут испытывать разные уровни FSS на каждом импульсе в указанном диапазоне.
Однако гидродинамическая фокусировка в условиях, используемых в этой модели, приводит к тому, что клетки направляются к центру потока, в сторону от стенки и, таким образом, к более низкому воздействию FSS32. Другие модели, такие как конусные и пластинчатые вискозиметры или камеры Couette, лучше подходят для применения FSS на постоянных уровнях к клеточной суспензии. Как упоминалось выше, по-прежнему сложно смоделировать воздействие FSS CTC in vitro. Эта модель лучше всего подходит для проверки эффектов высокого, но кратковременный воздействия FSS, как это может произойти через сердце. Поток через артерии и вены приводит к более длительному воздействию более низких уровней FSS. Однако, как уже упоминалось, как долго CTC остаются в непрерывном потоке в циркуляции, неясно, и большинство экспериментальных данных на сегодняшний день согласуются с короткими периодами (секундами) свободного потока, перемежающимися более длительными периодами ловушки в микроциркуляции.
Модели, которые подвергают раковые клетки в суспензии более низким уровням FSS (0,5-60 дин / см2)в течение более длительных периодов времени (от минут до дней), включают конусные и пластинчатые вискозиметры, камеры Couette, петли непрерывного потока, шприц с удлинителями трубки и микрофлюидные устройства33,34,35,36,37. Они также были использованы для получения информации о том, как FSS может влиять на CTC, и привели к выводу, что воздействие FSS увеличивает окислительный стресс, пролиферацию и инвазию клеток, а также характеристики, подобные стволовым клеткам, в различных линиях раковых клеток. Будет интересно сравнить результаты, полученные из этих моделей, с описанными здесь. Например, используя модель петли непрерывного потока, Xin et al. обнаружили, что ось ROCK-actomyosin способствовала потере жизнеспособности клеток в линиях раковых клеток, подвергшихся воздействию FSS (20 дин/см2) в течение 2-12 ч, что резко контрастирует с данными, описанными выше38. Таким образом, биологический контекст, скорее всего, будет иметь значение для всех этих моделей in vitro, усиливая необходимость перевода результатов о CTC в модели in vivo и, в конечном счете, больных раком.
Раскрытие информации
MDH является соучредителем, президентом и акционером SynderBio, Inc. DLM является консультантом SynderBio, Inc.
Благодарности
Развитие модели, продемонстрированной здесь, было поддержано грантом Министерства энергетики США W81XWH-12-1-0163, грантами NIH R21 CA179981 и R21 CA196202, а также Фондом исследований метастазов Сато.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
Ссылки
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031 (2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973 (2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126 (2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399 (1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649 (2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711 (2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073 (2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены