Method Article
注射器と針を用いた循環腫瘍細胞に及ぼす血行力学的ストレスのモデル化
要約
ここでは、懸濁液中の癌細胞に流体せん断応力を適用し、循環腫瘍細胞に及ぼす血行力学的ストレスの影響をモデル化する方法を示す。
要約
転移の間、上皮を含む固体組織からの癌細胞は、血行性の流れによる機械的ストレスにさらされるリンパおよび血球循環にアクセスする。これらのストレスの 1 つは循環腫瘍細胞 (CTC) 経験は流体せん断応力 (FSS) です。がん細胞は間質流のために腫瘍内で低レベルのFSSを経験する可能性がありますが、CTCは細胞外マトリックス付着なしで、はるかに大きなレベルのFSSに曝露されます。生理学的には、FSSは3〜4桁を超え、リンパ系(<1 dyne/cm2)に存在する低レベルと、細胞が心臓と心臓弁の周りを通過する時点で短時間存在する最高レベル(>500ダイン/cm2)を有する。さまざまな時間枠にわたって生理学的剪断応力の異なる範囲をモデル化するように設計された いくつかのin vitro モデルがあります。本論文では、単純な注射器と針システムを用いて、がん細胞生物学における高レベルFSSの短い(ミリ秒)パルスの結果を調べるモデルについて説明する。
概要
転移、または初期腫瘍部位を超える癌の広がりは、癌死亡率の基礎となる主要な要因である。転移の間、癌細胞は循環系を高速道路として利用して、身体2、3を通して遠くの部位に広がる。これらの部位に向かう途中で、循環腫瘍細胞(CTC)は、元の原発腫瘍3、4、5とは異なり、動的流体微小環境内に存在する。この流体微小環境は転移に対する多くの障壁の1つであると提案されている。転移性非効率の概念には広く一致している、すなわち、循環に入るほとんどのCTCが滅びるか、または生産的な転移コロニーを形成しないこと6、7、8。しかし、なぜ個々のCTCの観点から転移が非効率的なのかは、あまり確実ではなく、依然として活発な調査分野である。CTCは、細胞外マトリックスから剥離され、原発性腫瘍に存在し得る可溶性増殖および生存因子を奪われ、原発腫瘍4とは大きく異なる方法で免疫系および血行力力にさらされる。これらの要因のそれぞれは、CTCの貧しい生存に寄与するかもしれないが、その相対的な貢献は不明である。本稿では、血行力がCTCに与える影響について論じ合う。
CTCに対する血行力の影響を研究することは非常に困難です。現在、人間の血管系の全体の時空間的ダイナミクス(心臓から毛細血管)およびレオロジー特性を複製できる、設計されたインビトロシステムはありません。さらに、CTCが循環系をどのように経験するかを完全には明らかではありません。実験的証拠は、ほとんどの癌細胞が血液細胞のように連続的に循環しないことを示している。むしろ、比較的大きなサイズ(直径10〜20μm)のため、ほとんどのCTCは、キャピラリーベッド(直径6〜8μm)に閉じ込められ、死んだり、空入部を起用したり、次のキャピラベッド8、9、10、11に変位したりする可能性があります。しかし、CTCサイズは生体内でより異種であり、より小さなCTCが検出可能な12であるといういくつかの証拠がある。従って、距離および血流速度に基づいて、CTCは、これらの捕捉期間間の数秒間だけ自由に循環し得るが、この挙動の定量的記述は13を欠いている。
さらに、CTCが循環に入る場所に応じて、肺および他の周辺部位の複数の毛細血管床を通過し、最終目的地に到達する前に左右の心臓を通過する可能性があります。途中、CTCは、流体せん断応力(FSS)、微小循環中の圧縮力、血管壁14に沿って白血球様転がりを示す可能性がある状況下での牽引力を含む様々な血行力学的ストレスにさらされる。したがって、循環をモデル化する能力と、モデル化するCTC挙動の理解の両方が制限される。この不確実性のために 、in vitro モデルシステムからの知見は、実験的な脊椎動物生物で、そして最終的には癌患者で検証されるべきである。
前述の注意点を用いて、この論文は、201215年に最初に説明されたCTCに対するFSSの影響を調査するために、懸濁液中の細胞にFSSを適用する比較的単純なモデルを示している。FSSは血管壁に対する血流の摩擦に起因し、より大きな血管における層流の条件下で放物線速度勾配を生じる。細胞は、血管壁付近のFSSの高レベルおよび血管の中心付近の低レベルを経験する。流体粘度、流量、および流れが発生する導管の寸法は、ハーゲン・ポイズイユ方程式で説明されているようにFSSに影響を与えます。これは、ニュートン流体として動作する血液の流れに適用されますが、微小循環のために保持されません。生理学的FSSは、リンパ球の最低レベル(<1 dyn/cm2)と心臓弁およびアテローム硬化性プラーク(>500 dyn/cm2)周辺の領域で最も高いレベルの数桁にわたって及ぶ5。動脈の平均壁せん断応力は、静脈16、17の10-70 dyn/cm2および1-6dyn/cm2である。
心臓では、細胞は非常に高レベルであるが、非常に短い期間のFSSが18、19を経験することができる弁のチラシの周りの乱流の流れにさらされるかもしれない。バイオプロセシング分野は長い間、哺乳類細胞に対するFSSの懸濁液への影響を研究してきたが、この情報は、一般的に長期間20回にわたって適用されるFSSのはるかに低いレベルに焦点を当てているため、CTCに対するFSSの影響を理解するための限られた価値がある可能性がある。後述するように、注射器および針を用いて、細胞懸濁液に比較的短い(ミリ秒)持続時間のために比較的高い(数十〜数千のdyn/cm2)FSSを適用することができる。このモデル15の最初の説明以来、他の人は癌細胞21、22、23に対するFSSの影響を研究するためにそれを採用している。FSSの複数の「パルス」を短時間で細胞懸濁液に適用して、下流の実験分析を容易にします。例えば、このモデルは、適用されるパルス数の関数として細胞の生存率を測定することによって、FSSによる機械的破壊に抵抗する細胞の能力を測定するために使用することができる。あるいは、がん細胞の生物学に及ぼすFSS曝露の効果は、さまざまな下流分析のために細胞を採取することによって探索することができる。重要なことに、細胞懸濁液の一部は、細胞剥離および懸濁液に保持される時間に関連する可能性のあるFSSの効果を比較するために、静的制御として予約されている。
プロトコル
1. 細胞の調製
- 使用している細胞株に推奨されるガイドラインに従うことによって、70〜90%コンフルエントの場合に組織培養皿から細胞を放出する。
- 例えば、PC-3細胞の増殖培地を吸引し、カルシウム及びマグネシウムフリーリン酸緩衝生理食塩水(PBS)の5mLで細胞の10cm皿を洗浄する。
- メーカーのプロトコルを使用して0.25%トリプシンの1 mLを追加する前にPBSを吸引してください。
- 逆顕微鏡下で細胞の剥離を観察した後、トリプシンを阻害するために10%のウシ胎児血清を含むDMEM:F12培地の5 mLを加える。
- 細胞懸濁液を円錐管に入れる。
- 細胞の濃度と総細胞数を決定します。
- 遠心分離(3分間300×g)によるペレット細胞、上清を吸引し、5×5細胞/mLの無血清組織培養培地中の細胞を再懸濁した。
注:細胞外Ca++がFSS15に対する細胞抵抗性に必要であることが実証されているように、アッセイ媒体が少なくとも1.17 mM Ca++を含むことが重要です。
2. 流体せん断応力暴露
- FSSに細胞を露出させる前に、ラウンドボトム14 mLポリスチレンチューブを7 mLラインで切断した。細胞懸濁液を混合し、5mLの懸濁液をカットチューブに入れ、静電気制御サンプルを採取します。
注:静的サンプルの収集に必要なボリュームは、使用される生存率アッセイによって異なります(ステップ3を参照)。 - 5 mL のシリンジに細胞懸濁液を引き込み、30 G 1/2 インチの針を取り付けます。針の蓋を解除し、注射器をシリンジポンプに置き、シリンジを固定し、必要なレベルのFSSを達成するために流量を設定します。
注: 表 1 は 、さまざまな針と流量の最大壁せん断応力と、セルサイズ(10、15、および 20 μm)に応じた FSS の最小レベルを示しています。使用前に針を点検して、曲がっていないか確認してください。不確かな場合は、針を新しいものに交換してください。針の完全性は適用されるFSSのレベルに大きな影響を与える可能性があります。 - シリンジポンプを実行し、発泡を減らすために、カットチューブ内のシア付きサンプルをおよそ45°の角度で収集します。実行可能性アッセイの種類や下流アッセイのニーズに応じてサンプルを収集します。
- 注射器ポンプから注射器と針を慎重に取り出し、注射器から針を取り除くためにペンチを使用し、針に触れないように注意してください。
注:ベベレ針以外は、追加の安全対策として、ベベ針と同じ意味で使用できます。
- 注射器ポンプから注射器と針を慎重に取り出し、注射器から針を取り除くためにペンチを使用し、針に触れないように注意してください。
- シリンジにシレの懸濁液を引き戻し、慎重にペンチを使用して針を取り付け直し、シリンジポンプに戻します。
- FSSのパルスの所望の数に細胞懸濁液が露出されるまで、ステップ2.3と2.4を繰り返します。
注:FSS暴露から機械的破壊に抵抗する細胞の容量を評価するために、細胞懸濁液は、通常、FSSの10パルスを受ける。しかし、細胞が2パルス24後にFSSに応答して生物学的適応を開始することが実証されている。
3. 生存率測定
注:生存率は酵素アッセイ(ルシファーゼ、レサズリン、WST-1)、無傷細胞のカウント、フローサイトメトリー、またはクロノジェニックアッセイを使用して評価することができます。
- すべての生存率の測定方法については、FSS に細胞を公開する前にサンプルを収集します。
- 酵素アッセイの場合は、100 μLのアリコートを複製し、96ウェルプレートに入れます。
- フローサイトメトリーの場合は、500 μL アリコートを 1 つ取り、1.5 mL チューブに入れます。
- クロノジェニックアッセイの場合は、100 μL アリコを収集します。
- 酵素アッセイ
- FSSの露出の1、2、4、6、8、および10パルスの後に100 μLのサンプルを収集し、96ウェルプレートに入れます。
- 目的の基板を追加し、使用するアッセイのプロトコルに従ってください。
- レサズリンの場合は、0.15 mg/mL溶液を各ウェルに20 μL加えます。100 μLの培地を含むウェルに0.15 mg/mLレサズリン溶液を20 μL添加します。37°Cの組織培養インキュベーターで2時間インキュベートする。蛍光を読み取ることができるプレートリーダー(579励起/584発光)を用いて吸光度を測定します。
- ルシファーゼ発現細胞の場合は、15 mg/mL D-ルシフェリンを培地5 mLに100 μL添加します。細胞を含む各ウェルに、その溶液の100 μLを加えます。5分間待ってから、発光と互換性のあるリーダーを使用してプレートを読みます。
- WST-1の場合は、ミディアムのみを含むウェルを含め、各ウェルに10 μLのWST-1を追加します。4時間インキュベートし、プレートリーダーを用いて420〜480nmの間の吸光度を読み取る。
- 各 FSS 公開サンプルからの平均信号を、平均された静的制御サンプルと比較して、生存可能なセルの割合を取得します。
- フローサイトメトリー24
- 500 μL サンプルを収集し、FSS の 1、2、5、および 10 パルス後の 1.5 mL 遠心分離管に入れます。
- 遠心分離機サンプル(500×g3分間)を、上清を捨てる。
- ペレットをカルシウムおよびマグネシウムフリーPBSの1 mLで再懸濁し、サンプルを遠心分離します(300×g 3分間)。
- 500 μLの蛍光活性化細胞選別(FACS)バッファー(PBSはウシ血清アルブミン、0.1%は、アジ化ナトリウム)を含むピオジジウムヨウ化プロピジウム(1.75 μg/mL)などの膜不透過性または生活性染料でペレットを停止します。
- 生細胞の比率を、帯別サンプルと静的サンプルの増殖体でカウントビーズに正規化して比較することにより生存率を決定する。
- クロノジェニックアッセイ
- 100 μLの静的サンプルを取り、900 μL の成長培地を加え、1:10 希釈します。
- 1:10希釈サンプルの100 μLを取り、900 μLの成長培地を加え、最終的な1:100希釈を行います。
- 1:100希釈サンプルの100 μLを、2 mLの成長培地を含む6ウェル皿の3つの井戸のそれぞれに加えます。
- FSS の 10 パルスを受けたサンプルで、手順 3.4.1 ~ 3.4.3 を繰り返します。
- 培地を変えずに細胞を7~10日間増殖させ、コロニー形成を確認します。≥50個の細胞のコロニーが形成されたら、成長培地を吸引し、PBSの1mLで各々をよくすすい、PBSを吸引し、1mLの氷冷70%エタノール(EtOH)を用いて5分間固定する。重要なのは、両方のサレと静的サンプルを同時に修正することです。
- 試料を固定した後、EtOHを吸引し、1〜2 mLの水晶紫色溶液(0.1%の水晶バイオレットを90%H2Oで、10%EtOH)5分間加えた。
- 余分な水ですすぎ、プレートを乾燥させる
- 静的およびシアレのサンプルの両方のコロニー(≥50細胞のクラスター)を数えます。サレドサンプルからのコロニーの平均数と静的サンプルからのコロニーの平均数を比較して、生存率を決定します。
結果
FSS誘発性機械的破壊に対する耐性の上昇は、非形質上皮細胞コンパラレータ15,24に対して腫瘍から新たに単離された複数の癌細胞株および癌細胞にわたって保存された表現型であることが以前に示されている。ここでは、様々な組織起源からの追加の癌細胞株(表2)が、これらの細胞の大部分が250μL/sでFSSの10パルス後に20%≥生存率を示すことを実証するために試験した。唯一の例外は、FSS(生存率≤10%)からの機械的破壊に比較的敏感であったMiaPaCa2細胞です。細胞株のFSS耐性プロファイルを適切に記述するために、n≥3生物学的複製が推奨される。
比較すると、検査された非形質上皮細胞の全てが、これらの条件下で10%<生存率を有する15,24である。従って、FSS耐性の範囲が観察される一方で、試験した癌細胞株の大部分は、非形質細胞よりも大きなFSS耐性を示す。癌細胞株は原発性腫瘍組織と転移の両方から誘導され得る。転移の流布の間にこの表現型が選択された可能性があるため、転移に由来する細胞はより大きなFSS耐性を示す可能性があることを示すことができる。しかしながら、FSS耐性レベルは、細胞が原発性腫瘍または転移15、24に由来するかどうかに依存しないことが示された。さらに、FSS耐性のレベルは、一連のヒト前立腺癌細胞株15における転移電位と相関しなかった。
これをさらに試験するために、変化する転移電位を有するBALB/c乳腺上皮細胞(4T1=高転移性、4T07=中程度の転移電位に弱い、67NR=低転移電位25,26)が用いられた。この実験は、FSS耐性が転移電位と相関していないことを明らかにした(図1)。さらに、4T1および4T07細胞の両方が、細胞生存率の二倍化損失を示し、後続のパルスで観察されるよりもパルス1〜2における生存率のより大きな損失を示す。これは、このグループによって調査されるほとんどの癌細胞株の典型的なものである。これに対し、67NRはFSSの関数として細胞生存率のより直線的な損失を示す。全体として、表2と図1のデータは、FSS耐性が変換された細胞の特性であることを示している。
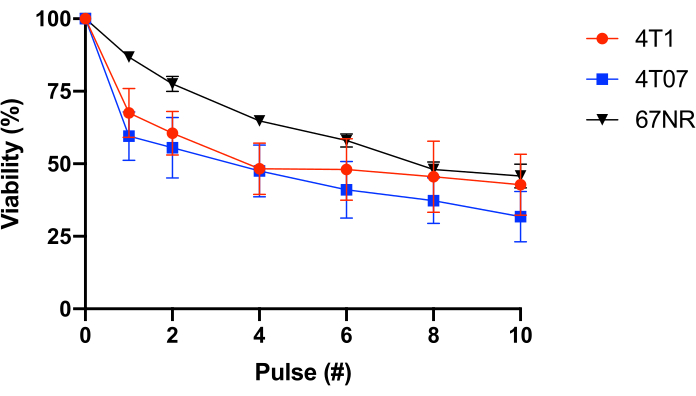
図1:同種BALB/c乳腺上皮癌細胞の流体剪断ストレス耐性 細胞をFSS(30G針、10 pulses@250 mL/s)に曝露し、生存率をレサズリン変換(n=4/細胞株)を用いて測定した。FSS暴露は生存細胞数(p<0.0001、2ウェイANOVA)を減少させ、各細胞株は異なる抵抗プロファイルを示したが(p = 0.0446、2ウェイANOVA)、FSS暴露の10パルス後の細胞株間に有意差はなかった(p = 0.2833、2ウェイANOVA)。略語: FSS = 流体せん断応力;分散分析 この図の大きなバージョンを表示するには、ここをクリックしてください。
| せん断(τ): | 壁(最大) | 最低限 | |||||||||||
| セルの直径: | 該当する | 10 μm | 15 μm | 20 μm | |||||||||
| 針ゲージ: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| 流量(μL/秒) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
表1:最大せん断応力(τ壁)レベル この表は、20、50、100、150、200、250 μL/秒の流速での30G、27G、および25G針のdyn/cm2 の最大壁FSSレベルをリストしています。せん断応力レベルは、 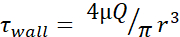 各針ゲージの内径に関する情報(およびμ= 0.01 dyn·s/cm2)を使用して計算した。各サイズの最小FSSレベルは
各針ゲージの内径に関する情報(およびμ= 0.01 dyn·s/cm2)を使用して計算した。各サイズの最小FSSレベルは 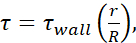 、wherein rがセルの半径、Rが針の半径を用いて計算した。略語: FSS = 流体せん断応力;τ = せん断; τ壁 = 最大せん断;μ = 粘度;Q = 体積流量。
、wherein rがセルの半径、Rが針の半径を用いて計算した。略語: FSS = 流体せん断応力;τ = せん断; τ壁 = 最大せん断;μ = 粘度;Q = 体積流量。
| セルライン | 組織ソース | 種 | 10パルス後の平均生存率(%) |
| トラムPC1 | 前立腺 | 鼠 | 40 |
| 4T01 | 胸 | 鼠 | 32 |
| 4T7 | 胸 | 鼠 | 43 |
| 67NR | 胸 | 鼠 | 46 |
| 66CL4 | 胸 | 鼠 | 28 |
| RT4 | 膀胱 | 人間 | 62 |
| W17-266-4 | 黒色腫 | 人間 | 46 |
| HS852 | 黒色腫 | 人間 | 41 |
| HS695 | 黒色腫 | 人間 | 41 |
| A2058 | 黒色腫 | 人間 | 37 |
| A375 | 黒色腫 | 人間 | 37 |
| RPMI-7951 | 黒色腫 | 人間 | 35 |
| スクメル2 | 黒色腫 | 人間 | 29 |
| A101D | 黒色腫 | 人間 | 28 |
| ミアパカ | 膵臓 | 人間 | 7 |
表2:各種癌細胞株の流体剪断ストレス耐性。 各癌細胞株は、シリンジおよびニードルモデル(30G針、10 pulses@250 mL/s)(n≥3/細胞株)から液性せん断応力にさらされ、生存率はルシファーゼ活性またはレサズリン変換のいずれかによって測定した。
ディスカッション
本論文では、注射器と針を用いた懸濁液中のがん細胞へのFSSの応用について説明する。このモデルを用いて、癌細胞は、非形質上皮細胞15、22、24に対して高レベルFSSの短いパルスに対してより耐性であることが示されている。さらに、このモデルを用いたFSSへの暴露は、細胞剛性の急激な増加、RhoAの活性化、および皮質F-アクチンおよびミオシンIIベースの収縮性24,27の増加をもたらす。急速メカノ適応(状況に応じて多かれ少なかれ硬くなるCTCの能力)は、CTCの機械的破壊を防止し、転移コロニー形成24、28の他の側面を容易にすることができる。実際、このin vitroモデルを用いて行われた知見は、動物モデル24の実験CTCを用いて確認されている。この急速なメカノ適応は、このモデルで一般的に観察される細胞生存率のバイフェージック損失を説明する可能性が高い(図1)、すなわち、FSS-ナイーブ細胞は、FSSの単一のパルスに曝された細胞よりも破壊の影響を受けやすい。まとめると、これはFSSが後のFSSのパルスからそれらを保護する癌細胞の急速な細胞硬化を誘導することを示す。
RhoA-アクトミオシン軸はFSS抵抗15、21、24の重要な原動力であるが、他のメカニズムが29を含む可能性が高い。細胞剛性がFSS耐性の重要な決定要因であるというさらなる証拠は、細胞の最も硬い成分の核の構造的完全性を制御するラミンAの破壊が、このモデル22を用いて癌細胞におけるFSS耐性を低下させることである。このモデルを用いて、がん細胞のFSS耐性のメカニズムをさらに探る。ここで、このモデルは、FSSの高レベルの短いパルスに細胞を曝露することによって機械的破壊に抵抗する様々な癌細胞株の容量を測定するために使用されてきた。これは比較的安価で簡単なモデルですが、最も高価な要素はシリンジポンプですが、再現性のある結果を得るためにはプロトコルに忠実に従うように注意する必要があります。FSSの複数のパルスは、非常に短い時間で、<10分で細胞に適用することができます。実験の合計経過時間は、サスペンションボリューム、流量、脈拍数、およびパルス間でサスペンションを転送するユーザの器用さによって異なります。経験を積み、FSSに露出した5 mLのサスペンションは、30Gの針で10 pulses@250 μL/sで約10分で処理できます。ほとんどの細胞株では、この長い間懸濁液に保持されることによる生存率の損失は最小限である。
FSSへの暴露は比較的迅速に起こるので、FSSは通常、サンプルの発泡を減少させるために無血清培地中の細胞懸濁液に適用される。このアッセイでは、0〜10%のウシ胎児血清の粘度差はごくわずかです。しかし、細胞がシアレ化される培地中のカルシウムの生理学的レベルを確保することが重要です。また、FSS曝露前の細胞解離方法については、非酵素解離剤15によるトリプシン化または治療により調製したPC-3細胞懸濁液においてFSS耐性の差は検出されなかった。細胞濃度は、下流の用途のニーズに応じて5×105セル/mLより大きいまたはより小さくすることができます。PC-3前立腺癌細胞の応答は、5×104から5×105、15の範囲で類似している。しかし、FSS曝露後の生存可能性に対する細胞濃度の影響は経験的に決定されるべきである。
培養細胞を想定したほとんどの用途では、細胞密度は粘度に大きな影響を与えてはならないため、適用されるFSSの量は大きく影響する必要があります。FSS曝露前に細胞が懸濁状態に保持される時間などの変数は、実験反復全体で一定に保たれるべきである。前述のように、針の完全性も重要です。ロットバリエーションは、時間をかけてこのアッセイに関して針で注目されています。皮下注射針は、ここで用いられた流量ではなく、臨床用に設計された。まれに、針のハブは部分的に閉塞することができ、その後のパルスの間に、針を通る懸濁液の通過を妨げ、最終的にはシリンジプランジャーの周りの逆流を引き起こす。さらに、前に示したように、死んだ/死んでいる細胞は、FSSに非常に敏感であることを理解することは非常に重要です。したがって、特定の細胞株が、ルーチン特性または実験的操作(例えば、薬物治療)として、死にかけている細胞のレベルが高い場合、これは、静的制御と比較して完全に正規化されない可能性のある細胞生存率の非常に急な損失をもたらす。
FSSの適用は、免疫蛍光、プルダウンアッセイ、およびウェスタンブロッティングなどの他のアッセイと組み合わせることができ、FSSが癌細胞生物学24に及ぼす影響を研究することができる。原則として、このモデルは、血液細胞を含む他の細胞タイプに対する高レベル、短期間FSSの影響を探求するためにも使用される可能性がある。正常な赤血球および白血球は、生理学的に理にゆうまでも癌細胞よりも、この方法で適用されるFSSに対してはるかに耐性である。実際、適用されるFSSのレベルは、250mL/sの流速で30G 1/2"針を使用して、赤細胞膜の破壊に必要な範囲を括弧(ミリ秒の力の適用に基づく)30、31。このモデルの1つの制限は、または導管を通って流体を通過することを含む、最大壁せん断応力および導管の中心の最小から範囲内で細胞が経験するFSSの正確なレベルが知られていないということです。したがって、各パルスで、すべての細胞は同じレベルのFSSを経験せず、繰り返しパルスを介して、個々の細胞は、指定された範囲内の各パルスで異なるレベルのFSSを経験することが期待されるであろう。
しかし、このモデルで用いられている条件下での流体力学的焦点合わせは、細胞が流れの中心に向けられ、壁から離れ、したがってFSS曝露が低い32に向けられる結果となる。コーンやプレート粘度計、クエットチャンバなどの他のモデルは、細胞懸濁液に一定のレベルでFSSを適用するのに適しています。前述のように、 インビトロでCTのFSS暴露をモデル化することは依然として困難である。このモデルは、心臓を横断する可能性がある FSS への高い、しかし短い露出の影響をテストするのに最適です。動脈および静脈を通る流れは、より低いレベルのFSSへのより長い露出をもたらす。しかし、前述のように、CTCが循環中に連続的な流れにとどまる期間は不明であり、これまでのほとんどの実験的証拠は、微小循環におけるより長い期間の封じ込めによって中断された自由流の短い期間(秒)と一致している。
より長い期間(分から日)のFSS(0.5-60 dyn/cm2)の低レベルに癌細胞を暴露するモデルには、コーンとプレート粘度計、クエットチャンバー、連続フローループ、チューブ延長付きシリンジ、およびマイクロ流体デバイス33、34、36、37が含まれます。また、FSSがCTCにどのような影響を与えるかについての洞察を得るためにも使用されており、FSSへの暴露は酸化ストレス、細胞増殖および浸潤、および幹細胞のような特性を様々な癌細胞株で増加させることを発見しました。これらのモデルから得られた結果を、ここで説明したものと比較することは興味深いでしょう。例えば、連続的なフローループモデルを用いて、Xinら.は、ROCK-アクトミオシン軸が、上記のデータとは対照的に2-12hのFSS(20 dyn/cm2)に曝露された癌細胞株における細胞生存率の喪失を促進することを発見した。したがって、生物学的文脈は、これらのインビトロモデルのすべてにとって重要である可能性が非常に高く、CTCに関する知見をin vivoモデルに変換する必要性を強化し、最終的には癌患者である。
開示事項
MDHは、シンダーバイオ社の共同創設者、社長兼株主であり、シンダーバイオ社のコンサルタントです。
謝辞
ここで実証したモデルの開発は、DOD助成金W81XWH-12-1-0163、NIH助成金R21 CA179981とR21 CA196202、およびサトウ転移研究基金によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
参考文献
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031(2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973(2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), Pt 2 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126(2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399(1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649(2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711(2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073(2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved