Method Article
使用注射器和针头模拟血液学应激对循环肿瘤细胞的影响
摘要
在这里,我们演示了一种方法,将液剪应力应用于悬浮中的癌细胞,以模拟血液动力学应激对循环肿瘤细胞的影响。
摘要
在转移过程中,来自固体组织的癌细胞,包括绰号,获得淋巴和血源循环,在那里他们暴露在机械应激由于血液同源流动。其中一个压力是循环肿瘤细胞(CTCs)的经验是液体剪切应力(FSS)。虽然癌细胞可能由于间歇性流动而在肿瘤内经历低水平的FSS,但CTC在没有细胞外基质附着的情况下暴露在更大的FSS水平上。从生理学上讲,FSS的震级范围超过3-4级,淋巴(<1分/厘米2)中含量较低,当细胞穿过心脏和心脏瓣膜时,最高水平短暂存在(>500dynes/cm2)。有几个 体外 模型设计为在不同的时间范围内模拟不同范围的生理剪切应力。本文描述了一个模型,利用简单的注射器和针头系统来研究高水平FSS的短暂(毫秒)脉冲对癌细胞生物学的影响。
引言
转移,或癌症的扩散超过最初的肿瘤部位,是导致癌症死亡率的主要因素1。在转移过程中,癌细胞利用循环系统作为高速公路传播到全身2、3的遥远部位。在前往这些部位的途中,循环肿瘤细胞(CTCs)存在于动态流体微环境内,不像其原始原发肿瘤3、4、5。有人提出,这种流体微环境是转移4的众多障碍之一。转移效率低下的概念大体一致,即大多数进入循环的CTC要么灭亡,要么不形成生产性转移殖民地6,7,8。然而,为什么从单个反恐委员会的角度来看,转移效率低下,这一点不太确定,而且仍然是一个活跃的调查领域。CTC与细胞外基质分离,剥夺了原发性肿瘤中可能存在的可溶性生长和生存因子,并且以与原发性肿瘤4大不相同的方式暴露在免疫系统和血液动力中。这些因素都可能导致CTC的存活率低,但其相对贡献尚不清楚。本文讨论了血液动力如何影响CTC的问题。
研究血液动力对CTC的影响是相当具有挑战性的。目前,没有工程体外系统可以复制整个空间动力学(心到毛细血管)和人类血管系统的流变特性。此外,CTC如何体验循环系统还不完全清楚。实验证据表明,大多数癌细胞不会像血细胞那样持续循环。相反,由于它们的尺寸相对较大(直径为10-20μm),大多数CTC被卡在毛细血管床(直径为6-8μm)的可变时间长度(s至天),在那里他们可能会死亡,奢侈,或被转移到下一个毛细血管床8,9,10,11。然而,有一些证据表明,CTC的大小可能更异质的体内,较小的CTC是可检测到的12。因此,根据距离和血流速度,CTC只能在这些诱捕期之间自由循环几秒钟,尽管缺乏对这种行为的定量描述。
此外,根据CTC进入循环的位置,它们可能通过肺部和其他外周部位的多个毛细发床,在到达最终目的地之前通过左右心脏。一路上,CTC 暴露于各种血液动力学应力,包括液切变应力 (FSS)、在微循环中诱捕过程中的压缩力,以及在可能表现出类似白细胞的沿着血管壁滚动的情况下的牵引力。因此,对流通进行建模的能力和对要建模的CTC行为的理解都是有限的。由于这种不确定性, 体外 模型系统的任何发现都应在实验脊椎动物体内以及最终在癌症患者中得到验证。
有了上述警告,本文演示了一个相对简单的模型,将FSS应用于悬浮细胞,以探讨FSS对CTC的影响首次描述在2012年15。FSS 是血流摩擦血管壁的结果,在较大血管的层压流条件下产生抛物线速度梯度。细胞在血管壁附近经历更高水平的FSS,在血管中心附近经历较低的FSS水平。流体粘度、流速和流经管道的尺寸会影响 FSS,如哈根-波塞耶方程所述。这适用于血流作为牛顿流体的行为,但不适用于微循环。生理FSS的范围超过几个数量级,淋巴(<1 dyn/cm2)中最低,心脏瓣膜和动脉粥样硬化斑块周围区域最高(>500 dyn/cm2)5。动脉中的平均壁切应力为10-70 dyn/cm2和静脉1-6 dyn/cm2,静脉16,17。
在心脏,细胞可能暴露在阀门传单周围的湍流,其中非常高水平,但非常短的FSS可能会经历18,19。虽然生物处理领域长期以来一直研究FSS对悬浮哺乳动物细胞的影响,但这种信息对于理解FSS对CTC的影响可能价值有限,因为它通常侧重于长期应用的低得多的FSS水平。如下所述,使用注射器和针头,可以将相对较高的(数万至数千丁/厘米2)FSS用于相对较短的(毫秒)的细胞悬架。自最初描述这个模型15以来,其他人已经利用它来研究FSS对癌细胞21,22,23的影响。FSS 的多个"脉冲"可在短时间内应用于细胞悬浮,以促进下游实验分析。例如,该模型可用于测量细胞通过 FSS 抵抗机械破坏的能力,测量细胞的可行性作为应用脉冲数量的函数。或者,可以通过收集细胞进行各种下游分析来探索FSS暴露对癌细胞生物学的影响。重要的是,部分单元格悬架保留为静态控制,以比较 FSS 与可能与单元格分离和悬架中保持的时间相关的影响。
研究方案
1. 细胞制备
- 当 70-90% 汇流时,通过遵循所用细胞系的建议指南从组织培养皿中释放细胞。
- 例如,为 PC-3 细胞吸气生长介质,用 5 mL 的无钙和无镁磷酸盐缓冲盐水 (PBS) 清洗 10 厘米的细胞盘。
- 在使用制造商协议添加 1 mL 的 0.25% 试用素之前,先吸气 PBS。
- 在倒置显微镜下观察细胞分离后,加入含有10%胎儿牛血清的5 mL DMEM:F12介质,以抑制试金石。
- 将细胞悬架放入圆锥管中。
- 确定细胞浓度和总细胞数。
- 通过离心(300×g 3 分钟),吸气超高分子,并在无血清组织培养介质中将细胞重新吸回 5 × 105细胞/mL。
注:至关重要的是,检测介质包含至少1.17 mM Ca+作为细胞外Ca+已被证明需要细胞抵抗FSS15。
2. 流体剪应激暴露
- 在将细胞暴露在 FSS 之前,在 7 mL 线路上切割一个圆底 14 mL 聚苯乙烯管。将电池悬架混合,将悬架的 5 mL 放入切割管中,并收集静态控制样品。
注:静态样本所需的体积取决于使用的可行性测定(参见第 3 步)。 - 将电池悬架拉入 5 mL 注射器中,并连接 30 G 1/2"针头。解开针头,将注射器放在注射器泵上,固定注射器,并设置流速,以达到所需的 FSS 水平。
注: 表1 显示不同针头的最大壁切应力和流速,以及根据细胞大小(10、15 和 20 μm)的 FSS 的最小水平。使用前检查针头,以确保针头不弯曲:如果不确定,用新针头代替针头。针头完整性可对 FSS 应用水平产生重大影响。 - 运行注射器泵,并以大约 45° 的角度在切管中收集剪切样品,以减少发泡。根据可行性检测类型或下游检测需求收集样本。
- 小心地从注射器泵中取出注射器和针头,并用钳子从注射器中取出针头,注意不要触摸针头。
注:非斜针可与斜针互换使用,作为额外的安全措施。
- 小心地从注射器泵中取出注射器和针头,并用钳子从注射器中取出针头,注意不要触摸针头。
- 将剪切的悬架拉回注射器中,用钳子小心地重新连接针头,然后放回注射器泵中。
- 重复步骤 2.3 和 2.4,直到细胞悬浮暴露在 FSS 所需的脉冲数量中。
注:为了评估细胞抵抗FSS暴露的机械破坏的能力,细胞悬浮通常受FSS的10个脉冲的影响。然而,已经证明,细胞开始进行生物适应,以响应FSS后,2脉冲24。
3. 可行性测量
注:可使用酶检测(葡萄糖、雷萨祖林和WST-1)评估可行性,计算完整的细胞、流动细胞学或克隆性测定。
- 对于所有生存能力指标,在将细胞暴露在 FSS 之前收集样本。
- 对于酶检测,请重复 100 μL 的 aliquot,并将其放入 96 井板中。
- 对于流细胞学,取一个 500 μL 的阿利奎特,并将其放入 1.5 mL 管中。
- 对于克隆性测定,收集 100 μL 的阿利库特。
- 酶检测
- 在 1、2、4、6、8 和 10 个 FSS 暴露脉冲后收集 100 个 μL 样本,并将其放置在 96 井板中。
- 添加所需的基板,并遵循使用检测的协议:
- 对于雷萨祖林,在每口井中加入 20 微升 0.15 毫克/mL 溶液。将 20 μL 的 0.15 毫克/mL 雷萨祖林溶液添加到仅含有 100 μL 介质的油井中。在 37 °C 组织培养孵化器中孵育 2 小时。使用能够读取荧光(579 激发/584 发射)的板读器测量吸气度。
- 对于荧光酶表达细胞,在 5 mL 介质中加入 100 微升 15 毫克/mL D-luciferin。将 100 μL 的溶液添加到每个含有该溶液的井中。等待 5 分钟,然后使用与发光兼容的读卡器读取板。
- 对于 WST-1,在每个油井中加入 10 μL 的 WST-1,包括仅含介质的井。孵育4小时,然后使用板读器读取420至480纳米之间的吸血。
- 将每个 FSS 暴露样本的平均信号与平均静态控制样本进行比较,以获得可行细胞的百分比。
- 流细胞学24
- 收集 500 个 μL 样品,并在 1、2、5 和 10 个 FSS 脉冲后将其放入 1.5 mL 离心机管中。
- 离心机样品(500× 克 3分钟),并丢弃超强。
- 用1兆L的无钙和无镁PBS重新消耗颗粒,并离心取样(3分钟300× 克 )。
- 暂停颗粒与500微升荧光激活细胞排序(FACS)缓冲(PBS与0.5%牛血清白蛋白和0.1%钠阿齐德)与计数珠和膜防渗或可行性染料,如碘化物(1.75微克/兆升)。
- 通过比较可正常化的可行细胞与计数珠子的比例,确定切片样品与静态样本的存活率。
- 克隆性测定
- 取 100 μL 的静态样品,并添加 900 μL 的生长介质,进行 1:10 稀释。
- 取 1:10 稀释样品的 100 μL,并添加 900 μL 的生长介质,进行最终的 1:100 稀释。
- 将 1:100 稀释样品中的 100 μL 加入包含 2 mL 生长介质的 6 井盘的 3 口井中的每口。
- 重复步骤 3.4.1-3.4.3 与样本已经受到 10 脉冲的 FSS.
- 让细胞生长7-10天而不改变介质,并检查菌落的形成。一旦形成≥50个细胞的菌落,吸气生长介质,用1mL的PBS冲洗每口井,吸气PBS,并使用1mL的冰冷70%乙醇(EtOH)固定5分钟。重要的是,同时修复剪切和静态样品
- 修复样品后,吸气 EtOH,并加入 1 至 2 mL 的水晶紫罗兰溶液(90% H2O 中的 0.1% 晶体紫罗兰,10% EtOH)5 分钟。
- 用多余的水冲洗,让盘子干涸
- 计算静态和剪切样本的菌落(≥50个细胞簇)。比较切切样本中的平均菌落数量与静态样本中菌落平均数量的比例,以确定生存能力。
结果
先前已证明,对FSS诱发的机械破坏的耐药性升高是多种癌细胞系的保存表型,而与未转化的上皮细胞比较器15、24相比,从肿瘤中新分离出来的癌细胞是一种保存的表型。在这里,从各种组织起源(表2)的其他癌细胞系测试,以证明这些细胞的大多数显示生存能力≥20%后,10脉冲的FSS在250μL/s。一个例外是MiaPaCa2细胞,它对FSS的机械破坏相对敏感(生存能力≤10%)。为了充分描述细胞系的 FSS 电阻配置文件,建议进行 n ≥ 3 个生物复制。
相比之下,所有被检查的非转化上皮细胞在15、24条件下的生存能力<10%。因此,虽然观察到的FSS耐药性范围很大,但大多数测试的癌细胞系比非转化细胞表现出更大的FSS耐药性。癌细胞系可以从原发性肿瘤组织和转移中提取。可以假设,从转移中提取的细胞可能表现出更大的FSS抵抗力,因为这种表型可能是在转移传播过程中选择的。然而,FSS的抵抗水平显示,不取决于细胞是来自原发性肿瘤还是转移15,24。此外,FSS抵抗水平与一系列人类前列腺癌细胞系15中的转移潜力无关。
为了进一步测试这一点,使用了具有不同转移电位(4T1 = 高度转移,4T07 = 弱到中度转移电位,67NR = 否到低转移电位25,26)的 BALB/c 乳腺上皮细胞。该实验表明,FSS电阻与转移电位无关(图1)。此外,4T1 和 4T07 细胞都表现出细胞生存能力的双相损失 - 与后续脉冲中观察到的相比,脉冲 1-2 的生存能力损失更大。这是这个小组调查的大多数癌细胞系的典型。相比之下,67NR作为FSS的功能,表现出更线性的细胞生存能力损失。表2和图1的数据共同表明,FSS电阻是转化细胞的特性。
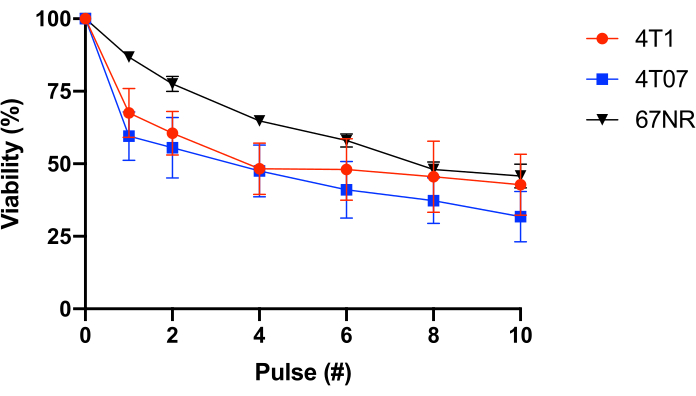
图1:合成BALB/c乳腺上皮癌细胞的流体剪切应力抵抗力。 细胞暴露在FSS(30G针,10 pulses@250 mL/s),并且使用再沙祖林转换(n = 4/细胞线)测量生存能力。虽然 FSS 暴露减少了可行细胞的数量(p < 0.0001,双向 ANOVA),并且每个细胞线都显示不同的电阻配置文件(p = 0.0446,双向 ANOVA),但经过 10 次 FSS 暴露脉冲(p = 0.2833、双向 ANOVA)后,细胞系之间没有显著差异。缩写:FSS = 流体剪应力;ANOVA = 差异分析。 请单击此处查看此图的较大版本。
| 剪切 (+): | 墙(最大) | 最低 | |||||||||||
| 细胞直径: | 不适用 | 10μm | 15 μm | 20 μm | |||||||||
| 针表: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| 流量 (μL/s) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
表1:最大剪切应力(+壁)水平。 该表列出了30 G、27 G 和 25 G 针的最大壁 FSS 水平,流量为 20、50、100、150、200 和 250 μL/s。剪应力水平计算使用Poiseuille方程 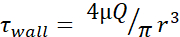 (),每个针头测量仪的内径的可用信息,以及假设,μ = 0.01 Dyn=s/cm2。每个尺寸的最小 FSS 水平是使用
(),每个针头测量仪的内径的可用信息,以及假设,μ = 0.01 Dyn=s/cm2。每个尺寸的最小 FSS 水平是使用 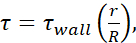 r 是细胞的半径计算的,R 是针的半径。缩写: FSS = 流体剪切应力;•剪切; •墙壁 = 最大剪切;μ = 粘度;Q = 体积流速。
r 是细胞的半径计算的,R 是针的半径。缩写: FSS = 流体剪切应力;•剪切; •墙壁 = 最大剪切;μ = 粘度;Q = 体积流速。
| 单元格线 | 组织源 | 物种 | 10 脉冲后的平均生存能力 (%) |
| 电车1 | 前列腺 | 鼠 | 40 |
| 4T01 | 胸 | 鼠 | 32 |
| 4T7 | 胸 | 鼠 | 43 |
| 67NR | 胸 | 鼠 | 46 |
| 66CL4 | 胸 | 鼠 | 28 |
| RT4 | 膀胱 | 人 | 62 |
| W17-266-4 | 黑色素瘤 | 人 | 46 |
| HS852 | 黑色素瘤 | 人 | 41 |
| HS695 | 黑色素瘤 | 人 | 41 |
| A2058 | 黑色素瘤 | 人 | 37 |
| A375 | 黑色素瘤 | 人 | 37 |
| RPMI-7951 | 黑色素瘤 | 人 | 35 |
| 斯克梅尔 2 | 黑色素瘤 | 人 | 29 |
| A101D | 黑色素瘤 | 人 | 28 |
| 米亚帕卡 | 胰腺 | 人 | 7 |
表2:各种癌细胞系的流体剪切应力耐药性。 每个癌细胞系都暴露在注射器和针头模型(30 G针,10 pulses@250 mL/s)(n ≥3/细胞线)的液切变应力下,生存能力通过葡萄糖活性或再酶素转换来测量。
讨论
本文演示了FSS在悬架中使用注射器和针头对癌细胞的应用。使用这个模型,癌细胞已经证明对高水平FSS的短暂脉冲比非转化上皮细胞15,22,24更耐药。此外,使用此模型接触FSS可导致细胞僵硬度迅速增加,RhoA激活,皮质F-actin和肌素II基收缩性增加24,27。快速机械适应(CTC的能力,变得或多或少僵硬取决于情况)可以防止机械破坏的CTC,并促进转移殖民化的其他方面24,28。事实上,使用这种体外模型的发现已经证实使用实验性CTC在动物模型24。这种快速的机械适应可能解释了在这个模型(图1)中通常观察到的细胞生存能力的双相丧失,即FSS-天真细胞比暴露于FSS单个脉冲的细胞更容易受到破坏。综合起来,这表明FSS诱导癌细胞快速僵硬,保护他们免受FSS随后的脉冲。
虽然RhoA-actomyosin轴线是FSS抵抗15,21,24的重要驱动因素,但可能还有其他机制涉及29。进一步证据表明,细胞僵硬是FSS抵抗的关键决定因素,即层压A的破坏,控制细胞最硬的成分-细胞的结构完整性,减少FSS抵抗癌细胞使用这个模型22。我们正利用这个模型进一步探索癌细胞中FSS抵抗机制。在这里,该模型已经用于测量各种癌细胞系的能力,以抵抗机械破坏,使细胞暴露在高水平FSS的短暂脉冲。虽然这是一个相对便宜,简单的模型,在实验室开发,最昂贵的元素是注射器泵,必须小心遵循协议忠实地获得可重复的结果。FSS 的多个脉冲可以在很短的时间内应用于细胞,<10 分钟。实验的总时间取决于悬浮量、流速、脉冲数以及用户在脉冲之间传输悬浮的灵巧性。根据经验,5 mL 悬架暴露在 FSS 中,30 G 针头为 10 pulses@250 μL/s 可在 +10 分钟内处理。对于大多数单元格线,由于在此时间段内暂停,生存能力损失最小。
由于接触 FSS 的速度相对较快,FSS 通常应用于无血清介质中的细胞悬浮,以减少样品的发泡。在本次检测中,0-10%胎儿牛血清粘度差异可以忽略不小。然而,在细胞被切切的介质中,确保钙的生理水平至关重要。此外,关于FSS暴露前的细胞分离方法,通过尝试或使用非酶分离剂15制备的PC-3细胞悬架中未发现FSS耐药性差异。根据下游应用需求,细胞浓度可以大于或小于 5 ×10 5细胞/mL。PC-3前列腺癌细胞的反应相似,范围从5×104到5×105,15。然而,细胞浓度对FSS暴露后生存能力的影响应由经验确定。
对于大多数与培养细胞一起设想的应用,细胞密度不应显著影响粘度,因此,FSS 的应用量。变量,例如细胞在FSS暴露前处于悬浮状态的时间,应在整个实验复制中保持恒定。如上所述,针头的完整性也至关重要。随着时间的推移,针头中注意到了与此检测有关很多差异。皮下针头是专为临床用途设计的,而不是为这里采用的流速设计的。在极少数情况下,针头的发泡可以部分遮挡,在随后的脉搏中,会渗出悬架穿过针头,并最终在注射器柱塞周围回流。此外,重要的是要了解,死亡/死亡细胞对FSS特别敏感,如前24例所示。因此,如果特定细胞系具有高水平的死亡细胞,无论是作为常规特征还是实验性操作(例如药物治疗),这将导致细胞生存能力的急剧丧失,与静态控制相比,这些细胞的生存能力可能无法完全正常化。
FSS的应用可以与其他检测,如免疫荧光,拉下测定,和西方印迹配对,以研究FSS对癌细胞生物学的影响24。原则上,该模型还可用于探索高水平、短周期 FSS 对包括血细胞在内的其他细胞类型的影响。正常的红血球和白细胞比癌症细胞对以这种方式应用的FSS的抵抗力要强得多,这在生理上是合理的。事实上,FSS水平应用,使用30G 1/2"针在250 mL/s的流动速度,括号所需的范围中断的红细胞膜(基于毫秒的强制应用)30,31。此模型的一个限制,或任何涉及通过管道的流体,是细胞在最大壁切变应力和管道中心的最低范围内体验的 FSS 的精确水平尚不清楚。因此,在每个脉冲中,所有细胞都不经历相同水平的 FSS,在重复脉冲中,单个细胞在指定范围内的每个脉冲中都会经历不同级别的 FSS。
然而,在这个模型中采用的条件体动力学聚焦导致细胞被引导到流的中心,远离墙壁,从而向较低的 FSS 暴露32 。其他型号,如圆锥体和板粘度计或库埃特室,更适合在恒定水平上将 FSS 应用到细胞悬架上。如上所述, 在体外模拟CTC的FSS暴露仍然是具有挑战性的。这个模型最适合测试高,但短暂的,暴露在FSS的影响,可能发生在心脏。流经动脉和静脉会导致长时间暴露在较低水平的 FSS 中。然而,如前所述,CTC在循环中持续流动的时间尚不清楚,迄今为止,大多数实验证据都与微循环中长时间诱捕的短周期(秒)自由流动一致。
在较长时间内(分钟到天)将悬浮中的癌细胞暴露在较低水平的FSS(0.5-60 Dyn/cm2)的模型包括圆锥体和板粘度计、库埃特腔、连续流回路、带管子延伸的注射器和微流体装置33、34、35、36、37。这些也被用来深入了解FSS如何影响CTC,并导致发现暴露在FSS增加氧化应激,细胞增殖和入侵,以及干细胞样特征在各种癌细胞系。将来自这些模型的结果与此处描述的结果进行比较会很有趣。例如,使用连续循环模型,鑫等人发现,ROCK-actomyosin轴在2-12小时暴露在FSS(20 dyn/cm2)的癌细胞系中促进细胞生存能力的丧失,这与上述38的数据形成鲜明对比。因此,生物背景很可能对所有这些体外模型都很重要,这进一步增加了将有关CTC的发现转化为体内模型,并最终转化为癌症患者的必要性。
披露声明
MDH 是 SynderBio 公司的联合创始人、总裁和股东,DLM 是 SynderBio 公司的顾问。
致谢
这里展示的模型的发展得到了DOD赠款W81XWH-12-1-0163、NIH赠款R21 CA179981和R21CA196202以及佐藤转移研究基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
参考文献
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031(2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973(2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), Pt 2 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126(2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399(1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649(2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711(2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073(2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。