Method Article
Modelando os efeitos do estresse hemodinâmico em células tumorais circulantes usando uma seringa e agulha
Neste Artigo
Resumo
Aqui demonstramos um método para aplicar o estresse da tesoura de fluido às células cancerosas em suspensão para modelar os efeitos do estresse hemodinâmico nas células tumorais circulantes.
Resumo
Durante a metástase, as células cancerígenas de tecidos sólidos, incluindo a epitélia, ganham acesso à circulação linfática e hemógena, onde são expostas ao estresse mecânico devido ao fluxo hemodinâmico. Uma delas salienta que a experiência das células tumorais circulantes (CTCs) é o estresse da tesoura de fluidos (FSS). Embora as células cancerígenas possam experimentar baixos níveis de FSS dentro do tumor devido ao fluxo intersticial, os CTCs são expostos, sem apego à matriz extracelular, a níveis muito maiores de FSS. Fisiologicamente, o FSS varia mais de 3-4 ordens de magnitude, com baixos níveis presentes em linfáticos (<1 dyne/cm2) e os níveis mais altos presentes brevemente à medida que as células passam pelo coração e ao redor das válvulas cardíacas (>500 dynes/cm2). Existem alguns modelos in vitro projetados para modelar diferentes faixas de estresse fisiológico de tesoura ao longo de vários períodos de tempo. Este artigo descreve um modelo para investigar as consequências de pulsos breves (milissegundos) de FSS de alto nível na biologia celular do câncer usando um simples sistema de seringa e agulha.
Introdução
A metástase, ou a disseminação do câncer para além do local inicial do tumor, é um fator importante na mortalidade por câncer1. Durante a metástase, as células cancerígenas utilizam o sistema circulatório como uma rodovia para disseminar para locais distantes em todo o corpo2,3. Enquanto estão a caminho desses locais, as células tumorais circulantes (CTCs) existem dentro de um microambiente dinâmico de fluidos diferente do tumor primário original3,4,5. Foi proposto que esse microambiente fluido é uma das muitas barreiras à metástase4. Há ampla concordância no conceito de ineficiência metastática, ou seja, que a maioria dos CTCs que entram na circulação perecem ou não formem colônias metastáticas produtivas6,7,8. No entanto, por que a metástase é ineficiente na perspectiva de um CTC individual é menos certa e continua sendo uma área ativa de investigação. Os CTCs são separados da matriz extracelular, privados de fatores solúveis de crescimento e sobrevivência que podem estar presentes no tumor primário, e expostos ao sistema imunológico e às forças hemodinâmicas de uma maneira muito diferente do tumor primário4. Cada um desses fatores pode contribuir para a má sobrevivência dos CTCs, mas suas contribuições relativas não são claras. Este artigo aborda a questão de como as forças hemodinâmicas afetam os CTCs.
Estudar os efeitos das forças hemodinâmicas nos CTCs é bastante desafiador. Atualmente, não existem sistemas in vitro projetados que possam replicar toda a dinâmica espostetemporal (coração para capilares) e propriedades reológicas do sistema vascular humano. Além disso, a forma como os CTCs experimentam o sistema circulatório não é totalmente clara. Evidências experimentais indicam que a maioria das células cancerígenas não circulam continuamente como células sanguíneas. Em vez disso, devido ao seu tamanho relativamente grande (10-20 μm de diâmetro), a maioria dos CTCs ficam presos em leitos capilares (6-8 μm de diâmetro) para períodos variáveis de tempo (s a dias) onde podem morrer, extravasar ou serem deslocados para o próximo leito capilar8,9,10,11. No entanto, há algumas evidências de que o tamanho do CTC pode ser mais heterogêneo in vivo, e que ctcs menores são detectáveis12. Portanto, com base na distância e na velocidade do fluxo sanguíneo, os CTCs só podem circular livremente por uma questão de segundos entre esses períodos de armadilha, embora falta uma descrição quantitativa desse comportamento13.
Além disso, dependendo de onde os CTCs entram na circulação, eles podem passar por vários leitos capilares no pulmão e outros locais periféricos e através do coração direito e esquerdo antes de chegar ao seu destino final. Ao longo do caminho, os CTCs são expostos a vários estresses hemodinâmicos, incluindo o estresse da cisalhamento de fluidos (FSS), forças compressivas durante sua armadilha na microcirculação e, potencialmente, forças de tração sob circunstâncias onde podem exibir rolamento semelhante a leucócitos ao longo das paredes dos vasos sanguíneos14. Assim, tanto a capacidade de modelar a circulação quanto a compreensão do comportamento do CTC a ser modelado é limitada. Por causa dessa incerteza, quaisquer achados de sistemas de modelos in vitro devem ser validados em um organismo experimental de vertebrados e, finalmente, em pacientes com câncer.
Com as ressalvas acima mencionadas, este artigo demonstra um modelo relativamente simples de aplicar FSS às células em suspensão para sondar os efeitos do FSS nos CTCs descritos pela primeira vez em 201215. FSS resulta do atrito do fluxo sanguíneo contra a parede do vaso, que produz um gradiente de velocidade parabólica sob condições de fluxo laminar em vasos maiores. As células experimentam níveis mais altos de FSS perto de paredes de vasos e níveis mais baixos perto do centro do vaso sanguíneo. Viscosidade fluida, taxa de fluxo e dimensões do conduíte através do qual o fluxo ocorre influenciam FSS, como descrito pela equação de Hagen-Poiseuille. Isso se aplica aos fluxos sanguíneos comportando-se como fluidos newtonianos, mas não se sustenta para a microcirculação. O FSS fisiológico abrange várias ordens de magnitude com os níveis mais baixos nos linfáticos (<1 dyn/cm2) e o mais alto em regiões ao redor de válvulas cardíacas e placas ateroscleróticas (>500 dyn/cm2)5. O estresse médio da tesoura de parede nas artérias é de 10-70 dyn/cm2 e 1-6 dyn/cm2 nas veias16,17.
No coração, as células podem ser expostas a fluxos turbulentos ao redor de folhetos de válvulas onde fss de alto nível, mas de curta duração pode ser experimentado18,19. Embora o campo de bioprocessamento tenha estudado há muito tempo os efeitos da FSS sobre células mamíferas em suspensão, essas informações podem ser de valor limitado para entender os efeitos do FSS nos CTCs, pois geralmente se concentra em níveis muito mais baixos de FSS aplicados ao longo de uma longa duraçãode 20. Como descrito abaixo, usando uma seringa e agulha, pode-se aplicar relativamente alto (dezenas a milhares de dyn/cm2) FSS para uma duração relativamente curta (milissegundos) a uma suspensão celular. Desde a descrição inicial deste modelo15,outros o utilizaram para estudar os efeitos da FSS nas células cancerosas21,22,23. Vários "pulsos" de FSS podem ser aplicados em suspensões celulares em um curto período de tempo para facilitar análises experimentais a jusante. Por exemplo, este modelo pode ser usado para medir a capacidade das células de resistir à destruição mecânica por FSS medindo a viabilidade celular em função do número de pulsos aplicados. Alternativamente, os efeitos da exposição da FSS na biologia das células cancerosas podem ser explorados coletando células para uma variedade de análises a jusante. É importante ressaltar que parte da suspensão celular é reservada como um controle estático para comparar os efeitos do FSS daqueles que podem estar associados ao descolamento celular e tempo mantido em suspensão.
Protocolo
1. Preparação celular
- Libere células do prato de cultura tecidual quando 70-90% confluentes seguindo as diretrizes recomendadas para a linha celular em uso.
- Por exemplo, aspire o meio de crescimento para células PC-3, e lave o prato de 10 cm de células com 5 mL de soro fisco sem fosfato e 5 mL de salina tamponada sem cálcio e magnésio (PBS).
- Aspire o PBS antes de adicionar 1 mL de trippsina de 0,25% usando o protocolo do fabricante.
- Após observar o descolamento das células sob um microscópio invertido, adicione 5 mL de DMEM:F12 médio contendo 10% de soro bovino fetal para inibir a trippsina.
- Coloque a suspensão da célula em um tubo cônico.
- Determine a concentração celular e o número total da célula.
- As células de pelotas por centrifugação (300 × g por 3 min), aspiram o supernasce, e resuspendam células em cultura tecidual livre de soro para 5 × 105 células/mL.
NOTA: É fundamental que o meio de ensaio contenha pelo menos 1,17 mM Ca++ como ca++ extracelular foi demonstrado ser necessário para resistência celular ao FSS15.
2. Exposição de estresse de calha de fluidos
- Antes de expor células ao FSS, corte um tubo de poliestireno de 14 mL na linha de 7 mL. Misture a suspensão celular, coloque 5 mL da suspensão no tubo de corte e colete amostras de controle estático.
NOTA: O volume necessário para coletar para a amostra estática depende do ensaio de viabilidade utilizado (ver etapa 3). - Desenhe a suspensão da célula em uma seringa de 5 mL e conecte uma agulha de 30 G 1/2". Despreste a agulha, coloque a seringa sobre uma bomba de seringa, proteja a seringa e defina a taxa de fluxo para atingir o nível desejado de FSS.
NOTA: A Tabela 1 mostra o estresse máximo da cisalhamento da parede para diferentes agulhas e taxas de fluxo, bem como o nível mínimo de FSS dependendo do tamanho da célula (10, 15 e 20 μm). Inspecione a agulha antes de ser usada para garantir que ela não esteja dobrada; se incerto, substitua a agulha por uma nova. A integridade da agulha pode ter um impacto significativo no nível de FSS aplicado. - Execute a bomba de seringa e colete a amostra de corte no tubo de corte em um ângulo aproximado de 45° para reduzir a espuma. Colete uma amostra dependendo do tipo de ensaio de viabilidade ou das necessidades de ensaio a jusante.
- Remova cuidadosamente a seringa e a agulha da bomba de seringa e use um alicate para remover a agulha da seringa, tomando o cuidado de não tocar na agulha.
NOTA: Agulhas não chanfradas podem ser usadas intercambiavelmente com agulhas chanfradas como medida de segurança adicional.
- Remova cuidadosamente a seringa e a agulha da bomba de seringa e use um alicate para remover a agulha da seringa, tomando o cuidado de não tocar na agulha.
- Desenhe a suspensão de corte de volta para a seringa, recoloque cuidadosamente a agulha usando alicate e coloque-a de volta na bomba de seringa.
- Repita as etapas 2.3 e 2.4 até que a suspensão da célula tenha sido exposta ao número desejado de pulsos de FSS.
NOTA: Para avaliar a capacidade das células de resistir à destruição mecânica da exposição ao FSS, a suspensão celular é tipicamente submetida a 10 pulsos de FSS. No entanto, foi demonstrado que as células começam a se submeter a adaptações biológicas em resposta ao FSS após 2 pulsos24.
3. Medição de viabilidade
NOTA: A viabilidade pode ser avaliada utilizando ensaios enzimáticos (luciferase, resazurina e WST-1), contando células intactas, citometria de fluxo ou por ensaios clonogênicos.
- Para todas as medidas de viabilidade, colete uma amostra antes de expor células à FSS.
- Para ensaios enzimáticos, pegue alíquotas duplicadas de 100 μL e coloque-as em uma placa de 96 poços.
- Para citometria de fluxo, pegue uma alíquota de 500 μL e coloque-a em um tubo de 1,5 mL.
- Para ensaio clonogênico, colete uma alíquota de 100 μL.
- Ensaio enzimático
- Colete 100 amostras de μL após 1, 2, 4, 6, 8 e 10 pulsos de exposição fss e coloque-as em uma placa de 96 poços.
- Adicione o substrato desejado e siga o protocolo para o ensaio utilizado:
- Para resazurina, adicione 20 μL de uma solução de 0,15 mg/mL para cada poço. Adicione 20 μL de solução de resazurina de 0,15 mg/mL a poços que contenham 100 μL de meio sozinho. Incubar por 2 h em uma incubadora de cultura de tecido de 37 °C. Meça a absorvância utilizando um leitor de placas capaz de ler fluorescência (579 excitação/ 584 emissão).
- Para células que expressam luciferase, adicione 100 μL de 15 mg/mL D-luciferin a 5 mL de médio. Adicione 100 μL dessa solução a cada poço que contenha células. Aguarde 5 minutos e leia a placa usando um leitor compatível com luminescência.
- Para WST-1, adicione 10 μL de WST-1 a cada poço, incluindo poços contendo apenas meio. Incubar por 4h e, em seguida, ler a absorvância entre 420 e 480 nm usando um leitor de placas.
- Compare o sinal médio de cada uma das amostras expostas ao FSS com a amostra média de controle estático para obter a porcentagem de células viáveis.
- Citometria de fluxo24
- Colete 500 amostras de μL e coloque-as em tubos de centrífugas de 1,5 mL após 1, 2, 5 e 10 pulsos de FSS.
- Amostras centrífugas (500 × g por 3 min) e descartam os sobrenantes.
- Resuspengue as pelotas com 1 mL de PBS livre de cálcio e magnésio e centrífugue as amostras (300 × g por 3 min).
- Suspenda as pelotas com 500 μL de tampão de triagem celular ativado por fluorescência (FACS) (PBS com albumina de soro bovino de 0,5% e 0,1% de azida de sódio) com a contagem de contas e corantes de membrana impermeáveis ou viáveis, como iodeto de propidium (1,75 μg/mL).
- Determinar a viabilidade comparando a razão de células viáveis, normalizadas à contagem de contas, em amostras desarmadas com a da amostra estática.
- Ensaio clonogênico
- Pegue 100 μL da amostra estática e adicione 900 μL de meio de crescimento para fazer uma diluição de 1:10.
- Pegue 100 μL da amostra diluída de 1:10 e adicione 900 μL de meio de crescimento para fazer uma diluição final de 1:100.
- Adicione 100 μL da amostra de diluição de 1:100 em cada um dos 3 poços de um prato de 6 poços contendo 2 mL de meio de crescimento.
- Repetição de passos 3.4.1-3.4.3 com amostras que foram submetidas a 10 pulsos de FSS.
- Deixe as células crescerem por 7-10 dias sem alterar o meio, e verifique se há formação de colônia. Uma vez formadas colônias de ≥50 células, aspirem o meio de crescimento, enxáguem cada poço com 1 mL de PBS, aspirem o PBS e fixem por 5 min usando 1 mL de etanol gelado de 70% (EtOH). Importante, fixar amostras de tesoura e estática ao mesmo tempo
- Depois de fixar as amostras, aspire o EtOH e adicione 1 a 2 mL de solução violeta cristalina (0,1% violeta cristalina em 90% H2O, 10% EtOH) por 5 min.
- Enxágüe com um excesso de água, e deixe a placa secar
- Conte as colônias (aglomerados de ≥50 células) para as amostras estáticas e desarquivadas. Compare a razão do número médio de colônias da amostra de tesoura com o número médio de colônias da amostra estática para determinar a viabilidade.
Resultados
A resistência elevada à destruição mecânica induzida pelo FSS tem sido anteriormente demonstrada como um fenótipo conservado em múltiplas linhas de células cancerosas e células cancerígenas recém-isoladas de tumores relativos aos comparadores de células epiteliais não transformadas15,24. Aqui, linhas adicionais de células cancerígenas de uma variedade de origens teciduais (Tabela 2) foram testadas para demonstrar que a maioria dessas células apresentam viabilidade ≥ 20% após 10 pulsos de FSS a 250 μL/s. A única exceção são as células MiaPaCa2, que eram relativamente sensíveis à destruição mecânica da FSS (viabilidade ≤ 10%). Para descrever adequadamente o perfil de resistência FSS de uma linha celular, n ≥ 3 réplicas biológicas são recomendadas.
A caminho da comparação, todas as células epiteliais não transformadas examinadas possuem viabilidade < 10% nessas condições15,24. Assim, embora exista uma faixa de resistência fss observada, a maioria das linhas de células cancerosas testadas apresentam maior resistência fss do que células não transformadas. As linhas celulares cancerígenas podem ser derivadas tanto de tecidos tumorais primários quanto de metástases. Pode-se postular que as células derivadas de metástases podem apresentar maior resistência ao FSS, pois este fenótipo pode ter sido selecionado durante a disseminação metastática. No entanto, o nível de resistência do FSS mostrou-se não depender se as células eram derivadas de tumores primários ou metástases15,24. Além disso, os níveis de resistência ao FSS não se correlacionam com o potencial metastático em uma série de linhas de células cancerígenas da próstata humana15.
Para testar isso ainda mais, foram utilizadas células epiteliais mamárias BALB/c com potencial metastático variado (4T1 = altamente metastático, 4T07 = potencial metastático fraco a moderado, 67NR = não ao baixo potencial metastático25,26). Este experimento revelou que a resistência fss não está correlacionada com o potencial metastático(Figura 1). Além disso, ambas as células 4T1 e 4T07 apresentam uma perda bifásica de viabilidade celular - uma maior perda de viabilidade nos pulsos 1-2 do que o observado em pulsos subsequentes. Isso é típico da maioria das linhas de células cancerígenas investigadas por esse grupo. Em contraste, o 67NR apresenta uma perda mais linear de viabilidade celular em função do FSS. Coletivamente, os dados da Tabela 2 e da Figura 1 demonstram que a resistência fss é uma propriedade de células transformadas.
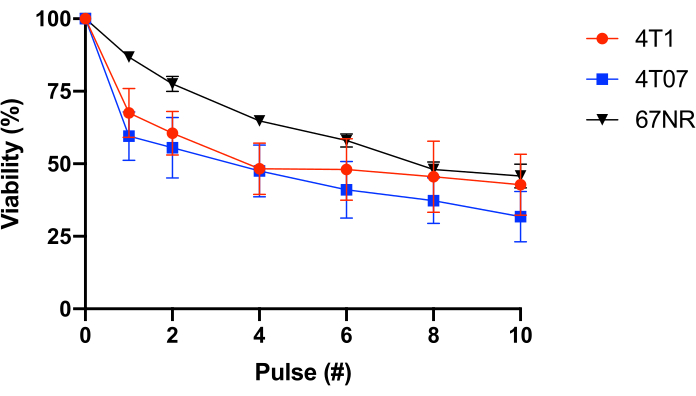
Figura 1: Resistência ao estresse da tesoura fluida das células cancerígenas epiteliais sinagênicas BALB/c. As células foram expostas à FSS (agulha de 30 G, 10 pulses@250 mL/s), e a viabilidade foi medida por meio da conversão de resazurina (n = 4/linha celular). Enquanto a exposição ao FSS reduziu o número de células viáveis (p < 0,0001, ANOVA de 2 vias), e cada linha celular exibiu diferentes perfis de resistência (p = 0,0446, ANOVA de 2 vias), não houve diferença significativa entre as linhas celulares após 10 pulsos de exposição FSS (p = 0,2833, ANOVA 2-way). Abreviaturas: FSS = estresse da tesoura de fluido; ANOVA = análise de variância. Clique aqui para ver uma versão maior desta figura.
| Shear (τ): | parede (máximo) | mínimo | |||||||||||
| Diâmetro da célula: | N/A | 10 μm | 15 μm | 20 μm | |||||||||
| Medidor de agulhas: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| Taxa de fluxo (μL/s) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
Tabela 1: Tensão máxima de tesoura (parede τ) níveis. A tabela lista os níveis máximos de FSS de parede em dyn/cm2 para agulhas de 30 G, 27 G e 25 G nas taxas de fluxo de 20, 50, 100, 150, 200 e 250 μL/s. Os níveis de estresse de corte foram calculados utilizando-se a equação de Poiseuille ( 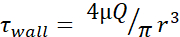 ), informações disponíveis para o diâmetro interno de cada medidor de agulha, bem como a suposição de que μ = 0,01 dyn·s/cm2. Os níveis mínimos de FSS para cada tamanho foram calculados
), informações disponíveis para o diâmetro interno de cada medidor de agulha, bem como a suposição de que μ = 0,01 dyn·s/cm2. Os níveis mínimos de FSS para cada tamanho foram calculados 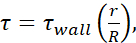 utilizando-se o raio da célula, e R é o raio da agulha. Abreviação: FSS = estresse da tesoura de fluido; τ = tesoura; τparede = tesoura máxima; μ = viscosidade; Q = taxa de fluxo volumoso.
utilizando-se o raio da célula, e R é o raio da agulha. Abreviação: FSS = estresse da tesoura de fluido; τ = tesoura; τparede = tesoura máxima; μ = viscosidade; Q = taxa de fluxo volumoso.
| Linha celular | Fonte de tecido | Espécie | Viabilidade Média (%) após 10 pulsos |
| TRAMPC1 | Próstata | Rato | 40 |
| 4T01 | Seio | Rato | 32 |
| 4T7 | Seio | Rato | 43 |
| 67NR | Seio | Rato | 46 |
| 66CL4 | Seio | Rato | 28 |
| RT4 | Bexiga | Humano | 62 |
| W17-266-4 | Melanoma | Humano | 46 |
| HS852 | Melanoma | Humano | 41 |
| HS695 | Melanoma | Humano | 41 |
| A2058 | Melanoma | Humano | 37 |
| A375 | Melanoma | Humano | 37 |
| RPMI-7951 | Melanoma | Humano | 35 |
| SKMEL2 | Melanoma | Humano | 29 |
| A101D | Melanoma | Humano | 28 |
| MiaPaCa | Pancreático | Humano | 7 |
Tabela 2: Resistência ao estresse da tesoura fluida de várias linhas de células cancerosas. Cada linha de células cancerígenas foi exposta ao estresse da tesoura de fluidos do modelo de seringa e agulha (agulha de 30 G, 10 pulses@250 mL/s) (n ≥ linha 3/célula), e a viabilidade foi medida por atividade de luciferase ou conversão de resazurina.
Discussão
Este artigo demonstra a aplicação de FSS às células cancerígenas em suspensão usando uma seringa e agulha. Usando este modelo, as células cancerígenas têm se mostrado mais resistentes a pulsos breves de FSS de alto nível em relação às células epiteliais não transformadas15,22,24. Além disso, a exposição ao FSS usando este modelo resulta em um rápido aumento da rigidez celular, ativação de RhoA e aumento da contractilidade baseada em F-actin e myosin II24,27. Rápida adaptação mecano (a capacidade dos CTCs de se tornarem mais ou menos rígidos dependendo das circunstâncias) pode impedir a destruição mecânica dos CTCs e facilitar outros aspectos da colonização metastática24,28. De fato, foram confirmados achados usando este modelo in vitro usando CTCs experimentais em modelos animais24. Esta rápida adaptação mecano provavelmente explica a perda bifásica da viabilidade celular tipicamente observada neste modelo (Figura 1), ou seja, células ingênuas do FSS são mais suscetíveis à destruição do que células que foram expostas até mesmo a um único pulso de FSS. Em conjunto, isso indica que a FSS induz o enrijecimento rápido das células cancerosas que as protege dos pulsos subsequentes da FSS.
Embora o eixo RhoA-actomyosin seja um importante condutor da resistência FSS15,21,24, há provavelmente outros mecanismos envolvidos29. Outra evidência de que a rigidez celular é um determinante fundamental da resistência fss é que a interrupção do lamin A, que controla a integridade estrutural do núcleo - o componente mais rígido da célula, reduz a resistência fss em células cancerosas usando este modelo22. Estamos usando este modelo para sondar os mecanismos de resistência fss em células cancerosas ainda mais. Aqui, este modelo tem sido usado para medir a capacidade de várias linhas de células cancerosas para resistir à destruição mecânica, expondo células a pulsos breves de altos níveis de FSS. Embora este seja um modelo relativamente barato e simples de se desenvolver em laboratório, sendo o elemento mais caro a bomba de seringa, deve-se tomar cuidado para seguir o protocolo fielmente para obter resultados reprodutíveis. Múltiplos pulsos de FSS podem ser aplicados às células em um tempo muito curto, <10min. O tempo total decorrido para o experimento depende do volume de suspensão, taxa de fluxo, número de pulso e da destreza do usuário transferindo a suspensão entre pulsos. Com experiência, uma suspensão de 5 mL exposta ao FSS com uma agulha de 30 G por 10 pulses@250 μL/s pode ser processada em ~10 min. Para a maioria das linhas de celular, há perda mínima de viabilidade devido a ser mantido em suspensão por este período de tempo.
Como a exposição ao FSS ocorre relativamente rapidamente, o FSS é tipicamente aplicado a suspensões celulares em meio livre de soro para reduzir a espuma das amostras. A diferença de viscosidade entre 0-10% de soro bovino fetal é insignificante neste ensaio. No entanto, é fundamental garantir níveis fisiológicos de cálcio no meio em que as células são desarquivadas. Além disso, no que diz respeito aos métodos de dissociação celular antes da exposição ao FSS, não foi detectada diferença na resistência ao FSS em suspensões celulares PC-3 preparadas por trippsinização ou tratamento com agentes de dissociação não enzimática15. A concentração celular pode ser maior ou inferior a 5 × 105 células/mL, dependendo das necessidades de aplicação a jusante. A resposta das células cancerígenas da próstata PC-3 é semelhante em uma faixa de 5 × 104 a 5 × 105,15. No entanto, os efeitos da concentração celular na viabilidade após a exposição ao FSS devem ser empiricamente determinados.
Para a maioria das aplicações vislumbradas com células cultivadas, a densidade celular não deve afetar significativamente a viscosidade e, portanto, a quantidade de FSS aplicada. Variáveis, como o tempo para o qual as células são mantidas em suspensão antes da exposição ao FSS, devem ser mantidas constantes em todas as réplicas experimentais. Como mencionado acima, a integridade da agulha também é crítica. Variações de lotes têm sido notadas em agulhas em relação a este ensaio ao longo do tempo. Agulhas hipodérmicas foram projetadas para uso clínico, não para as taxas de fluxo empregadas aqui. Em raras ocasiões, o cubo da agulha pode ser parcialmente ocluído, o que durante pulsos subsequentes, oclui a passagem da suspensão através da agulha e, finalmente, o fluxo de volta em torno do êmbolo da seringa. Além disso, é muito importante entender que as células mortas/moribundas são excepcionalmente sensíveis ao FSS, como mostrado anteriormente24. Portanto, se uma determinada linha celular tem um alto nível de células moribundas, seja como uma característica de rotina ou manipulações experimentais (por exemplo, tratamentos medicamentosos), isso resultará em uma perda muito acentuada da viabilidade celular que pode não ser completamente normalizada em comparação com o controle estático.
A aplicação do FSS pode ser emparelhada com outros ensaios, como imunofluorescência, ensaios de pulldown e manchas ocidentais, para estudar o efeito da FSS na biologia celular do câncer 24. Em princípio, este modelo também pode ser usado para explorar os efeitos do FSS de alto nível e de curta duração em outros tipos de células, incluindo células sanguíneas. Glóbulos vermelhos normais e leucócitos são muito mais resistentes ao FSS aplicados desta forma do que até mesmo as células cancerígenas, o que significa fisiologicamente15. Na verdade, o nível de FSS aplicado, utilizando uma agulha de 30 G 1/2" a uma vazão de 250 mL/s, bracket a faixa necessária para a interrupção da membrana celular vermelha (baseada na aplicação de milissegundos de força)30,31. Uma limitação deste modelo, ou qualquer outra que envolva passar fluido através de um conduíte, é que o nível preciso de FSS que as células experimentam dentro da faixa do estresse máximo da tesoura da parede e o mínimo no centro do conduíte não é conhecido. Assim, a cada pulso, todas as células não experimentam o mesmo nível de FSS, e ao longo de pulsos repetidos, espera-se que as células individuais experimentem diferentes níveis de FSS em cada pulso dentro do intervalo especificado.
No entanto, o foco hidrodinâmico nas condições empregadas neste modelo resulta em células sendo direcionadas para o centro do fluxo, longe da parede, e, portanto, para menor exposiçãofss 32. Outros modelos, como viscometros de cone e placa ou câmaras de Couette, são mais adequados para a aplicação de FSS em níveis constantes a uma suspensão celular. Como mencionado acima, continua sendo desafiador a exposição modelo FSS de CTCs in vitro. Este modelo é mais adequado para testar os efeitos da alta, mas breve, exposição ao FSS como pode acontecer atravessando o coração. O fluxo através de artérias e veias resulta em maior exposição a níveis mais baixos de FSS. No entanto, como mencionado, não está claro quanto tempo os CTCs permanecem em fluxo contínuo na circulação, e a maioria das evidências experimentais até o momento é consistente com períodos curtos (segundos) de fluxo livre pontuados por períodos mais longos de armadilha na microcirculação.
Os modelos que expõem as células cancerígenas em suspensão a níveis mais baixos de FSS (0,5-60 dyn/cm2) para longas durações (minutos a dias) incluem viscometros de cone e placa, câmaras de couette, laços de fluxo contínuos, seringa com extensão de tubo e dispositivos microfluidos33,34,35,36,37. Estes também têm sido usados para obter insights sobre como o FSS pode afetar os CTCs e levaram a descobrir que a exposição ao FSS aumenta o estresse oxidativo, a proliferação e invasão celular, e características semelhantes a células-tronco em várias linhas de células cancerosas. Será interessante comparar os resultados derivados desses modelos com o descrito aqui. Por exemplo, usando um modelo de loop de fluxo contínuo, Xin et al. descobriram que o eixo ROCK-actomyosin promoveu uma perda de viabilidade celular em linhas de células cancerosas expostas a FSS (20 dyn/cm2) por 2-12h em contraste com os dados descritos acimade 38. Assim, é muito provável que o contexto biológico importe para todos esses modelos in vitro, reforçando a necessidade de traduzir achados sobre CTCs em modelos in vivo e, finalmente, pacientes com câncer.
Divulgações
MDH é co-fundador, Presidente e acionista da SynderBio, Inc. DLM é consultor da SynderBio, Inc.
Agradecimentos
O desenvolvimento do modelo demonstrado aqui foi apoiado pela concessão do DOD W81XWH-12-1-0163, o NIH concede R21 CA179981 e R21 CA196202, e o Fundo de Pesquisa de Metástase Sato.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
Referências
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031(2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973(2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), Pt 2 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126(2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399(1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649(2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711(2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073(2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados