Method Article
주사기와 바늘을 사용하여 순환 종양 세포에 혈역학 적 스트레스의 효과 모델링
요약
여기서 우리는 순환 종양 세포에 대한 혈역학 적 스트레스의 효과를 모델링하기 위해 현탁액의 암세포에 유체 전단 스트레스를 적용하는 방법을 시연한다.
초록
전이 도중, epithelia를 포함하여 고체 조직에서 암세포는, 혈역학 적인 흐름 때문에 기계적인 긴장에 드러나는 림프및 조혈 순환에 접근을 얻습니다. 순환 종양 세포 (CtC) 경험 이러한 스트레스 중 하나는 유체 전단 스트레스 (FSS)입니다. 암세포는 간질 적인 흐름 때문에 종양 내의 FSS의 낮은 수준을 경험할 수 있는 동안, CTC는, 세포외 매트릭스 부착 없이, FSS의 훨씬 더 중대한 수준에, 드러냅니다. 생리학적으로, 금감원은 3~4배 이상의 크기로 림프제(<1dyne/cm2)에 존재하는 낮은수준과 세포가 심장을 통과하고 심장 판막(>500dynes/cm2)을통과할 때 가장 높은 수준이 간략하게 존재한다. 다양한 시간 프레임에 걸쳐 다양한 범위의 생리 전단 응력을 모델링하도록 설계된 몇 가지 체외 모델이 있습니다. 이 논문은 간단한 주사기 및 바늘 시스템을 사용하여 암 세포 생물학에 대한 높은 수준의 FSS의 짧은 (밀리초) 펄스의 결과를 조사하는 모델을 설명합니다.
서문
전이, 또는 초기 종양 부위를 넘어 암의 확산은 암 사망률1의근본적인 주요 인자이다. 전이 중, 암세포는 순환 계통을 고속도로로서 활용하여 몸 전체에 먼 부위로 전파한다2,3. 이러한 사이트로 가는 도중에, 순환 종양 세포(CtC)는 그들의 원래 1차종양3,4,5와는 달리 동적 유체 미세 환경 내에 존재한다. 이 유체 미세 환경은 전이4에많은 장벽 중 하나입니다 제안되었습니다. 전이성 비효율성의 개념, 즉, 순환을 입력하는 대부분의 CtC가 멸망하거나 생산적인 전이성 콜로니6,7,8을형성하지 않는다는개념에대한 광범위한 합의가 있다. 그러나, 왜 전이개별 CTC의 관점에서 비효율적이다는 것은 덜 확실하고 조사의 적극적인 영역으로 남아 있습니다. CTC는 세포외 매트릭스로부터 분리되고, 1차 종양에 존재할 수 있는 수용성 성장 및 생존 인자를 박탈하고, 1차 종양4와는 훨씬 다른 방식으로 면역 계통 및 혈역학력에 노출된다. 이러한 요인의 각각은 CtC의 가난한 생존에 기여할 수 있습니다,하지만 그들의 상대적 기여는 불분명하다. 이 백서는 혈역학적 힘이 CTC에 미치는 영향에 대한 문제를 다룹니다.
CTC에 대한 혈역학적 힘의 영향을 연구하는 것은 매우 어렵습니다. 현재, 전체 현부종 역학 (모세 혈관에 심장) 및 인간 혈관 시스템의 유변학적 특성을 복제 할 수있는 체외 시스템에 엔지니어링 된 이 없습니다. 또한 CtC가 순환 시스템을 어떻게 경험하는지 완전히 명확하지는 않습니다. 실험적인 기록은 대부분의 암세포가 혈액 세포 같이 연속해서 순환하지 않는다는 것을 표시합니다. 오히려, 비교적 큰 크기(직경 10-20 μm)로 인해 대부분의 CTC는 모세관 침대(직경 6-8 μm)에 갇혀 가변 길이(들에서 일)에 대해 죽거나 사치스라우거나 다음 모세혈관 침대8,9,10,11로변위된다. 그러나 CTC 크기가 생체 내에서 더 이질적일 수 있으며 더 작은 CTC가12를검출할 수 있다는 몇 가지 증거가 있습니다. 따라서 거리 및 혈류 속도에 따라 CTC는 이러한 함정 기간 사이에 몇 초 동안만 자유롭게 순환할 수 있지만 이러한 행동에 대한 정량적 설명은13이부족합니다.
또한, CtC가 혈액 순환을 입력하는 위치에 따라, 그들은 폐 및 기타 주변 부위의 여러 모세관 침대를 통과하고 최종 목적지에 도달하기 전에 오른쪽과 왼쪽 심장을 통과 할 수 있습니다. 길을 따라, CTC는 유체 전단 응력 (FSS), 마이크로 순환에 자신의 함정 동안 압축 력, 잠재적으로, 그들은 혈관 벽을 따라 백혈구와 같은 롤링을 나타낼 수있는 상황에서 견인 력을 포함하여 다양한 혈역학 적 스트레스에노출된다 14. 따라서, 모델링할 CTC 동작의 순환 및 이해를 모델링하는 능력은 모두 제한적이다. 이 불확실성 때문에, 체외 모형 시스템에서 어떤 사실 인정든지 실험적인 척추동물 유기체에서 그리고 궁극적으로, 암 환자에서 확인되어야 합니다.
앞서 언급한 주의 사항으로, 이 논문은 2012년15년에처음 설명된 CTC에 대한 FSS의 효과를 조사하기 위해 현탁액의 세포에 FSS를 적용하는 비교적 간단한 모델을 보여 준다. 금감원은 혈관 벽에 대한 혈류의 마찰로 인해 더 큰 혈관의 라미나르 흐름 조건에서 포물선 속도 그라데이션을 생성합니다. 세포는 혈관 벽 근처 FSS의 상부를 경험하고 혈관의 중심 근처 낮은 수준. 하겐-포수유 방정식에 의해 설명된 바와 같이, 흐름이 발생하는 도관의 유체 점도, 유량 및 치수는 FSS에 영향을 미친다. 이것은 뉴턴 액체로 행동하는 혈액 흐름에 적용되지만 미세 순환을 위해 보유하지 않습니다. 생리적 금감원은 림프계(<1dyn/cm2)에서가장 낮은 수준과 심장 판막 및 죽상 경화성 플라크(>500 dyn/cm2)5에서가장 높은 수준으로 여러 수주 이상의 크기를 다양하게 다양하게 다수 범위로 한다. 동맥의 평균 벽 전단 응력은 10-70 dyn/cm2 및 1-6 dyn/cm2 in 정맥16,17이다.
심장에서, 세포는 매우 높은 수준의 밸브 전단지 주위의 난류 흐름에 노출될 수 있지만, 매우 짧은 기간 FSS는18,19를경험할 수 있다. 바이오프로시전은 오랫동안 FSS가 현탁액의 포유류 세포에 미치는 영향을 연구해 왔지만, 이 정보는 일반적으로장기간 20에걸쳐 적용되는 FSS의 훨씬 낮은 수준에 초점을 맞추고 있기 때문에 CtC에 대한 FSS의 효과를 이해하기 위한 제한된 가치일 수 있다. 아래에 설명된 바와 같이, 주사기와 바늘을 사용하여, 세포 현탁액에 상대적으로 짧은 (밀리초) 기간 동안 상대적으로 높은 (수만 ~ 수천 개의 다인/cm2)FSS를 적용할 수 있다. 이모델(15)의초기 설명 이후, 다른 사람들은암세포(21,22,23)에대한 FSS의 효과를 연구하기 위해 이를채택하였다. FSS의 여러 "펄스"는 다운스트림 실험 분석을 용이하게하기 위해 짧은 기간 동안 세포 현탁액에 적용 될 수 있습니다. 예를 들어, 이 모델은 적용된 펄스 수의 함수로서 세포 생존가능성을 측정하여 FSS에 의한 기계적 파괴에 저항하는 세포의 능력을 측정하는 데 사용될 수 있다. 대안적으로, FSS 노출이 암세포의 생물학에 미치는 영향은 다양한 다운스트림 분석을 위해 세포를 수집하여 탐구할 수 있다. 중요한 것은, 셀 서스펜션의 일부는 정지에 보관된 세포 분리 및 시간과 연관될 수 있는 것과 FSS의 효력을 비교하기 위하여 정적 제어로 예약됩니다.
프로토콜
1. 셀 준비
- 사용 중 세포주에 대한 권장 지침을 준수하여 70-90% 컨실업할 때 조직 배양 접시에서 세포를 방출한다.
- 예를 들어, PC-3 세포의 성장 배지를 흡인시키고, 칼슘 및 마그네슘이 없는 인산염 식염수(PBS)의 5mL로 세포의 10cm 접시를 세척한다.
- 제조업체의 프로토콜을 사용하여 0.25 %의 트립신1 mL을 추가하기 전에 PBS를 흡입하십시오.
- 반전 된 현미경하에서 세포의 분리를 관찰 한 후, 트립신을 억제하기 위해 10 % 태아 소 혈청을 포함하는 DMEM: F12 배지의 5 mL을 추가합니다.
- 세포 현탁액을 원문 튜브에 넣습니다.
- 세포 농도 와 총 세포 수를 결정합니다.
- 펠릿 세포는 원심분리(3분 × g)에 의해, 수퍼나탄을 흡인시키고, 혈청이 없는 조직 배양 배지에서 세포를 5×105 세포/mL로 재분리한다.
참고: 분석 매체는 세포외 Ca++가 FSS15에대한 세포 저항에 필요한 것으로 입증되었기 때문에 적어도 1.17 mM Ca++를 포함하는 것이 중요합니다.
2. 유체 전단 응력 노출
- FSS에 세포를 노출하기 전에, 7 mL 라인에서 라운드 하단 14 mL 폴리스티렌 튜브를 잘라. 셀 서스펜션을 혼합하고, 서스펜션의 5mL를 절단 튜브에 배치하고, 정적 제어 샘플을 수집합니다.
참고: 정적 샘플에 대해 수집하는 데 필요한 볼륨은 사용된 실행 가능성 분석(3단계 참조)에 따라 달라집니다. - 셀 서스펜션을 5mL 주사기로 끌어넣고 30 G 1/2" 바늘을 부착합니다. 바늘을 풀고 주사기를 주사기 펌프에 놓고 주사기를 고정하고 유량을 설정하여 원하는 수준의 FSS를 달성합니다.
참고: 표 1은 다른 바늘과 유량에 대한 최대 벽 전단 응력뿐만 아니라 세포 크기(10, 15 및 20 μm)에 따라 최소 수준의 FSS를 보여줍니다. 바늘이 구부러지지 않도록 사용하기 전에 바늘을 검사하십시오. 확실하지 않은 경우 바늘을 새 바늘로 교체하십시오. 바늘 무결성은 적용된 FSS 수준에 큰 영향을 미칠 수 있습니다. - 주사기 펌프를 실행하고, 발포를 줄이기 위해 약 45 ° 각도에서 절단 튜브에서 시어드 샘플을 수집합니다. 생존 가능성 분석 또는 다운스트림 분석 요구 유형에 따라 샘플을 수집합니다.
- 주사기 펌프에서 주사기와 바늘을 조심스럽게 제거하고 펜치를 사용하여 주사기에서 바늘을 제거하여 바늘을 만지지 않도록주의하십시오.
참고: 비beveled 바늘추가 안전 측정으로 beveled 바늘과 상호 교환적으로 사용할 수 있습니다.
- 주사기 펌프에서 주사기와 바늘을 조심스럽게 제거하고 펜치를 사용하여 주사기에서 바늘을 제거하여 바늘을 만지지 않도록주의하십시오.
- 시어드 서스펜션을 주사기에 다시 넣고 펜치를 사용하여 바늘을 조심스럽게 다시 부착하고 주사기 펌프에 다시 넣습니다.
- 세포 현탁액이 원하는 수의 FSS에 노출될 때까지 2.3 및 2.4단계를 반복한다.
참고: FSS 노출로부터 기계적 파괴에 저항하는 세포의 용량을 평가하기 위해 세포 현탁액은 전형적으로 FSS의 10 펄스를 받게 된다. 그러나, 세포가 2펄스24후에 FSS에 반응하여 생물학적 적응을 시작하기 시작한다는 것이 입증되었다.
3. 생존력 측정
참고: 생존능력은 효소 분석(루시파아제, 레사쥐린 및 WST-1), 그대로 셀, 유동 세포측정, 또는 클로노제닉 분석으로 계산하여 평가될 수 있다.
- 생존가능성의 모든 측정을 위해, FSS에 세포를 노출하기 전에 샘플을 수집합니다.
- 효소 적 인 에세이의 경우 중복 100 μL 알리코를 가져 와서 96 웰 플레이트에 넣습니다.
- 유동 세포측정을 위해 500 μL 알리쿼트 1개를 받아 1.5mL 튜브에 넣습니다.
- clonogenic 분석의 경우 100 μL 알리쿼트를 수집합니다.
- 효소 분석
- 1, 2, 4, 6, 8 및 10 펄스 후 100 μL 샘플을 수집하고 96웰 플레이트에 넣습니다.
- 원하는 기판을 추가하고 사용된 분석서에 대한 프로토콜을 따릅니다.
- resazurin의 경우 각 웰에 0.15 mg/mL 용액의 20 μL을 추가합니다. 0.15 mg/mL resazurin 용액의 20 μL을 중간 100 μL만 포함하는 우물에 추가합니다. 37°C 조직 배양 인큐베이터에서 2h에 대한 인큐베이션을 한다. 형광을 판독할 수 있는 플레이트 리더를 사용하여 흡광도를 측정합니다(579 엑아지션/584 배출).
- 루시파아제를 표현하는 세포의 경우, 15 mg/mL D-루시퍼린의 100 μL을 배지 5mL에 추가합니다. 해당 용액의 100 μL을 각 우물에 셀을 포함합니다. 5 분 기다린 다음 발광과 호환되는 판독기를 사용하여 접시를 읽으십시오.
- WST-1의 경우 배지만 함유된 우물을 포함하여 각 웰에 WST-1 1의 10 μL을 추가합니다. 4시간 동안 배양한 다음 플레이트 판독기를 사용하여 420~480nm 사이의 흡광도를 읽습니다.
- FSS에 노출된 각 샘플의 평균 신호를 평균 정적 제어 샘플과 비교하여 실행 가능한 셀의 백분율을 얻습니다.
- 유동 세포측정제24
- 500μL 샘플을 수집하고 FSS의 1, 2, 5 및 10 펄스 후 1.5 mL 원심 분리기 튜브에 배치합니다.
- 원심분리기 샘플(500 × g 3분)을 제거하고 초월제를 폐기합니다.
- 칼슘과 마그네슘이 없는 PBS1mL로 펠릿을 회수하고 시료(3분 동안 300g ×)를 원심분리합니다.
- 500μL의 형광 활성 세포 선별(FACS) 버퍼(PBS 0.5% 소 세럼 알부민 및 0.1% 나트륨 아지드)로 펠릿을 일시 중단하여 구슬과 멤브레인 불투과성 또는 생존성 염료(1.75 μg/mL)를 계산합니다.
- 미리 식 샘플에서 구슬계로 정규화된 실행 가능한 셀의 비율을 정적 샘플과 비교하여 생존가능성을 결정합니다.
- 클로노제닉 분석
- 정적 샘플의 100 μL을 취하고 성장 배지 900 μL을 추가하여 1:10 희석을 합니다.
- 1:10 희석된 시료의 100 μL을 취하고, 900 μL의 성장 매체를 추가하여 최종 1:100 희석을 합니다.
- 1:100 희석 샘플의 100 μL을 2mL의 성장 매체를 포함하는 6웰 접시 3개의 우물에 넣습니다.
- FSS의 10 펄스를 실시한 샘플과 함께 3.4.1-3.4.3 단계를 반복합니다.
- 세포를 배지를 변경하지 않고 7-10 일 동안 성장하고 식민지 형성을 확인하십시오. 일단 ≥50 세포의 식민지가 형성되면, 성장 배지를 흡인하고, PBS의 1mL로 각각 잘 헹구고, PBS를 흡인하고, 얼음 감기 70% 에탄올(EtOH)의 1mL를 사용하여 5분 동안 수정한다. 중요한 것은, 동시에 전단 및 정적 샘플을 모두 수정합니다.
- 시료를 고정한 후 EtOH를 흡인하고, 크리스탈 바이올렛 용액 1~2mL(90% H2O, 10% EtOH)를 5분 동안 첨가한다.
- 물을 과도하게 헹구고 접시를 건조시키십시오.
- 정적 및 전단 시료 모두에 대한 콜로니(≥50 셀 의 클러스터)를 계산합니다. 전단 시료의 평균 식민지 수의 비율을 정적 샘플의 평균 콜로니 수와 비교하여 생존 가능성을 결정합니다.
결과
FSS 유도 된 기계적 파괴에 대한 높은 저항은 이전에 비 변형 상피 세포 비교기(15,24)에비해 종양으로부터 갓 분리 된 다중 암 세포 주 및 암 세포에 걸쳐 보존 된 표현형으로 나타났다. 여기서, 다양한 조직 기원으로부터의 추가 암 세포주(표2)는이들 세포의 대부분이 250 μL/s에서 FSS의 10펄스 후 20%≥ 표시한다는 것을 입증하기 위해 시험되었다. 한 가지 예외는 FSS (≤ 10 %)의 기계적 파괴에 상대적으로 민감한 MiaPaCa2 세포입니다. 세포주 FSS 저항 프로파일을 적절하게 설명하기 위해 n ≥ 3 생물학적 복제가 권장됩니다.
비교를 통해, 검사된 모든 비변형 상피 세포는 이러한 조건 하에서 10% < 생존가능성이있다 15,24. 따라서, FSS 저항이 관찰되는 범위가 있는 동안, 시험된 암 세포주의 대다수는 비변환된 세포 보다는 더 중대한 FSS 저항을 나타낸다. 암 세포선은 1 차적인 종양 조직 및 전이 둘 다에서 파생될 수 있습니다. 전이로부터 유래된 세포가 전이성 보급 중에 선택되었을 수 있기 때문에 더 큰 FSS 저항성을 나타낼 수 있다고 추정할 수 있다. 그러나, 금감원 내성 수준은 세포가 1차 종양 또는전이(15,24)로부터유래되었는지 여부에 의존하지 않는 것으로 나타났다. 더욱이, FSS 저항의 수준은 인간 적인 전립선암 세포주 15의 시리즈에서 전이성 전위와 상관관계가 없었다15.
이를 더 테스트하기 위해, 다양한 전이성 전위 전위(4T1 = 고전도, 4T07 = 약하여 중간 전이성 전위 전위, 67NR = 낮은 전이성 전위전위 25,26)을가진 BALB/c 유방 상피 세포가 사용되었다. 이 실험은 FSS 저항이 전이성 전위(도1)와상관관계가 아니라는 것을 밝혔다. 더욱이, 4T1 및 4T07 세포 둘 다 후속 펄스에서 관찰된 것보다 펄스 1-2에서 생존력의 더 중대한 손실세포 생존성의 양면 손실을 나타낸다. 이것은 이 단에 의해 조사된 대부분의 암 세포 주의 전형입니다. 반면, 67NR은 금감원의 기능으로서 세포 생존가능성을 보다 선형적 손실로 나타낸다. 전체적으로 표 2 및 그림 1의 데이터는 FSS 저항이 변형된 셀의 속성임을 보여줍니다.
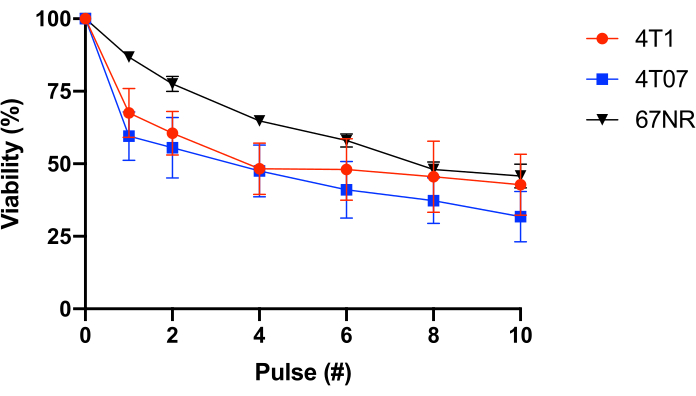
그림 1: 합성 BALB /c 유방 상피 암 세포의 유체 전단 스트레스 저항. 세포는 FSS(30G 바늘, 10 pulses@250 mL/s)에 노출되었고, 생존력은 레사쥐린 변환(n= 4/세포주)을 사용하여 측정하였다. FSS 노출은 실행 가능한 세포(p < 0.0001, 2way ANOVA)의 수를 감소시키고 각 세포주마다 상이한 저항 프로파일(p = 0.0446, 2-way ANOVA)을 표시했지만, FSS 노출의 10펄스(p= 0.2833, 2-way ANOVA)의 후 세포주 간에 는 유의한 차이가 없었습니다. 약어 : FSS = 유체 전단 응력; ANOVA = 분산 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 전단(θ): | 벽(최대) | 최소 | |||||||||||
| 셀 직경: | N/A | 10 μm | 15 μm | 20 μm | |||||||||
| 바늘 게이지: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| 유량(μL/s) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
표 1: 최대 전단 응력(θwall)수준입니다. 표에는 20G, 27G, 25G 바늘의 최대 벽 FSS 레벨이 20, 50, 100, 150, 200 및 250 μL/s로 나열됩니다. 전단 응력 수준은 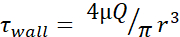 포수유 방정식(), 각 바늘 게이지의 내경에 사용할 수 있는 정보뿐만 아니라 μ = 0.01 dyn·s/cm2를사용하여 계산하였다. 각 크기에 대한 최소 FSS 수준은
포수유 방정식(), 각 바늘 게이지의 내경에 사용할 수 있는 정보뿐만 아니라 μ = 0.01 dyn·s/cm2를사용하여 계산하였다. 각 크기에 대한 최소 FSS 수준은 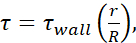 r이 셀의 반경이며, R은 바늘의 반경인 것을 사용하여 계산하였다. 약어: FSS = 유체 전단 응력; [θ] 전단; θ벽 = 최대 전단; μ = 점도; Q = 체적 유량.
r이 셀의 반경이며, R은 바늘의 반경인 것을 사용하여 계산하였다. 약어: FSS = 유체 전단 응력; [θ] 전단; θ벽 = 최대 전단; μ = 점도; Q = 체적 유량.
| 셀 라인 | 티슈 소스 | 종 | 10펄스 후 평균 생존가능성(%) |
| 트램PC1 | 전립선 | 마우스 | 40 |
| 4T01 | 가슴 | 마우스 | 32 |
| 4T7 | 가슴 | 마우스 | 43 |
| 67NR | 가슴 | 마우스 | 46 |
| 66CL4 | 가슴 | 마우스 | 28 |
| RT4 | 방광 | 사람의 | 62 |
| W17-266-4 | 흑색종 | 사람의 | 46 |
| HS852 | 흑색종 | 사람의 | 41 |
| HS695 | 흑색종 | 사람의 | 41 |
| A2058 | 흑색종 | 사람의 | 37 |
| A375 | 흑색종 | 사람의 | 37 |
| RPMI-7951 | 흑색종 | 사람의 | 35 |
| SK멜2 | 흑색종 | 사람의 | 29 |
| A101D | 흑색종 | 사람의 | 28 |
| 미아파카 | 췌 장 | 사람의 | 7 |
표 2: 다양한 암 세포선의 유체 전단 스트레스 저항. 각 암 세포주 주사기 및 바늘 모델(30G 바늘, 10 pulses@250 mL/s)(n≥ 3/세포주)로부터 유체 전단 응력에 노출되었고, 생존력은 루시파라제 활성 또는 레사쥐린 변환에 의해 측정되었다.
토론
이 논문은 주사기와 바늘을 사용하여 현탁액의 암세포에 FSS의 적용을 보여줍니다. 이 모델을 사용하여, 암세포는 비변형 상피세포(15,22,24)에비해 높은 수준의 FSS의 짧은 펄스에 더 저항하는 것으로 나타났다. 더욱이, 본 모델을 이용한 금감원에 노출되면 세포 강성, RhoA의 활성화, 피질 F-액틴 및 미오신 II 기반 수축도24,27의급속한 증가를 초래한다. 급속한 메카노 적응(상황에 따라 CTC가 다소 뻣뻣해지는 능력)은 CtC의 기계적 파괴를 방지하고 전이성식민지(24,28)의다른 측면을 용이하게 할 수 있다. 실제로, 이 체외 모델을 사용하여 만든 연구 결과는 동물모델(24)에서실험적인 CtC를 사용하여 확인되었습니다. 이러한 급속한 메카노 적응은 일반적으로 본모델(그림 1)에서관찰되는 세포 생존능력의 이중 단계적 손실을 설명하며, 즉, FSS-순진한 세포는 FSS의 단일 펄스에도 노출된 세포보다 파괴에 더 취약하다. 종합하면, 이것은 FSS가 FSS의 후속 펄스에서 그(것)들을 보호하는 암세포에 있는 급속한 세포 경화를 유도한다는 것을 표시합니다.
RhoA-actomyosin 축은 FSS 저항15,21,24의중요한 동인이지만,29와관련된 다른 메커니즘이 있을 가능성이 있다. 세포 강성이 FSS 저항의 주요 결정요인이라는 추가 증거는 세포의 가장 뻣뻣한 성분인 핵의 구조적 무결성을 제어하는 라민 A의 붕괴가 이모델(22)을사용하여 암세포에서 FSS 저항을 감소시킨다는 것이다. 우리는 암세포에 있는 FSS 저항의 기계장치를 더 조사하기 위하여 이 모형을 이용하고 있습니다. 여기서, 본 모델은 높은 수준의 FSS의 짧은 펄스에 세포를 노출시킴으로써 기계적 파괴에 저항하기 위하여 각종 암 세포선의 용량을 측정하는 데 이용되었습니다. 이것은 실험실에서 개발하는 비교적 저렴하고 간단한 모델이지만 가장 비싼 원소가 주사기 펌프인 경우 재현 가능한 결과를 얻기 위해 프로토콜을 충실히 따르도록주의를 기울여야합니다. FSS의 다중 펄스는 매우 짧은 시간에 세포에 적용될 수 있습니다<10 분. 실험에 대한 총 경과 시간은 정지 부피, 유량, 펄스 수 및 펄스 사이에 서스펜션을 전송하는 사용자의 손재주성에 따라 달라집니다. 경험으로, 10 pulses@250 μL/s에 대한 30 G 바늘과 FSS에 노출 된 5 mL 서스펜션은 ~ 10 분에서 처리 할 수 있습니다. 대부분의 세포주에 대 한, 시간의이 길이 대 한 현 탁 증에 개최 되 고 때문에 생존의 최소한의 손실이 있다.
FSS에 대한 노출이 비교적 빠르게 발생하기 때문에, FSS는 일반적으로 샘플의 발포를 줄이기 위해 혈청이없는 매체의 세포 현탁액에 적용됩니다. 0-10% 태아 소 혈청 사이의 점도의 차이는이 분석에서 무시할 수 있습니다. 그러나 세포가 전염되는 매체에서 칼슘의 생리학적 수준을 보장하는 것이 중요합니다. 더욱이, 금감원 노출 이전의 세포 해리 방법에 대해서는, FSS 저항성의 차이는 비효소해리제(15)를가진 트립시화 또는 치료에 의해 제조된 PC-3 세포 현탁액에서 검출되었다. 세포 농도는 다운스트림 적용 요구에 따라 5× 미만105 셀/mL 보다 클 수 있다. PC-3 전립선암세포의 반응은 5× 104~5× 105,15의범위에서 유사하다. 그러나, FSS 노출 후에 생존에 세포 농도의 효력은 경험적으로 결정되어야 합니다.
배양 된 세포로 구상 된 대부분의 응용 프로그램의 경우 세포 밀도가 점도에 크게 영향을 미치지 않아야하므로 FSS의 양이 적용됩니다. FSS 노출 전에 세포가 현탁액으로 유지되는 시간과 같은 변수는 실험 복제에 걸쳐 일정하게 유지되어야 합니다. 위에서 언급 했듯이 바늘 무결성도 중요합니다. 많은 변화는 시간이 지남에 따라이 분석에 관한 바늘에서 지적되었습니다. 피하 바늘은 여기에 사용되는 유량이 아니라 임상 사용을 위해 설계되었습니다. 드문 경우에, 바늘의 허브는 부분적으로 가려질 수 있습니다. 또한, 죽은/죽어가는 세포가 이전에24번과같이 FSS에 매우 민감하다는 것을 이해하는 것이 매우 중요합니다. 따라서, 특정 세포주가 정지 세포의 높은 수준을 가지고 있는 경우에, 일상적인 특성 또는 실험 적인 조작으로 (예를 들면, 약물 처리), 이것은 정적인 통제에 비해 완전히 정규화되지 않을 지도 모르다 세포 생존성의 아주 가파른 손실 귀착될 것입니다.
FSS의 적용은 면역형광, 풀다운 분석 및 서부 블로팅과 같은 다른 분석과 결합하여 암 세포 생물학(24)에대한 FSS의 효과를 연구할 수 있다. 원칙적으로,이 모델은 또한 혈액 세포를 포함한 다른 세포 유형에 높은 수준의, 짧은 기간 FSS의 효과를 탐구하는 데 사용할 수 있습니다. 정상적인 적혈구와 백혈구는 생리학적으로15를추론하는 암세포보다 이러한 방식으로 적용되는 FSS에 훨씬 더 내성이 있다. 실제로, FSS의 수준은 250mL/s의 유속에서 30 G 1/2" 바늘을 사용하여, 적혈구막의 중단에 필요한 범위를 브래킷 (힘의 밀리초 적용에 기초)30,31. 이 모델의 한 가지 제한, 또는 도관을 통해 유체를 통과하는 것을 포함하는 어떤, 세포가 최대 벽 전단 응력및 도관의 중심에 최소 범위 내에서 경험하는 FSS의 정확한 수준은 알려져 있지 않다는 것입니다. 따라서, 각 펄스에서, 모든 세포는 동일한 수준의 FSS를 경험하지 않으며, 반복된 펄스를 통해, 개별 세포는 지정된 범위 내의 각 펄스에서 FSS의 상이한 수준을 경험할 것으로 예상될 것이다.
그러나, 이 모델에 사용되는 조건 하에서 유체역학적 초점으로 인해 세포가 유량의 중심을 향해, 벽에서 멀어지고, 따라서 낮은 FSS노출(32)을향해 향하도록 한다. 콘 및 플레이트 점도계 또는 쿠엣 챔버와 같은 다른 모델은 세포 현탁액에 일정한 수준에서 FSS를 적용하는 데 더 적합합니다. 위에서 언급 했듯이, 시험관 내에서CTC의 FSS 노출을 모델링하는 것은 여전히 어려운 일입니다. 이 모델은 심장을 통과하는 일이 발생할 수 있는 것처럼 FSS에 대한 높지만 짧은 노출의 효과를 테스트하는 데 가장 적합합니다. 동맥과 정맥을 통해 흐르는 것은 FSS의 낮은 수준에 더 이상 노출을 초래합니다. 그러나, 언급했듯이, CtC가 순환의 연속 흐름에 머무르는 기간은 불분명하며, 현재까지 대부분의 실험 적 증거는 미세 순환에 있는 함정의 긴 기간에 의해 구두점된 자유 유량의 짧은 기간 (초)과 일치합니다.
더 긴 기간(분내지 일)에 대한 FSS(0.5-60 dyn/cm2)의낮은 수준으로 현탁액에 암세포를 노출하는 모델은 콘 및 플레이트 점도계, 쿠엣 챔버, 연속 흐름 루프, 튜브 확장시 주사기, 및 미세 유체 장치33,34,35,36,37을포함한다. 이들은 또한 FSS가 CTC에 영향을 미칠 수 있는 방법에 대한 통찰력을 얻기 위하여 이용되고 FSS에 노출이 산화 스트레스를 증가한다는 것을 것을을 발견하기 위하여, 세포 증식 및 침략, 각종 암 세포 주에서 줄기 세포 같이 특성을 증가시킨다. 이러한 모델에서 파생된 결과를 여기에 설명한 결과와 비교하는 것은 흥미로할 것입니다. 예를 들어, 연속 흐름 루프 모델을 이용하여, 신외항액은 FSS(20dyn/cm2)에노출된 암 세포주에서 세포 생존가능성을 촉진한 것으로 나타났으며, 이는 상기38과는 확연한 대조를 이룬다. 따라서, 생물학적 맥락은 이러한 체외 모델의 모든 중요 할 가능성이 매우 높습니다, 생체 내 모델과 궁극적으로, 암 환자로 CTC에 대한 결과를 번역 할 필요성을 강화.
공개
MDH는 SynderBio, Inc.의 공동 창립자이자 사장이자 주주입니다.
감사의 말
여기에서 입증된 모델의 개발은 DOD 보조금 W81XWH-12-1-0163, NIH 보조금 R21 CA179981 및 R21 CA196202 및 사토 메타스타시스 연구 기금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
참고문헌
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031 (2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973 (2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126 (2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399 (1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649 (2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711 (2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073 (2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유