Method Article
Modelado de los efectos del estrés hemodinámico en las células tumorales circulantes utilizando una jeringa y una aguja
En este artículo
Resumen
Aquí demostramos un método para aplicar estrés por cizallamiento de fluidos a las células cancerosas en suspensión para modelar los efectos del estrés hemodinámico en las células tumorales circulantes.
Resumen
Durante la metástasis, las células cancerosas de tejidos sólidos, incluidos los epitelios, obtienen acceso a la circulación linfática y hematógena donde están expuestas al estrés mecánico debido al flujo hemodinámico. Una de estas tensiones que experimentan las células tumorales circulantes (CTC) es el estrés por cizallamiento de fluidos (FSS). Si bien las células cancerosas pueden experimentar niveles bajos de FSS dentro del tumor debido al flujo intersticial, las CTC están expuestas, sin unión a la matriz extracelular, a niveles mucho mayores de FSS. Fisiológicamente, el FSS oscila entre 3 y 4 órdenes de magnitud, con niveles bajos presentes en los linfáticos (<1 gineco/cm2 ) y los niveles más altos se presentan brevemente a medida que las células pasan a través del corazón y alrededor de las válvulas cardíacas (>500 dinas/cm2). Hay algunos modelos in vitro diseñados para modelar diferentes rangos de tensión de cizallado fisiológico en varios marcos de tiempo. Este artículo describe un modelo para investigar las consecuencias de pulsos breves (milisegundos) de FSS de alto nivel en la biología de las células cancerosas utilizando un sistema simple de jeringas y agujas.
Introducción
La metástasis, o la diseminación del cáncer más allá del sitio inicial del tumor, es un factor importante que subyace a la mortalidad por cáncer1. Durante la metástasis, las células cancerosas utilizan el sistema circulatorio como una autopista para diseminarse a sitios distantes en todo el cuerpo2,3. Mientras se dirige a estos sitios, las células tumorales circulantes (CTC) existen dentro de un microambiente fluido dinámico a diferencia del de su tumor primario original3,4,5. Se ha propuesto que este microambiente fluido es una de las muchas barreras para la metástasis4. Existe un amplio acuerdo en el concepto de ineficiencia metastásica, es decir, que la mayoría de los CTC que entran en circulación perecen o no forman colonias metastásicas productivas6,7,8. Sin embargo, por qué la metástasis es ineficiente desde la perspectiva de un CTC individual es menos seguro y sigue siendo un área activa de investigación. Las CTC están separadas de la matriz extracelular, privadas de factores solubles de crecimiento y supervivencia que pueden estar presentes en el tumor primario, y expuestas al sistema inmune y a las fuerzas hemodinámicas de una manera muy diferente a la del tumor primario4. Cada uno de estos factores puede contribuir a la escasa supervivencia de los CTC, pero sus contribuciones relativas no están claras. Este artículo aborda la cuestión de cómo las fuerzas hemodinámicas afectan a las CTC.
Estudiar los efectos de las fuerzas hemodinámicas en los CTC es bastante desafiante. Actualmente, no existen sistemas in vitro diseñados que puedan replicar toda la dinámica espaciotemporal (corazón a capilares) y las propiedades reológicas del sistema vascular humano. Además, la forma en que los CTC experimentan el sistema circulatorio no está del todo clara. La evidencia experimental indica que la mayoría de las células cancerosas no circulan continuamente como las células sanguíneas. Más bien, debido a su tamaño relativamente grande (10-20 μm de diámetro), la mayoría de los CTC quedan atrapados en lechos capilares (6-8 μm de diámetro) durante períodos variables de tiempo (s a días) donde pueden morir, extravasar o ser desplazados al siguiente lecho capilar8,9,10,11. Sin embargo, hay algunas pruebas de que el tamaño de la CTC puede ser más heterogéneo in vivo, y que las CTC más pequeñas son detectables12. Por lo tanto, en función de la distancia y la velocidad del flujo sanguíneo, los CTC solo pueden circular libremente durante cuestión de segundos entre estos períodos de atrapamiento, aunque falta una descripción cuantitativa de este comportamiento13.
Además, dependiendo de dónde entren en circulación los CTC, pueden pasar a través de múltiples lechos capilares en el pulmón y otros sitios periféricos y a través del corazón derecho e izquierdo antes de llegar a su destino final. En el camino, los CTC están expuestos a diversas tensiones hemodinámicas, incluida la tensión de cizallamiento de fluidos (FSS), las fuerzas de compresión durante su atrapamiento en la microcirculación y, potencialmente, las fuerzas de tracción en circunstancias en las que podrían exhibir un rodar similar a un leucocitos a lo largo de las paredes de los vasos sanguíneos14. Por lo tanto, tanto la capacidad de modelar la circulación como la comprensión del comportamiento de CTC a modelar es limitada. Debido a esta incertidumbre, cualquier hallazgo de los sistemas modelo in vitro debe validarse en un organismo vertebrado experimental y, en última instancia, en pacientes con cáncer.
Con las advertencias antes mencionadas, este trabajo demuestra un modelo relativamente simple para aplicar FSS a células en suspensión para sondear los efectos de FSS en CTC descritos por primera vez en 201215. FSS resulta de la fricción del flujo sanguíneo contra la pared del vaso, lo que produce un gradiente de velocidad parabólica en condiciones de flujo laminar en vasos más grandes. Las células experimentan niveles más altos de FSS cerca de las paredes de los vasos y niveles más bajos cerca del centro del vaso sanguíneo. La viscosidad del fluido, el caudal y las dimensiones del conducto a través del cual se produce el flujo influyen en el FSS, como se describe en la ecuación de Hagen-Poiseuille. Esto se aplica a los flujos sanguíneos que se comportan como fluidos newtonianos, pero no se mantienen para la microcirculación. El FSS fisiológico varía en varios órdenes de magnitud con los niveles más bajos en los linfáticos (<1 dyn/cm2) y los más altos en las regiones alrededor de las válvulas cardíacas y las placas ateroscleróticas (>500 dyn/cm2)5. El esfuerzo cizallamiento medio de la pared en las arterias es de 10-70 dinas/cm2 y de 1-6 dinares/cm2 en las venas16,17.
En el corazón, las células pueden estar expuestas a flujos turbulentos alrededor de las valvas de las válvulas donde se puede experimentar FSS de muy alto nivel, pero de muy corta duración18,19. Aunque el campo del bioprocesamiento ha estudiado durante mucho tiempo los efectos de FSS en células de mamíferos en suspensión, esta información puede ser de valor limitado para comprender los efectos de FSS en CTC, ya que generalmente se centra en niveles mucho más bajos de FSS aplicados durante una larga duración20. Como se describe a continuación, usando una jeringa y una aguja, se puede aplicar FSS relativamente alto (decenas a miles de dinas / cm2)durante una duración relativamente corta (milisegundos) a una suspensión celular. Desde la descripción inicial de este modelo15,otros lo han empleado para estudiar los efectos del FSS sobre las células cancerosas21,22,23. Se pueden aplicar múltiples "pulsos" de FSS a las suspensiones celulares en un corto período de tiempo para facilitar los análisis experimentales posteriores. Por ejemplo, este modelo se puede utilizar para medir la capacidad de las células para resistir la destrucción mecánica por FSS midiendo la viabilidad celular en función del número de pulsos aplicados. Alternativamente, los efectos de la exposición a FSS en la biología de las células cancerosas se pueden explorar mediante la recolección de células para una variedad de análisis posteriores. Es importante destacar que parte de la suspensión celular se reserva como un control estático para comparar los efectos de FSS de aquellos que podrían estar asociados con el desprendimiento celular y el tiempo mantenido en suspensión.
Protocolo
1. Preparación celular
- Libere las células de la placa de cultivo de tejidos cuando el 70-90% confluyen siguiendo las pautas recomendadas para la línea celular en uso.
- Por ejemplo, aspire el medio de crecimiento para las células PC-3 y lave el plato de 10 cm de las células con 5 ml de solución salina tamponada con fosfato libre de calcio y magnesio (PBS).
- Aspire el PBS antes de agregar 1 ml de tripsina al 0,25% utilizando el protocolo del fabricante.
- Después de observar el desprendimiento de las células bajo un microscopio invertido, agregue 5 ml de medio DMEM: F12 que contenga un 10% de suero bovino fetal para inhibir la tripsina.
- Coloque la suspensión celular en un tubo cónico.
- Determinar la concentración celular y el número total de células.
- Las células de pellets por centrifugación (300 × g durante 3 min), aspiran el sobrenadante y resuspend las células en medio de cultivo de tejido libre de suero a 5 × 105 células/ml.
NOTA: Es fundamental que el medio de ensayo contenga al menos 1,17 mM de Ca++ ya que se ha demostrado que el Ca++ extracelular es necesario para la resistencia celular a FSS15.
2. Exposición al estrés por cizallado de fluidos
- Antes de exponer las células a FSS, corte un tubo de poliestireno de 14 ml de fondo redondo en la línea de 7 ml. Mezcle la suspensión celular, coloque 5 ml de la suspensión en el tubo de corte y recoja muestras de control estáticas.
NOTA: El volumen necesario a recoger para la muestra estática depende del ensayo de viabilidad utilizado (consulte el paso 3). - Extraiga la suspensión celular en una jeringa de 5 ml y coloque una aguja de 30 G 1/2". Desencuelte la aguja, coloque la jeringa en una bomba de jeringa, asegure la jeringa y establezca el caudal para alcanzar el nivel deseado de FSS.
NOTA: La Tabla 1 muestra la tensión máxima de cizallamiento de la pared para diferentes agujas y caudales, así como el nivel mínimo de FSS dependiendo del tamaño de la celda (10, 15 y 20 μm). Inspeccione la aguja antes de usarla para asegurarse de que no esté doblada; si no está seguro, reemplace la aguja por una nueva. La integridad de la aguja puede tener un impacto significativo en el nivel de FSS aplicado. - Haga funcionar la bomba de la jeringa y recoja la muestra cortada en el tubo de corte en un ángulo aproximado de 45 ° para reducir la formación de espuma. Recolectar una muestra dependiendo del tipo de ensayo de viabilidad o de las necesidades del ensayo aguas abajo.
- Retire cuidadosamente la jeringa y la aguja de la bomba de la jeringa y use alicates para extraer la aguja de la jeringa, teniendo cuidado de no tocar la aguja.
NOTA: Las agujas no biseladas se pueden usar indistintamente con agujas biseladas como medida de seguridad adicional.
- Retire cuidadosamente la jeringa y la aguja de la bomba de la jeringa y use alicates para extraer la aguja de la jeringa, teniendo cuidado de no tocar la aguja.
- Vuelva a colocar la suspensión cizallada en la jeringa, vuelva a colocar cuidadosamente la aguja con alicates y vuelva a colocarla en la bomba de la jeringa.
- Repita los pasos 2.3 y 2.4 hasta que la suspensión celular haya sido expuesta al número deseado de pulsos de FSS.
NOTA: Para evaluar la capacidad de las células para resistir la destrucción mecánica de la exposición a FSS, la suspensión celular generalmente se somete a 10 pulsos de FSS. Sin embargo, se ha demostrado que las células comienzan a sufrir adaptaciones biológicas en respuesta a FSS después de 2 pulsos24.
3. Medición de la viabilidad
NOTA: La viabilidad se puede evaluar mediante ensayos enzimáticos (luciferasa, resazolina y WST-1), contando células intactas, citometría de flujo o mediante ensayos clonogénicos.
- Para todas las medidas de viabilidad, recoja una muestra antes de exponer las células a FSS.
- Para ensayos enzimáticos, tome alícuotas duplicadas de 100 μL y colóquelas en una placa de 96 pozos.
- Para la citometría de flujo, tome una alícuota de 500 μL y colóquela en un tubo de 1,5 ml.
- Para el ensayo clonogénico, recolectar una alícuota de 100 μL.
- Ensayo enzimático
- Recolecte muestras de 100 μL después de 1, 2, 4, 6, 8 y 10 pulsos de exposición a FSS y colóquelas en una placa de 96 pozos.
- Agregue el sustrato deseado y siga el protocolo para el ensayo utilizado:
- Para la resazolina, agregue 20 μL de una solución de 0,15 mg/ml a cada pozo. Añadir 20 μL de solución de resazurina de 0,15 mg/ml a los pozos que contengan 100 μL de medio solo. Incubar durante 2 h en una incubadora de cultivo de tejidos a 37 °C. Mida la absorbancia utilizando un lector de placas capaz de leer la fluorescencia (579 excitación / emisión 584).
- Para las células que expresan luciferasa, agregue 100 μL de 15 mg/ml de D-luciferina a 5 ml de medio. Agregue 100 μL de esa solución a cada pozo que contenga células. Espere 5 minutos y luego lea la placa con un lector compatible con luminiscencia.
- Para WST-1, agregue 10 μL de WST-1 a cada pozo, incluidos los pozos que contengan solo medio. Incubar durante 4 h, y luego leer la absorbancia entre 420 y 480 nm utilizando un lector de placas.
- Compare la señal promediada de cada una de las muestras expuestas a FSS con la muestra de control estática promediada para obtener el porcentaje de células viables.
- Citometría de flujo24
- Recolecte muestras de 500 μL y colóquelas en tubos centrífugos de 1,5 ml después de 1, 2, 5 y 10 pulsos de FSS.
- Centrifugar muestras (500 × g durante 3 min), y desechar los sobrenadantes.
- Resuspónda los gránulos con 1 ml de PBS libre de calcio y magnesio, y centrífuga las muestras (300 × g durante 3 min).
- Suspender los gránulos con 500 μL de tampón de clasificación celular activado por fluorescencia (FACS) (PBS con albúmina sérica bovina al 0,5% y azida de sodio al 0,1%) con perlas de conteo y colorantes impermeables a la membrana o de viabilidad como yoduro de propidio (1,75 μg/ml).
- Determinar la viabilidad comparando la relación de células viables, normalizadas a cuentas de conteo, en muestras esquiladas con la de la muestra estática.
- Ensayo clonogénico
- Tome 100 μL de la muestra estática y agregue 900 μL de medio de crecimiento para hacer una dilución de 1:10.
- Tome 100 μL de la muestra diluida 1:10 y agregue 900 μL de medio de crecimiento para hacer una dilución final de 1:100.
- Agregue 100 μL de la muestra de dilución 1:100 en cada uno de los 3 pozos de un plato de 6 pozos que contenga 2 ml de medio de crecimiento.
- Repita los pasos 3.4.1-3.4.3 con muestras que hayan sido sometidas a 10 pulsos de FSS.
- Deje que las células crezcan durante 7-10 días sin cambiar el medio, y verifique la formación de colonias. Una vez que se hayan formado colonias de células ≥50, aspire el medio de crecimiento, enjuague cada pozo con 1 ml de PBS, aspire el PBS y fije durante 5 minutos con 1 ml de etanol helado al 70% (EtOH). Es importante destacar que arregle las muestras cizalladas y estáticas al mismo tiempo.
- Después de fijar las muestras, aspire el EtOH y agregue de 1 a 2 ml de solución violeta cristalina (0.1% de violeta de cristal en 90% H2O, 10% de EtOH) durante 5 min.
- Enjuague con un exceso de agua y deje que el plato se seque
- Cuente las colonias (grupos de ≥50 células) tanto para las muestras estáticas como para las esquiladas. Compare la relación entre el número promedio de colonias de la muestra esquilada y el número promedio de colonias de la muestra estática para determinar la viabilidad.
Resultados
Se ha demostrado previamente que la resistencia elevada a la destrucción mecánica inducida por FSS es un fenotipo conservado a través de múltiples líneas celulares de cáncer y células cancerosas recién aisladas de tumores en relación con los comparadores de células epiteliales no transformadas15,24. Aquí, se probaron líneas celulares de cáncer adicionales de una variedad de orígenes tisulares(Tabla 2)para demostrar que la mayoría de estas células muestran viabilidad ≥ 20% después de 10 pulsos de FSS a 250 μL / s. La única excepción son las células MiaPaCa2, que eran relativamente sensibles a la destrucción mecánica de FSS (viabilidad ≤ 10%). Para describir adecuadamente el perfil de resistencia a FSS de una línea celular, se recomiendan n ≥ 3 réplicas biológicas.
A modo de comparación, todas las células epiteliales no transformadas examinadas tienen una viabilidad < 10% en estas condiciones15,24. Por lo tanto, si bien hay un rango en la resistencia a FSS observada, la mayoría de las líneas celulares de cáncer probadas exhiben una mayor resistencia a FSS que las células no transformadas. Las líneas celulares de cáncer se pueden derivar tanto de los tejidos tumorales primarios como de las metástasis. Se podría postular que las células derivadas de metástasis pueden exhibir una mayor resistencia a FSS, ya que este fenotipo puede haber sido seleccionado durante la diseminación metastásica. Sin embargo, se demostró que el nivel de resistencia al FSS no dependía de si las células se derivaban de tumores primarios o metástasis15,24. Además, los niveles de resistencia a FSS no se correlacionaron con el potencial metastásico en una serie de líneas celulares de cáncer de próstata humano15.
Para probar esto aún más, se utilizaron células epiteliales mamarias BALB/c con potencial metastásico variable (4T1 = altamente metastásico, 4T07 = potencial metastásico débil a moderado, 67NR = no a bajo potencial metastásico25,26). Este experimento reveló que la resistencia al FSS no está correlacionada con el potencial metastásico(Figura 1). Además, tanto las células 4T1 como las 4T07 exhiben una pérdida bifásica de viabilidad celular, una mayor pérdida de viabilidad en los pulsos 1-2 que la observada en pulsos posteriores. Esto es típico de la mayoría de las líneas celulares de cáncer investigadas por este grupo. En contraste, 67NR exhibe una pérdida más lineal de viabilidad celular en función de FSS. En conjunto, los datos de la Tabla 2 y la Figura 1 demuestran que la resistencia FSS es una propiedad de las celdas transformadas.
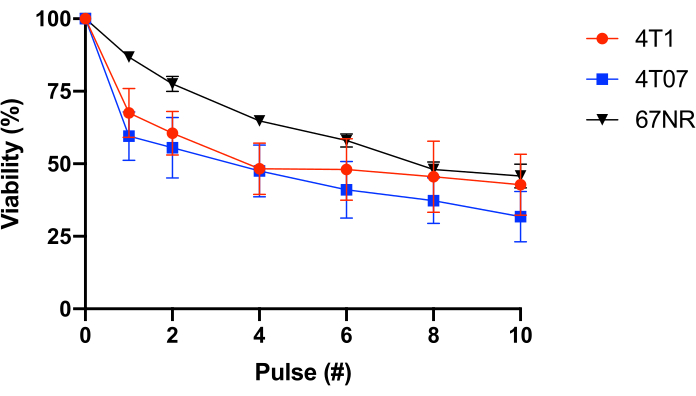
Figura 1: Resistencia al estrés por cizallado de líquidos de células cancerosas epiteliales mamarias BALB/c singénicas. Las células fueron expuestas a FSS (aguja de 30 G, 10 pulses@250 ml/s), y la viabilidad se midió mediante conversión de resazourin (n = 4/línea celular). Si bien la exposición a FSS redujo el número de células viables (p < 0,0001, ANOVA de 2 vías), y cada línea celular mostró diferentes perfiles de resistencia (p = 0,0446, ANOVA de 2 vías), no hubo diferencias significativas entre las líneas celulares después de 10 pulsos de exposición a FSS (p = 0,2833, ANOVA de 2 vías). Abreviaturas: FSS = tensión de cizallado de fluidos; ANOVA = análisis de varianza. Haga clic aquí para ver una versión más grande de esta figura.
| Cizalla (τ): | pared (máximo) | mínimo | |||||||||||
| Diámetro de la celda: | N/A | 10 μm | 15 μm | 20 μm | |||||||||
| Medidor de aguja: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| Caudal (μL/s) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
Tabla 1: Niveles máximos de tensión de cizallama (τpared). La tabla enumera los niveles máximos de FSS de pared en dinamo/cm2 para agujas de 30 G, 27 G y 25 G a caudales de 20, 50, 100, 150, 200 y 250 μL/s. Los niveles de tensión de cizalla se calcularon utilizando la ecuación de Poiseuille ( 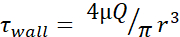 ), información disponible para el diámetro interior de cada medidor de aguja, así como la suposición de que μ = 0,01 dyn·s/cm2. Los niveles mínimos de FSS para cada tamaño se calcularon utilizando
), información disponible para el diámetro interior de cada medidor de aguja, así como la suposición de que μ = 0,01 dyn·s/cm2. Los niveles mínimos de FSS para cada tamaño se calcularon utilizando 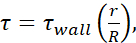 donde r es el radio de la celda y R es el radio de la aguja. Abreviatura: FSS = tensión de cizallado de fluidos; τ = cizalladura; τpared = cizalladura máxima; μ = viscosidad; Q = caudal volumétrico.
donde r es el radio de la celda y R es el radio de la aguja. Abreviatura: FSS = tensión de cizallado de fluidos; τ = cizalladura; τpared = cizalladura máxima; μ = viscosidad; Q = caudal volumétrico.
| Línea celular | Fuente de tejido | Especie | Viabilidad media (%) después de 10 pulsos |
| TRAMPC1 | Próstata | Ratón | 40 |
| 4T01 | Seno | Ratón | 32 |
| 4T7 | Seno | Ratón | 43 |
| 67NR | Seno | Ratón | 46 |
| 66CL4 | Seno | Ratón | 28 |
| RT4 | Vejiga | Humano | 62 |
| W17-266-4 | Melanoma | Humano | 46 |
| HS852 | Melanoma | Humano | 41 |
| HS695 | Melanoma | Humano | 41 |
| A2058 | Melanoma | Humano | 37 |
| A375 | Melanoma | Humano | 37 |
| RPMI-7951 | Melanoma | Humano | 35 |
| SKMEL2 | Melanoma | Humano | 29 |
| A101D | Melanoma | Humano | 28 |
| MiaPaCa | Pancreático | Humano | 7 |
Tabla 2: Resistencia al estrés por cizallado de fluidos de varias líneas celulares de cáncer. Cada línea celular de cáncer fue expuesta a la tensión de cizallamiento de líquido del modelo de jeringa y aguja (aguja de 30 G, 10 pulses@250 ml / s) (n ≥ 3 / línea celular), y la viabilidad se midió mediante la actividad de la luciferasa o la conversión de resazurin.
Discusión
Este artículo demuestra la aplicación de FSS a las células cancerosas en suspensión utilizando una jeringa y una aguja. Usando este modelo, se ha demostrado que las células cancerosas son más resistentes a pulsos breves de FSS de alto nivel en relación con las células epiteliales no transformadas15,22,24. Además, la exposición a FSS utilizando este modelo resulta en un rápido aumento de la rigidez celular, la activación de RhoA y el aumento de la F-actina cortical y la contractilidad basada en miosina II24,27. La rápida mecanoad adaptación (la capacidad de los CTC para volverse más o menos rígidos dependiendo de las circunstancias) puede prevenir la destrucción mecánica de los CTC y facilitar otros aspectos de la colonización metastásica24,28. De hecho, los hallazgos realizados utilizando este modelo in vitro se han confirmado utilizando CTC experimentales en modelos animales24. Esta rápida mecanoa adaptación probablemente explica la pérdida bifásica de viabilidad celular típicamente observada en este modelo(Figura 1),es decir, las células sin FSS son más susceptibles a la destrucción que las células que han estado expuestas incluso a un solo pulso de FSS. En conjunto, esto indica que FSS induce una rápida rigidez celular en las células cancerosas que las protege de los pulsos posteriores de FSS.
Aunque el eje RhoA-actomiosina es un importante impulsor de la resistencia FSS15,21,24,es probable que haya otros mecanismos involucrados29. Otra evidencia de que la rigidez celular es un determinante clave de la resistencia a FSS es que la interrupción de la lamina A, que controla la integridad estructural del núcleo, el componente más rígido de la célula, reduce la resistencia a FSS en células cancerosas utilizando este modelo22. Estamos utilizando este modelo para investigar más a fondo los mecanismos de resistencia a FSS en las células cancerosas. Aquí, este modelo se ha utilizado para medir la capacidad de varias líneas celulares de cáncer para resistir la destrucción mecánica al exponer las células a pulsos breves de altos niveles de FSS. Aunque se trata de un modelo relativamente económico y sencillo de desarrollar en el laboratorio, siendo el elemento más caro la bomba de jeringa, se debe tener cuidado de seguir fielmente el protocolo para obtener resultados reproducibles. Se pueden aplicar múltiples pulsos de FSS a las células en muy poco tiempo, <10 minutos. El tiempo total transcurrido para el experimento depende del volumen de suspensión, el caudal, el número de pulso y la destreza del usuario que transfiere la suspensión entre pulsos. Con experiencia, una suspensión de 5 ml expuesta a FSS con una aguja de 30 G durante 10 pulses@250 μL / s se puede procesar en ~ 10 min. Para la mayoría de las líneas celulares, hay una pérdida mínima de viabilidad debido a que se mantienen en suspensión durante este período de tiempo.
Debido a que la exposición a FSS ocurre relativamente rápido, FSS generalmente se aplica a suspensiones celulares en medio libre de suero para reducir la formación de espuma de las muestras. La diferencia de viscosidad entre el 0-10% del suero fetal bovino es insignificante en este ensayo. Sin embargo, es fundamental asegurar niveles fisiológicos de calcio en el medio en el que se cizallan las células. Además, con respecto a los métodos de disociación celular previos a la exposición a FSS, no se detectaron diferencias en la resistencia a FSS en suspensiones de células PC-3 preparadas por tripsinización o tratamiento con agentes de disociación no enzimática15. La concentración celular puede ser mayor o menor que 5 × 105 células/ml dependiendo de las necesidades de la aplicación posterior. La respuesta de las células de cáncer de próstata PC-3 es similar en un rango de 5 ×10 4 a 5 × 105,15. Sin embargo, los efectos de la concentración celular sobre la viabilidad después de la exposición a FSS deben determinarse empíricamente.
Para la mayoría de las aplicaciones previstas con células cultivadas, la densidad celular no debe afectar significativamente la viscosidad y, por lo tanto, la cantidad de FSS aplicada. Las variables, como el tiempo durante el cual las células se mantienen en suspensión antes de la exposición a FSS, deben mantenerse constantes en todas las réplicas experimentales. Como se mencionó anteriormente, la integridad de la aguja también es crítica. Se han observado variaciones de lotes en las agujas con respecto a este ensayo a lo largo del tiempo. Las agujas hipodérmicas fueron diseñadas para uso clínico, no para los caudales empleados aquí. En raras ocasiones, el cubo de la aguja puede estar parcialmente ocluido, lo que durante los pulsos posteriores, ocluye el paso de la suspensión a través de la aguja y, en última instancia, el reflujo alrededor del émbolo de la jeringa. Además, es muy importante entender que las células muertas / moribundas son excepcionalmente sensibles a FSS, como se mostró anteriormente24. Por lo tanto, si una línea celular en particular tiene un alto nivel de células moribundas, ya sea como una característica de rutina o manipulaciones experimentales (por ejemplo, tratamientos farmacológicos), esto resultará en una pérdida muy pronunciada de viabilidad celular que podría no estar completamente normalizada en comparación con el control estático.
La aplicación de FSS se puede combinar con otros ensayos, como inmunofluorescencia, ensayos pulldown y western blotting, para estudiar el efecto de FSS en la biología de células cancerosas 24. En principio, este modelo también podría usarse para explorar los efectos del FSS de alto nivel y corta duración en otros tipos de células, incluidas las células sanguíneas. Los glóbulos rojos normales y los leucocitos son mucho más resistentes al FSS aplicado de esta manera que incluso las células cancerosas, lo que es lógico fisiológicamente15. De hecho, el nivel de FSS aplicado, utilizando una aguja de 30 G 1/2" a un caudal de 250 mL/s, brackets el rango requerido para la interrupción de la membrana de los glóbulos rojos (basado en la aplicación de fuerza en milisegundos)30,31. Una limitación de este modelo, o cualquiera que implique pasar fluido a través de un conducto, es que no se conoce el nivel preciso de FSS que experimentan las células dentro del rango de la tensión de cizallamiento máxima de la pared y el mínimo en el centro del conducto. Por lo tanto, en cada pulso, todas las células no experimentan el mismo nivel de FSS, y sobre pulsos repetidos, se esperaría que las células individuales experimenten diferentes niveles de FSS en cada pulso dentro del rango especificado.
Sin embargo, el enfoque hidrodinámico en las condiciones empleadas en este modelo da como resultado que las células se dirijan hacia el centro del flujo, lejos de la pared y, por lo tanto, hacia una menor exposición a FSS32. Otros modelos, como los viscosímetros de cono y placa o las cámaras Couette, son más adecuados para la aplicación de FSS a niveles constantes a una suspensión celular. Como se mencionó anteriormente, sigue siendo un desafío modelar la exposición FSS de CTC in vitro. Este modelo es el más adecuado para probar los efectos de la exposición alta, pero breve, a FSS como podría suceder atravesando el corazón. El flujo a través de las arterias y venas resulta en una exposición más prolongada a niveles más bajos de FSS. Sin embargo, como se mencionó, no está claro cuánto tiempo permanecen los CTC en flujo continuo en la circulación, y la mayoría de la evidencia experimental hasta la fecha es consistente con períodos cortos (segundos) de flujo libre puntuados por períodos más largos de atrapamiento en la microcirculación.
Los modelos que exponen las células cancerosas en suspensión a niveles más bajos de FSS (0.5-60 dyn/cm2)durante períodos más largos (minutos a días) incluyen viscosímetros de cono y placa, cámaras de Couette, bucles de flujo continuo, jeringa con una extensión de tubo y dispositivos microfluídicos33,34,35,36,37. Estos también se han utilizado para obtener información sobre cómo FSS podría afectar a las CTC y han llevado a descubrir que la exposición a FSS aumenta el estrés oxidativo, la proliferación e invasión celular y las características similares a las células madre en varias líneas celulares de cáncer. Será interesante comparar los resultados derivados de esos modelos con el aquí descrito. Por ejemplo, utilizando un modelo de bucle de flujo continuo, Xin et al. encontraron que el eje ROCK-actomiosina promovió una pérdida de viabilidad celular en líneas celulares de cáncer expuestas a FSS (20 dyn/cm2) durante 2-12h en marcado contraste con los datos descritos anteriormente38. Por lo tanto, es muy probable que el contexto biológico sea importante para todos estos modelos in vitro, lo que refuerza la necesidad de traducir los hallazgos sobre los CTC en modelos in vivo y, en última instancia, en pacientes con cáncer.
Divulgaciones
MDH es cofundador, presidente y accionista de SynderBio, Inc. DLM es consultor de SynderBio, Inc.
Agradecimientos
El desarrollo del modelo demostrado aquí fue apoyado por la subvención del DOD W81XWH-12-1-0163, las subvenciones de los NIH R21 CA179981 y R21 CA196202, y el Fondo de Investigación de Metástasis Sato.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
Referencias
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031 (2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973 (2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126 (2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399 (1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649 (2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711 (2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073 (2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados