Method Article
Modélisation des effets du stress hémodynamique sur les cellules tumorales circulantes à l’aide d’une seringue et d’une aiguille
Dans cet article
Résumé
Ici, nous démontrons une méthode pour appliquer la contrainte de cisaillement des fluides aux cellules cancéreuses en suspension pour modéliser les effets du stress hémodynamique sur les cellules tumorales circulantes.
Résumé
Au cours des métastases, les cellules cancéreuses des tissus solides, y compris les épithéliums, accèdent à la circulation lymphatique et hématogène où elles sont exposées à un stress mécanique dû au flux hémodynamique. L’un de ces stress que subissent les cellules tumorales circulantes (CCC) est le stress de cisaillement des fluides (FSS). Alors que les cellules cancéreuses peuvent présenter de faibles niveaux de FSS dans la tumeur en raison du flux interstitiel, les CTC sont exposés, sans attachement à la matrice extracellulaire, à des niveaux beaucoup plus élevés de FSS. Physiologiquement, le FSS varie sur 3-4 ordres de grandeur, avec de faibles niveaux présents dans les lymphatiques (<1 dyne/cm2) et les niveaux les plus élevés présents brièvement lorsque les cellules traversent le cœur et autour des valves cardiaques (>500 dynes/cm2). Il existe quelques modèles in vitro conçus pour modéliser différentes gammes de contraintes physiologiques de cisaillement sur différentes périodes. Cet article décrit un modèle pour étudier les conséquences de brèves impulsions (millisecondes) de FSS de haut niveau sur la biologie des cellules cancéreuses à l’aide d’un simple système de seringue et d’aiguille.
Introduction
Les métastases, ou la propagation du cancer au-delà du site tumoral initial, sont un facteur majeur sous-jacent à la mortalité par cancer1. Au cours des métastases, les cellules cancéreuses utilisent le système circulatoire comme une autoroute pour se dissémer vers des sites éloignés dans tout le corps2,3. En route vers ces sites, les cellules tumorales circulantes (CCC) existent au sein d’un microenvironnement fluide dynamique contrairement à celui de leur tumeur primaire d’origine3,4,5. Il a été proposé que ce microenvironnement fluide soit l’un des nombreux obstacles aux métastases4. Il existe un large consensus dans le concept d’inefficacité métastatique, c’est-à-dire que la plupart des CTCC entrant dans la circulation périssent ou ne forment pas de colonies métastatiques productives6,7,8. Cependant, la raison pour laquelle les métastases sont inefficaces du point de vue d’un CCT individuel est moins certaine et demeure un domaine d’investigation actif. Les CTCC sont détachés de la matrice extracellulaire, privés de facteurs solubles de croissance et de survie qui peuvent être présents dans la tumeur primaire, et exposés au système immunitaire et aux forces hémodynamiques d’une manière très différente de celle de la tumeur primaire4. Chacun de ces facteurs peut contribuer à la faible survie des CTCC, mais leurs contributions relatives ne sont pas claires. Cet article aborde la question de savoir comment les forces hémodynamiques affectent les CTCC.
L’étude des effets des forces hémodynamiques sur les CTCC est assez difficile. Actuellement, il n’existe aucun système in vitro conçu capable de reproduire l’ensemble de la dynamique spatio-temporelle (du cœur aux capillaires) et des propriétés rhéologiques du système vasculaire humain. De plus, la façon dont les CTCC vivent le système circulatoire n’est pas tout à fait claire. Les preuves expérimentales indiquent que la plupart des cellules cancéreuses ne circulent pas continuellement comme les cellules sanguines. Au contraire, en raison de leur taille relativement grande (10-20 μm de diamètre), la plupart des CCC sont piégés dans des lits capillaires (6-8 μm de diamètre) pendant des durées variables (s à jours) où ils peuvent mourir, extravaser ou être déplacés vers le lit capillaire suivant8,9,10,11. Cependant, il existe des preuves que la taille du CTC peut être plus hétérogène in vivo et que les CTC plus petits sont détectables12. Par conséquent, sur la base de la distance et de la vitesse du flux sanguin, les CTCC ne peuvent circuler librement que pendant quelques secondes entre ces périodes de piégeage, bien qu’il manque une description quantitative de ce comportement13.
De plus, selon l’endroit où les CCC pénètrent dans la circulation, ils peuvent traverser plusieurs lits capillaires dans le poumon et d’autres sites périphériques et à travers le cœur droit et gauche avant d’atteindre leur destination finale. En cours de route, les CTCC sont exposés à diverses contraintes hémodynamiques, y compris la contrainte de cisaillement des fluides (FSS), les forces de compression lors de leur piégeage dans la microcirculation et, potentiellement, les forces de traction dans des circonstances où ils pourraient présenter un roulement semblable à celui d’un leucocyte le long des parois des vaisseaux sanguins14. Ainsi, la capacité de modéliser la circulation et la compréhension du comportement CTC à modéliser sont limitées. En raison de cette incertitude, tout résultat de systèmes modèles in vitro doit être validé dans un organisme vertébré expérimental et, en fin de compte, chez des patients atteints de cancer.
Avec les mises en garde susmentionnées, cet article démontre un modèle relativement simple pour appliquer le FSS aux cellules en suspension afin de sonder les effets du FSS sur les CTC décrits pour la première fois en 201215. FSS résulte du frottement du flux sanguin contre la paroi des vaisseaux, ce qui produit un gradient de vitesse parabolique dans des conditions d’écoulement laminaire dans les plus gros vaisseaux. Les cellules éprouvent des niveaux plus élevés de FSS près des parois des vaisseaux et des niveaux plus bas près du centre du vaisseau sanguin. La viscosité du fluide, le débit et les dimensions du conduit à travers lequel l’écoulement se produit influencent FSS, comme décrit par l’équation de Hagen-Poiseuille. Cela s’applique aux flux sanguins se comportant comme des fluides newtoniens, mais ne tient pas pour la microcirculation. Le FSS physiologique varie sur plusieurs ordres de grandeur avec les niveaux les plus bas dans les lymphatiques (<1 dyn/cm 2 ) et les plus élevés dans les régionsautourdes valves cardiaques et des plaques d’athérosclérose (>500 dyn/cm2)5. Le stress moyen de cisaillement de la paroi dans les artères est de 10-70 dyn/cm2 et de 1-6 dyn/cm2 dans les veines16,17.
Dans le cœur, les cellules peuvent être exposées à des écoulements turbulents autour des folioles valvulaires où un niveau très élevé, mais de très courte durée FSS peut être expérimenté18,19. Bien que le domaine du biotraitement ait longtemps étudié les effets du FSS sur les cellules de mammifères en suspension, cette information peut être d’une valeur limitée pour comprendre les effets du FSS sur les CTCC car elle se concentre généralement sur des niveaux beaucoup plus faibles de FSS appliqués sur une longue durée20. Comme décrit ci-dessous, à l’aide d’une seringue et d’une aiguille, on peut appliquer un FSS relativement élevé (des dizaines à des milliers dedyn/cm2)pendant une durée relativement courte (millisecondes) sur une suspension cellulaire. Depuis la description initiale de ce modèle15,d’autres l’ont utilisé pour étudier les effets du FSS sur les cellules cancéreuses21,22,23. De multiples « impulsions » de FSS peuvent être appliquées à des suspensions cellulaires en peu de temps pour faciliter les analyses expérimentales en aval. Par exemple, ce modèle peut être utilisé pour mesurer la capacité des cellules à résister à la destruction mécanique par FSS en mesurant la viabilité des cellules en fonction du nombre d’impulsions appliquées. Alternativement, les effets de l’exposition au FSS sur la biologie des cellules cancéreuses peuvent être explorés en collectant des cellules pour une variété d’analyses en aval. Il est important de savoir qu’une partie de la suspension cellulaire est réservée en tant que contrôle statique pour comparer les effets du FSS de ceux qui pourraient être associés au détachement cellulaire et au temps passé en suspension.
Protocole
1. Préparation des cellules
- Libérez les cellules de la boîte de culture tissulaire lorsqu’elles sont confluentes à 70 à 90 % en suivant les directives recommandées pour la lignée cellulaire utilisée.
- Par exemple, aspirez le milieu de croissance des cellules PC-3 et lavez le plat de 10 cm de cellules avec 5 mL de solution saline tamponnée au phosphate (PBS) sans calcium et magnésium.
- Aspirer le PBS avant d’ajouter 1 mL de trypsine à 0,25 % en utilisant le protocole du fabricant.
- Après avoir observé le détachement des cellules au microscope inversé, ajouter 5 mL de milieu DMEM:F12 contenant 10% de sérum bovin fœtal pour inhiber la trypsine.
- Placez la suspension cellulaire dans un tube conique.
- Déterminez la concentration et le nombre total de cellules.
- Les cellules granulées par centrifugation (300 × g pendant 3 min), aspirent le surnageant et ressuspendent les cellules dans un milieu de culture tissulaire sans sérum jusqu’à 5 × 105 cellules/mL.
REMARQUE: Il est essentiel que le milieu d’essai contienne au moins 1,17 mM de Ca++, car il a été démontré que le Ca++ extracellulaire est nécessaire pour la résistance cellulaire à FSS15.
2. Exposition aux contraintes de cisaillement des fluides
- Avant d’exposer les cellules au FSS, coupez un tube de polystyrène à fond rond de 14 mL à la ligne de 7 mL. Mélanger la suspension cellulaire, placer 5 mL de la suspension dans le tube coupé et prélever des échantillons de contrôle statique.
REMARQUE : Le volume nécessaire au prélèvement de l’échantillon statique dépend du test de viabilité utilisé (voir l’étape 3). - Aspirez la suspension cellulaire dans une seringue de 5 mL et fixez une aiguille de 30 G 1/2 po. Décapsulez l’aiguille, placez la seringue sur une pompe à seringue, fixez la seringue et réglez le débit pour atteindre le niveau souhaité de FSS.
REMARQUE : Le tableau 1 indique la contrainte maximale de cisaillement de la paroi pour différentes aiguilles et débits, ainsi que le niveau minimum de FSS en fonction de la taille de la cellule (10, 15 et 20 μm). Inspecter l’aiguille avant de l’utiliser pour s’assurer qu’elle n’est pas pliée; en cas d’incertitude, remplacez l’aiguille par une nouvelle. L’intégrité de l’aiguille peut avoir un impact significatif sur le niveau de FSS appliqué. - Faites fonctionner la pompe à seringue et prélever l’échantillon cisaillé dans le tube coupé à un angle d’environ 45 ° pour réduire la mousse. Prélever un échantillon en fonction du type d’essai de viabilité ou des besoins en aval.
- Retirez soigneusement la seringue et l’aiguille de la pompe à seringue et utilisez une pince pour retirer l’aiguille de la seringue, en prenant soin de ne pas toucher l’aiguille.
REMARQUE: Les aiguilles non biseautées peuvent être utilisées de manière interchangeable avec les aiguilles biseautées comme mesure de sécurité supplémentaire.
- Retirez soigneusement la seringue et l’aiguille de la pompe à seringue et utilisez une pince pour retirer l’aiguille de la seringue, en prenant soin de ne pas toucher l’aiguille.
- Retirez la suspension cisaillée dans la seringue, refixez soigneusement l’aiguille à l’aide d’une pince et replacez-la dans la pompe à seringue.
- Répétez les étapes 2.3 et 2.4 jusqu’à ce que la suspension cellulaire ait été exposée au nombre souhaité d’impulsions de FSS.
REMARQUE: Pour évaluer la capacité des cellules à résister à la destruction mécanique de l’exposition au FSS, la suspension cellulaire est généralement soumise à 10 impulsions de FSS. Cependant, il a été démontré que les cellules commencent à subir des adaptations biologiques en réponse au FSS après 2 impulsions24.
3. Mesure de la viabilité
REMARQUE: La viabilité peut être évaluée à l’aide de tests enzymatiques (luciférase, résazurine et WST-1), en comptant les cellules intactes, en cytométrie en flux ou par des tests clonogènes.
- Pour toutes les mesures de viabilité, prélever un échantillon avant d’exposer les cellules au FSS.
- Pour les essais enzymatiques, prenez des aliquotes de 100 μL en double et placez-les dans une plaque de 96 puits.
- Pour la cytométrie en flux, prenez une aliquote de 500 μL et placez-la dans un tube de 1,5 mL.
- Pour le dosage clonogène, prélever une aliquote de 100 μL.
- Essai enzymatique
- Prélever des échantillons de 100 μL après 1, 2, 4, 6, 8 et 10 impulsions d’exposition au FSS et les placer dans une plaque de 96 puits.
- Ajoutez le substrat souhaité et suivez le protocole pour le test utilisé:
- Pour la résazurine, ajouter 20 μL d’une solution de 0,15 mg/mL à chaque puits. Ajouter 20 μL de solution de résazurine à 0,15 mg/mL aux puits contenant 100 μL de milieu seul. Incuber pendant 2 h dans un incubateur de culture tissulaire à 37 °C. Mesurer l’absorbance à l’aide d’un lecteur de plaques capable de lire la fluorescence (579 excitation/ 584 émission).
- Pour les cellules exprimant la luciférase, ajouter 100 μL de 15 mg/mL de D-luciférine à 5 mL de milieu. Ajouter 100 μL de cette solution à chaque puits contenant des cellules. Attendez 5 min, puis lisez la plaque à l’aide d’un lecteur compatible avec la luminescence.
- Pour WST-1, ajouter 10 μL de WST-1 à chaque puits, y compris les puits contenant uniquement du milieu. Incuber pendant 4 h, puis lire l’absorbance entre 420 et 480 nm à l’aide d’un lecteur de plaques.
- Comparez le signal moyenné de chacun des échantillons exposés au FSS à l’échantillon de contrôle statique moyenné pour obtenir le pourcentage de cellules viables.
- Cytométrie en flux24
- Prélever des échantillons de 500 μL et les placer dans des tubes centrifuges de 1,5 mL après 1, 2, 5 et 10 impulsions de FSS.
- Centrifuger les échantillons (500 × g pendant 3 min) et jeter les surnageants.
- Resuspendez les granulés avec 1 mL de PBS sans calcium et magnésium et centrifugez les échantillons (300 × g pendant 3 min).
- Suspendre les granulés avec 500 μL de tampon de tri cellulaire activé par fluorescence (FACS) (PBS avec 0,5% d’albumine sérique bovine et 0,1% d’azide de sodium) avec des billes de comptage et des colorants imperméables à la membrane ou viables tels que l’iodure de propidium (1,75 μg / mL).
- Déterminer la viabilité en comparant le rapport entre les cellules viables, normalisées pour compter les billes, dans les échantillons cisaillés et celui de l’échantillon statique.
- Essai clonogénique
- Prendre 100 μL de l’échantillon statique et ajouter 900 μL de milieu de croissance pour faire une dilution de 1:10.
- Prendre 100 μL de l’échantillon dilué 1:10 et ajouter 900 μL de milieu de croissance pour faire une dilution finale de 1:100.
- Ajouter 100 μL de l’échantillon de dilution 1:100 dans chacun des 3 puits d’une boîte de 6 puits contenant 2 mL de milieu de croissance.
- Répétez les étapes 3.4.1 à 3.4.3 avec des échantillons qui ont été soumis à 10 impulsions de FSS.
- Laissez les cellules se développer pendant 7 à 10 jours sans changer le milieu et vérifiez la formation de colonies. Une fois que des colonies de cellules ≥50 se sont formées, aspirez le milieu de croissance, rincez chaque puits avec 1 mL de PBS, aspirez le PBS et fixez pendant 5 minutes à l’aide de 1 mL d’éthanol glacé à 70% (EtOH). Il est important de fixer les échantillons cisaillés et statiques en même temps.
- Après avoir fixé les échantillons, aspirer l’EtOH et ajouter 1 à 2 mL de solution de violet cristallin (0,1% de violet cristallin dans 90% H2O, 10% EtOH) pendant 5 min.
- Rincer avec un excès d’eau et laisser sécher la plaque
- Comptez les colonies (grappes de ≥50 cellules) pour les échantillons statiques et cisaillés. Comparez le rapport entre le nombre moyen de colonies de l’échantillon cisaillé et le nombre moyen de colonies de l’échantillon statique pour déterminer la viabilité.
Résultats
Une résistance élevée à la destruction mécanique induite par le FSS s’est déjà avérée être un phénotype conservé dans plusieurs lignées cellulaires cancéreuses et cellules cancéreuses fraîchement isolées de tumeurs par rapport aux comparateurs de cellules épithéliales non transformées15,24. Ici, d’autres lignées cellulaires cancéreuses provenant de diverses origines tissulaires(tableau 2)ont été testées pour démontrer que la majorité de ces cellules présentent une viabilité ≥ 20 % après 10 impulsions de FSS à 250 μL/s. La seule exception concerne les cellules MiaPaCa2, qui étaient relativement sensibles à la destruction mécanique par FSS (viabilité ≤ 10%). Pour décrire adéquatement le profil de résistance FSS d’une lignée cellulaire, n ≥ 3 répliques biologiques sont recommandées.
A titre de comparaison, toutes les cellules épithéliales non transformées examinées ont une viabilité < 10% dans ces conditions15,24. Ainsi, bien qu’il y ait une gamme de résistance au FSS observée, la majorité des lignées cellulaires cancéreuses testées présentent une plus grande résistance au FSS que les cellules non transformées. Les lignées cellulaires cancéreuses peuvent être dérivées à la fois de tissus tumoraux primaires et de métastases. On pourrait postuler que les cellules dérivées de métastases peuvent présenter une plus grande résistance au FSS car ce phénotype peut avoir été sélectionné lors de la dissémination métastatique. Cependant, il a été démontré que le niveau de résistance FSS ne dépendait pas du fait que les cellules étaient dérivées de tumeurs primaires ou de métastases15,24. De plus, les niveaux de résistance au FSS n’étaient pas corrélés avec le potentiel métastatique dans une série de lignées cellulaires de cancer de la prostate humaine15.
Pour tester cela plus avant, des cellules épithéliales mammaires BALB/c avec un potentiel métastatique variable (4T1 = hautement métastatique, 4T07 = potentiel métastatique faible à modéré, 67NR = potentiel métastatique nul à faible25,26) ont été utilisées. Cette expérience a révélé que la résistance au FSS n’est pas corrélée au potentiel métastatique(Figure 1). De plus, les cellules 4T1 et 4T07 présentent une perte biphasique de viabilité cellulaire - une perte de viabilité plus importante dans les impulsions 1 à 2 que dans les impulsions suivantes. Ceci est typique de la plupart des lignées cellulaires cancéreuses étudiées par ce groupe. En revanche, le 67NR présente une perte plus linéaire de viabilité cellulaire en fonction du FSS. Collectivement, les données du tableau 2 et de la figure 1 démontrent que la résistance au FSS est une propriété des cellules transformées.
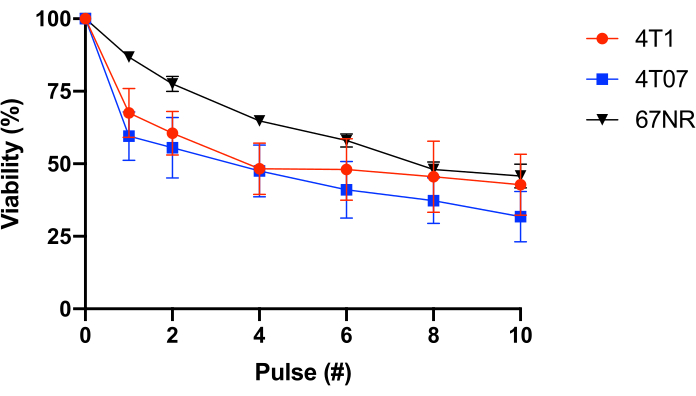
Figure 1: Résistance au stress de cisaillement des cellules cancéreuses épithéliales mammaires BALB/c syngéniques. Les cellules ont été exposées au FSS (aiguille de 30 G, 10 pulses@250 mL/s), et la viabilité a été mesurée à l’aide de la conversion de la résazurine (n = 4/lignée cellulaire). Bien que l’exposition au FSS ait réduit le nombre de cellules viables (p < 0,0001, ANOVA à 2 voies) et que chaque lignée cellulaire présentait des profils de résistance différents (p = 0,0446, ANOVA à 2 voies), il n’y avait pas de différence significative entre les lignées cellulaires après 10 impulsions d’exposition au FSS (p = 0,2833, ANOVA à 2 voies). Abréviations : FSS = contrainte de cisaillement du fluide; ANOVA = analyse de la variance. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Cisaillement (τ): | mur (maximum) | minimum | |||||||||||
| Diamètre de la cellule: | N/A | 10 μm | 15 μm | 20 μm | |||||||||
| Jauge d’aiguille: | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | 30 | 27 | 25 | |
| Débit (μL/s) | 20 | 507 | 220 | 116 | 32 | 10 | 4 | 48 | 16 | 7 | 64 | 21 | 9 |
| 50 | 1267 | 550 | 290 | 80 | 26 | 11 | 120 | 39 | 17 | 159 | 52 | 22 | |
| 100 | 2534 | 1100 | 580 | 159 | 52 | 22 | 239 | 79 | 33 | 319 | 105 | 45 | |
| 150 | 3801 | 1650 | 869 | 239 | 79 | 33 | 359 | 118 | 50 | 478 | 157 | 67 | |
| 200 | 5068 | 2200 | 1159 | 319 | 105 | 45 | 478 | 157 | 67 | 637 | 210 | 89 | |
| 250 | 6335 | 2750 | 1449 | 398 | 131 | 56 | 598 | 196 | 84 | 797 | 262 | 111 | |
Tableau 1: Niveaux maximaux de contrainte de cisaillement (paroi τ). Le tableau répertorie les niveaux FSS muraux maximaux en dyn/cm2 pour les aiguilles de 30 G, 27 G et 25 G aux débits de 20, 50, 100, 150, 200 et 250 μL/s. Les niveaux de contrainte de cisaillement ont été calculés à l’aide de l’équation de Poiseuille ( 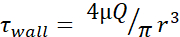 ), des informations disponibles pour le diamètre intérieur de chaque jauge d’aiguille, ainsi que de l’hypothèse selon laquelle μ = 0,01 dyn·s/cm2. Les niveaux minimaux de FSS pour chaque taille ont été calculés en utilisant
), des informations disponibles pour le diamètre intérieur de chaque jauge d’aiguille, ainsi que de l’hypothèse selon laquelle μ = 0,01 dyn·s/cm2. Les niveaux minimaux de FSS pour chaque taille ont été calculés en utilisant 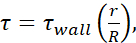 r est le rayon de la cellule et R est le rayon de l’aiguille. Abréviation : FSS = contrainte de cisaillement du fluide; τ = cisaillement; paroi τ = cisaillement maximal; μ = viscosité; Q = débit volumétrique.
r est le rayon de la cellule et R est le rayon de l’aiguille. Abréviation : FSS = contrainte de cisaillement du fluide; τ = cisaillement; paroi τ = cisaillement maximal; μ = viscosité; Q = débit volumétrique.
| Lignée cellulaire | Source tissulaire | Espèce | Viabilité moyenne (%) après 10 impulsions |
| TRAMPC1 | Prostate | Souris | 40 |
| 4T01 | Sein | Souris | 32 |
| 4T7 | Sein | Souris | 43 |
| 67NR | Sein | Souris | 46 |
| 66CL4 | Sein | Souris | 28 |
| RT4 | Vessie | Humain | 62 |
| W17-266-4 | Mélanome | Humain | 46 |
| HS852 | Mélanome | Humain | 41 |
| HS695 | Mélanome | Humain | 41 |
| A2058 | Mélanome | Humain | 37 |
| A375 | Mélanome | Humain | 37 |
| RPMI-7951 | Mélanome | Humain | 35 |
| SKMEL2 | Mélanome | Humain | 29 |
| A101D | Mélanome | Humain | 28 |
| MiaPaCa | Pancréatique | Humain | 7 |
Tableau 2 : Résistance au stress de cisaillement des fluides de diverses lignées cellulaires cancéreuses. Chaque lignée cellulaire cancéreuse a été exposée à une contrainte de cisaillement du liquide provenant du modèle de seringue et d’aiguille (aiguille de 30 G, 10 pulses@250 mL/s) (n ≥ 3/lignée cellulaire), et la viabilité a été mesurée soit par l’activité de la luciférase, soit par conversion de la résazurine.
Discussion
Cet article démontre l’application du FSS aux cellules cancéreuses en suspension à l’aide d’une seringue et d’une aiguille. En utilisant ce modèle, il a été démontré que les cellules cancéreuses sont plus résistantes aux brèves impulsions de FSS de haut niveau par rapport aux cellules épithéliales non transformées15,22,24. De plus, l’exposition au FSS à l’aide de ce modèle entraîne une augmentation rapide de la rigidité cellulaire, l’activation du RhoA et une augmentation de la contractilité corticale à base de F-actine et de myosine II24,27. Une mécano-adaptation rapide (la capacité des CTC à devenir plus ou moins rigides selon les circonstances) peut prévenir la destruction mécanique des CTC et faciliter d’autres aspects de la colonisation métastatique24,28. En effet, les résultats réalisés à l’aide de ce modèle in vitro ont été confirmés à l’aide de CTC expérimentaux dans des modèles animaux24. Cette mécano-adaptation rapide explique probablement la perte biphasique de la viabilité cellulaire généralement observée dans ce modèle(Figure 1),c’est-à-dire que les cellules naïves de FSS sont plus susceptibles d’être détruites que les cellules qui ont été exposées à une seule impulsion de FSS. Pris ensemble, cela indique que le FSS induit un raidissement cellulaire rapide dans les cellules cancéreuses qui les protège des impulsions ultérieures du FSS.
Bien que l’axe RhoA-actomyosine soit un facteur important de la résistance FSS15,21,24, il existe probablement d’autres mécanismes impliqués29. Une autre preuve que la rigidité cellulaire est un déterminant clé de la résistance FSS est que la perturbation de la lamine A, qui contrôle l’intégrité structurelle du noyau - le composant le plus rigide de la cellule, réduit la résistance FSS dans les cellules cancéreuses en utilisant ce modèle22. Nous utilisons ce modèle pour sonder davantage les mécanismes de résistance au FSS dans les cellules cancéreuses. Ici, ce modèle a été utilisé pour mesurer la capacité de diverses lignées cellulaires cancéreuses à résister à la destruction mécanique en exposant les cellules à de brèves impulsions de niveaux élevés de FSS. Bien qu’il s’agisse d’un modèle relativement peu coûteux et simple à développer en laboratoire, l’élément le plus coûteux étant la pompe à seringue, il faut veiller à suivre fidèlement le protocole pour obtenir des résultats reproductibles. Plusieurs impulsions de FSS peuvent être appliquées aux cellules en très peu de temps, <10min. Le temps total écoulé pour l’expérience dépend du volume de suspension, du débit, du nombre d’impulsions et de la dextérité de l’utilisateur transférant la suspension entre les impulsions. Avec l’expérience, une suspension de 5 mL exposée au FSS avec une aiguille de 30 G pendant 10 pulses@250 μL / s peut être traitée en ~ 10 min. Pour la plupart des lignées cellulaires, il y a une perte minimale de viabilité en raison du fait d’être maintenu en suspension pendant cette durée.
Étant donné que l’exposition au FSS se produit relativement rapidement, le FSS est généralement appliqué sur des suspensions cellulaires dans un milieu sans sérum pour réduire la formation de mousse des échantillons. La différence de viscosité entre 0-10% de sérum bovin fœtal est négligeable dans ce dosage. Cependant, il est essentiel d’assurer des niveaux physiologiques de calcium dans le milieu dans lequel les cellules sont cisaillées. De plus, en ce qui concerne les méthodes de dissociation cellulaire avant l’exposition au FSS, aucune différence de résistance au FSS n’a été détectée dans les suspensions de cellules PC-3 préparées par trypsinisation ou traitement avec des agents de dissociation non enzymatiques15. La concentration cellulaire peut être supérieure ou inférieure à 5 × 105 cellules/mL selon les besoins de l’application en aval. La réponse des cellules cancéreuses de la prostate PC-3 est similaire dans une plage allant de 5 ×10 4 à 5 × 105,15. Cependant, les effets de la concentration cellulaire sur la viabilité après une exposition au FSS doivent être déterminés empiriquement.
Pour la plupart des applications envisagées avec des cellules cultivées, la densité cellulaire ne devrait pas affecter de manière significative la viscosité et, par conséquent, la quantité de FSS appliquée. Les variables, telles que la durée pendant laquelle les cellules sont maintenues en suspension avant l’exposition au FSS, doivent être maintenues constantes dans tous les répliqués expérimentaux. Comme mentionné ci-dessus, l’intégrité de l’aiguille est également essentielle. Des variations de lot ont été observées dans les aiguilles en ce qui concerne ce test au fil du temps. Les aiguilles hypodermiques ont été conçues pour un usage clinique, et non pour les débits utilisés ici. En de rares occasions, le moyeu de l’aiguille peut être partiellement obstrué, ce qui, lors des impulsions suivantes, obstrue le passage de la suspension à travers l’aiguille et, finalement, le reflux autour du piston de la seringue. De plus, il est très important de comprendre que les cellules mortes/mourantes sont exceptionnellement sensibles au FSS, comme indiqué précédemment24. Par conséquent, si une lignée cellulaire particulière a un niveau élevé de cellules mourantes, que ce soit en tant que caractéristique de routine ou en tant que manipulation expérimentale (par exemple, des traitements médicamenteux), cela entraînera une perte très importante de viabilité cellulaire qui pourrait ne pas être complètement normalisée par rapport au contrôle statique.
L’application du FSS peut être associée à d’autres tests, tels que l’immunofluorescence, les tests de traction et le transfert western, pour étudier l’effet du FSS sur la biologie des cellules cancéreuses 24. En principe, ce modèle pourrait également être utilisé pour explorer les effets d’un FSS de haut niveau et de courte durée sur d’autres types de cellules, y compris les cellules sanguines. Les globules rouges normaux et les leucocytes sont beaucoup plus résistants au FSS appliqué de cette manière que même les cellules cancéreuses, ce qui va de soi physiologiquement15. En fait, le niveau de FSS appliqué, à l’aide d’une aiguille de 30 G 1/2 » à un débit de 250 mL/s, supporte la plage requise pour la perturbation de la membrane des globules rouges (sur la base de l’application milliseconde de force)30,31. L’une des limites de ce modèle, ou de toute limitation qui implique le passage de fluide à travers un conduit, est que le niveau précis de FSS que les cellules subissent dans la plage allant de la contrainte de cisaillement maximale de la paroi au minimum au centre du conduit n’est pas connu. Ainsi, à chaque impulsion, toutes les cellules ne connaissent pas le même niveau de FSS, et sur des impulsions répétées, on s’attendrait à ce que les cellules individuelles connaissent différents niveaux de FSS à chaque impulsion dans la plage spécifiée.
Cependant, la focalisation hydrodynamique dans les conditions utilisées dans ce modèle entraîne une orientation des cellules vers le centre de l’écoulement, loin de la paroi, et donc vers une exposition FSS plus faible32. D’autres modèles, tels que les viscosimètres à cônes et à plaques ou les chambres Couette, sont mieux adaptés à l’application de FSS à des niveaux constants sur une suspension cellulaire. Comme mentionné ci-dessus, il reste difficile de modéliser l’exposition FSS des CTCC in vitro. Ce modèle est le mieux adapté pour tester les effets d’une exposition élevée, mais brève, au FSS comme cela pourrait se produire en traversant le cœur. L’écoulement dans les artères et les veines entraîne une exposition plus longue à des niveaux plus faibles de FSS. Cependant, comme nous l’avons mentionné, on ne sait pas combien de temps les CCC restent en flux continu dans la circulation, et la plupart des preuves expérimentales à ce jour sont compatibles avec de courtes périodes (secondes) de libre écoulement ponctuées de périodes plus longues de piégeage dans la microcirculation.
Les modèles qui exposent les cellules cancéreuses en suspension à des niveaux inférieurs de FSS (0,5-60 dyn / cm2) pour des durées plus longues (minutes à jours) comprennent les viscosimètres à cône et à plaque, les chambres à couette, les boucles à flux continu, la seringue avec une extension de tube et les dispositifs microfluidiques33,34,35,36,37. Ceux-ci ont également été utilisés pour mieux comprendre comment le FSS pourrait affecter les CTCC et ont conduit à la découverte que l’exposition au FSS augmente le stress oxydatif, la prolifération et l’invasion cellulaires, et les caractéristiques semblables à celles des cellules souches dans diverses lignées cellulaires cancéreuses. Il sera intéressant de comparer les résultats dérivés de ces modèles avec ceux décrits ici. Par exemple, en utilisant un modèle de boucle d’écoulement continu, Xin et al. ont constaté que l’axe ROCK-actomyosine favorisait une perte de viabilité cellulaire dans les lignées cellulaires cancéreuses exposées au FSS (20 dyn/cm2) pendant 2 à 12h, ce qui contraste fortement avec les données décrites ci-dessus38. Ainsi, le contexte biologique est très susceptible d’avoir de l’importance pour tous ces modèles in vitro, ce qui renforce la nécessité de traduire les résultats sur les CTC en modèles in vivo et, en fin de compte, en patients atteints de cancer.
Déclarations de divulgation
MDH est co-fondateur, président et actionnaire de SynderBio, Inc. DLM est consultant pour SynderBio, Inc.
Remerciements
Le développement du modèle démontré ici a été soutenu par la subvention W81XWH-12-1-0163 du DOD, les subventions R21 CA179981 et R21 CA196202 des NIH et le Sato Metastasis Research Fund.
matériels
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 14 mL round bottom tubes | Falcon - Corning | 352059 | |
| 30 G 1/2" Needle | BD | 305106 | |
| 5 mL syringe | BD | 309646 | |
| 96-well black bottom plate | Costar - Corning | 3915 | |
| Bioluminescence detector | AMI | AMI HTX | |
| BSA, Fraction V | Sigma | 10735086001 | |
| Cell Titer Blue | Promega | G8081 | |
| crystal violet | Sigma | C0775 | |
| D-luciferin | GoldBio | D-LUCK | |
| DMEM | Gibco | 11965-092 | |
| FBS | Atlanta Biologicals | S11150 | |
| PBS | Gibco | 10010023 | |
| Plate Reader | BioTek | Synergy HT | |
| Sodium Azide (NaN3) | Sigma | S2002 | |
| Syringe Pump | Harvard Apparatus | 70-3005 |
Références
- Dillekås, H., Rogers, M. S., Straume, O. Are 90% of deaths from cancer caused by metastases. Cancer medicine. 8 (12), 5574-5576 (2019).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Strilic, B., Offermanns, S. Intravascular survival and extravasation of tumor cells. Cancer Cell. 32 (3), 282-293 (2017).
- Labelle, M., Hynes, R. O. The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discovery. 2 (12), 1091-1099 (2012).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Weiss, L. Metastatic inefficiency. Advances in Cancer Research. 54, 159-211 (1990).
- Zeidman, I., Mc, C. M., Coman, D. R. Factors affecting the number of tumor metastases; experiments with a transplantable mouse tumor. Cancer Research. 10 (6), 357-359 (1950).
- Fidler, I. J. Metastasis: quantitative analysis of distribution and fate of tumor embolilabeled with 125 I-5-iodo-2'-deoxyuridine. Journal of the National Cancer Institute. 45 (4), 773-782 (1970).
- Cameron, M. D., et al. Temporal progression of metastasis in lung: cell survival, dormancy, and location dependence of metastatic inefficiency. Cancer Research. 60 (9), 2541-2546 (2000).
- Luzzi, K. J., et al. Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. American Journal of Pathology. 153 (3), 865-873 (1998).
- Kienast, Y., et al. Real-time imaging reveals the single steps of brain metastasis formation. Nature Medicine. 16 (1), 116-122 (2010).
- Takagi, H., et al. Analysis of the circulating tumor cell capture ability of a slit filter-based method in comparison to a selection-free method in multiple cancer types. International journal of molecular sciences. 21 (23), 9031(2020).
- Scott, J., Kuhn, P., Anderson, A. R. Unifying metastasis--integrating intravasation, circulation and end-organ colonization. Nature Reviews Cancer. 12 (7), 445-446 (2012).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Barnes, J. M., Nauseef, J. T., Henry, M. D. Resistance to fluid shear stress is a conserved biophysical property of malignant cells. PLoS One. 7 (12), 50973(2012).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. JAMA. 282 (21), 2035-2042 (1999).
- Brass, L. F., Diamond, S. L. Transport physics and biorheology in the setting of hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 14 (5), 906-917 (2016).
- Stein, P. D., Sabbah, H. N. Turbulent blood flow in the ascending aorta of humans with normal and diseased aortic valves. Circulation Research. 39 (1), 58-65 (1976).
- Strony, J., Beaudoin, A., Brands, D., Adelman, B. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis. The American Journal of Physiology. 265 (5), Pt 2 1787-1796 (1993).
- Chalmers, J. J. Mixing, aeration and cell damage, 30+ years later: what we learned, how it affected the cell culture industry and what we would like to know more about. Current Opinion in Chemical Engineering. 10, 94-102 (2015).
- Vennin, C., et al. Trsient tissue priming via ROCK inhibition uncouples pancreatic cancer progression, sensitivity to chemotherapy, and metastasis. Science Translational Medicine. 9 (384), 126(2017).
- Mitchell, M. J., et al. Lamin A/C deficiency reduces circulating tumor cell resistance to fluid shear stress. American Journal of Physiology: Cell Physiology. 309 (11), 736-746 (2015).
- Ortiz-Otero, N., et al. Cancer associated fibroblasts confer shear resistance to circulating tumor cells during prostate cancer metastatic progression. Oncotarget. 11 (12), 1037-1050 (2020).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Miller, B. E., Miller, F. R., Wilburn, D. J., Heppner, G. H. Analysis of tumour cell composition in tumours composed of paired mixtures of mammary tumour cell lines. British Journal of Cancer. 56 (5), 561-569 (1987).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Research. 52 (6), 1399(1992).
- Chivukula, V. K., Krog, B. L., Nauseef, J. T., Henry, M. D., Vigmostad, S. C. Alterations in cancer cell mechanical properties after fluid shear stress exposure: a micropipette aspiration study. Cell Health Cytoskeleton. 7, 25-35 (2015).
- Gensbittel, V., et al. Mechanical adaptability of tumor cells in metastasis. Developmental Cell. 56 (2), 164-179 (2021).
- O'Leary, B. R., et al. Pharmacological ascorbate inhibits pancreatic cancer metastases via a peroxide-mediated mechanism. Scientific Reports. 10 (1), 17649(2020).
- Williams, A. R., Hughes, D. E., Nyborg, W. L. Hemolysis near a transversely oscillating wire. Science. 169 (3948), 871-873 (1970).
- Rooney, J. A. Hemolysis near an ultrasonically pulsating gas bubble. Science. 169 (3948), 869-871 (1970).
- Connolly, S., McGourty, K., Newport, D. The in vitro inertial positions and viability of cells in suspension under different in vivo flow conditions. Scientific Reports. 10 (1), 1711(2020).
- Brooks, D. E. The biorheology of tumor cells. Biorheology. 21 (1-2), 85-91 (1984).
- Triantafillu, U. L., Park, S., Klaassen, N. L., Raddatz, A. D., Kim, Y. Fluid shear stress induces cancer stem cell-like phenotype in MCF7 breast cancer cell line without inducing epithelial to mesenchymal transition. Internation Journal of Oncology. 50 (3), 993-1001 (2017).
- Fan, R., et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Scientific Reports. 6, 27073(2016).
- Fu, A., et al. High expression of MnSOD promotes survival of circulating breast cancer cells and increases their resistance to doxorubicin. Oncotarget. 7 (31), 50239-50257 (2016).
- Li, S., et al. Shear stress promotes anoikis resistance of cancer cells via caveolin-1-dependent extrinsic and intrinsic apoptotic pathways. Journal of Cellular Physiology. 234 (4), 3730-3743 (2019).
- Xin, Y., et al. Mechanics and actomyosin-dependent survival/chemoresistance of suspended tumor cells in shear flow. Biophysical Journal. 116 (10), 1803-1814 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon