Method Article
Farelerde Tümör Sızan CD8 + T Hücrelerinin Dinamiğini Değerlendirmek için Tümör Transplantasyonu
Bu Makalede
Erratum Notice
Özet
Burada, bir fare tümörü modelinde tümöre özgü ve periferi kaynaklı tümör kaynaklı lenfositlerin karakterizasyonu için bir tümör transplantasyon protokolü sunulmaktadır. Alıcı kaynaklı immün hücrelerin akışının akım sitometrisi ile spesifik olarak izlenmesi, antitümör immün yanıtlar sırasında bu hücrelerin fenotipik ve fonksiyonel değişikliklerinin dinamiklerini ortaya koymaktadır.
Özet
T hücresi aracılı bağışıklık, tümörlere karşı immün yanıtlarda çok önemli bir rol oynarken, sitotoksik T lenfositler (CTL'ler) kanserli hücrelerin eradikasyonunda öncü rol oynamaktadır. Bununla birlikte, tümör mikroçevresi (TME) içindeki tümör antijenine özgü CD8 + T hücrelerinin kökenleri ve yenilenmesi belirsizliğini korumaktadır. Bu protokol, vekil neoantijen, ovalbümin (OVA) ve TCR transgenik OT-I farelerini istikrarlı bir şekilde eksprese eden B16F10-OVA melanom hücre hattını kullanır; burada CD8 + T hücrelerinin% 90'ından fazlası, sınıf I majör histouyumluluk kompleksi (MHC) molekülü H2-Kb'ye bağlı OVA türevi peptid OVA 257-264'ü (SIINFEKL) spesifik olarak tanır. Bu özellikler, tümörigenez sırasında antijene özgü T hücre yanıtlarının incelenmesini sağlar.
Bu modeli tümör nakli cerrahisi ile birleştirerek, donörlerden gelen tümör dokuları, alıcı kaynaklı bağışıklık hücrelerinin nakledilen donör dokulara akışını kesin olarak izlemek için tümörle eşleşen sinjenik alıcı farelere nakledildi ve tümöre özgü ve periferi kaynaklı antijene özgü CD8 + 'nın bağışıklık yanıtlarının analizine izin verdi. T hücreleri. Bu iki popülasyon arasında dinamik bir geçişin gerçekleştiği bulunmuştur. Toplu olarak, bu deneysel tasarım, TME'deki CD8 + T hücrelerinin bağışıklık tepkilerini tam olarak araştırmak için başka bir yaklaşım sağlamıştır ve bu da tümör immünolojisine yeni bir ışık tutacaktır.
Giriş
CD8 + T hücre aracılı immün yanıt, tümör büyümesini kontrol etmede çok önemli bir rol oynar. Tümörigenez sırasında, naif CD8 + T hücreleri, MHC sınıf I kısıtlı bir şekilde antijen tanınması üzerine aktive olur ve daha sonra efektör hücrelere farklılaşır ve tümör kütlesi 1,2'ye sızar. Bununla birlikte, tümör mikroortamında (TME), uzun süreli antijen maruziyeti ve immünosüpresif faktörler, infiltre edilmiş tümöre özgü CD8 + T hücrelerini "tükenme" olarak bilinen hiporesponsive bir duruma yönlendirir3. Tükenmiş T hücreleri (Tex), akut viral enfeksiyonda hem transkripsiyonel hem de epigenetik olarak üretilen efektör veya hafıza T hücrelerinden farklıdır. Bu Tex hücreleri esas olarak bir dizi inhibitör reseptörün sürekli ve yüksek ekspresyonunun yanı sıra efektör fonksiyonlarının hiyerarşik kaybı ile karakterizedir. Ayrıca, tükenmiş CD8 + T hücrelerinin bozulmuş proliferatif kapasitesi, tümöre özgü T hücrelerinin sayısının azalmasına neden olur, böylece TME içindeki artık CD8 + T hücreleri, tümör progresyonuna karşı yeterli koruyucu bağışıklığı zar zor sağlayabilir3. Bu nedenle, intratümöral antijene özgü CD8 + T hücrelerinin bakımı veya güçlendirilmesi, tümör represyonu için vazgeçilmezdir.
Ayrıca, immün kontrol noktası blokajı (ICB) tedavisinin, T hücresi infiltrasyonunu artırarak tümörlerde Tex'i yeniden canlandırdığına ve dolayısıyla T hücre sayılarını ve tümör baskısını artırmak için T hücresi fonksiyonlarını gençleştirdiğine inanılmaktadır. ICB tedavisinin yaygın olarak uygulanması, kanser tedavisi manzarasını değiştirmiş ve hastaların önemli bir alt kümesi kalıcı yanıtlar yaşamıştır 4,5,6. Bununla birlikte, hastaların ve kanser türlerinin çoğunluğu ICB'ye yanıt vermez veya sadece geçici olarak yanıt vermez. TME'de yetersiz T hücre infiltrasyonunun ICB direncini oluşturan temel mekanizmalardan biri olduğu varsayılmıştır 7,8.
Birçok çalışma, tümör infiltrasyonu yapan CD8 + T hücrelerinin (TIL'ler) hem hastalarda hem de fare modellerinde heterojenliğini göstermiştir 9,10,11,12. Bir tümör kütlesinde T hücre faktörü-1'i (TCF1) eksprese eden CD8 + T hücrelerinin bir alt kümesinin, ölümcül tükenmiş T hücrelerine yol açabilecek kök hücre benzeri özellikler sergilediği ve ICB tedavisi 12,13,14,15,16,17,18,19,20 sonrası proliferasyon patlamasından sorumlu olduğu doğrulanmıştır. 21,22. Bununla birlikte, TME'de antijene özgü TCF1 + CD8 + T hücrelerinin sadece küçük bir kısmının bulunduğu ve ICB 23,24,25,26'ya yanıt olarak genişlemiş bir farklılaşmış soy havuzu oluşturduğu kanıtlanmıştır. Bu popülasyonun sınırlı büyüklüğünün, tümör progresyonunu kontrol etmek için sitotoksik T lenfositlerin (CTL'ler) kalıcılığını sağlamak için yeterli olup olmadığı bilinmemektedir ve çevre dokulardan yenilenme olup olmadığı daha fazla araştırma gerektirmektedir. Ayrıca, son araştırmalar, önceden var olan tümöre özgü T hücrelerinin yetersiz canlandırma kapasitesini ve anti-programlanmış hücre ölümü proteini 1 tedavisinden sonra yeni, daha önce var olmayan klonotiplerin ortaya çıktığını göstermektedir. Bu, kontrol noktası blokajına T hücresi yanıtının, T hücresi klonlarının farklı bir repertuarının yeni akışından kaynaklanabileceğini göstermektedir27. TME'de tümör reaktif olmayan sitotoksik T hücre fraksiyonunun varlığı ile birlikte, bu bulgular periferi kaynaklı CD8 + T hücrelerinin rolünü incelemek için bir tümör allogreft modelinin kurulmasını sağlamıştır11.
Şimdiye kadar, çeşitli tümör implantasyonlarının yanı sıra immün hücre evlat edinen transferi, tümör immünolojisi alanında yaygın olarak kullanılmaktadır28. TIL'ler, periferik kan mononükleer hücreleri ve diğer dokulardan kaynaklanan tümör-reaktif bağışıklık hücreleri bu yöntemler kullanılarak iyi karakterize edilebilir. Bununla birlikte, sistemik ve lokal antitümör bağışıklık arasındaki etkileşimleri incelerken, bu modeller periferiden ve TME'den türetilen bağışıklık hücreleri arasındaki etkileşimleri incelemek için yetersiz görünmektedir. Burada, tümör dokuları, alıcı kaynaklı bağışıklık hücrelerinin akışını kesin olarak izlemek ve TME'deki donör kaynaklı hücreleri eşzamanlı olarak gözlemlemek için donörlerden tümörle eşleşen alıcı farelere nakledildi.
Bu çalışmada, vekil neoantijen ovalbümini kararlı bir şekilde eksprese eden B16F10-OVA melanom hücre hattı ile murin sinjenik bir melanom modeli oluşturulmuştur. CD8 + T hücrelerinin% 90'ından fazlasının, sınıf I MHC molekülü H2-Kb'ye bağlı OVA türevi peptid OVA 257-264'ü (SIINFEKL) spesifik olarak tanıdığı TCR transgenik OT-I fareleri, B16F10-OVA tümör modelinde geliştirilen antijene özgü T hücresi yanıtlarının incelenmesini sağlar. Bu model tümör transplantasyonu ile birleştirildiğinde, tümöre özgü ve periferi kaynaklı antijen spesifik CD8 + T hücrelerinin immün yanıtları karşılaştırılarak bu iki popülasyon arasında dinamik bir geçiş ortaya çıkarıldı. Toplu olarak, bu deneysel tasarım, TME'deki CD8 + T hücrelerinin bağışıklık tepkilerini tam olarak araştırmak için başka bir yaklaşım sağlamıştır ve bu da TME'deki tümöre özgü T hücresi bağışıklık yanıtlarının dinamiklerine yeni bir ışık tutmaktadır.
Protokol
Tüm fare deneyleri, Üçüncü Askeri Tıp Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitelerinin yönergelerine uygun olarak gerçekleştirildi. 6-8 haftalık C57BL/6 fareleri ve 18-22 g ağırlığındaki naif OT-I transgenik fareleri kullanın. Hem erkek hem de dişi randomizasyon veya "körleştirme" olmadan kullanın.
1. Ortam ve reaktiflerin hazırlanması
- Dulbecco'nun Modifiye Kartal Ortamına %10 fetal sığır serumu (FBS), 100 U/mL penisilin, 100 mg/mL streptomisin ve 2 mM L-glutamin ekleyerek hücre kültürü ortamı D10'u daha önce tarif edildiği gibihazırlayın 29 .
- RPMI-1640'ı% 10 FBS, 100 U / mL penisilin ve 100 mg / mL streptomisin ile destekleyerek hücre kültürü ortamı R10'u hazırlayın.
NOT: Kültür ortamı, D10 ve R10, 2-4 °C'de saklandığında en az 2 hafta steril ve stabil kalabilir. - 1x fosfat tamponlu salini (PBS) %2 FBS ve %0,01 sodyum azid ile destekleyerek Floresan Aktif Hücre Ayıklama (FACS) tamponunu hazırlayın.
NOT: Sodyum azid ilavesi ile FACS Tamponu 2-4 °C'de aylarca saklanabilir. - Çift damıtılmış suya 155 mM NH4Cl, 10 mM KHCO 3 ve 0,1 mM etilendiamin tetraasetik asit (EDTA) ekleyerek kırmızı kan hücresi lizisi (RBL) tamponunu hazırlayın ve pH'ını7,3'e ayarlayın.
NOT: RBL tamponu, oda sıcaklığında (RT) 3 aya kadar stabildir. - PBS'yi %0,5 sığır serum albümini (BSA) ve 2 mM EDTA ile destekleyerek manyetik aktive hücre sıralama (MACS) tamponu hazırlayın.
NOT: Çözelti, reaktif çözüldükten ve asepsis içinde korunduktan sonra 0,22 μm'lik bir filtreden geçirilmelidir. - 2,2,2-tribromoetanolün çalışan bir çözeltisini hazırlayın.
- 2.5 g 2,2,2-tribromoetanol, 5 mL tert-amil alkol (2-metil-2-bütanol) içinde çözün. Buhar banyosu yapan, sabit sıcaklıktaki vibratörde 180 rpm, 40 °C'de gece boyunca karıştırın.
- Çözeltiyi 0,22 μm'lik bir filtreden steril bir kaba süzün. 200 mL'lik son hacme kadar çift damıtılmış su ekleyin ve çözelti berrak ve şeffaf hale gelene kadar iyice ve sürekli olarak karıştırın.
- Çözeltinin pH değerini belirleyin ve 7.3'e ayarlayın. Işığı dışlamak ve 4 ° C'de saklamak için kabı alüminyum folyo ile tamamen sarın.
NOT: 2,2,2-tribromoetanol çalışma çözeltisinin son konsantrasyonu 12.5 mg / mL'dir. Daha konsantre bir çözelti tavsiye edilmez, çünkü malzeme daha yüksek konsantrasyonlarda tahriş edicidir. Her kullanımdan önce çalışma çözeltisinin pH değerini test edin ve pH 5'ten düşükse atın.
2. B16F10-OVA hücre süspansiyonunun hazırlanması
NOT: Hücre kültürü, sıkı aseptik koşullar altında bir biyogüvenlik başlığında yapılmalıdır.
- 37 ° C'de bir hücre kültürü inkübatöründe D10 ile B16F10-OVA hücrelerinin bir şişesini çözün ve kültürleyin ve% 5 CO2.
- Hücreler yaklaşık% 80-90'lık bir akıcılığa ulaştığında, hücreleri alt kültüre alır.
- Kültür ortamını bir pipetörle çıkarın ve PBS kullanarak hücreleri iki kez durulayın.
NOT: PBS'yi şişe veya hücre kültürü kabındaki yapışkan hücrelere karşı zorla eklemeyin. Bunun yerine, PBS'yi bir yanaklığa doğru pipetleyin veya şişeye veya tabağa damla damla ekleyin. - PBS'yi çıkarın ve şişeye veya kaba 1-2 mL% 0.25 tripsin-EDTA çözeltisi ekleyin. Tüm hücre yüzeyini kaplamak için ileri geri sallayın. Şişeyi veya çanağı, hücreler ayrılana kadar ~ 1 dakika boyunca 37 ° C'de veya RT'de bir inkübatöre yerleştirin.
NOT: Hücrelerin ayrılıp ayrılmadığını kontrol etmek için ters çevrilmiş bir mikroskop kullanılabilir. - Tripsinizasyonu durdurmak için taze D10 ekleyin. Tüm hücrelerin şişe veya çanak yüzeyinden ayrıldığından emin olmak için süspansiyonu yukarı ve aşağı pipetleyin.
- B16F10-OVA hücre süspansiyonunu 15 mL'lik bir konik tüpe aktarın. RT'de 5-7 dakika boyunca hücreleri 125 × g'de santrifüj yapın.
- Süper natantı atın ve hücre peletini D10 ile yeniden askıya alın. B16F10-OVA hücre süspansiyonunu D10 içeren yeni bir şişeye veya hücre kültürü kabına dağıtın ve 37 ° C ve% 5 CO2'de bir hücre kültürü inkübatöründe inkübe edin.
- Kültür ortamını bir pipetörle çıkarın ve PBS kullanarak hücreleri iki kez durulayın.
- Tümör implantasyonu gününde, adım 2.2.1 ila 2.2.4'te açıklandığı gibi ~% 90 oranında kaynayan B16F10-OVA hücrelerini hasat edin. Süper natantı atın ve hücre peletini 1 mL PBS ile yeniden askıya alın.
- Canlı hücreleri% 0.4 tripan mavisi kullanarak bir hemositometre ile sayın. PBS ekleyerek hücre yoğunluğunu 100 μL başına 1 × 106 hücreye ayarlayın. Hücreleri buz üzerinde tutun.
3. Farelerin kasık bölgesinde B16F10-OVA hücrelerinin ektopik tümör implantasyonu
- 18-22 g ağırlığındaki 6-8 haftalık C57BL/6 fareleri kullanın. Hem erkek hem de dişi randomizasyon veya "körleştirme" olmadan kullanın.
- Hazırlanan B16F10-OVA hücre süspansiyonunun 100 μL'sini 1 mL'lik bir tüberkülin şırıngasına çekin. Kabarcıkları en üste taşımak için namluya dokunun ve hava kabarcıklarını gidermek için pistonu yavaşça itin.
- Fareyi kısıtlayın ve karnını açığa çıkarın. Sol kasık bölgesinin derisini sıkılaştırmak için sol arka bacağına serçe parmağınızla bastırın.
- Farenin saçını sol alt karnından elektrikli tıraş makinesi ile çıkarın. Sol karın bölgesinin arka kadranını temizlemek için% 75 etanol içine batırılmış pamuk kullanın.
- Şırıngayı iğnenin eğimi yukarı bakacak şekilde çok sığ bir açıyla (0-15 °) tutarak, sol üst uyluk bölgesine yerleştirin ve deri altı dokusundan kasık bölgesine 0.5-1 cm ilerletin.
- Enjeksiyondan önce pistonu geri çekin. Negatif basınç varsa, pistonu tamamen bastırın ve subkutiste ortaya çıkan küçük bir bolus (sıvı cebi oluşumu) gözlemleyin.
NOT: Kan iğne göbeğinin içine geri çekilirse, geri çekilin ve başka bir yerde tekrar deneyin. - Enjeksiyon yapıldıktan sonra iğneyi çıkarın ve uygun şekilde atın. Fareyi serbest bırakın ve tekrar kafese yerleştirin.
- B16F10-OVA implantasyonundan sonra vernier bir ölçek kullanarak 6-8. günlerde tümör boyutunu ölçün. ~ 3 mm çapında (maş fasulyesi büyüklüğünde) tümörü olan fareleri seçin ve bunları eşit ve rastgele iki gruba ayırın.
NOT: Benzer büyüklükteki tümörlere sahip fareler rastgele donör ve alıcı fareler olarak atanır; Donör farelerden eksize edilen eşleşen tümör dokusu, alıcı farelere nakledilecektir. Ayrıca, ameliyatın evlat edinilmiş hücre transferi ve farelerin genel sağlığı üzerindeki etkilerini değerlendirmek için ameliyatsız kontroller ve sahte ameliyat kontrolleri dahil edilmelidir. Bu nedenle, bir grup tümör taşıyan fare, CD45.1 + CD45.2 + veya CD45.1 + OT-I hücrelerini alan ancak ameliyat edilmeyen ameliyat edilmemiş kontroller olarak işlev görür. Diğer fare grubu, CD45.1 + CD45.2 + veya CD45.1 + OT-I hücrelerini alan ve deney grubuna benzer ancak allogreft transplantasyonu olmayan müteakip cerrahi olarak sham ile ameliyat edilen kontroller olarak işlev görür.
4. Konjenik olarak işaretlenmiş OT-I T hücrelerinin tümör taşıyan farelere adaptif transferi
- Transferden önceki gün, her tümör taşıyan fareye intraperitoneal enjeksiyon yoluyla 200 μL PBS'de çözünmüş 4 mg siklofosfamid uygulayın.
NOT: Siklofosfamid ile tedavi, konakçıda transfer edilen hücreler için "alan" üreten, sağkalımlarını teşvik eden ve verimli çalışması için lenfoid organlara yönelen lenfopeniyi indüklemeyi amaçlamaktadır. - Farklı konjenik belirteçlere sahip naif OT-I transgenik fareler kullanın (6-8 haftalık, 18-22 g, tümör taşıyan farelerle aynı cinsiyette). CD45.1 + OT-I fareleri ve CD45.1 + CD45.2 + OT-I fareleri kullanarak, OVA257-264 antijene özgü T hücrelerini sırasıyla tümör taşıyan donör ve alıcı farelere benimseyici olarak aktarın.
NOT: Evlat edinilen olarak aktarılan OT-I hücrelerinin kökeni, farklı konjenik veya floresan belirteçler gösteriyorlarsa kolayca tanımlanabilir. Örneğin, CD45.1 + OT-I T hücrelerini B16F10-OVA taşıyan donör farelere enjekte ederken, CD45.1 + CD45.2 + OT-I T hücrelerini B16F10-OVA taşıyan alıcı farelere enjekte edin. CD45.1 ve CD45.2, pan-lenfosit belirteci CD45'in (Ly5) izoformlarıdır. Yaygın olarak kullanılan diğer konjenik belirteçler, CD90'ın (Thy1) farklı izoformlarını içerir. Bu protokol, farklı konjenik belirteçler taşıyan fareler için kullanılabilir. OT-I fareleri, reddetme sorunlarını önlemek için OT-I hücre transferi alan farelerle aynı cinsiyette olmalıdır. - Lenfositleri OT-I farenin dalak ve lenf düğümlerinden izole edin.
NOT: Bu adımdaki aşağıdaki prosedürler, sıkı asepsiyi korumak için bir biyogüvenlik kabininde gerçekleştirilmelidir.- İki adet 60 mm × 10 mm Petri kabı hazırlayın. Bir kaba 3 mL R10 ortamı eklerken, başka bir kaba 3 mL RBL tamponu ekleyin. RBL tamponu içeren kaba 70 μm naylon hücre süzgeci yerleştirin.
- Bir OT-I faresini bir izofluran odasında ötenazi hale getirir ve ardından servikal çıkığı izler.
- Farenin dalak, kasık (subiliak) ve aksiller lenf düğümlerini toplayın ve bunları buz üzerinde 3 mL R10 bulunan 60 mm × 10 mm'lik bir kaba aktarın.
NOT: Kurban edilen OT-I farelerin sayısı, aktarılacak tümör taşıyan farelerin sayısına bağlı olarak ayarlanabilir. OT-I CD8 + T hücrelerinin bir dalak ve bilateral kasık ve aksiller lenf düğümlerinden OT-I CD8 + T hücrelerinin tipik bir verimi, fare başına ~ 30-100 × 106 hücredir. - 1 mL'lik bir şırınganın uç namlusunu kullanarak, dalağı süzgeçten 3 mL RBL tamponunda maserasyonlayın. RT'de 3 dakika boyunca inkübe edin ve 3 mL soğuk R10 ortamı ekleyerek reaksiyonu sonlandırın.
- Sadece bağ dokuları kalana kadar lenf düğümlerini ezin. Filtreyi R10 ile durulayın. Hücre süspansiyonunu yeni bir 15 mL konik tüpe aktarın. Santrifüj, 500 × g, 6 dakika boyunca 4 °C'de santrifüj.
- Süper natantı boşaltın ve hücreleri 3 mL MACS tamponunda yeniden askıya alın. Herhangi bir flok'u çıkarmak için hücre süspansiyonunu yeni bir 70 μm hücre süzgecinden geçirin.
- Hücre süspansiyonunu 500 × g'da 4 ° C'de 5 dakika boyunca santrifüj yapın. Süper natantı dekant.
- CD8 + T hücrelerini üreticinin protokolüne göre negatif seçimle saflaştırmak için bir fare CD8 + T hücre izolasyon kiti kullanın (Malzeme Tablosuna bakın).
NOT: Diğer şirketlerin kitlerini kullanırken, üreticinin talimatlarını izleyin. - Saflaştırılmış hücre süspansiyonunu buz üzerinde tutun. Küçük bir hücre örneği alın ve bir hemositometre kullanarak hücreleri saymak için tripan mavisi ile karıştırın.
- OT-I (canlı/ölü-CD8+Va2+) hücrelerinin yüzdesini akış sitometrisi ile belirleyin.
NOT: Transferden önce hücrelerin doğru fenotipini doğrulamak için konjenik belirteçlerin ve transgenik TCR'nin eşzamanlı boyanması yapılmalıdır.- 1,5 mL'lik bir santrifüj tüpünde 1 mL FACS tamponuna 5 × 10 4-1 × 105 hücre ekleyin ve hücre süspansiyonunu 3 dakika boyunca 350 × g,4 °C'de santrifüj edin.
- Süper nantantı atın ve tüpün dibine hafifçe vurarak hücreleri dağıtın. Tüpü buzun üzerine yerleştirin.
- Aşağıdaki konjuge antikor karışımlarını hazırlayın (100 μL FACS tamponunda seyreltilmiş): anti-CD8, 1:200; anti-TCR Vα2, 1:100; anti-CD45.1, 1:200; anti-CD45.2, 1:200; ve canlı/ölü, 1:200 ( Malzeme Tablosuna bakınız).
- Antikor kokteylini vorteksleyin ve 15.000 × g'da santrifüjü 3 dakika boyunca pelet antikor agregalarına verin. Kokteyli buz üzerinde saklayın ve ışıktan koruyun.
- Hücreleri 100 μL antikor kokteyli ile yeniden askıya alın ve tüpü hafifçe vurarak iyice karıştırın. Karanlıkta buz üzerinde 30 dakika boyunca kuluçkaya yatın.
NOT: Tüpün altındaki antikor agregalarını bozmaktan kaçının. - Peletleri 1 mL FACS tamponu ile iki kez yıkayın. 350 × g, 4 °C'de 3 dakika santrifüj. Hücreleri 200 μL FACS tamponunda yeniden askıya alın ve hücre süspansiyonunu bir FACS tüpüne aktarın.
NOT: Aktarılacak OT-I hücrelerinin canlılığını korumak için, numuneyi mümkün olan en kısa sürede test edin. Lekeli OT-I hücreleri hemen test edilemezse, hücreleri buz üzerinde karanlıkta tutun veya analize kadar 4 ° C'de soğutun. Alternatif olarak, numuneler, bozulmayı önlemek için uzun süreli depolama (16 saat) için% 1-4 paraformaldehit içinde yeniden askıya alınabilir. - Numuneyi bir akış sitometresinde çalıştırın. Canlı/ölü-CD8+Vα2+ hücrelerinin sayısını canlı/ölü hücre sayısına bölerek canlı/ölü-CD8+Va2+ hücrelerinin yüzdesini hesaplayın.
- OT-I hücrelerinin mutlak sayısını (canlı/ölü-CD8+Va2+) canlı/ölü-CD8+Va2+ hücrelerinin yüzdesini adım 4.3.9'da elde edilen canlı hücre sayısıyla çarparak belirleyin.
- OT-I hücrelerinin (canlı/ölü-CD8+Va2+) konsantrasyonunu PBS ile 1,5 × 106/mL'ye ayarlayın.
- 200 μL PBS'de 3 × 105 ayrı konjenik olarak işaretlenmiş OT-I hücresini (canlı/ölü-CD8+Va2+) intravenöz olarak iki grup B16F10-OVA taşıyan fareye (3.8. adımdan itibaren donör ve alıcı farelere bölünmüş tümör taşıyan fareler) enjekte edin.
- 200 μL OT-I hücresi (canlı/ölü-CD8+Va2+) süspansiyonunu 100 U insülin şırıngasına (29 G) çekin ve adım 3.2'deki gibi kabarcıkları çıkarın.
- Kuyruk damarını genişletmek için fareyi kafesin üzerine kızılötesi lambalı bir kafese 5-10 dakika boyunca ayrı ayrı yerleştirin. Fareyi uygun boyutta bir kısıtlama cihazıyla hareketsiz hale getirin. Düzeltmek için kuyruğu çekin ve damarı görünür kılmak için% 75 etanol püskürtün.
- Şırıngayı damara paralel tutun ve damara 0-15 ° 'lik bir açıyla yerleştirin. Pistonu hafifçe geri çekin ve namluya kan girerse, süspansiyonu yavaşça ve sabit bir şekilde 1 mL / dak'dan fazla olmayan bir hızda enjekte edin.
NOT: Enjeksiyon bölgesinde direnç veya şişlik, iğnenin damarın içinde olmadığını gösterir; enjeksiyon bölgesi yakınına hareket ettirilmelidir. - Enjeksiyon tamamlandıktan sonra, şırıngayı çıkarın ve kanamayı durdurmak için yerleştirme alanına 3-5 s hafifçe bastırın. Fareyi kafese geri döndürün ve olumsuz reaksiyonlar için birkaç dakika boyunca yakından gözlemleyin. Normal hareketliliğe ve burun akıntısına sahipse, diğer farelerin yanına geri yerleştirin.
5. Tümör taşıyan donör farelerden tümör kitlesini disseke edin
NOT: Ameliyat sırasında bölüm 5 ve 6'da steril koşulları koruyun. Her kullanımdan önce ve sonra otoklavlama yaparak tüm cerrahi aletleri sterilize edin. Biyogüvenlik kabinindeki çalışma alanını% 75 etanol ve ardından ultraviyole ışınlama ile dezenfekte edin. Temiz bir elbise, şapka, yüz maskesi ve steril eldivenler giyin.
- Evlat edinilen transferden sekiz ila on gün sonra, transplantasyon cerrahisi için ~ 5 mm çapında (soya fasulyesi büyüklüğünde) karşılaştırılabilir tümör kütlesi taşıyan donör fareleri seçin.
- Bir biyogüvenlik kabininde 100 mm × 20 mm'lik bir tabak hazırlayın ve 10 mL steril buz gibi soğuk PBS ekleyin.
- Bir izofluran odasında tümör taşıyan bir donör fareyi ötenazi ve ardından servikal çıkığı izleyin. Fareyi 3-5 dakika boyunca% 75 etanol içine daldırın ve biyogüvenlik kabinine aktarın.
NOT: Bu adımdaki aşağıdaki prosedürler, sıkı asepsiyi korumak için bir biyogüvenlik kabininde gerçekleştirilmelidir. - Fareyi temiz emici kağıtla kaplı bir diseksiyon panosuna sırtüstü pozisyonda yerleştirin. Fare uzuvlarını diseksiyon iğneleriyle kısıtlayın.
- Cildi orta hat boyunca üretral deliğin üstünden makasla ksifoide doğru kesin. Cildi cımbızla fare gövdesinin sol tarafına doğru gerin ve cildi diseksiyon iğneleriyle kısıtlayın.
- Kapsülünü mümkün olduğunca sağlam tutarak tümörü tüketin. Tümörün yakınındaki bağ dokusunu cerrahi makasla dikkatlice ve nazikçe çıkarın.
NOT: Tümörün bütünlüğünü korumak için, tümör kapsülünü soymayın veya tümör dokusunu parçalara ayırmayın. - Tümör dokusunu, sonraki nakil için 10 mL steril buz gibi soğuk PBS içeren 100 mm × 20 mm'lik bir kaba yerleştirin.
6. Donör kaynaklı tümörün tümörle eşleşen alıcı farelere deri altı transplantasyonu
NOT: İki tümörün aynı lenf noduna akmasını sağlamak için allogreftin farenin alt kanadına daha önce var olan tümörle aynı tarafa implante edilmesi gerekir. Burada sunulan protokolde, B16F10-OVA tümörü farenin sol kasık bölgesine deri altından implante edildiğinden (bölüm 3), donör kaynaklı tümör dokusu bu adımda alıcının sol kanadına nakledildi. Transplantasyon bölgesi ilk implante edilen tümör bölgesine uyarlanabilir.
- İntraperitoneal enjeksiyon yoluyla 250 mg / kg 2,2,2-tribromoetanol ile tümör uyumlu bir alıcı fareyi anestezi altına alın. Anestezi seviyesini değerlendirmek için farenin ekstansör uzuvlarının ayak parmağını sıkıştırın ve ameliyatı gerçekleştirmek için uygun anestezi derinliğini gösteren ağrı refleksi eksikliğini bekleyin. Seslendirme veya arka ekstremite çekilmesi gözlenirse, ayrıca 0.01-0.03 mL 2,2,2-tribromoetanol enjekte edin.
NOT: Tümörle eşleşen alıcı fare, reddetme sorunlarını önlemek için allogreft sağlayan donör fare ile aynı cinsiyette olmalıdır. - Kuruluğu önlemek için gözlerde veteriner merhem kullanın. Farenin sol kanadını elektrikli tıraş makinesiyle tıraş edin. Kalan saçları çıkarmak için tüy dökücü bir krem uygulayın.
NOT: Cildi aşındırmaktan kaçının, bu da kontaminasyon ve enfeksiyon riskini artırabilir. - Fareyi biyogüvenlik kabinine yerleştirin. Temiz emici kağıtla kaplı bir diseksiyon tahtası üzerinde, farenin dikey ekseni paralel ve başı deneycinin sağ tarafına gelecek şekilde eğilimli konuma getirin.
NOT: Bu adımdaki aşağıdaki prosedürler, sıkı asepsiyi korumak için bir biyogüvenlik kabininde gerçekleştirilmelidir. - Tıraş edilen bölgenin cildini povidon-iyota batırılmış pamukla ovalayın.
NOT: Vücut ısısı kaybını önlemek için sterilizasyon için% 75 etanol yerine povidon-iyot kullanın. - Cerrahi cımbızla fare kalça eklemleri arasındaki merkez noktadaki cildi kaldırın. 5 mm uzunluğunda dikey eksizyon yapmak için makası kullanın. Kesimi dorsal orta hat boyunca rostral olarak ~ 10-15 mm'ye kadar uzatın.
- Makasın kapalı uçlarını kesiye sokarak ve ardından sol kanadın peritonunu deriden ve yumuşak dokudan ayırmak için açarak keskin bir diseksiyon yapın.
NOT: Deri altı dokusuna ve peritona zarar vermemek için, cildi insizyonun ortasından kaldırın ve ardından kapalı makası cilde mümkün olduğunca yakın bir yere yerleştirin. - Birkaç kez keskin diseksiyon yaparak sol kanatta bir cilt cebi yapın. Kapsüllenmiş, sağlam donör kaynaklı tümör kütlesini kapsülün içine yerleştirin.
NOT: Sahte ameliyat edilen kontrol grubundaki fareler, donör kaynaklı tümör nakli olmadan aynı ameliyat ameliyatını alırlar. - Kesisi kesilmiş dikişle kapatın (bkz. Malzeme Listesi). Her kesi için 2-3 dikiş yerleştirin. Kesimin etrafındaki cildi povidon-iyota batırılmış pamukla dezenfekte edin.
NOT: Ardışık iki dikiş arasında 5 mm ve kesiden 3 mm mesafe olmalıdır. - Fareyi yanal konuma temiz ve ılık bir kafese yerleştirin. Sternal yassılığı korumak için yeterli bilinci yeniden kazanana kadar sürekli olarak izleyin.
- Ağrıyı hafifletmek için ameliyattan sonra her 8 saatte bir 0.1 mg / kg vücut ağırlığı dozunda deri altından büprenorfin uygulayın. Farenin yeme, içme, hareket etme ve üzerinde çalışılan alanı izleyin. Nakil alıcısını diğer hayvanların şirketine ancak tamamen iyileştikten sonra iade edin.
NOT: Fare tipik olarak ameliyatın travmasından 3 gün içinde kurtulur. Fare normal beslenmeye ve hareketliliğe geri dönmediyse ve herhangi bir enfeksiyon belirtisi gösteriyorsa, müdahaleler için bir veterinere danışın veya ötenazi yapın. - Fareleri belirtilen zaman noktalarında kurban edin (adım 4.3.2'de olduğu gibi hayvanları ötenazileştirin) ve akış sitometrik analizi için ilgilenilen hücreleri geri kazanın.
Sonuçlar
Bu protokolün şeması Şekil 1'de gösterilmiştir. Tümör aşılamasından sekiz gün sonra, CD45.1 + ve CD45.1 + CD45.2 + OT-I hücreleri, B16F10-OVA tümörü taşıyan C57BL / 6 farelere enjekte edildi. Tümör, transfer sonrası 8. günde CD45.1+ OT-I hücre implante edilmiş farelerden (donör) cerrahi olarak diseke edildi ve implante edilen tümörle aynı taraftaki dorsal kanatta tümörle eşleşen CD45.1 + CD45.2 + OT-I hücre implante edilmiş farelere (alıcı) nakledildi. Akış sitometrisi (Şekil 2'de gösterilen geçit stratejisi) analizi sayesinde, CD45.1 + donör kaynaklı ve CD45.1 + CD45.2 + alıcı kaynaklı TIL'ler dahil olmak üzere CD44 + CD8 + tümör antijenine özgü T hücrelerinin iki popülasyonu TME'de kolayca tanımlanabilir. Daha sonra, bu iki popülasyonun allogreftler içindeki oranları, antijene özgü CD8 + T hücrelerinin dinamiklerini incelemek için belirtilen zaman noktalarında analiz edildi. Transplantasyon sonrası 2. günde, nakledilen tümör içinde donör kaynaklı antijen spesifik CD8 + T hücrelerinin ~% 83'ü vardı ve alıcı kaynaklı meslektaşlarından daha baskındı. Bununla birlikte, alıcı kaynaklı OT-I hücrelerinin oranı, tümörigenezin geç evresinde, donörden türetilen tümöre özgü OT-I hücrelerini aşarak yükselmiştir. (Şekil 3).
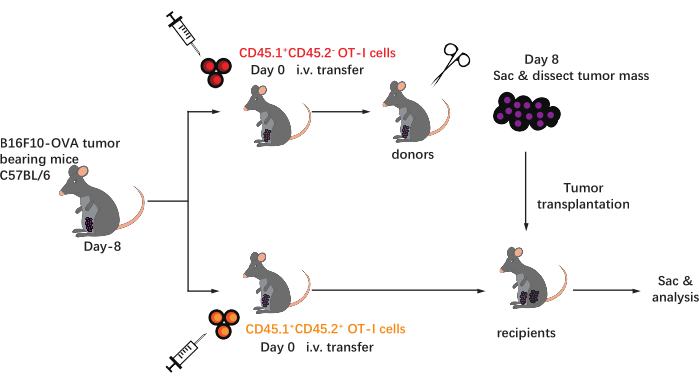
Resim 1: Deneysel tasarımın şeması. C57BL/6 farelere kasık bölgesinde B16F10-OVA tümörü ile meydan okunur. Sekiz gün sonra, farklı konjenik olarak işaretlenmiş (CD45.1 + veya CD45.1 + CD45.2 +) OT-I hücreleri tümör taşıyan farelere aktarılır. Transferden sonraki 8. günde, CD45.1 + OT-I hücre implante edilmiş farelerdeki tümör cerrahi olarak diseke edilir ve mevcut tümörle aynı taraftaki kanattaki tümör uyumlu CD45.1 + CD45.2 + OT-I hücre implante edilmiş alıcılara deri altından nakledilir. Daha sonra, fareler kurban edilir ve allogreftler içindeki antijene özgü T hücreleri (OT-I hücreleri) belirtilen zaman noktalarında analiz edilir. Kısaltmalar: CD = farklılaşma kümesi; i.v. = intravenöz; Sac = kurban. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
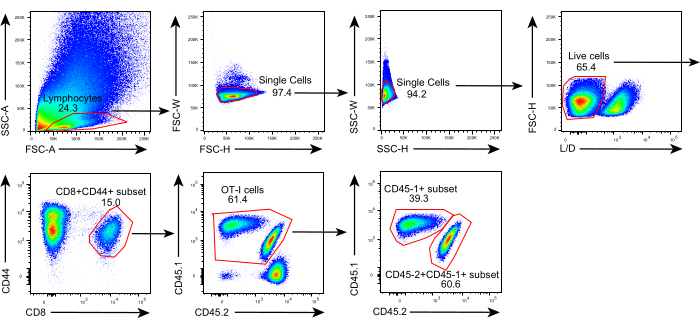
Şekil 2: Akış sitometrisi analizinin geçit stratejisi. Allogreftler içinde donör kaynaklı (CD45.1+) ve alıcı kaynaklı (CD45.1+CD45.2+) antijene özgü CD44+CD8+ T hücrelerini tanımlamak için kullanılan geçit stratejisi. Kısaltmalar: SSC-A = yan saçılma alanı; FSC-A = ileri saçılma alanı; FSC-W = ileri saçılma genişliği; FSC-H = ileri saçılma yüksekliği; SSC-W = yan saçılma genişliği; SSC-H = yan saçılma yüksekliği; L/D = canlı/ölü; CD = farklılaşma kümesi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Tümör allogreftleri içinde donör ve alıcı kaynaklı antijene özgü CD8+ T hücrelerinin oranı. Transplantasyondan sonraki 2, 8. ve 15. günlerde tümör allogreftleri içindeki donör kaynaklı ve alıcı kaynaklı OT-I hücrelerini tanımlamak için kullanılan konjenik belirteçler CD45.1 ve CD45.2'nin ekspresyonunu gösteren temsili akış sitometri grafikleri. Sayılar, CD44+CD8+ T hücre popülasyonundaki iki alt kümenin yüzdelerini temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
T hücre aracılı bağışıklık, tümörlere karşı bağışıklık yanıtlarında çok önemli bir rol oynarken, CTL'ler kanserli hücrelerin yok edilmesinde öncü rol oynamaktadır. Bununla birlikte, TME içindeki tümör antijenine özgü CTL'lerin kökenleri aydınlatılamamıştır30. Bu tümör transplantasyon protokolünün kullanılması, kök benzeri TCF1 + progenitör CD8 + T hücrelerinin varlığına rağmen, intratümöral antijene özgü CD8 + T hücrelerinin uzun süre devam etmeyebileceğine dair önemli bir ipucu sağlamıştır. Özellikle, periferi kaynaklı tümör spesifik CD8 + T hücrelerinin tümör kütlesine sürekli bir akışı vardır.
Bildiğimiz kadarıyla, bu, TME içindeki antijene özgü CD8 + T hücrelerinin korunmasının, ağırlıklı olarak, tümörde yerleşik TIL'lerin kendi kendini yenilemesi yerine, periferi kaynaklı tümör spesifik CD8 + T hücrelerinin yenilenmesine bağlı olduğunu doğrulayan nispeten uygun ve ikna edici bir yöntemdir. Burada sunulan protokol sadece donör kaynaklı ve alıcı kaynaklı TIL'lerin oranlarına odaklanmasına rağmen, bu iki popülasyonun fenotipik, fonksiyonel ve transkripsiyonel özellikleri akış sitometrisi ile kolayca incelenebilir. Ayrıca, belirli bir hücre alt kümesinin ICB tedavisine yanıtlarını araştırmak için ICB antikorlarını birleştirmek mümkündür.
Bu protokolde, donör kaynaklı tümör dokusu, mevcut bir orijinal tümörle alıcı fareye nakledilir. Bir alıcı faredeki iki tümör, periferi tarafından üretilen T hücrelerinin iki tümör kütlesine dağılmasına yol açacaktır. Dahası, tümör yükü, nakil yapılmayan hayvanlara kıyasla neredeyse iki katına çıkacaktır. Pilot deneylerde, transplantasyondan önce alıcı farelerdeki orijinal tümörü eksize etmeye çalıştık; Bununla birlikte, tüm tümör hücrelerini ameliyatla tamamen ortadan kaldırmak teknik olarak zordu. Artık tümör hücreleri hızla ve yakında yeni bir tümör dokusu oluşturacaktır. Bu nedenle, T hücresi bağışıklık tepkilerini nakledilmemiş farelerdekilerle karşılaştırırken bu sistem için bir sınırlama vardır. Bununla birlikte, bu sistem, donör tümör taşıyan farelerden nakledilen aynı TME içindeki yakın zamanda göç etmiş ve mevcut T hücrelerinin karşılaştırılması için hala yararlıdır. Ayrıca, tümör dokusunun transplantasyonunun, tümör içindeki bağışıklık hücresi dinamiklerini etkileyebilecek inflamasyona yol açabileceği inkar edilemez. Ameliyatın OT-I hücre infiltrasyonu üzerindeki etkisi, ameliyat edilmemiş ve sahte ameliyat edilen kontrollerle dışlanabilse de, lokal inflamatuar yanıtların OT-I hücre dinamiklerine etkilerini değerlendirmedik.
Biri siklofosfamid kullanımı olan bazı hususlar dikkate alınmalıdır. Siklofosfamid31 , solid organ maligniteleri ile lenfoproliferatif ve otoimmün bozuklukların tedavisinde yaygın olarak kullanılan bir alkilleyici ajandır. B16F10-OVA aşılamasından altı ila sekiz gün sonra, konakçı farelerin lenfodeplesyonunu indüklemek ve transfer edilen OT-I hücrelerinin aktivitesini arttırmak için evlat edinilmiş transferden önce siklofosfamid uygulanır29. Melanom bu reaktife duyarlı olmamasına rağmen, bir murin timik lenfoma hücre hattı olan EG732 gibi bazı tümör hücre hatları siklofosfamid'e yanıt verir. EG7 taşıyan farelerin siklofosfamid ile tedavisi, tümörlerin eradikasyonuyla sonuçlanır, bu da siklofosfamidin hassas tümör modelleri için dikkatlice kullanılması veya titre edilmesi gerektiğini düşündürmektedir. Önerilen alternatif yöntem, transferden bir gün önce tek bir ölümcül radyasyon dozudur (4.5-5.5 Gy) ve optimal seçim tümör hücre hatlarının karakteristiğine bağlıdır.
Tümör taşıyan donör farelerin dikkatli seçimi ve tümör nakli sırasında hassas cerrahi operasyon da dahil olmak üzere diğer adımların dikkatli bir şekilde atılması gerekir. İmplante edilen tümörler cerrahi olarak çıkarılacak ve transferden 8-10 gün sonra tümörle eşleşen alıcı farelere nakledilecektir. Transplantasyondan önce, bireysel fareler arasındaki tutarsızlıkları azaltmak ve elde edilen verileri daha güvenilir hale getirmek için ~ 5 mm çapında karşılaştırılabilir bir tümör kütlesi boyutu bir allogreft olarak seçilmelidir. Ayrıca, ameliyat sırasında, allogrefti alıcı farede zaten mevcut olan tümörden uzak tutmak için insizyon, farenin sırtının orta çizgisine yakın olmalıdır. Kasık lenf nodu ve çevre dokulardaki yaralanmaları önlemek için nazik diseksiyon da önerilmektedir.
Kanserli hücrelerin etkili bir şekilde öldürülmesi, TME33 içindeki çeşitli bileşenlerin koordinasyonunu gerektirir. Burada sunulan protokol, doğal öldürücü hücreler, tümörle ilişkili makrofajlar ve dendritik hücreler gibi adaptif ve doğuştan gelen bağışıklık hücrelerinin araştırılmasına genişletilebilir. Ayrıca, burada kullanılan B16F10-OVA'ya ek olarak, bu protokol diğer deri altı tümör modellerine de uygulanabilir. Sonuç olarak, yukarıda belirtilen tümör transplantasyonu testi, antitümör yanıtları sırasında belirli tipte bağışıklık hücrelerinin etkileşimli geçişlerinin incelenmesi için yeni bir yaklaşım sunmaktadır ve tümör immünolojisindeki araştırmacılar için yararlıdır.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Seçkin Genç Akademisyenler için Ulusal Doğa Bilimleri Fonu (LY'ye No. 31825011) ve Çin Ulusal Doğa Bilimleri Vakfı'ndan (QH'ye No. 31900643, ZW'ye No. 31900656) hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
Referanslar
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867 (2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794 (2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507 (2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169 (2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806 (2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır