Method Article
Transplantation tumorale pour évaluer la dynamique des lymphocytes T CD8+ infiltrant la tumeur chez la souris
Dans cet article
Erratum Notice
Résumé
Ici, nous présentons un protocole de transplantation tumorale pour la caractérisation des lymphocytes infiltrés tumoraux inhérents à la tumeur et dérivés de la périphérie dans un modèle tumoral murin. Le traçage spécifique de l’afflux de cellules immunitaires dérivées du receveur avec cytométrie en flux révèle la dynamique des changements phénotypiques et fonctionnels de ces cellules au cours des réponses immunitaires antitumorales.
Résumé
L’immunité médiée par les lymphocytes T joue un rôle crucial dans les réponses immunitaires contre les tumeurs, les lymphocytes T cytotoxiques (CTL) jouant le rôle principal dans l’éradication des cellules cancéreuses. Cependant, les origines et la reconstitution des lymphocytes T CD8+ spécifiques de l’antigène tumoral dans le microenvironnement tumoral (TME) restent obscures. Ce protocole utilise la lignée cellulaire de mélanome B16F10-OVA, qui exprime de manière stable le néoantigène de substitution, l’ovalbumine (OVA) et les souris OT-I transgéniques TCR, dans lesquelles plus de 90% des lymphocytes T CD8+ reconnaissent spécifiquement le peptide dérivé de l’OVA OVA257-264 (SIINFEKL) lié à la molécule H2-Kb du complexe majeur d’histocompatibilité (CMH) de classe I. Ces caractéristiques permettent d’étudier les réponses des lymphocytes T spécifiques de l’antigène au cours de la tumorigenèse.
En combinant ce modèle avec la chirurgie de transplantation tumorale, les tissus tumoraux de donneurs ont été transplantés dans des souris receveuses syngéniques appariées à une tumeur pour tracer avec précision l’afflux de cellules immunitaires dérivées du receveur dans les tissus de donneurs transplantés, permettant l’analyse des réponses immunitaires de CD8+ spécifiques à l’antigène inhérent à la tumeur et d’origine périphérique Lymphocytes T. Une transition dynamique s’est produite entre ces deux populations. Collectivement, cette conception expérimentale a fourni une autre approche pour étudier avec précision les réponses immunitaires des lymphocytes T CD8+ dans le TME, ce qui apportera un nouvel éclairage sur l’immunologie tumorale.
Introduction
La réponse immunitaire médiée par les lymphocytes T CD8+ joue un rôle central dans le contrôle de la croissance tumorale. Au cours de la tumorigenèse, les lymphocytes T CD8+ naïfs sont activés lors de la reconnaissance de l’antigène d’une manière restreinte au CMH de classe I, puis se différencient en cellules effectrices et s’infiltrent dans la masse tumorale 1,2. Cependant, dans le microenvironnement tumoral (TME), une exposition prolongée à l’antigène, ainsi que des facteurs immunosuppresseurs, conduisent les lymphocytes T CD8+ spécifiques à la tumeur infiltrés dans un état hyporésensible connu sous le nom d'« épuisement »3. Les lymphocytes T épuisés (Tex) sont distincts des lymphocytes T effecteurs ou mémoire générés lors d’une infection virale aiguë, à la fois transcriptionnellement et épigénétiquement. Ces cellules Tex sont principalement caractérisées par l’expression soutenue et élevée d’une série de récepteurs inhibiteurs ainsi que par la perte hiérarchique des fonctions effectrices. En outre, l’altération de la capacité proliférative des lymphocytes T CD8+ épuisés entraîne une diminution du nombre de lymphocytes T spécifiques à la tumeur, de sorte que les lymphocytes T CD8+ résiduels dans le TME peuvent à peine fournir une immunité protectrice suffisante contre la progression tumorale3. Ainsi, le maintien ou le renforcement des lymphocytes T CD8+ spécifiques de l’antigène intratumoral est indispensable à la répression tumorale.
De plus, on pense que la thérapie de blocage des points de contrôle immunitaires (ICB) revigore Tex dans les tumeurs en augmentant l’infiltration des lymphocytes T et, par conséquent, le nombre de lymphocytes T et en rajeunissant les fonctions des lymphocytes T pour stimuler la répression tumorale. L’application généralisée du traitement par ICB a changé le paysage du traitement du cancer, avec un sous-ensemble substantiel de patients présentant des réponses durables 4,5,6. Néanmoins, la majorité des patients et des types de cancer ne répondent pas ou seulement temporairement à l’ICB. Une infiltration inadéquate des lymphocytes T dans le TME a été postulée comme l’un des mécanismes sous-jacents expliquant la résistance iCB 7,8.
Plusieurs études ont démontré l’hétérogénéité des lymphocytes T CD8+ (TIL) infiltrant les tumeurs chez les patients et les modèles murins 9,10,11,12. Il a été confirmé qu’un sous-ensemble de lymphocytes T CD8+ exprimant le facteur T-1 (TCF1) dans une masse tumorale présente des propriétés semblables à celles des cellules souches, ce qui pourrait donner lieu à des lymphocytes T épuisés en phase terminale et est responsable de l’éclatement de la prolifération après le traitement par ICB 12,13,14,15,16,17,18,19,20, 21,22. Cependant, il a été prouvé que seule une faible proportion de lymphocytes TCF1+CD8+ spécifiques de l’antigène existent dans le TME et génèrent un pool élargi de descendance différenciée en réponse à l’ICB 23,24,25,26. On ne sait pas si la taille limitée de cette population est suffisante pour assurer la persistance des lymphocytes T cytotoxiques (LCR) pour contrôler la progression tumorale, et s’il y a réapprovisionnement des tissus périphériques nécessite des recherches plus approfondies. En outre, des recherches récentes suggèrent la capacité de revitalisation insuffisante des lymphocytes T spécifiques de la tumeur préexistants et l’apparition de nouveaux clonotypes auparavant inexistants après un traitement antiprogrammé de la protéine de mort cellulaire 1. Cela indique que la réponse des lymphocytes T au blocage des points de contrôle peut être due au nouvel afflux d’un répertoire distinct de clones de lymphocytes T27. Avec la présence de la fraction de lymphocytes T cytotoxiques non réactifs à la tumeur dans le TME, ces résultats ont incité à l’établissement d’un modèle d’allogreffe tumorale pour étudier le rôle des lymphocytes T CD8+ dérivés de la périphérie11.
Jusqu’à présent, plusieurs types d’implantation tumorale, ainsi que le transfert adoptif de cellules immunitaires, ont été largement utilisés dans le domaine de l’immunologie tumorale28. Les TIL, les cellules mononucléaires du sang périphérique et les cellules immunitaires réactives à la tumeur provenant d’autres tissus peuvent être bien caractérisés à l’aide de ces méthodes. Cependant, lors de l’étude des interactions entre l’immunité antitumorale systémique et locale, ces modèles semblent inadéquats pour examiner les interactions entre les cellules immunitaires dérivées de la périphérie et le TME. Ici, les tissus tumoraux ont été transplantés de donneurs dans des souris receveuses appariées par tumeur pour suivre avec précision l’afflux de cellules immunitaires dérivées de receveurs et observer les cellules dérivées de donneurs dans le TME en concomitance.
Dans cette étude, un modèle syngénique murin du mélanome a été établi avec la lignée cellulaire de mélanome B16F10-OVA, qui exprime de manière stable l’ovalbumine néoantigène de substitution. Les souris OT-I transgéniques TCR, dans lesquelles plus de 90% des lymphocytes T CD8+ reconnaissent spécifiquement le peptide dérivé de l’OVA OVA OVA257-264 (SIINFEKL) lié à la molécule H2-Kb du CMH de classe I, permettent l’étude des réponses des lymphocytes T spécifiques à l’antigène développées dans le modèle tumoral B16F10-OVA. En combinant ce modèle avec la transplantation tumorale, les réponses immunitaires des lymphocytes T CD8+ spécifiques à l’antigène inhérents à la tumeur et d’origine périphérique ont été comparées pour révéler une transition dynamique entre ces deux populations. Collectivement, cette conception expérimentale a fourni une autre approche pour étudier avec précision les réponses immunitaires des lymphocytes T CD8+ dans le TME, ce qui jette un nouvel éclairage sur la dynamique des réponses immunitaires des lymphocytes T spécifiques à la tumeur dans le TME.
Protocole
Toutes les expériences sur la souris ont été réalisées conformément aux directives des comités institutionnels de soins et d’utilisation des animaux de la troisième université médicale militaire. Utilisez des souris C57BL/6 âgées de 6 à 8 semaines et des souris transgéniques OT-I naïves pesant de 18 à 22 g. Utilisez à la fois l’homme et la femme sans randomisation ni « aveugle ».
1. Préparation du milieu et des réactifs
- Préparer le milieu de culture cellulaire D10 tel que décrit précédemment29 en ajoutant 10 % de sérum fœtal bovin (FBS), 100 U/mL de pénicilline, 100 mg/mL de streptomycine et 2 mM de L-glutamine dans le milieu Eagle modifié de Dulbecco.
- Préparer le milieu de culture cellulaire R10 en complétant RPMI-1640 avec 10% FBS, 100 U / mL de pénicilline et 100 mg / mL de streptomycine.
REMARQUE: Les milieux de culture, D10 et R10, peuvent rester stériles et stables pendant au moins 2 semaines lorsqu’ils sont stockés à 2-4 ° C. - Préparez un tampon de tri cellulaire activé par fluorescence (FACS) en complétant 1x solution saline tamponnée au phosphate (PBS) avec 2% de FBS et 0,01% d’azoture de sodium.
REMARQUE: Avec l’ajout d’azoture de sodium, le tampon FACS peut être conservé à 2-4 ° C pendant des mois. - Préparez un tampon de lyse des globules rouges (RBL) en ajoutant 155 mM nh4Cl, 10 mM de KHCO3 et 0,1 mM d’acide tétraacétique d’éthylènediamine (EDTA) dans de l’eau double distillée, et ajustez son pH à 7,3.
REMARQUE: Le tampon RBL est stable jusqu’à 3 mois à température ambiante (RT). - Préparer un tampon de tri cellulaire activé magnétiquement (MACS) en complétant le PBS avec 0,5% d’albumine sérique bovine (BSA) et 2 mM d’EDTA.
REMARQUE: La solution doit être passée à travers un filtre de 0,22 μm après que le réactif est dissous et conservé dans l’asepsie. - Préparer une solution de travail de 2,2,2-tribromoéthanol.
- Dissoudre 2,5 g de 2,2,2-tribromoéthanol dans 5 mL d’alcool tert-amylique (2-méthyl-2-butanol). Incorporer un vibrateur à température constante baignant de vapeur à 180 tr/min, 40 °C pendant la nuit.
- Filtrer la solution à travers un filtre de 0,22 μm dans un récipient stérile. Ajouter l’eau doublement distillée jusqu’à un volume final de 200 mL et mélanger soigneusement et continuellement jusqu’à ce que la solution devienne claire et transparente.
- Déterminez et ajustez la valeur du pH de la solution à 7,3. Envelopper complètement le récipient avec du papier d’aluminium pour exclure la lumière et conserver à 4 °C.
NOTE: La concentration finale de la solution de travail de 2,2,2-tribromoéthanol est de 12,5 mg/mL. Une solution plus concentrée n’est pas recommandée car le matériau est irritant à des concentrations plus élevées. Testez la valeur du pH de la solution de travail avant chaque utilisation et jetez-la si le pH est inférieur à 5.
2. Préparation de la suspension cellulaire B16F10-OVA
REMARQUE: La culture cellulaire doit être réalisée dans une hotte de biosécurité dans des conditions aseptiques strictes.
- Décongeler et mettre en culture un flacon de cellules B16F10-OVA avec D10 dans un incubateur de culture cellulaire à 37 °C et 5% de CO2.
- Lorsque les cellules atteignent la confluence d’environ 80 à 90%, sous-cultivez les cellules.
- Retirez le milieu de culture à l’aide d’un pipetteur et rincez les cellules deux fois à l’aide de PBS.
REMARQUE: N’ajoutez pas de PBS avec force contre les cellules adhérentes dans la fiole ou la boîte de culture cellulaire. Au lieu de cela, pipettez le PBS vers un flanc ou ajoutez-le par goutte dans la fiole ou le plat. - Retirer le PBS et ajouter 1 à 2 mL de solution de trypsine-EDTA à 0,25 % dans la fiole ou le plat. Balancez-le d’avant en arrière pour couvrir toute la surface de la cellule. Placer la fiole ou la boîte dans un incubateur à 37 °C pendant ~1 min ou à TA jusqu’à ce que les cellules se détachent.
REMARQUE: Un microscope inversé peut être utilisé pour vérifier si les cellules se sont détachées. - Ajouter du D10 frais pour arrêter la trypsinisation. Pipettez la suspension de haut en bas pour s’assurer que toutes les cellules sont dissociées de la surface de la fiole ou de la vaisselle.
- Transférer la suspension de cellule B16F10-OVA dans un tube conique de 15 mL. Centrifuger les cellules à 125 × g pendant 5-7 min à RT.
- Jetez le surnageant et remettez en suspension la pastille de cellule avec D10. Distribuer la suspension cellulaire B16F10-OVA dans une nouvelle fiole ou boîte de culture cellulaire contenant du D10 et incuber dans un incubateur de culture cellulaire à 37 °C et 5 % de CO2.
- Retirez le milieu de culture à l’aide d’un pipetteur et rincez les cellules deux fois à l’aide de PBS.
- Le jour de l’implantation de la tumeur, récoltez les cellules B16F10-OVA qui sont confluentes à ~ 90% comme décrit aux étapes 2.2.1 à 2.2.4. Jetez le surnageant et remettez en suspension la pastille de cellule avec 1 mL de PBS.
- Comptez les cellules viables avec un hémocytomètre en utilisant 0,4% de bleu de trypan. Ajustez la densité cellulaire à 1 × 106 cellules par 100 μL en ajoutant PBS. Gardez les cellules sur la glace.
3. Implantation de tumeurs ectopiques de cellules B16F10-OVA dans la région inguinale de souris
- Utilisez des souris C57BL/6 âgées de 6 à 8 semaines pesant de 18 à 22 g. Utilisez à la fois l’homme et la femme sans randomisation ni « aveugle ».
- Prélever 100 μL de la suspension de cellules B16F10-OVA préparée dans une seringue de tuberculine de 1 mL. Appuyez sur le baril pour déplacer les bulles vers le haut et poussez doucement le piston pour éliminer les bulles d’air.
- Retenez la souris et exposez son abdomen. Appuyez sur la patte arrière gauche avec le petit doigt pour resserrer la peau de la région inguinale gauche.
- Retirez les poils de la souris de son bas-ventre gauche avec un rasoir électrique. Utilisez du coton imbibé d’éthanol à 75% pour nettoyer le quadrant postérieur de l’abdomen gauche.
- En tenant la seringue à un angle très peu profond (0-15°) avec le biseau de l’aiguille tourné vers le haut, insérez-la au site du haut de la cuisse gauche et avancez de 0,5 à 1 cm à travers le tissu sous-cutané dans la région inguinale.
- Tirez sur le piston avant l’injection. S’il y a une pression négative, appuyez complètement sur le piston et observez un petit bolus (formation de poche de liquide) dans la sous-cutis émerger.
REMARQUE: Si du sang est ramené dans le moyeu de l’aiguille, retirez et réessayez à un autre site. - Retirez l’aiguille après l’injection et jetez-la de manière appropriée. Relâchez et replacez la souris dans la cage.
- Mesurer la taille de la tumeur aux jours 6-8 en utilisant une échelle de vernier après l’implantation de B16F10-OVA. Sélectionnez des souris avec une tumeur d’environ 3 mm de diamètre (de la taille d’un haricot mungo) et divisez-les de manière égale et aléatoire en deux groupes.
REMARQUE: Les souris avec des tumeurs de taille similaire sont assignées au hasard comme souris donneuses et receveuses; le tissu tumoral apparié excisé de souris donneuses sera transplanté chez les souris receveuses. En outre, des témoins non opérés et des contrôles simulés devraient être inclus pour évaluer les effets de la chirurgie sur le transfert de cellules adoptives et sur la santé générale des souris. Ainsi, un groupe de souris porteuses de tumeurs sert de témoins non opérés, recevant soit des cellules CD45.1 + CD45.2+ ou CD45.1+ OT-I, mais pas de chirurgie. L’autre groupe de souris sert de témoins simulés, recevant des cellules CD45.1 + CD45.2+ ou CD45.1+ OT-I et une chirurgie ultérieure similaire au groupe expérimental, mais pas de transplantation d’allogreffe.
4. Transfert adoptif de lymphocytes T OT-I marqués congénitalement chez des souris porteuses de tumeurs
- La veille du transfert, administrer 4 mg de cyclophosphamide dissous dans 200 μL de PBS par injection intrapéritonéale à chaque souris porteuse de tumeur.
REMARQUE: Le traitement par cyclophosphamide vise à induire une lymphopénie chez l’hôte qui produit un « espace » pour les cellules transférées, favorisant leur survie et favorisant le fonctionnement efficace des organes lymphoïdes. - Utilisez des souris transgéniques OT-I naïves avec des marqueurs congéniques distincts (6-8 semaines, 18-22 g, du même sexe que les souris porteuses de tumeurs). Utilisez des souris OT-I CD45.1+ et des souris OT-I CD45.1+CD45.2+ pour transférer de manière adoptive des lymphocytes T spécifiques de l’antigène OVA257-264 à des souris donneuses et receveuses porteuses de tumeurs, respectivement.
REMARQUE: L’origine des cellules OT-I transférées de manière adoptive peut être facilement identifiée si elles présentent des marqueurs congéniques ou fluorescents distincts. Par exemple, injecter des lymphocytes T OT-I CD45.1+ dans des souris donneuses porteuses de B16F10-OVA tout en injectant des lymphocytes T OT-I CD45.1+CD45.2+ dans des souris receveuses porteuses de B16F10-OVA. CD45.1 et CD45.2 sont tous deux des isoformes du marqueur pan-lymphocytaire CD45 (Ly5). D’autres marqueurs congéniques couramment utilisés comprennent différentes isoformes de CD90 (Thy1). Ce protocole peut être utilisé pour les souris portant différents marqueurs congéniques. Les souris OT-I doivent être du même sexe que les souris recevant le transfert de cellules OT-I pour éviter les problèmes de rejet. - Isolez les lymphocytes de la rate et des ganglions lymphatiques de la souris OT-I.
REMARQUE: Les procédures suivantes dans cette étape doivent être effectuées dans une armoire de biosécurité pour maintenir une asepsie stricte.- Préparez deux boîtes de Petri de 60 mm × 10 mm. Ajouter 3 mL de milieu R10 dans un plat tout en ajoutant 3 mL de tampon RBL dans un autre plat. Placez une passoire à cellules en nylon de 70 μm dans la boîte contenant un tampon RBL.
- Euthanasier une souris OT-I dans une chambre d’isoflurane suivie d’une luxation cervicale.
- Récoltez les ganglions lymphatiques de la rate, inguinaux (sous-jacents) et axillaires de la souris et transférez-les dans un plat de 60 mm × de 10 mm avec 3 mL de R10 sur glace.
REMARQUE: Le nombre de souris OT-I sacrifiées peut être ajusté en fonction du nombre de souris porteuses de tumeurs à transférer. Un rendement typique de lymphocytes T OT-I CD8+ provenant d’une rate et de ganglions lymphatiques inguinaux et axillaires bilatéraux des lymphocytes T OT-I CD8+ est d’environ 30 à 100 × 106 cellules par souris. - À l’aide du baril d’extrémité d’une seringue de 1 mL, macérer la rate dans 3 mL de tampon RBL à travers la passoire. Incuber pendant 3 min à TA, et terminer la réaction en ajoutant 3 mL de milieu R10 froid.
- Écrasez les ganglions lymphatiques jusqu’à ce qu’il ne reste que des tissus conjonctifs. Rincez le filtre avec du R10. Transférer la suspension cellulaire dans un nouveau tube conique de 15 mL. Centrifuger à 500 × g, 4 °C pendant 6 min.
- Décantez le surnageant et remettez en suspension les cellules dans 3 mL de tampon MACS. Passez la suspension cellulaire à travers une nouvelle passoire cellulaire de 70 μm pour éliminer les flocs.
- Centrifuger la suspension de la cellule à 500 × g pendant 5 min à 4 °C. Décantez le surnageant.
- Utilisez un kit d’isolation des lymphocytes T CD8+ de souris (voir le Tableau des matériaux) pour purifier les lymphocytes T CD8+ par sélection négative, conformément au protocole du fabricant.
REMARQUE: Lorsque vous utilisez des kits d’autres sociétés, suivez les instructions du fabricant. - Conservez la suspension cellulaire purifiée sur la glace. Prélever un petit échantillon de cellules et mélanger avec du bleu de trypan pour compter les cellules à l’aide d’un hémocytomètre.
- Déterminer le pourcentage de cellules OT-I (vivants/morts-CD8+Va2+) par cytométrie en flux.
REMARQUE: La coloration simultanée des marqueurs congéniques et du TCR transgénique doit être effectuée pour vérifier le phénotype correct des cellules avant le transfert.- Ajouter 5 × 104-1 × 105 cellules dans 1 mL de tampon FACS dans un tube centrifuge de 1,5 mL, et centrifuger la suspension cellulaire à 350 × g, 4 °C pendant 3 min.
- Jetez le surnageant et dispersez les cellules en effleurant le fond du tube. Placez le tube sur de la glace.
- Préparer les mélanges d’anticorps conjugués suivants (dilués dans un tampon FACS de 100 μL) : anti-CD8, 1:200 ; anti-TCR Vα2, 1:100; anti-CD45.1, 1:200; anti-CD45.2, 1:200; et vivant/mort, 1:200 (voir la Table des matériaux).
- Vortex le cocktail d’anticorps et centrifugeuse à 15 000 × g pendant 3 min pour granuler les agrégats d’anticorps. Conservez le cocktail sur de la glace et protégez-le de la lumière.
- Resuspendez les cellules avec 100 μL de cocktail d’anticorps et mélangez soigneusement en agitant le tube. Incuber dans l’obscurité pendant 30 min sur de la glace.
REMARQUE: Évitez de perturber les agrégats d’anticorps au fond du tube. - Lavez les granulés deux fois avec 1 mL de tampon FACS. Centrifuger à 350 × g, 4 °C pendant 3 min. Remettez les cellules en suspension dans 200 μL de tampon FACS et transférez la suspension cellulaire dans un tube FACS.
REMARQUE: Pour maintenir la viabilité des cellules OT-I à transférer, testez l’échantillon dès que possible. Si les cellules OT-I colorées ne peuvent pas être testées immédiatement, gardez les cellules dans l’obscurité sur de la glace ou réfrigérez-les à 4 °C jusqu’à l’analyse. Alternativement, les échantillons peuvent être remis en suspension dans 1-4% de paraformaldéhyde pour un stockage prolongé (16 h) afin d’éviter toute détérioration. - Exécutez l’échantillon sur un cytomètre en flux. Calculer le pourcentage de cellules CD8+Va2+ vivantes/mortes en divisant le nombre de cellules vivantes/mortes CD8+Vα2+ par le nombre de cellules vivantes/mortes.
- Déterminer le nombre absolu de cellules OT-I (vivant/mortes-CD8+Va2+) en multipliant le pourcentage de cellules vivantes/mortes-CD8+Va2+ par le nombre de cellules viables obtenu à l’étape 4.3.9.
- Ajuster la concentration de cellules OT-I (vivants/morts-CD8+Va2+) à 1,5 × 106/mL avec PBS.
- Injecter 3 × 105 cellules OT-I distinctes marquées congénitalement (VIVANTS/MORTS-CD8+Va2+) dans 200 μL de PBS par voie intraveineuse dans deux groupes de souris porteuses de B16F10-OVA (souris porteuses de tumeurs divisées en souris donneuses et receveuses à partir de l’étape 3.8).
- Prélever 200 μL de suspension de cellules OT-I (CD8+Va2+ vivantes/mortes) dans une seringue à insuline de 100 U (29 G) et retirer les bulles comme à l’étape 3.2.
- Placez la souris séparément dans une cage avec une lampe infrarouge sur la cage pendant 5 à 10 minutes pour dilater la veine caudale. Immobilisez la souris avec un dispositif de retenue de taille appropriée. Tirez la queue pour la redresser et vaporisez de l’éthanol à 75% pour rendre la veine visible.
- Tenez la seringue parallèlement à la veine et insérez-la dans la veine à un angle de 0 à 15 °. Retirez légèrement le piston et, si du sang pénètre dans le barillet, injectez lentement et régulièrement la suspension à une vitesse maximale de 1 mL / min.
REMARQUE: La résistance ou l’enflure au site d’injection indique que l’aiguille n’est pas à l’intérieur de la veine; le site d’injection doit être déplacé par voie proximale. - Une fois l’injection terminée, retirez la seringue et appuyez doucement sur la zone d’insertion pendant 3 à 5 s pour arrêter le saignement. Remettez la souris dans la cage et observez-la de près pendant quelques minutes pour détecter les effets indésirables. S’il a une mobilité normale et un écoulement nasal, replacez-le en compagnie des autres souris.
5. Disséquer la masse tumorale de souris donneuses porteuses de tumeurs
REMARQUE: Maintenir des conditions stériles pendant la chirurgie dans les sections 5 et 6. Stériliser tous les instruments chirurgicaux par autoclavage avant et après chaque utilisation. Désinfecter la zone d’opération de l’armoire de biosécurité avec de l’éthanol à 75 % suivi d’une irradiation ultraviolette. Portez une blouse propre, une casquette, un masque facial et des gants stériles.
- Huit à dix jours après le transfert adoptif, sélectionnez des souris donneuses portant une masse tumorale comparable d’environ 5 mm de diamètre (taille de soja) pour la chirurgie de transplantation.
- Préparer un plat de 100 mm × de 20 mm dans une armoire de biosécurité et ajouter 10 mL de PBS stérile glacé.
- Euthanasier une souris donneuse porteuse de tumeur dans une chambre d’isoflurane suivie d’une luxation cervicale. Immerger la souris dans de l’éthanol à 75% pendant 3-5 min et transférer dans l’armoire de biosécurité.
REMARQUE: Les procédures suivantes dans cette étape doivent être effectuées dans une armoire de biosécurité pour maintenir une asepsie stricte. - Placez la souris sur une planche de dissection recouverte de papier absorbant propre en position couchée. Retenez les membres de la souris avec des aiguilles de dissection.
- Coupez la peau le long de la ligne médiane du haut de l’orifice urétral jusqu’au xiphoïde avec des ciseaux. Étirez la peau vers le côté gauche du corps de la souris avec une pince à épiler et retenez la peau avec des aiguilles de dissection.
- Excisez la tumeur, en gardant sa capsule aussi intacte que possible. Retirez soigneusement et doucement le tissu conjonctif près de la tumeur avec des ciseaux chirurgicaux.
REMARQUE: Pour maintenir l’intégrité de la tumeur, ne décollez pas la capsule tumorale ou ne coupez pas le tissu tumoral en morceaux. - Placez le tissu tumoral dans un plat de 100 mm × de 20 mm contenant 10 mL de PBS stérile glacé pour une transplantation ultérieure.
6. Transplantation sous-cutanée d’une tumeur dérivée d’un donneur sur les souris receveuses appariées à la tumeur
REMARQUE: L’allogreffe est censée être implantée dans le flanc inférieur de la souris du même côté que la tumeur précédemment existante pour que deux tumeurs s’écoulent vers le même ganglion lymphatique. Dans le protocole présenté ici, comme la tumeur B16F10-OVA a été implantée par voie sous-cutanée sur la région inguinale gauche de la souris (section 3), le tissu tumoral dérivé du donneur a été transplanté sur le flanc gauche du receveur dans cette étape. Le site de transplantation peut être adapté au premier site tumoral implanté.
- Anesthésier une souris receveuse appariée à une tumeur avec 250 mg / kg de 2,2,2-tribromoéthanol par injection intrapéritonéale. Pincez l’orteil d’un membre extenseur de la souris pour évaluer le niveau d’anesthésie et attendez l’absence de réflexe de douleur, ce qui indique la profondeur appropriée de l’anesthésie pour effectuer la chirurgie. Si une vocalisation ou un retrait des membres postérieurs est observé, injecter 0,01−0,03 mL de 2,2,2-tribromoéthanol.
REMARQUE: La souris receveuse appariée par tumeur doit être du même sexe que la souris donneuse qui fournit l’allogreffe pour éviter les problèmes de rejet. - Utilisez une pommade vétérinaire sur les yeux pour prévenir la sécheresse. Rasez le flanc gauche de la souris avec un rasoir électrique. Appliquez une crème dépilatoire pour enlever les poils restants.
REMARQUE: Évitez d’abraser la peau, ce qui peut augmenter le risque de contamination et d’infection. - Placez la souris dans l’armoire de biosécurité. Placez-le en position couchée sur une planche de dissection recouverte de papier absorbant propre, avec l’axe vertical de la souris parallèle et sa tête sur le côté droit de l’expérimentateur.
REMARQUE: Les procédures suivantes dans cette étape doivent être effectuées dans une armoire de biosécurité pour maintenir une asepsie stricte. - Frottez la peau de la zone rasée avec du coton imbibé de povidone-iode.
REMARQUE: Utilisez de la povidone-iode au lieu de l’éthanol à 75% pour la stérilisation afin d’éviter la perte de chaleur corporelle. - Soulevez la peau au point central entre les articulations de la hanche de la souris avec une pince à épiler chirurgicale. Utilisez les ciseaux pour faire une excision verticale de 5 mm de long. Étendez la coupe rostralement le long de la ligne médiane dorsale jusqu’à ~10-15 mm.
- Effectuez une dissection nette en insérant les pointes fermées des ciseaux dans l’incision, puis en ouvrant pour séparer le péritoine du flanc gauche de la peau et des tissus mous.
REMARQUE: Pour éviter de causer des dommages au tissu sous-cutané et au péritoine, soulevez la peau au centre de l’incision, puis insérez les ciseaux fermés aussi près que possible de la peau. - Faites une poche de peau sur le flanc gauche en effectuant une dissection nette plusieurs fois. Déposez la masse tumorale encapsulée et intacte dérivée du donneur dans la capsule.
REMARQUE: Les souris du groupe témoin opéré par simulacre reçoivent la même opération chirurgicale sans la greffe de tumeur dérivée du donneur. - Fermez l’incision par suture interrompue (voir Liste des matériaux). Placez 2-3 sutures pour chaque incision. Désinfectez la peau autour de la coupe avec du coton imbibé de povidone-iode.
REMARQUE: Il doit y avoir 5 mm entre deux points de suture consécutifs et une distance de 3 mm de l’incision. - Placez la souris en position latérale dans une cage propre et chaude. Surveillez-le continuellement jusqu’à ce qu’il ait retrouvé une conscience suffisante pour maintenir la position couchée sternale.
- Administrer la buprénorphine par voie sous-cutanée à une dose de 0,1 mg/kg de poids corporel toutes les 8 h trois fois après la chirurgie pour soulager la douleur. Surveillez la souris qui mange, boit, bouge et la zone opérée. Ne retournez le receveur de la greffe à la compagnie d’autres animaux qu’après qu’il se soit complètement rétabli.
REMARQUE: La souris se remet généralement du traumatisme de la chirurgie dans les 3 jours. Si la souris n’est pas revenue à une alimentation et à une mobilité normales et présente des manifestations d’infection, consultez un vétérinaire pour des interventions ou euthanasiez-la. - Sacrifier (euthanasier les animaux comme à l’étape 4.3.2) les souris aux points temporels indiqués, et récupérer les cellules d’intérêt pour l’analyse cytométrique en flux.
Résultats
Le schéma de ce protocole est illustré à la figure 1. Huit jours après l’inoculation tumorale, des cellules CD45.1+ et CD45.1+CD45.2+ OT-I ont été injectées dans des souris C57BL/6 porteuses de tumeurs B16F10-OVA. La tumeur a été disséquée chirurgicalement à partir de souris implantées par cellules CD45.1+ OT-I (donneuse) le jour 8 après le transfert et transplantée dans des souris CD45.1 + CD45.2+ OT-I implantées dans le flanc dorsal du même côté que la tumeur implantée. Grâce à l’analyse par cytométrie en flux (stratégie de contrôle illustrée à la figure 2), deux populations de lymphocytes T spécifiques de l’antigène tumoral CD44+CD8+ peuvent être facilement identifiées dans le TME, y compris les TIL CD45.1+ dérivés du donneur et CD45.1+CD45.2+ . Par la suite, les proportions de ces deux populations au sein des allogreffes ont été analysées à des moments indiqués pour étudier la dynamique des lymphocytes T CD8+ spécifiques de l’antigène. Au jour 2 après la transplantation, il y avait environ 83% de lymphocytes T CD8+ spécifiques à l’antigène dérivés du donneur dans la tumeur transplantée, plus prédominants que leurs homologues dérivés du receveur. Cependant, la proportion de cellules OT-I dérivées du receveur était élevée au stade avancé de la tumorigenèse, dépassant les cellules OT-I inhérentes à la tumeur dérivées du donneur. (Figure 3).
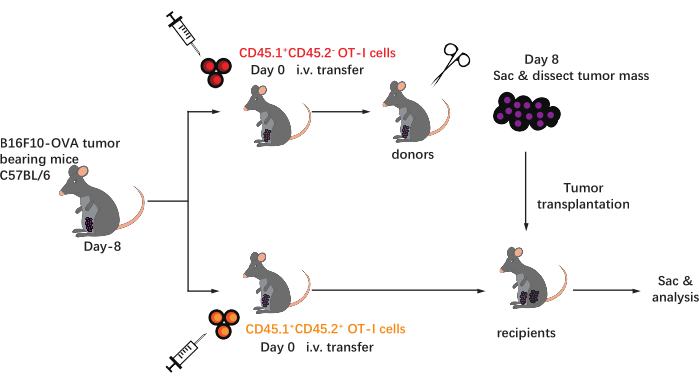
Figure 1 : Schéma du plan expérimental. C57BL / 6mice sont confrontés à une tumeur B16F10-OVA sur la région inguinale. Huit jours plus tard, différentes cellules OT-I marquées congénitalement (CD45.1+ ou CD45.1+CD45.2+) sont transférées dans des souris porteuses de tumeurs. Le jour 8 après le transfert, la tumeur sur les souris implantées par cellules CD45.1+ OT-I est disséquée chirurgicalement et transplantée par voie sous-cutanée dans des receveurs cd45.1 + CD45.2+ OT-I implantés dans le flanc du même côté que la tumeur existante. Ensuite, les souris sont sacrifiées et les cellules T spécifiques de l’antigène (cellules OT-I) dans les allogreffes sont analysées aux points de temps indiqués. Abréviations : CD = cluster de différenciation ; i.v. = intraveineuse; Sac = sacrifice. Veuillez cliquer ici pour voir une version agrandie de cette figure.
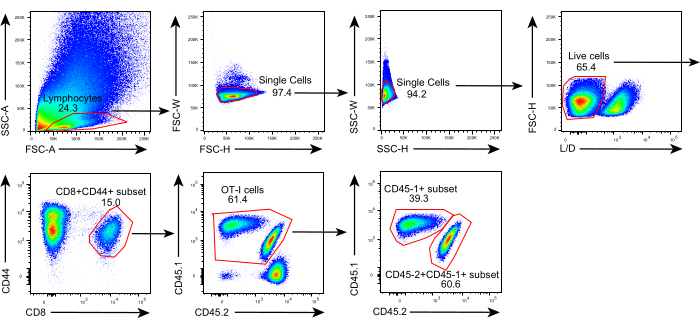
Figure 2 : Stratégie de contrôle de l’analyse de cytométrie en flux. Stratégie de contrôle utilisée pour identifier les lymphocytes T CD44+CD8+ spécifiques de l’antigène dérivés du donneur (CD45.1+CD45.2+) dans les allogreffes. Abréviations : SSC-A = zone de diffusion latérale; FSC-A = zone de diffusion vers l’avant; FSC-W = largeur de diffusion vers l’avant; FSC-H = hauteur de diffusion vers l’avant; SSC-W = largeur de diffusion latérale; SSC-H = hauteur de diffusion latérale; L/D = vivant/mort; CD = groupe de différenciation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Le rapport entre les lymphocytes T CD8+ spécifiques de l’antigène dérivé du donneur et du receveur dans les allogreffes tumorales. Diagrammes représentatifs de cytométrie en flux montrant l’expression des marqueurs congéniques CD45.1 et CD45.2 utilisés pour identifier les cellules OT-I dérivées du donneur et du receveur dans les allogreffes tumorales aux jours 2, 8 et 15 après la transplantation. Les chiffres représentent les pourcentages des deux sous-ensembles de la population de lymphocytes T CD44+CD8+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’immunité médiée par les lymphocytes T joue un rôle crucial dans les réponses immunitaires contre les tumeurs, les CTL jouant le rôle principal dans l’éradication des cellules cancéreuses. Cependant, les origines des CTL spécifiques de l’antigène tumoral dans le TME n’ont pas été élucidées30. L’utilisation de ce protocole de transplantation tumorale a fourni un indice important que les lymphocytes T CD8+ spécifiques de l’antigène intratumoral peuvent ne pas persister longtemps, malgré l’existence de lymphocytes TCF1+ progéniteurs TCF1+ de type souche. Notamment, il y a un afflux continu de cellules T CD8+ spécifiques à la tumeur dérivées de la périphérie dans la masse tumorale.
À notre connaissance, il s’agit d’une méthode relativement pratique et convaincante confirmant que le maintien des lymphocytes T CD8+ spécifiques à l’antigène dans le TME dépend principalement de la reconstitution des lymphocytes T CD8+ spécifiques à la tumeur dérivée de la périphérie plutôt que de l’auto-renouvellement des TIL résidents de la tumeur. Bien que le protocole présenté ici ne se concentre que sur les proportions de TIL dérivés et de RECEVEUR, les propriétés phénotypiques, fonctionnelles et transcriptionnelles de ces deux populations peuvent être facilement examinées par cytométrie en flux. De plus, il est possible de combiner des anticorps ICB pour étudier les réponses d’un sous-ensemble cellulaire spécifique au traitement ICB.
Dans ce protocole, le tissu tumoral dérivé du donneur est transplanté sur la souris receveuse avec une tumeur originale existante. Deux tumeurs chez une souris receveuse conduiront à la distribution des lymphocytes T générés par la périphérie en deux masses tumorales. De plus, la charge tumorale sera presque doublée par rapport aux animaux sans greffe. Dans des expériences pilotes, nous avons tenté d’exciser la tumeur d’origine sur des souris receveuses avant la transplantation; cependant, il était techniquement difficile d’éliminer toutes les cellules tumorales par chirurgie à fond. Les cellules tumorales résiduelles formeraient rapidement et formeraient bientôt un nouveau tissu tumoral. Ainsi, il y a une limitation pour ce système lors de la comparaison des réponses immunitaires des lymphocytes T avec celles de souris non transplantées. Cependant, ce système est toujours utile pour la comparaison des cellules T récemment migrées et existantes au sein du même TME transplanté à partir de souris porteuses de tumeurs donneuses. En outre, il est indéniable que la transplantation de tissu tumoral peut entraîner une inflammation, ce qui pourrait influencer la dynamique des cellules immunitaires au sein de la tumeur. Bien que l’impact de la chirurgie sur l’infiltration des cellules OT-I puisse être exclu par des contrôles non opérés et simulés, nous n’avons pas évalué les effets des réponses inflammatoires locales à la dynamique des cellules OT-I.
Certaines considérations doivent être prises en compte, dont l’une est l’utilisation du cyclophosphamide. Le cyclophosphamide31 est un agent alkylant largement utilisé pour traiter les tumeurs malignes des organes solides et les troubles lymphoprolifératifs et auto-immuns. Six à huit jours après l’inoculation de B16F10-OVA, le cyclophosphamide est administré avant le transfert adoptif pour induire la lymphodéplétion des souris hôtes et améliorer l’activité des cellules OT-I transférées29. Bien que le mélanome ne soit pas sensible à ce réactif, certaines lignées cellulaires tumorales, telles que EG732, une lignée cellulaire de lymphome thymique murin, répondent au cyclophosphamide. Le traitement des souris porteuses d’EG7 avec du cyclophosphamide entraîne l’éradication des tumeurs, ce qui suggère que le cyclophosphamide doit être soigneusement utilisé ou titré pour les modèles tumoraux sensibles. La méthode alternative recommandée est une dose sublétale unique de rayonnement (4,5-5,5 Gy) un jour avant le transfert, et le choix optimal dépend de la caractéristique des lignées cellulaires tumorales.
D’autres mesures doivent être prises avec prudence, y compris la sélection minutieuse des souris donneuses porteuses de tumeurs et l’opération chirurgicale délicate lors de la transplantation tumorale. Les tumeurs implantées seraient enlevées chirurgicalement et transplantées chez des souris receveuses appariées par tumeur 8 à 10 jours après le transfert. Avant la transplantation, une taille comparable de masse tumorale d’environ 5 mm de diamètre doit être choisie comme allogreffe pour réduire les écarts entre les souris individuelles et rendre les données acquises plus fiables. De plus, pendant la chirurgie, l’incision doit être près de la ligne médiane du dos de la souris pour maintenir l’allogreffe à une distance de la tumeur déjà existante chez la souris receveuse. Un curage doux est également suggéré pour prévenir les blessures sur le ganglion lymphatique inguinal et les tissus environnants.
La destruction efficace des cellules cancéreuses nécessite la coordination de divers composants au sein du TME33. Le protocole présenté ici peut être étendu à l’étude des cellules immunitaires adaptatives et innées telles que les cellules tueuses naturelles, les macrophages associés aux tumeurs et les cellules dendritiques. De plus, en plus du B16F10-OVA utilisé ici, ce protocole peut être appliqué à d’autres modèles de tumeurs sous-cutanées. Pour conclure, le test de transplantation tumorale susmentionné offre une nouvelle approche pour l’étude des transitions interactives de certains types de cellules immunitaires au cours des réponses antitumorales et est utile pour les chercheurs en immunologie tumorale.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été soutenue par des subventions du National Natural Science Fund for Distinguished Young Scholars (n ° 31825011 à LY) et de la National Natural Science Foundation of China (n ° 31900643 à QH, n ° 31900656 à ZW).
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
Références
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867(2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794(2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507(2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169(2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806(2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon