Method Article
마우스에서 종양 침윤성 CD8+ T 세포의 역학을 평가하기 위한 종양 이식
Erratum Notice
요약
여기에서, 마우스 종양 모델에서 종양 내재 및 주변부 유래 종양 침윤된 림프구의 특성화를 위한 종양 이식 프로토콜을 제시한다. 유세포 분석기를 사용한 수용자 유래 면역 세포의 유입에 대한 특이적 추적은 항종양 면역 반응 동안 이들 세포의 표현형 및 기능적 변화의 역학을 드러낸다.
초록
T 세포 매개 면역은 종양에 대한 면역 반응에 중요한 역할을하며, 세포독성 T 림프구 (CTLs)는 암 세포를 근절하는 데 주도적 인 역할을합니다. 그러나, 종양 미세환경(TME) 내의 종양 항원-특이적 CD8+ T 세포의 기원 및 보충은 모호한 채로 남아있다. 이 프로토콜은 대리 신항원, 난알부민 (OVA) 및 TCR 트랜스제닉 OT-I 마우스를 안정적으로 발현하는 B16F10-OVA 흑색종 세포주를 채용하며, 여기서 CD8+ T 세포의 90% 이상이 클래스 I 주조직 적합성 복합체 (MHC) 분자 H2-Kb에 결합된 OVA 유래 펩티드 OVA 257-264 (SIINFEKL)를 특이적으로 인식한다. 이러한 특징들은 종양발생 동안 항원-특이적 T 세포 반응의 연구를 가능하게 한다.
이 모델을 종양 이식 수술과 결합하여, 기증자의 종양 조직을 종양과 일치하는 합성 수용자 마우스에 이식하여 이식된 기증자 조직으로의 수용자 유래 면역 세포의 유입을 정확하게 추적하여, 종양 고유 및 주변부 기원 항원 특이적 CD8+ 의 면역 반응을 분석할 수 있게 하였다. T 세포. 이 두 집단 사이에서 역동적 인 전환이 일어나는 것으로 나타났습니다. 총체적으로,이 실험 설계는 TME에서 CD8+ T 세포의 면역 반응을 정확하게 조사하기위한 또 다른 접근법을 제공했으며, 이는 종양 면역학에 대한 새로운 빛을 비출 것입니다.
서문
CD8+ T 세포-매개 면역 반응은 종양 성장을 조절하는데 중추적인 역할을 한다. 종양 생성 동안, 나이브 CD8+ T 세포는 MHC 클래스 I-제한 방식으로 항원 인식시 활성화되고, 이어서 이펙터 세포로 분화되고 종양 질량 1,2로 침윤된다. 그러나, 종양 미세환경(TME) 내에서, 장기간의 항원 노출, 뿐만 아니라 면역억제 인자는, 침윤된 종양 특이적 CD8+ T 세포를 "고갈"3으로 알려진 저반응 상태로 유도한다. 고갈된 T 세포 (Tex)는 급성 바이러스 감염에서 생성된 이펙터 또는 기억 T 세포와 구별되며, 전사적으로 및 후성유전학적으로 둘 다이다. 이들 텍스 세포는 주로 일련의 억제 수용체의 지속적이고 상승된 발현뿐만 아니라 이펙터 기능의 계층적 손실을 특징으로 한다. 또한, 소진된 CD8+ T 세포의 손상된 증식 능력은 종양 특이적 T 세포의 수의 감소를 초래하여, TME 내의 잔류 CD8+ T 세포가 종양 진행에 대해 충분한 보호 면역을 간신히 제공할 수 있다3. 따라서, 종양내 항원-특이적 CD8+ T 세포의 유지 또는 강화는 종양 억제에 필수적이다.
더욱이, 면역 체크포인트 봉쇄 (ICB) 요법은 T 세포 침윤을 증가시킴으로써 종양에서 텍스를 다시 활성화시키고, 따라서, T 세포 수 및 회춘 T 세포 기능을 활성화시켜 종양 억제를 증진시키는 것으로 여겨진다. ICB 치료의 광범위한 적용은 암 치료 환경을 변화시켰으며, 환자의 상당 부분이 내구성 있는 반응을 경험하고있다 4,5,6. 그럼에도 불구하고, 대부분의 환자와 암 유형은 ICB에 일시적으로 반응하지 않거나 단지 일시적으로 반응한다. TME에서의 부적절한 T 세포 침윤은 ICB 내성 7,8을 차지하는 근본적인 메카니즘 중 하나로 가정되었다.
몇몇 연구는 환자 및 마우스 모델 9,10,11,12 모두에서 종양 침윤성 CD8+ T 세포 (TILs)의 이질성을 입증하였다. 종양 덩어리에서 T 세포 인자-1 (TCF1)을 발현하는 CD8+ T 세포의 서브세트가 줄기 세포 유사 특성을 나타내는 것으로 확인되었으며, 이는 말기 소모 된 T 세포를 더 일으킬 수 있으며 ICB 치료 후 증식 파열을 담당합니다 12,13,14,15,16,17,18,19,20, 21,22년. 그러나, 항원 특이적 TCF1+CD8+ T 세포의 단지 작은 비율만이 TME에 존재하고, ICB23,24,25,26에 반응하여 분화된 자손의 확장된 풀을 생성한다는 것이 입증되었다. 이 집단의 제한된 크기가 종양 진행을 조절하기 위해 세포독성 T 림프구 (CTLs)의 지속성을 보장하기에 충분한지 여부는 알려지지 않았으며, 주변 조직으로부터 보충이 있는지 여부는 추가 조사가 필요하다. 더욱이, 최근의 연구는 기존의 종양 특이적 T 세포의 불충분한 활성화 능력 및 항프로그램된 세포 사멸 단백질 1 처리 후에 신규한, 이전에 존재하지 않는 클론형의 출현을 시사한다. 이는 체크포인트 차단에 대한 T 세포 반응이 T 세포 클론(27)의 별개의 레퍼토리의 새로운 유입에 기인할 수 있음을 나타낸다. TME에서 방관자 비종양 반응성 세포독성 T 세포 분획의 존재와 함께, 이러한 발견은 주변부 유래 CD8+ T 세포11의 역할을 연구하기 위한 종양 동종이식편 모델의 확립을 촉발시켰다.
지금까지, 여러 종류의 종양 이식뿐만 아니라 면역 세포 입양 전달이 종양 면역학28 분야에서 널리 사용되어 왔다. TILs, 말초 혈액 단핵 세포, 및 종양-반응성 면역 세포는 다른 조직으로부터 기원된 이들 방법을 사용하여 잘 특성화될 수 있다. 그러나, 전신 및 국소 항종양 면역 사이의 상호작용을 연구할 때, 이들 모델은 주변부와 TME로부터 유래된 면역 세포 사이의 상호작용을 조사하기에 부적합한 것으로 보인다. 여기서, 종양 조직을 공여자로부터 종양 매칭 수용자 마우스로 이식하여 수용자 유래 면역 세포의 유입을 정확하게 추적하고 TME에서 공여체 유래 세포를 동시에 관찰하였다.
본 연구에서, 대리 신항원 난알부민을 안정적으로 발현하는 B16F10-OVA 흑색종 세포주와 함께 흑색종의 뮤린 신생 모델이 확립되었다. CD8+ T 세포의 90% 이상이 클래스 I MHC 분자 H2-Kb에 결합된 OVA 유래 펩티드 OVA257-264(SIINFEKL)를 특이적으로 인식하는 TCR 트랜스제닉 OT-I 마우스는 B16F10-OVA 종양 모델에서 개발된 항원 특이적 T 세포 반응의 연구를 가능하게 한다. 이 모델을 종양 이식과 결합하여, 종양-고유 및 주변-기원 항원-특이적 CD8+ T 세포의 면역 반응을 비교하여, 이들 두 집단 사이의 동적 전이를 드러냈다. 총체적으로, 이 실험 설계는 TME에서 CD8+ T 세포의 면역 반응을 정밀하게 조사하기 위한 또 다른 접근법을 제공하였고, 이는 TME에서 종양 특이적 T 세포 면역 반응의 역학에 대한 새로운 빛을 발산한다.
프로토콜
모든 마우스 실험은 세 번째 군사 의과 대학의 기관 동물 관리 및 사용위원회의 지침에 따라 수행되었습니다. 6-8 주령의 C57BL / 6 마우스와 18-22 g의 나이브 OT-I 트랜스제닉 마우스를 사용하십시오. 무작위 추출이나 "눈부심"없이 남성과 여성 모두를 사용하십시오.
1. 배지 및 시약의 제조
- 앞서 기술한 바와 같이 세포 배양 배지 D10을 준비하고, 둘베코의 변형 이글 배지에 10% 우태아 혈청(FBS), 100 U/mL 페니실린, 100 mg/mL 스트렙토마이신 및 2 mM L-글루타민을 첨가한다.
- RPMI-1640에 10% FBS, 100 U/mL 페니실린 및 100mg/mL 스트렙토마이신을 보충하여 세포 배양 배지 R10을 준비합니다.
참고: 배양 배지인 D10 및 R10은 2-4°C에서 보관할 때 적어도 2주 동안 멸균되고 안정하게 유지될 수 있다. - 1x 인산완충식염수(PBS)에 2% FBS와 0.01%의 아지드나트륨을 보충하여 형광활성화세포분류(FACS) 완충액을 준비한다.
참고: 나트륨 아지드를 첨가하면 FACS 버퍼를 2-4°C에서 수개월 동안 보관할 수 있습니다. - 이중 증류수에 155 mMNH4Cl, 10 mMKHCO3 및 0.1 mM 에틸렌디아민테트라아세트산(EDTA)을 첨가하여 적혈구 용해(RBL) 완충액을 제조하고, pH를 7.3으로 조절한다.
참고: RBL 버퍼는 실온(RT)에서 최대 3개월 동안 안정적입니다. - PBS에 0.5% 소 혈청 알부민(BSA) 및 2mM EDTA를 보충하여 자기 활성화 세포 분류 (MACS) 완충액을 준비한다.
참고: 시약이 용해되고 무균에 보존된 후 용액은 0.22μm 필터를 통과해야 합니다. - 2,2,2-트리브로모에탄올의 작업 용액을 준비하십시오.
- 2.5 g의 2,2,2-트리브로모에탄올을 5 mL의 tert-아밀 알코올 (2-메틸-2-부탄올)에 녹인다. 증기 입욕, 180 rpm, 40°C에서 밤새 정온 진동기에서 저어준다.
- 용액을 0.22 μm 필터를 통해 멸균 용기에 여과한다. 최종 부피 200 mL까지 이중 증류수를 첨가하고 용액이 맑고 투명해질 때까지 철저하고 지속적으로 혼합하십시오.
- 결정하고 용액의 pH 값을 7.3으로 조정한다. 용기를 알루미늄 호일로 완전히 감싸서 빛을 배제하고 4°C에서 보관한다.
참고 : 2,2,2- 트리 브로 모 에탄올의 작업 용액의 최종 농도는 12.5 mg / mL입니다. 더 농축 된 용액은 재료가 더 높은 농도에서 자극적이기 때문에 권장되지 않습니다. 각 사용 전에 작업 용액의 pH 값을 테스트하고 pH가 5보다 작 으면 폐기하십시오.
2. B16F10-OVA 세포 현탁액의 제조
참고 : 세포 배양은 엄격한 무균 조건 하에서 생물 안전 후드에서 수행되어야합니다.
- B16F10-OVA 세포의 바이알을 37°C 및 5%CO2의 세포 배양 인큐베이터에서 D10과 함께 해동시키고 배양하였다.
- 세포가 약 80-90%의 컨플루언시에 도달하면, 세포를 계대배양한다.
- 피펫터로 배양액을 제거하고, PBS를 이용하여 세포를 두 번 헹구었다.
참고: 플라스크 또는 세포 배양 접시에서 부착성 세포에 대해 PBS를 강제로 첨가하지 마십시오. 대신, PBS를 측벽 쪽으로 피펫하거나 플라스크 또는 접시에 드롭 방식으로 첨가하십시오. - PBS를 제거하고, 0.25% 트립신-EDTA 용액 1-2 mL를 플라스크 또는 접시에 첨가한다. 전체 세포 표면을 덮기 위해 앞뒤로 흔든다. 플라스크 또는 디쉬를 세포가 분리될 때까지 37°C에서 ~1분 동안 또는 RT에서 인큐베이터에 놓는다.
참고: 거꾸로 된 현미경을 사용하여 세포가 분리되었는지 여부를 확인할 수 있습니다. - 트립신화를 중지하기 위해 신선한 D10을 추가하십시오. 현탁액을 위아래로 피펫하여 모든 세포가 플라스크 또는 접시 표면으로부터 해리되도록 한다.
- B16F10-OVA 세포 현탁액을 15 mL 원뿔형 튜브로 옮긴다. 세포를 RT에서 5-7분 동안 125 × g 에서 원심분리한다.
- 상청액을 버리고, 세포 펠릿을 D10으로 재현탁시킨다. B16F10-OVA 세포 현탁액을 D10을 함유하는 새로운 플라스크 또는 세포 배양 접시에 분주하고 37°C 및 5%CO2의 세포 배양 배양기에서 배양한다.
- 피펫터로 배양액을 제거하고, PBS를 이용하여 세포를 두 번 헹구었다.
- 종양 이식 당일에, 단계 2.2.1 내지 2.2.4에 기재된 바와 같이 ∼90% 합류하는 B16F10-OVA 세포를 수확한다. 상청액을 버리고, 세포 펠릿을 PBS 1 mL로 재현탁시켰다.
- 0.4% 트리판 블루를 사용하여 혈구측정기로 생존 가능한 세포를 계수하십시오. PBS를 첨가하여 세포 밀도를 100 μL 당 1 × 106 세포로 조정하였다. 세포를 얼음 위에 보관하십시오.
3. 마우스의 사타구니 부위에 B16F10-OVA 세포의 자궁외 종양 이식
- 체중이 18-22g인 6-8주령의 C57BL/6 마우스를 사용합니다. 무작위 추출이나 "눈부심"없이 남성과 여성 모두를 사용하십시오.
- 제조된 B16F10-OVA 세포 현탁액 100 μL를 1 mL 투베르쿨린 주사기에 넣고 인출한다. 배럴을 탭하여 거품을 상단으로 이동시키고 플런저를 부드럽게 밀어 기포를 제거하십시오.
- 마우스를 제지하고 복부를 노출시킵니다. 새끼 손가락으로 왼쪽 뒷다리를 눌러 왼쪽 사타구니 부위의 피부를 조입니다.
- 전기 면도기로 왼쪽 하복부에서 마우스의 머리카락을 제거하십시오. 75 % 에탄올에 적신 면화를 사용하여 왼쪽 복부의 후부 사분면을 청소하십시오.
- 바늘의 경사가 위쪽을 향하도록 주사기를 매우 얕은 각도 (0-15 °)로 잡고 왼쪽 위 허벅지 부위에 삽입하고 피하 조직을 통해 사타구니 영역으로 0.5-1cm 전진시킵니다.
- 주사하기 전에 플런저를 뒤로 당깁니다. 음압이있는 경우, 플런저를 완전히 누르고 서브 클리티스에 작은 볼루스 (유체 포켓 형성)가 나타나는 것을 관찰하십시오.
참고: 혈액이 바늘 허브로 다시 유입되면 철수하고 다른 부위에서 다시 시도하십시오. - 주사가 수행 된 후 바늘을 제거하고 적절하게 폐기하십시오. 마우스를 떼어 케이지에 다시 넣습니다.
- B16F10-OVA 이식 후 버니어 스케일을 사용하여 6-8일째에 종양 크기를 측정한다. ~ 3mm 직경 (녹두 크기) 종양을 가진 마우스를 선택하고 동등하게 무작위로 두 그룹으로 나눕니다.
참고: 비슷한 크기의 종양을 가진 마우스는 무작위로 기증자 및 수용자 마우스로 할당됩니다. 공여체 마우스로부터 적출된 매칭된 종양 조직은 수용자 마우스에 이식될 것이다. 또한, 입양 세포 전달 및 마우스의 일반적인 건강에 대한 수술의 효과를 평가하기 위해 비 조작 제어 및 가짜 조작 제어가 포함되어야합니다. 따라서, 종양 보유 마우스의 한 그룹은 CD45.1+CD45.2+ 또는 CD45.1+ OT-I 세포를 투여받지만 수술은 받지 않은 비-조작된 대조군으로서 작용한다. 다른 그룹의 마우스는 CD45.1+CD45.2+ 또는 CD45.1+ OT-I 세포 및 후속 수술을 받은 가짜 조작 대조군으로서 작용하며, 실험군과 유사하지만 동종이식편 이식은 하지 않는다.
4. 선천적으로 표시된 OT-I T 세포를 종양 보유 마우스로 입양 전달
- 전사 전날, PBS 200 μL에 용해된 사이클로포스파미드 4 mg을 복강내 주사를 통해 각 종양 보유 마우스에 투여한다.
참고 : 사이클로 포스파미드 치료는 전달 된 세포를위한 "공간"을 생산하는 숙주에서 림프구 감소증을 유도하여 생존을 촉진하고 림프성 장기에 호밍하여 효율적으로 기능하는 것을 목표로합니다. - 뚜렷한 동종 마커 (6-8 주령, 18-22 g, 종양 보유 마우스와 동일성)가있는 순진한 OT-I 트랜스제닉 마우스를 사용하십시오. CD45.1+ OT-I 마우스 및 CD45.1+CD45.2+ OT-I 마우스를 사용하여 OVA257-264 항원 특이적 T 세포를 각각 종양 보유 공여자 및 수용자 마우스로 입양적으로 전달한다.
참고: 입양적으로 전이된 OT-I 세포의 기원은 뚜렷한 원성 또는 형광 마커를 표시하면 쉽게 확인할 수 있습니다. 예를 들어, CD45.1+ OT-I T 세포를 B16F10-OVA 보유 공여자 마우스에 주입하면서 CD45.1+CD45.2+ OT-I T 세포를 B16F10-OVA 보유 수용자 마우스에 주입한다. CD45.1 및 CD45.2는 둘 다 범림프구 마커 CD45(Ly5)의 이소형이다. 다른 일반적으로 사용되는 원생 마커는 CD90 (Thy1)의 상이한 이소형을 포함한다. 이 프로토콜은 상이한 원생 마커를 운반하는 마우스에 사용될 수 있다. OT-I 마우스는 거부 문제를 피하기 위해 OT-I 세포 전달을 받는 마우스와 동일한 성별이어야 한다. - OT-I 마우스의 비장 및 림프절로부터 림프구를 분리한다.
참고: 이 단계의 다음 절차는 엄격한 무균을 유지하기 위해 생물 안전 캐비닛에서 수행되어야 합니다.- 두 개의 60mm × 10mm 페트리 접시를 준비하십시오. R10 배지 3 mL를 한 접시에 넣고 RBL 버퍼 3 mL를 다른 접시에 넣으십시오. 70 μm 나일론 세포 스트레이너를 RBL 완충액을 함유하는 접시에 넣는다.
- OT-I 마우스를 이소플루란 챔버에서 안락사시킨 후 자궁경부 탈구를 실시한다.
- 마우스의 비장, 사타구니 (subiliac) 및 겨드랑이 림프절을 수확하여 얼음 위에 3 mL의 R10이 들어있는 60mm × 10mm 접시로 옮깁니다.
주: 희생된 OT-I 마우스의 수는 전이될 종양 보유 마우스의 수에 따라 조정될 수 있다. OT-I CD8+ T 세포의 비장 및 양측 사타구니 및 액와부 림프절로부터의 OT-I CD8+ T 세포의 전형적인 수율은 마우스 당 ∼30-100 × 106 세포이다. - 1 mL 주사기의 말단 배럴을 사용하여, 비장을 스트레이너를 통해 3 mL의 RBL 완충액에 침지시킨다. RT에서 3분 동안 인큐베이션하고, 차가운 R10 배지 3 mL를 첨가하여 반응을 종결시킨다.
- 결합 조직 만 남을 때까지 림프절을 매시하십시오. R10으로 필터를 헹구십시오. 세포 현탁액을 새로운 15 mL 코니컬 튜브로 옮긴다. 500 × g, 4°C에서 6분 동안 원심분리한다.
- 상청액을 데칸트하고, 세포를 3 mL의 MACS 완충액에 재현탁시켰다. 세포 현탁액을 새로운 70 μm 세포 스트레이너를 통해 통과시켜 임의의 플록을 제거한다.
- 세포 현탁액을 500 × g 에서 4°C에서 5분 동안 원심분리한다. 상층액을 데칸트하십시오.
- 마우스 CD8+ T 세포 분리 키트(물질 표 참조)를 사용하여 제조업체의 프로토콜에 따라 음성 선택에 의해 CD8+ T 세포를 정제한다.
참고: 다른 회사의 키트를 사용하는 경우 제조업체의 지침을 따르십시오. - 정제된 세포 현탁액을 얼음 위에 보관하십시오. 작은 세포 샘플을 채취하고 트리판 블루와 혼합하여 혈구 세포계를 사용하여 세포를 계산합니다.
- 유세포 분석기에 의해 OT-I (라이브/데드-CD8+Va2+) 세포의 백분율을 결정한다.
참고: 동종 마커와 트랜스제닉 TCR의 동시 염색은 전사 전에 세포의 정확한 표현형을 확인하기 위해 수행되어야 한다.- 5 × 104-1 × 105 세포를 1.5 mL 원심분리 튜브에 FACS 버퍼 1 mL에 넣고, 세포 현탁액을 350 × g, 4°C에서 3분 동안 원심분리한다.
- 상청액을 버리고, 튜브의 바닥을 휙휙 분산시킨다. 튜브를 얼음 위에 놓습니다.
- 다음 컨쥬게이션된 항체 혼합물 (100 μL FACS 완충액으로 희석)을 준비한다: 항-CD8, 1:200; 항-TCR Vα2, 1:100; 항-CD45.1, 1:200; 항-CD45.2, 1:200; 그리고 살아있는 / 죽음, 1:200 ( 자료 표 참조).
- 항체 칵테일을 볼텍스 및 15,000 × g 에서 3분 동안 원심분리하여 항체 응집체를 펠릿화한다. 칵테일을 얼음에 보관하고 빛으로부터 보호하십시오.
- 세포를 100 μL의 항체 칵테일로 재현탁시키고 튜브를 플릭싱하여 완전히 혼합한다. 얼음 위에서 30 분 동안 어둠 속에서 배양하십시오.
참고: 튜브 바닥에서 항체 응집체를 방해하지 마십시오. - 펠렛을 FACS 버퍼 1mL로 두 번 세척한다. 350 × g, 4°C에서 3분 동안 원심분리한다. 세포를 200 μL의 FACS 완충액에 재현탁시키고, 세포 현탁액을 FACS 튜브로 옮긴다.
참고: 전사될 OT-I 세포의 생존력을 유지하려면 가능한 한 빨리 시편을 시험하십시오. 염색된 OT-I 세포를 즉시 시험할 수 없는 경우, 세포를 얼음 위에 어둠 속에 두거나 분석될 때까지 4°C에서 냉장 보관한다. 대안적으로, 샘플은 열화를 방지하기 위해 연장된 저장 (16 h)을 위해 1-4% 파라포름알데히드에 재현탁될 수 있다. - 표본을 유세포 분석기에서 실행하십시오. 라이브/데드-CD8+Vα2+ 세포의 수를 라이브/데드-세포의 수로 나누어 라이브/데드-CD8+Va2+ 세포의 백분율을 계산합니다.
- 라이브/데드-CD8+Va2+ 세포의 백분율에 단계 4.3.9에서 얻은 생존 가능한 세포 번호를 곱하여 OT-I 세포(라이브/데드-CD8+Va2+)의 절대 수를 결정한다.
- OT-I 세포 (라이브/데드-CD8+Va2+)의 농도를 PBS로 1.5 × 106 /mL로 조정한다.
- 3 × 10 5개의 별개의 선천적으로 표시된 OT-I 세포(라이브/데드-CD8+Va2+)를 200 μL의 PBS에 정맥내 B16F10-OVA 보유 마우스(종양 보유 마우스로 나뉘어 단계 3.8의 공여자 및 수용자 마우스로 나눠짐)의 두 그룹으로 정맥내 주사한다.
- 200μL의 OT-I 세포(라이브/데드-CD8+Va2+) 현탁액을 100U 인슐린 주사기(29G)로 회수하고, 단계 3.2에서와 같이 기포를 제거한다.
- 꼬리 정맥을 확장시키기 위해 새장 위에 적외선 램프가있는 케이지에 마우스를 별도로 5-10 분 동안 놓습니다. 적절한 크기의 억제 장치로 마우스를 고정시킵니다. 꼬리를 당겨 곧게 펴고 75 % 에탄올로 스프레이하여 정맥을 보이게하십시오.
- 주사기를 정맥에 평행하게 잡고 0-15 ° 각도로 정맥에 삽입하십시오. 플런저를 약간 뒤로 당기고 혈액이 배럴에 들어가면 천천히 그리고 꾸준히 1 mL / min 이하의 속도로 현탁액을 주입하십시오.
참고 : 주사 부위의 저항 또는 팽창은 바늘이 정맥 내부에 있지 않음을 나타냅니다. 주사 부위는 근접하게 이동해야합니다. - 주사가 완료된 후 주사기를 제거하고 삽입 부위를 3-5 초 동안 부드럽게 눌러 출혈을 멈 춥니 다. 마우스를 케이지로 돌려 놓고 부작용이 있는지 몇 분 동안 면밀히 관찰하십시오. 정상적인 이동성과 비강 분비물이있는 경우 다른 마우스의 회사에 다시 넣으십시오.
5. 종양을 가진 기증자 쥐에게서 종양 질량을 해부하십시오
참고: 섹션 5와 6에서 수술 중 멸균 상태를 유지하십시오. 각 사용 전후에 오토클레이빙을 통해 모든 수술기구를 멸균하십시오. 생물 안전 캐비닛의 작동 영역을 75 % 에탄올로 소독 한 다음 자외선을 조사하십시오. 깨끗한 가운, 모자, 얼굴 마스크 및 멸균 장갑을 착용하십시오.
- 입양 이식 후 여덟 내지 열흘 후, 이식 수술을 위해 직경 ~5 mm(대두 크기)의 대등한 종양 질량을 지닌 기증자 마우스를 선택한다.
- 생물 안전 캐비닛에 100mm × 20mm 접시를 준비하고 멸균 빙냉 PBS 10mL를 첨가하십시오.
- 종양이 있는 기증자 마우스를 이소플루란 챔버에서 안락사시킨 후 자궁경부 탈구를 한다. 마우스를 75% 에탄올에 3-5분 동안 담그고 생물안전 캐비닛으로 옮긴다.
참고: 이 단계의 다음 절차는 엄격한 무균을 유지하기 위해 생물 안전 캐비닛에서 수행되어야 합니다. - 마우스를 깨끗한 흡수성 종이로 덮인 해부 보드에 수핀 위치에 놓습니다. 해부 바늘로 마우스 팔다리를 제지하십시오.
- 요도 오리피스 위에서 가위로 xiphoid까지 중간 선을 따라 피부를 자릅니다. 핀셋으로 마우스 몸의 왼쪽으로 피부를 스트레칭하고 해부 바늘로 피부를 억제하십시오.
- 종양을 소비하고 캡슐을 가능한 한 그대로 유지하십시오. 조심스럽게 부드럽게 수술 가위로 종양 근처의 결합 조직을 제거하십시오.
참고: 종양의 완전성을 유지하려면 종양 캡슐을 벗겨내거나 종양 조직을 조각으로 자르지 마십시오. - 종양 조직을 후속 이식을 위해 멸균 빙냉 PBS 10 mL를 함유하는 100 mm × 20 mm 디쉬에 넣는다.
6. 종양-매칭된 수용자 마우스에 공여체 유래 종양의 피하 이식
참고 : 동종 이식편은 두 개의 종양이 동일한 림프절로 배출되도록 이전에 존재하는 종양과 같은면에있는 마우스의 아래쪽 측면에 이식되어야합니다. 여기에 제시된 프로토콜에서, B16F10-OVA 종양이 마우스의 왼쪽 사타구니 영역에 피하 이식됨에 따라(섹션 3), 공여체 유래 종양 조직을 이 단계에서 수용자의 왼쪽 측면 상에 이식하였다. 이식 부위는 최초 이식된 종양 부위에 적응될 수 있다.
- 복강 내 주사를 통해 250 mg / kg의 2,2,2- 트리브로 모 에탄올로 종양과 일치하는 수용자 마우스를 마취하십시오. 마우스의 신근 사지의 발가락을 꼬집어 마취 수준을 평가하고 통증 반사가 부족할 때까지 기다리면 수술을 수행하기위한 마취의 적절한 깊이를 나타냅니다. 발성 또는 뒷다리 금단이 관찰되면 0.01-0.03 mL의 2,2,2-트리브로모에탄올을 추가로 주입하십시오.
참고: 종양 매칭 수용자 마우스는 거부 문제를 피하기 위해 동종이식편을 제공하는 공여자 마우스와 동일해야 한다. - 건조를 방지하기 위해 눈에 수의학 연고를 사용하십시오. 전기 면도기로 마우스의 왼쪽 측면을 면도하십시오. 탈모 크림을 바르면 나머지 머리카락을 제거하십시오.
참고: 오염 및 감염의 위험을 증가시킬 수 있는 피부 훼손은 피하십시오. - 마우스를 생물 안전 캐비닛에 놓습니다. 마우스의 수직 축이 평행하고 머리가 실험자의 오른쪽에 평행 한 깨끗한 흡수 종이로 덮인 해부 보드의 쉬운 위치에 놓습니다.
참고: 이 단계의 다음 절차는 엄격한 무균을 유지하기 위해 생물 안전 캐비닛에서 수행되어야 합니다. - 면도 부위의 피부를 포비돈 요오드에 적신 면화로 문지릅니다.
참고: 체온의 손실을 방지하기 위해 살균을 위해 75% 에탄올 대신 포비돈-요오드를 사용하십시오. - 수술 핀셋으로 마우스 엉덩이 관절 사이의 중심점에서 피부를 들어 올립니다. 가위를 사용하여 5mm 길이의 수직 절제를 만드십시오. 등쪽 미드라인을 따라 컷을 로스트랄로 ~10-15mm까지 연장합니다.
- 가위의 닫힌 끝을 절개에 삽입 한 다음 왼쪽 측면의 복막을 피부와 연조직으로부터 분리하여 열어 날카로운 해부를 수행하십시오.
참고: 피하 조직과 복막에 손상을 입히지 않으려면 절개 중앙에서 피부를 들어 올린 다음 닫힌 가위를 가능한 한 피부에 가깝게 삽입하십시오. - 날카로운 해부를 여러 번 수행하여 왼쪽 측면에 스킨 포켓을 만드십시오. 캡슐화된, 손상되지 않은 공여체 유래 종양 덩어리를 캡슐 내로 침전시킨다.
주: 가짜 조작 대조군의 마우스는 공여체 유래 종양 이식 없이 동일한 수술 수술을 받는다. - 중단 봉합사로 절개를 닫습니다 (재료 목록 참조). 각 절개마다 2-3 봉합사를 놓습니다. 포비돈 요오드에 적신 면화로 컷 주위의 피부를 소독하십시오.
참고: 두 개의 연속 스티치 사이에 5mm와 절개로부터 3mm 거리가 있어야 합니다. - 마우스를 깨끗하고 따뜻한 케이지의 옆 위치에 놓습니다. 흉골 잔해를 유지하기에 충분한 의식을 회복 할 때까지 지속적으로 모니터링하십시오.
- 통증을 완화하기 위해 수술 후 8 시간마다 0.1 mg / kg 체중의 용량으로 부프레 노르핀을 피하 투여하십시오. 마우스의 먹고, 마시고, 움직이고, 작동 부위를 모니터링합니다. 이식 수혜자를 완전히 회복 한 후에 만 다른 동물의 회사로 돌려 보내십시오.
참고 : 마우스는 일반적으로 3 일 이내에 수술의 외상에서 회복됩니다. 마우스가 정상적인 수유 및 이동성으로 돌아 가지 않고 감염의 징후가 나타나면 수의사와 상담하여 중재를 받거나 안락사하십시오. - 마우스를 지시된 시점에서 희생시키고(단계 4.3.2에서와 같이 동물을 안락사시킴), 유세포 분석을 위해 관심있는 세포를 회수한다.
결과
이 프로토콜의 회로도는 그림 1에 나와 있습니다. 종양 접종 8일 후, CD45.1+ 및 CD45.1+CD45.2+ OT-I 세포를 B16F10-OVA 종양 보유 C57BL/6 마우스에 주사하였다. 종양을 이식 후 8일째에 CD45.1+ OT-I 세포 이식 마우스(공여자)로부터 외과적으로 해부하고, 이식된 종양과 동일한 쪽의 등쪽 옆구리에 종양-매칭된 CD45.1+CD45.2+ OT-I 세포 이식된 마우스(수용자)에 이식하였다. 유세포 분석기(도 2에 도시된 게이팅 전략) 분석을 통해, CD44+CD8+ 종양 항원-특이적 T 세포의 2개 집단은 CD45.1+ 공여자 유래 및 CD45.1+CD45.2+ 수용자 유래 TIL을 포함하는 TME에서 용이하게 확인될 수 있다. 이어서, 동종이식편 내의 이들 두 집단의 비율을 항원 특이적 CD8+ T 세포의 역학을 연구하기 위해 지시된 시점에서 분석하였다. 이식 후 2일째에, 이식된 종양 내에 공여체 유래 항원 특이적 CD8+ T 세포의 ~83%가 존재하였으며, 이는 수용자 유래 대응물보다 더 우세하였다. 그러나, 수용자 유래 OT-I 세포의 비율은 종양발생의 후기 단계에서 상승하였고, 종양-공여체로부터 유래된 종양-고유 OT-I 세포를 초과하였다. (그림 3).
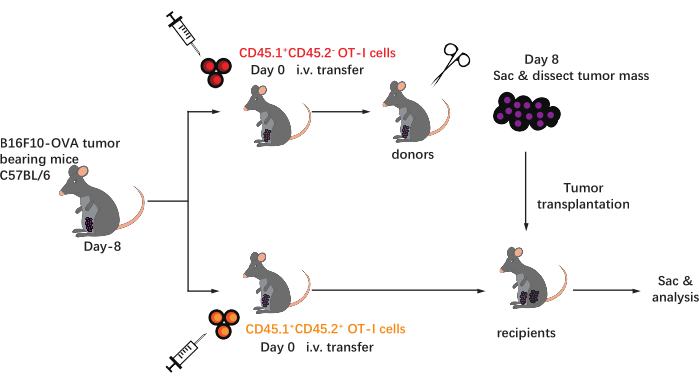
그림 1: 실험 설계의 회로도. C57BL / 6마우스는 사타구니 부위의 B16F10-OVA 종양으로 도전받습니다. 8일 후, 상이한 선천적으로 표시된 (CD45.1+ 또는 CD45.1+CD45.2+) OT-I 세포가 종양 보유 마우스로 전달된다. 전사 후 8일째에, CD45.1+ OT-I 세포-이식된 마우스 상의 종양을 외과적으로 해부하고, 종양과 일치하는 CD45.1+CD45.2+ OT-I 세포-이식된 수용자 내로 피하 이식하여 기존 종양과 동일한 측면의 측면으로 이식한다. 이어서, 마우스를 희생시키고, 동종이식편 내의 항원 특이적 T 세포 (OT-I 세포)를 지시된 시점에서 분석한다. 약어: CD = 분화의 클러스터; i.v. = 정맥내; 삭 = 희생. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
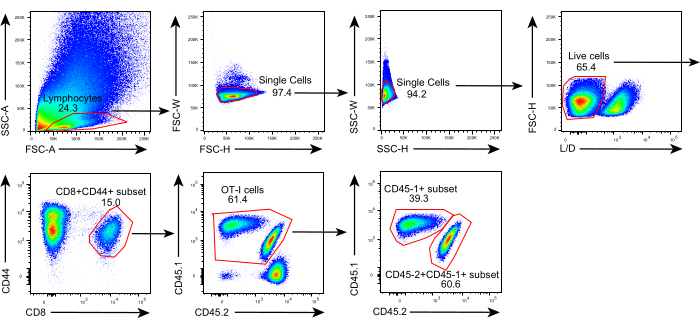
그림 2: 유세포 분석의 게이팅 전략. 게이팅 전략은 동종이식편 내에서 공여체 유래 (CD45.1+) 및 수용자 유래 (CD45.1+CD45.2+) 항원 특이적 CD44+CD8+ T 세포를 확인하기 위해 사용된다. 약어: SSC-A = 측면 산란 영역; FSC-A = 전방 산란-영역; FSC-W = 전방 산란-폭; FSC-H = 순방향 산란-높이; SSC-W = 측면 산란-폭; SSC-H = 측면 산란-높이; L / D = 라이브 / 데드; CD = 차별화의 클러스터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 종양 동종이식편 내의 공여체 및 수용자 유래 항원-특이적 CD8+ T 세포의 비율. 이식 후 제2일, 8일 및 제15일에 종양 동종이식편 내에서 공여체 유래 및 수용자 유래 OT-I 세포를 확인하기 위해 사용된 동종 마커 CD45.1 및 CD45.2의 발현을 나타내는 대표적인 유세포 분석 플롯. 상기 숫자는 CD44+CD8+ T 세포 집단에서 두 하위세트의 백분율을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
T 세포 매개 면역은 종양에 대한 면역 반응에 중요한 역할을하며, CTL은 암 세포를 근절하는 데 주도적 인 역할을합니다. 그러나, TME 내의 종양 항원-특이적 CTLs의 기원은 해명되지 않았다(30). 이러한 종양 이식 프로토콜의 사용은 종양내 항원-특이적 CD8+ T 세포가 줄기-유사 TCF1+ 전구 CD8+ T 세포의 존재에도 불구하고 오랫동안 지속되지 않을 수 있다는 중요한 단서를 제공하였다. 주목할 만하게, 종양 덩어리 내로의 주변부 유래 종양 특이적 CD8+ T 세포의 지속적인 유입이 존재한다.
우리의 지식에 따르면, 이것은 TME 내의 항원 특이적 CD8+ T 세포의 유지가 종양 상주 TIL의 자기 재생 대신에 주위 유래 종양 특이적 CD8+ T 세포의 보충에 주로 의존한다는 것을 확인하는 비교적 편리하고 설득력있는 방법이다. 여기에 제시된 프로토콜은 공여체 유래 및 수용자 유래 TIL의 비율에만 초점을 맞추고 있지만,이 두 집단의 페노티픽, 기능적 및 전사 특성은 유세포 분석기로 쉽게 검사 할 수 있습니다. 더욱이, ICB 요법에 대한 특정 세포 하위세트의 반응을 조사하기 위해 ICB 항체를 결합하는 것이 가능하다.
이 프로토콜에서, 공여체 유래 종양 조직은 기존의 원래 종양을 갖는 수용자 마우스 상에 이식된다. 수용자 마우스에서 두 개의 종양은 주변-생성된 T 세포를 두 개의 종양 덩어리로 분포시킬 것이다. 더욱이, 종양 부담은 이식이 없는 동물에 비해 거의 두 배가 될 것이다. 파일럿 실험에서, 우리는 이식 전에 수용자 마우스에 원래의 종양을 절제하려고 시도했다; 그러나 수술로 모든 종양 세포를 철저히 제거하는 것은 기술적으로 어려웠습니다. 잔류 종양 세포는 신속하게 그리고 곧 새로운 종양 조직을 형성할 것이다. 따라서, T 세포 면역 반응을 이식되지 않은 마우스의 면역 반응과 비교할 때 이러한 시스템에 대한 한계가 있다. 그러나, 이러한 시스템은 공여체 종양 보유 마우스로부터 이식되는 동일한 TME 내의 최근 이동된 T 세포와 기존 T 세포의 비교에 여전히 유용하다. 게다가, 종양 조직의 이식이 염증으로 이어질 수 있다는 것을 부인할 수 없으며, 이는 종양 내의 면역 세포 역학에 영향을 줄 수 있습니다. OT-I 세포 침윤에 대한 수술의 영향은 비수술적 및 가짜 조작된 조절을 통해 배제될 수 있지만, 우리는 OT-I 세포 역학에 대한 국소 염증 반응의 효과를 평가하지 않았다.
몇 가지 고려 사항을 고려해야합니다.이 중 하나는 사이클로 포스파미드의 사용법입니다. 사이클로포스파미드31 은 고형 장기 악성 종양 및 림프증식성 및 자가면역 장애를 치료하는데 널리 사용되는 알킬화제이다. B16F10-OVA 접종 후 6 내지 8일 후, 사이클로포스파미드는 입양 전달 전에 투여되어 숙주 마우스의 림프고갈을 유도하고 전사된 OT-I 세포29의 활성을 강화시킨다. 흑색종이 이 시약에 민감하지는 않지만, 뮤린 흉선 림프종 세포주인 EG732와 같은 일부 종양 세포주는 사이클로포스파미드에 반응한다. EG7 보유 마우스를 사이클로포스파미드로 치료하면 종양이 박멸되며, 이는 사이클로포스파미드가 민감한 종양 모델에 대해 신중하게 사용되거나 적정되어야 함을 시사한다. 권장되는 대안적인 방법은 전달 하루 전에 단일 치사하 방사선 선량 (4.5-5.5 Gy)이며, 최적의 선택은 종양 세포주의 특성에 달려 있습니다.
종양 보유 기증자 마우스의 신중한 선택과 종양 이식 중 섬세한 외과 수술을 포함하여 다른 단계는주의 깊게 취해 져야합니다. 이식된 종양은 외과적으로 제거되고 이식 후 8-10일 후에 종양-매칭된 수용자 마우스에 이식될 것이다. 이식 전에, ~5mm 직경의 종양 질량의 대등한 크기는 개별 마우스 사이의 불일치를 줄이고 획득된 데이터를 보다 신뢰할 수 있게 하기 위해 동종이식편으로 선택되어야 한다. 또한, 수술 중에, 절개는 수용자 마우스에 이미 존재하는 종양으로부터 멀리 떨어진 곳에 동종이식편을 유지하기 위해 마우스의 중간 선 근처에 있어야 한다. 사타구니 림프절과 주변 조직의 부상을 예방하기 위해 부드러운 해부도 권장됩니다.
암 세포의 효과적인 사멸은 TME33 내의 다양한 성분들의 조정을 필요로 한다. 여기에 제시된 프로토콜은 자연 살해 세포, 종양 관련 대식세포 및 수지상 세포와 같은 적응 및 선천적 면역 세포의 조사로 확장될 수 있다. 또한, 여기에 활용되는 B16F10-OVA 이외에도, 이 프로토콜은 다른 피하 종양 모델에 적용될 수 있다. 결론적으로, 전술한 종양 이식 분석은 항종양 반응 동안 특정 유형의 면역 세포의 상호작용적 전이에 대한 연구를 위한 새로운 접근법을 제공하며, 종양 면역학 연구자들에게 유용하다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
이 연구는 저명한 젊은 학자를위한 국립 자연 과학 기금 (31825011 번에서 LY)과 중국 국립 자연 과학 재단 (QH에 31900643 번, ZW에 31900656 번)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
참고문헌
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867(2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794(2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507(2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169(2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806(2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유