Method Article
زرع الورم لتقييم ديناميكيات الخلايا التائية CD8+ المتسللة للورم في الفئران
In This Article
Erratum Notice
Summary
هنا ، نقدم بروتوكول زرع الورم لتوصيف الخلايا الليمفاوية المتأصلة في الورم والأطراف المشتقة من الورم في نموذج ورم الفئران. يكشف التتبع المحدد لتدفق الخلايا المناعية المشتقة من المتلقي باستخدام قياس التدفق الخلوي عن ديناميكيات النمط الظاهري والتغيرات الوظيفية لهذه الخلايا أثناء الاستجابات المناعية المضادة للورم.
Abstract
تلعب المناعة بوساطة الخلايا التائية دورا حاسما في الاستجابات المناعية ضد الأورام، حيث تلعب الخلايا الليمفاوية التائية السامة للخلايا (CTLs) الدور الرائد في القضاء على الخلايا السرطانية. ومع ذلك ، فإن أصول وتجديد خلايا CD8 + T الخاصة بمستضد الورم داخل البيئة الدقيقة للورم (TME) لا تزال غامضة. يستخدم هذا البروتوكول خط خلايا الورم الميلانيني B16F10-OVA ، الذي يعبر بثبات عن المستضد الجديد البديل ، ovalbumin (OVA) ، وفئران OT-I المعدلة وراثيا TCR ، حيث يتعرف أكثر من 90٪ من خلايا CD8 + T على وجه التحديد على الببتيد OVA المشتق من OVAOVA 257-264 (SIINFEKL) المرتبط بجزيء مركب التوافق النسيجي الرئيسي (MHC) من الفئة الأولى H2-K b. تمكن هذه الميزات من دراسة استجابات الخلايا التائية الخاصة بالمستضدات أثناء تكوين الأورام.
من خلال الجمع بين هذا النموذج وجراحة زرع الورم، تم زرع أنسجة الورم من المتبرعين في الفئران المتلقية المتجانسة المتطابقة مع الورم لتتبع تدفق الخلايا المناعية المشتقة من المتلقي بدقة إلى أنسجة المتبرعين المزروعة، مما يسمح بتحليل الاستجابات المناعية ل CD8+ الخاص بالمستضدات المتأصلة في الورم والمستضد المحيطي المنشأ. الخلايا التائية. ووجد أن هناك انتقالا ديناميكيا يحدث بين هاتين المجموعتين. بشكل جماعي ، قدم هذا التصميم التجريبي نهجا آخر للتحقيق بدقة في الاستجابات المناعية للخلايا التائية CD8 + في TME ، مما سيلقي ضوءا جديدا على مناعة الورم.
Introduction
تلعب الاستجابة المناعية بوساطة الخلايا التائية CD8+ دورا محوريا في التحكم في نمو الورم. أثناء تكوين الورم ، يتم تنشيط خلايا CD8 + T الساذجة عند التعرف على المستضدات بطريقة مقيدة من الفئة I من MHC ومن ثم تتمايز إلى خلايا مستجيبة وتتسلل إلى كتلة الورم 1,2. ومع ذلك ، داخل البيئة الدقيقة للورم (TME) ، فإن التعرض للمستضدات لفترة طويلة ، وكذلك العوامل المثبطة للمناعة ، تدفع الخلايا التائية CD8 + الخاصة بالورم إلى حالة نقص الاستجابة المعروفة باسم "الإرهاق"3. تختلف الخلايا التائية المستنفدة (Tex) عن الخلايا التائية المستجيبة أو الذاكرة المتولدة في العدوى الفيروسية الحادة ، سواء من الناحية النسخية أو اللاجينية. تتميز خلايا تكس هذه بشكل رئيسي بالتعبير المستمر والمرتفع لسلسلة من المستقبلات المثبطة بالإضافة إلى الفقدان الهرمي لوظائف المستجيب. علاوة على ذلك ، فإن ضعف القدرة التكاثرية للخلايا التائية CD8 + المنهكة يؤدي إلى انخفاض أعداد الخلايا التائية الخاصة بالورم ، بحيث لا يمكن للخلايا التائية CD8 + المتبقية داخل TME بالكاد توفير مناعة وقائية كافية ضد تطور الورم3. وبالتالي ، فإن الحفاظ على أو تعزيز خلايا CD8 + T الخاصة بالمستضد داخل الفخذ أمر لا غنى عنه لقمع الورم.
علاوة على ذلك ، يعتقد أن علاج حصار نقاط التفتيش المناعية (ICB) يعيد تنشيط Tex في الأورام عن طريق زيادة تسلل الخلايا التائية وبالتالي ، أعداد الخلايا التائية وتجديد وظائف الخلايا التائية لتعزيز قمع الورم. أدى التطبيق الواسع النطاق لعلاج ICB إلى تغيير مشهد علاج السرطان ، مع وجود مجموعة فرعية كبيرة من المرضى الذين يعانون من استجابات دائمة4،5،6. ومع ذلك ، فإن غالبية المرضى وأنواع السرطان لا يستجيبون أو يستجيبون مؤقتا فقط ل ICB. تم افتراض عدم كفاية تسلل الخلايا التائية في TME لتكون واحدة من الآليات الأساسية التي تمثل مقاومة ICB 7,8.
أظهرت العديد من الدراسات عدم تجانس الخلايا التائية CD8+ المتسللة للورم (TILs) في كل من المرضى ونماذج الفئران9،10،11،12. وقد تم التأكيد على أن مجموعة فرعية من الخلايا التائية CD8 + التي تعبر عن عامل الخلايا التائية -1 (TCF1) في كتلة الورم تظهر خصائص تشبه الخلايا الجذعية ، والتي يمكن أن تؤدي إلى مزيد من الخلايا التائية المنهكة نهائيا وهي مسؤولة عن انفجار الانتشار بعد علاج ICB 12,13,14,15,16,17,18,19,20 ، 21,22. ومع ذلك ، فقد ثبت أن نسبة صغيرة فقط من الخلايا التائية TCF1 + CD8 + الخاصة بالمستضد موجودة في TME وتولد مجموعة موسعة من النسل المتمايز استجابة ل ICB 23,24,25,26. ما إذا كان الحجم المحدود لهذه المجموعة كافيا لضمان استمرار الخلايا الليمفاوية التائية السامة للخلايا (CTLs) للسيطرة على تطور الورم لا يزال غير معروف ، وما إذا كان هناك تجديد من الأنسجة الطرفية يتطلب المزيد من التحقيق. علاوة على ذلك ، تشير الأبحاث الحديثة إلى عدم كفاية قدرة التنشيط للخلايا التائية الخاصة بالورم الموجودة مسبقا وظهور أنماط استنساخ جديدة لم تكن موجودة من قبل بعد علاج بروتين موت الخلايا 1 المضاد للبرمجة. وهذا يشير إلى أن استجابة الخلايا التائية لحصار نقاط التفتيش قد تكون بسبب التدفق الجديد لذخيرة متميزة من استنساخ الخلايا التائية27. جنبا إلى جنب مع وجود جزء الخلايا التائية غير التفاعلية للخلايا غير التفاعلية في TME ، دفعت هذه النتائج إلى إنشاء نموذج allograft الورم لدراسة دور الخلايا التائية CD8 + Tالمشتقة من المحيط 11.
حتى الآن ، تم استخدام عدة أنواع من زرع الورم ، وكذلك نقل الخلايا المناعية بالتبني ، على نطاق واسع في مجال علم المناعة للورم28. يمكن وصف TILs ، وخلايا الدم الطرفية أحادية النواة ، والخلايا المناعية التفاعلية للورم التي نشأت من أنسجة أخرى بشكل جيد باستخدام هذه الطرق. ومع ذلك ، عند دراسة التفاعلات بين المناعة المضادة للورم الجهازية والمحلية ، تبدو هذه النماذج غير كافية لفحص التفاعلات بين الخلايا المناعية المشتقة من المحيط و TME. هنا ، تم زرع أنسجة الورم من المتبرعين في الفئران المتلقية المطابقة للورم لتتبع تدفق الخلايا المناعية المشتقة من المتلقي بدقة ومراقبة الخلايا المشتقة من المتبرع في TME بشكل متزامن.
في هذه الدراسة ، تم إنشاء نموذج سينجيني للفئران من سرطان الجلد مع خط خلايا الورم الميلانيني B16F10-OVA ، والذي يعبر بثبات عن البويضات المستضدية الجديدة البديلة. الفئران OT-I المعدلة وراثيا TCR ، حيث تتعرف أكثر من 90٪ من خلايا CD8 + T على وجه التحديد على الببتيد OVA المشتق من OVA OVA257-264 (SIINFEKL) المرتبط بجزيء MHC من الفئة I H2-K b ، تمكن من دراسة استجابات الخلايا التائية الخاصة بالمستضدات التي تم تطويرها في نموذج الورم B16F10-OVA. ومن خلال الجمع بين هذا النموذج وزرع الورم، تمت مقارنة الاستجابات المناعية للخلايا التائية CD8+ الخاصة بالمستضدات المتأصلة في الورم والخلايا الطرفية للكشف عن انتقال ديناميكي بين هاتين المجموعتين. بشكل جماعي ، قدم هذا التصميم التجريبي نهجا آخر للتحقيق بدقة في الاستجابات المناعية للخلايا التائية CD8 + في TME ، مما يلقي ضوءا جديدا على ديناميكيات الاستجابات المناعية للخلايا التائية الخاصة بالورم في TME.
Protocol
تم إجراء جميع تجارب الفئران وفقا للمبادئ التوجيهية للجان رعاية واستخدام الحيوانات المؤسسية التابعة للجامعة الطبية العسكرية الثالثة. استخدم فئران C57BL/6 البالغة من العمر 6-8 أسابيع والفئران المعدلة وراثيا OT-I الساذجة التي تزن 18-22 جم. استخدم كلا من الذكور والإناث دون عشوائية أو "تعمية".
1. إعداد المواد المتوسطة والكواشف
- تحضير وسط زراعة الخلايا D10 كما هو موضح سابقا29 عن طريق إضافة 10٪ مصل بقري جنيني (FBS) ، و 100 U / mL البنسلين ، و 100 mg / mL streptomycin ، و 2 mM L-glutamine إلى Dulbecco's Modified Eagle Medium.
- تحضير زراعة الخلايا المتوسطة R10 عن طريق استكمال RPMI-1640 مع 10٪ FBS ، 100 U / مل البنسلين ، و 100 ملغ / مل ستربتومايسين.
ملاحظة: يمكن أن تظل وسائط الاستزراع ، D10 و R10 ، معقمة ومستقرة لمدة أسبوعين على الأقل عند تخزينها في 2-4 درجة مئوية. - قم بإعداد المخزن المؤقت لفرز الخلايا المنشط بالفلور (FACS) عن طريق استكمال 1x محلول ملحي مخزن بالفوسفات (PBS) مع 2٪ FBS و 0.01٪ من أزيد الصوديوم.
ملاحظة: مع إضافة أزيد الصوديوم ، يمكن تخزين FACS Buffer في 2-4 درجة مئوية لعدة أشهر. - تحضير مخزن مؤقت لتحلل خلايا الدم الحمراء (RBL) عن طريق إضافة 155 mM NH4Cl و 10 mM KHCO 3 و 0.1 mM ethylenediamine tetraacetic acid (EDTA) إلى ماء مقطر مزدوج ، وضبط درجة الحموضة إلى7.3.
ملاحظة: المخزن المؤقت RBL مستقر لمدة تصل إلى 3 أشهر في درجة حرارة الغرفة (RT). - قم بإعداد المخزن المؤقت لفرز الخلايا المنشط مغناطيسيا (MACS) عن طريق استكمال PBS بألبومين مصل البقر بنسبة 0.5٪ (BSA) و 2 mM EDTA.
ملاحظة: يجب تمرير المحلول عبر مرشح 0.22 ميكرومتر بعد إذابة الكاشف والحفاظ عليه في التعقيم. - إعداد حل عمل من 2،2،2-ثلاثي برومو الإيثانول.
- يذوب 2.5 غرام من 2،2،2-ثلاثي برومو الإيثانول في 5 مل من كحول تيرت أميل (2-ميثيل-2-بيوتانول). يقلب هزاز بخار وثابت الحرارة عند 180 دورة في الدقيقة و40 درجة مئوية طوال الليل.
- قم بتصفية المحلول من خلال مرشح 0.22 ميكرومتر في حاوية معقمة. أضف الماء المقطر المزدوج حتى الحجم النهائي من 200 مل ، واخلطه جيدا وبشكل مستمر حتى يصبح المحلول واضحا وشفافا.
- تحديد وضبط قيمة الرقم الهيدروجيني للمحلول إلى 7.3. لف الحاوية بالكامل بورق الألومنيوم لاستبعاد الضوء وتخزينها عند 4 درجات مئوية.
ملاحظة: التركيز النهائي لمحلول العمل من 2،2،2-ثلاثي برومو الإيثانول هو 12.5 ملغ / مل. لا ينصح بمحلول أكثر تركيزا لأن المادة مزعجة بتركيزات أعلى. اختبر قيمة الأس الهيدروجيني لمحلول العمل قبل كل استخدام، وتخلص منه إذا كان الرقم الهيدروجيني أقل من 5.
2. إعداد تعليق الخلايا B16F10-OVA
ملاحظة: ينبغي أن يتم استزراع الخلايا في غطاء للسلامة الأحيائية في ظل ظروف معقمة صارمة.
- إذابة وزراعة قارورة من خلايا B16F10-OVA مع D10 في حاضنة زراعة الخلايا عند 37 درجة مئوية و 5٪ CO2.
- عندما تصل الخلايا إلى التقاء حوالي 80-90 ٪ ، فإن الزراعة الفرعية للخلايا.
- قم بإزالة وسط المزرعة باستخدام ماصة ، وشطف الخلايا مرتين باستخدام PBS.
ملاحظة: لا تقم بإضافة PBS بقوة ضد الخلايا الملتصقة في طبق القارورة أو زراعة الخلايا. بدلا من ذلك ، قم بماصة PBS نحو جدار جانبي أو أضفها إلى القارورة أو الطبق. - قم بإزالة PBS ، وأضف 1-2 مل من محلول التربسين-EDTA بنسبة 0.25٪ في القارورة أو الطبق. قم بهزه ذهابا وإيابا لتغطية سطح الخلية بالكامل. ضع القارورة أو الطبق في حاضنة عند 37 درجة مئوية لمدة 1 دقيقة تقريبا أو في RT حتى تنفصل الخلايا.
ملاحظة: يمكن استخدام المجهر المقلوب للتحقق مما إذا كانت الخلايا قد انفصلت. - أضف D10 جديدا لإيقاف التربسين. قم بتقطيع التعليق لأعلى ولأسفل لضمان انفصال جميع الخلايا عن سطح القارورة أو الطبق.
- انقل تعليق الخلايا B16F10-OVA إلى أنبوب مخروطي 15 مل. الطرد المركزي للخلايا في 125 × غرام لمدة 5-7 دقائق في RT.
- تخلص من السوبرناتانت ، وأعد تعليق بيليه الخلية باستخدام D10. قم بتوزيع تعليق الخلايا B16F10-OVA في قارورة جديدة أو طبق زراعة الخلايا يحتوي على D10 واحتضنه في حاضنة زراعة الخلايا عند 37 درجة مئوية و 5٪ CO2.
- قم بإزالة وسط المزرعة باستخدام ماصة ، وشطف الخلايا مرتين باستخدام PBS.
- في يوم زرع الورم ، قم بحصاد خلايا B16F10-OVA التي تلتقي بنسبة 90٪ تقريبا كما هو موضح في الخطوات من 2.2.1 إلى 2.2.4. تخلص من السوبرناتانت ، وأعد تعليق بيليه الخلية مع 1 مل من PBS.
- عد الخلايا القابلة للحياة باستخدام مقياس الدم باستخدام 0.4٪ من التربان الأزرق. اضبط كثافة الخلايا على 1 × 106 خلايا لكل 100 ميكرولتر بإضافة PBS. حافظ على الخلايا على الجليد.
3. زرع ورم خارج الرحم لخلايا B16F10-OVA في المنطقة الإربية من الفئران
- استخدم الفئران C57BL/6 التي يبلغ عمرها 6-8 أسابيع والتي تزن 18-22 جم. استخدم كلا من الذكور والإناث دون عشوائية أو "تعمية".
- اسحب 100 ميكرولتر من تعليق الخلايا B16F10-OVA المحضر إلى حقنة درنية 1 مل. اضغط على البرميل لنقل الفقاعات إلى الأعلى ، وادفع المكبس برفق لإزالة فقاعات الهواء.
- كبح جماح الفأر وفضح بطنه. اضغط على الساق الخلفية اليسرى بالإصبع الصغير لشد جلد المنطقة الإربية اليسرى.
- قم بإزالة شعر الفأر من أسفل البطن الأيسر باستخدام ماكينة حلاقة كهربائية. استخدم القطن المنقوع في 75٪ من الإيثانول لتنظيف الربع الخلفي من البطن الأيسر.
- عقد المحقنة بزاوية ضحلة جدا (0-15 درجة) مع شطبة الإبرة متجهة لأعلى ، وإدخالها في موقع الفخذ العلوي الأيسر ، والتقدم 0.5-1 سم من خلال الأنسجة تحت الجلد إلى المنطقة الأربية.
- اسحب المكبس للخلف قبل الحقن. إذا كان هناك ضغط سلبي ، فقم بخفض المكبس تماما ، ولاحظ ظهور بلعة صغيرة (تكوين جيب سائل) في تحت الجلد.
ملاحظة: إذا تم سحب الدم مرة أخرى إلى مركز الإبرة، فاسحب وحاول مرة أخرى في موقع آخر. - قم بإزالة الإبرة بعد إجراء الحقن والتخلص منها بشكل مناسب. حرر الماوس وضعه مرة أخرى في القفص.
- قياس حجم الورم في الأيام 6-8 باستخدام مقياس vernier بعد زرع B16F10-OVA. اختر الفئران ذات الورم الذي يبلغ قطره ~ 3 مم (بحجم الفول المونج) وقسمها بالتساوي وبشكل عشوائي إلى مجموعتين.
ملاحظة: يتم تعيين الفئران ذات الأورام ذات الحجم المماثل بشكل عشوائي كفئران مانحة ومتلقية. سيتم زرع أنسجة الورم المتطابقة التي تم استئصالها من الفئران المانحة في الفئران المتلقية. وعلاوة على ذلك، ينبغي إدراج الضوابط غير المشغلة والضوابط التي تعمل بالصورية لتقييم آثار الجراحة على نقل الخلايا بالتبني وعلى الصحة العامة للفئران. وبالتالي ، فإن مجموعة واحدة من الفئران الحاملة للورم تعمل كعناصر تحكم غير عاملة ، حيث تتلقى إما خلايا CD45.1 + CD45.1 + CD45.1 + OT-I ولكن لا توجد جراحة. المجموعة الأخرى من الفئران بمثابة ضوابط تعمل بشكل صوري ، حيث تتلقى إما خلايا CD45.1 + CD45.2 + أو CD45.1 + OT-I وجراحة لاحقة مماثلة للمجموعة التجريبية ولكن لا توجد عملية زرع ألوغرافت.
4. النقل بالتبني للخلايا التائية OT-I ذات العلامات الخلقية إلى الفئران الحاملة للورم
- في اليوم السابق للنقل ، قم بإدارة 4 ملغ من السيكلوفوسفاميد المذاب في 200 ميكرولتر من PBS عن طريق الحقن داخل الصفاق لكل فأر حامل للورم.
ملاحظة: يهدف العلاج باستخدام السيكلوفوسفاميد إلى تحفيز اللمفاويات في المضيف الذي ينتج "مساحة" للخلايا المنقولة ، وتعزيز بقائها على قيد الحياة وتوجيهها إلى الأعضاء اللمفاوية للعمل بكفاءة. - استخدم الفئران المعدلة وراثيا الساذجة OT-I ذات العلامات الخلقية المميزة (6-8 أسابيع ، 18-22 جم ، نفس جنس الفئران الحاملة للورم). استخدم الفئران CD45.1+ OT-I و CD45.1 + CD45.2 + فئران OT-I لنقل الخلايا التائية الخاصة بالمستضدات OVA257-264 بالتبني إلى الفئران المانحة والمتلقية الحاملة للورم ، على التوالي.
ملاحظة: يمكن بسهولة تحديد أصل خلايا OT-I المنقولة بالتبني إذا كانت تعرض علامات جينية أو فلورية مميزة. على سبيل المثال ، حقن خلايا CD45.1 + OT-I T في الفئران المانحة الحاملة ل B16F10-OVA أثناء حقن خلايا CD45.1 + CD45.2 + OT-I T في الفئران المتلقية الحاملة ل B16F10-OVA. CD45.1 و CD45.2 كلاهما أشكال متساوية لعلامة الخلايا الليمفاوية الشاملة CD45 (Ly5). تشمل العلامات الجينية الأخرى الشائعة الاستخدام أشكالا مختلفة من CD90 (Thy1). يمكن استخدام هذا البروتوكول للفئران التي تحمل علامات جينية مختلفة. يجب أن تكون الفئران OT-I من نفس جنس الفئران التي تتلقى نقل خلايا OT-I لتجنب مشكلات الرفض. - عزل الخلايا الليمفاوية عن الطحال والغدد الليمفاوية في فأر OT-I.
ملاحظة: يجب تنفيذ الإجراءات التالية في هذه الخطوة في خزانة السلامة الأحيائية للحفاظ على التعقيم الصارم.- تحضير اثنين من أطباق بتري 60 مم × 10 مم. أضف 3 مل من R10 متوسطة في طبق واحد مع إضافة 3 مل من المخزن المؤقت RBL إلى طبق آخر. ضع مصفاة خلايا نايلون 70 ميكرومتر في الطبق الذي يحتوي على مخزن RBL المؤقت.
- القتل الرحيم لفأر OT-I في غرفة الايزوفلوران متبوعا بخلع عنق الرحم.
- حصاد الطحال ، الإربية (تحت الحرقفي) ، والغدد الليمفاوية الإبطية للفأر ونقلها إلى طبق 60 ملم × 10 ملم مع 3 مل من R10 على الجليد.
ملاحظة: يمكن تعديل عدد الفئران OT-I التي تم التضحية بها اعتمادا على عدد الفئران الحاملة للورم التي سيتم نقلها. العائد النموذجي للخلايا التائية OT-I CD8 + من الطحال والغدد الليمفاوية الإربية والإبطية الثنائية للخلايا التائية OT-I CD8 + T هو ~ 30-100 × 106 خلايا لكل ماوس. - باستخدام برميل نهاية حقنة 1 مل ، قم بنقع الطحال في 3 مل من المخزن المؤقت RBL من خلال المصفاة. احتضان لمدة 3 دقائق في RT ، وإنهاء التفاعل عن طريق إضافة 3 مل من وسط R10 البارد.
- اهرسي الغدد الليمفاوية حتى تبقى الأنسجة الضامة فقط. شطف الفلتر مع R10. انقل تعليق الخلية إلى أنبوب مخروطي جديد بسعة 15 مل. جهاز طرد مركزي عند 500 × جم ، 4 درجات مئوية لمدة 6 دقائق.
- قم بالتخلص من السوبرناتانت ، وأعد تعليق الخلايا في 3 مل من المخزن المؤقت لنظام التشغيل MACS. مرر تعليق الخلية من خلال مصفاة خلية جديدة 70 ميكرومتر لإزالة أي كتل.
- جهاز الطرد المركزي لتعليق الخلية عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. ديكان السوبرناتانت.
- استخدم مجموعة عزل الخلايا التائية CD8+ بالماوس (انظر جدول المواد) لتنقية خلايا CD8+ T عن طريق التحديد السلبي ، وفقا لبروتوكول الشركة المصنعة.
ملاحظة: عند استخدام مجموعات من شركات أخرى، اتبع إرشادات الشركة المصنعة. - حافظ على تعليق الخلية النقي على الجليد. خذ عينة صغيرة من الخلايا واخلطها مع التربان الأزرق لحساب الخلايا باستخدام مقياس الدم.
- أوجد النسبة المئوية لخلايا OT-I (حية/ميتة-CD8+Va2+) حسب قياس التدفق الخلوي.
ملاحظة: يجب إجراء تلطيخ متزامن للعلامات الخلقية و TCR المعدلة وراثيا للتحقق من النمط الظاهري الصحيح للخلايا قبل النقل.- أضف 5 × 10 4-1 × 10 5 خلايا إلى 1 مل من المخزن المؤقت FACS في أنبوب طرد مركزي1.5 مل ، وطرد مركزي تعليق الخلية عند 350 × جم ،4 درجات مئوية لمدة 3 دقائق.
- تخلص من السوبرناتانت ، وقم بتفريق الخلايا عن طريق النقر فوق قاع الأنبوب. ضع الأنبوب على الثلج.
- تحضير مخاليط الأجسام المضادة المترافقة التالية (المخففة في مخزن مؤقت FACS 100 ميكرولتر): مضاد CD8 ، 1:200 ؛ مكافحة TCR Vα2 ، 1:100 ؛ مكافحة CD45.1 ، 1:200 ؛ مكافحة CD45.2 ، 1:200 ؛ والأحياء / الأموات ، 1:200 (راجع جدول المواد).
- دوامة كوكتيل الأجسام المضادة وأجهزة الطرد المركزي في 15000 × غرام لمدة 3 دقائق لحبيبات مجاميع الأجسام المضادة. تخزين الكوكتيل على الجليد وحمايته من الضوء.
- أعد تعليق الخلايا مع 100 ميكرولتر من كوكتيل الأجسام المضادة واخلطها جيدا عن طريق تحريك الأنبوب. احتضن في الظلام لمدة 30 دقيقة على الجليد.
ملاحظة: تجنب إزعاج مجاميع الأجسام المضادة في الجزء السفلي من الأنبوب. - اغسل الكريات مرتين باستخدام 1 مل من المخزن المؤقت FACS. جهاز طرد مركزي عند 350 × جم ، 4 درجات مئوية لمدة 3 دقائق. أعد تعليق الخلايا في 200 ميكرولتر من المخزن المؤقت FACS ، وانقل تعليق الخلية إلى أنبوب FACS.
ملاحظة: للحفاظ على صلاحية خلايا OT-I المراد نقلها، اختبر العينة في أقرب وقت ممكن. إذا تعذر اختبار خلايا OT-I الملطخة على الفور ، فاحتفظ بالخلايا في الظلام على الجليد أو ضعها في الثلاجة عند 4 درجات مئوية حتى التحليل. بدلا من ذلك ، يمكن إعادة تعليق العينات في 1-4٪ paraformaldehyde للتخزين الممتد (16 ساعة) لمنع التدهور. - قم بتشغيل العينة على مقياس التدفق الخلوي. احسب النسبة المئوية للخلايا الحية / الميتة CD8 + Va2 + عن طريق قسمة عدد الخلايا الحية / الميتة CD8 + Vα2 + على عدد الخلايا الحية / الميتة.
- أوجد العدد المطلق لخلايا OT-I (حية/ميتة-CD8+Va2+) بضرب النسبة المئوية للخلايا الحية/الميتة-CD8+Va2+ في عدد الخلايا القابلة للحياة الذي تم الحصول عليه في الخطوة 4.3.9.
- اضبط تركيز خلايا OT-I (حية / ميتة-CD8 + Va2 +) إلى 1.5 × 106 / مل باستخدام PBS.
- حقن 3 × 105 خلايا OT-I مميزة بشكل خلقي (حية / ميتة CD8 + Va2 +) في 200 ميكرولتر من PBS عن طريق الوريد إلى مجموعتين من الفئران الحاملة ل B16F10-OVA (الفئران الحاملة للورم مقسمة إلى فئران مانحة ومتلقية من الخطوة 3.8).
- اسحب 200 ميكرولتر من تعليق خلية OT-I (حية / ميتة CD8 + Va2+) إلى حقنة أنسولين 100 U (29 G) ، وقم بإزالة الفقاعات كما في الخطوة 3.2.
- ضع الماوس بشكل منفصل في قفص مع مصباح الأشعة تحت الحمراء فوق القفص لمدة 5-10 دقائق لتوسيع الوريد الذيل. شل حركة الماوس باستخدام جهاز تقييد بحجم مناسب. اسحب الذيل لتصويبه ورش بنسبة 75٪ من الإيثانول لجعل الوريد مرئيا.
- امسك المحقنة موازية للوريد وأدخلها في الوريد بزاوية 0-15 درجة. اسحب المكبس قليلا ، وإذا دخل الدم إلى البرميل ، فقم بحقن التعليق ببطء وثبات بمعدل لا يزيد عن 1 مل / دقيقة.
ملاحظة: تشير المقاومة أو التورم في موقع الحقن إلى أن الإبرة ليست داخل الوريد. يجب نقل موقع الحقن عن قرب. - بعد اكتمال الحقن ، قم بإزالة المحقنة ، واضغط على منطقة الإدخال بلطف لمدة 3-5 ثوان لوقف النزيف. أعد الماوس إلى القفص وراقبه عن كثب لبضع دقائق بحثا عن ردود الفعل السلبية. إذا كان لديه حركة طبيعية وإفرازات أنفية ، فضعه مرة أخرى بصحبة الفئران الأخرى.
5. تشريح كتلة الورم من الفئران المانحة الحاملة للورم
ملاحظة: حافظ على ظروف معقمة أثناء الجراحة في القسمين 5 و 6. تعقيم جميع الأدوات الجراحية عن طريق التعقيم قبل وبعد كل استخدام. تطهير منطقة التشغيل في خزانة السلامة الأحيائية بنسبة 75٪ من الإيثانول تليها الأشعة فوق البنفسجية. ارتد ثوبا نظيفا وقبعة وقناعا للوجه وقفازات معقمة.
- بعد ثمانية إلى عشرة أيام من نقل التبني ، اختر الفئران المانحة التي تحمل كتلة ورم مماثلة قطرها ~ 5 مم (بحجم فول الصويا) لجراحة الزرع.
- قم بإعداد طبق 100 مم × 20 مم في خزانة السلامة البيولوجية ، وأضف 10 مل من PBS المثلج البارد المعقم.
- القتل الرحيم لفأر مانح حامل للورم في غرفة الأيزوفلوران متبوعا بخلع عنق الرحم. اغمر الماوس في 75٪ من الإيثانول لمدة 3-5 دقائق ونقله إلى خزانة السلامة الأحيائية.
ملاحظة: يجب تنفيذ الإجراءات التالية في هذه الخطوة في خزانة السلامة الأحيائية للحفاظ على التعقيم الصارم. - ضع الماوس على لوح تشريح مغطى بورق ماصة نظيف في وضع ضعيف. كبح جماح أطراف الماوس باستخدام إبر التشريح.
- قطع الجلد على طول خط الوسط من فوق فتحة مجرى البول إلى الخناق مع مقص. قم بتمديد الجلد نحو الجانب الأيسر من جسم الفأر باستخدام ملاقط وكبح جماح الجلد باستخدام إبر التشريح.
- استئصال الورم ، والحفاظ على كبسولة سليمة قدر الإمكان. قم بإزالة النسيج الضام بعناية ولطف بالقرب من الورم باستخدام مقص جراحي.
ملاحظة: للحفاظ على سلامة الورم، لا تقشر كبسولة الورم أو تقطع أنسجة الورم إلى أجزاء. - ضع أنسجة الورم في طبق 100 مم × 20 مم يحتوي على 10 مل من PBS المعقم للزرع اللاحق.
6. زرع تحت الجلد للورم المشتق من المتبرع على الفئران المتلقية المطابقة للورم
ملاحظة: من المفترض أن يتم زرع اللوغراف في الجناح السفلي للفأر على نفس جانب الورم الموجود سابقا لجعل اثنين من الأورام يستنزفان إلى العقدة الليمفاوية المتطابقة. في البروتوكول المعروض هنا ، حيث تم زرع ورم B16F10-OVA تحت الجلد في المنطقة الإربية اليسرى من الفأر (القسم 3) ، تم زرع أنسجة الورم المشتقة من المتبرع على الجناح الأيسر للمتلقي في هذه الخطوة. يمكن تكييف موقع الزرع مع موقع الورم المزروع أولا.
- تخدير الفأر المتلقي المطابق للورم مع 250 مغ / كغ من 2،2،2-ثلاثي برومو الإيثانول عن طريق الحقن داخل الصفاق. قرصة إصبع القدم من طرف باسطة من الماوس لتقييم مستوى التخدير والانتظار لعدم وجود رد فعل الألم ، مما يدل على العمق المناسب للتخدير لإجراء الجراحة. إذا لوحظ النطق أو انسحاب الطرف الخلفي ، فقم بحقن 0.01-0.03 مل من 2,2,2-tribromoethanol.
ملاحظة: يجب أن يكون الفأر المتلقي المطابق للورم من نفس جنس الفأر المتبرع الذي يوفر اللوغراف لتجنب مشكلات الرفض. - استخدم مرهم بيطري على العينين لمنع الجفاف. حلق الجناح الأيسر للماوس باستخدام ماكينة حلاقة كهربائية. ضع كريم مزيل للشعر لإزالة الشعر المتبقي.
ملاحظة: تجنب تآكل الجلد ، مما قد يزيد من خطر التلوث والعدوى. - ضع الماوس في خزانة السلامة الأحيائية. ضعه في وضع الانبطاح على لوح تشريح مغطى بورق ماصة نظيف ، مع المحور الرأسي للماوس مواز ورأسه إلى الجانب الأيمن من المجرب.
ملاحظة: يجب تنفيذ الإجراءات التالية في هذه الخطوة في خزانة السلامة الأحيائية للحفاظ على التعقيم الصارم. - فرك جلد المنطقة المحلوقة بالقطن المنقوع في البوفيدون اليود.
ملاحظة: استخدم البوفيدون اليود بدلا من 75٪ من الإيثانول للتعقيم لمنع فقدان حرارة الجسم. - ارفع الجلد عند النقطة الوسطى بين مفاصل ورك الفأر باستخدام ملاقط جراحية. استخدم المقص لإجراء استئصال رأسي بطول 5 مم. قم بتمديد القطع بشكل كبير على طول خط الوسط الظهري إلى ~ 10-15 ملم.
- قم بإجراء تشريح حاد عن طريق إدخال الأطراف المغلقة للمقص في الشق ثم فتحه لفصل الصفاق من الجناح الأيسر عن الجلد والأنسجة الرخوة.
ملاحظة: لتجنب التسبب في تلف الأنسجة تحت الجلد والصفاق، ارفع الجلد في وسط الشق، ثم أدخل المقص المغلق بالقرب من الجلد قدر الإمكان. - اصنع جيبا جلديا على الجناح الأيسر عن طريق إجراء تشريح حاد عدة مرات. قم بإيداع كتلة الورم المغلفة والسليمة المشتقة من المتبرع في الكبسولة.
ملاحظة: تتلقى الفئران في المجموعة الضابطة التي تديرها الشام نفس العملية الجراحية دون زرع الورم المشتق من المتبرع. - أغلق الشق عن طريق الخياطة المتقطعة (انظر قائمة المواد). ضع 2-3 خيوط لكل شق. تطهير الجلد حول القطع مع القطن المنقوع في البوفيدون اليود.
ملاحظة: يجب أن يكون هناك 5 مم بين غرزتين متتاليتين ومسافة 3 مم من الشق. - ضع الماوس في الموضع الجانبي في قفص نظيف ودافئ. راقبه باستمرار حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء الصارم.
- إدارة البوبرينورفين تحت الجلد بجرعة 0.1 مغ/كغ من وزن الجسم كل 8 ساعات ثلاث مرات بعد الجراحة لتخفيف الألم. راقب أكل الماوس وشربه وتحركه والمنطقة التي تعمل عليها. إعادة متلقي الزرع إلى شركة الحيوانات الأخرى فقط بعد أن يتعافى تماما.
ملاحظة: عادة ما يتعافى الفأر من صدمة الجراحة في غضون 3 أيام. إذا لم يعد الفأر إلى التغذية الطبيعية والتنقل وأظهر أي مظاهر للعدوى ، فاستشر الطبيب البيطري للتدخلات أو القتل الرحيم. - التضحية (القتل الرحيم للحيوانات كما في الخطوة 4.3.2) الفئران في النقاط الزمنية المشار إليها ، واستعادة الخلايا ذات الأهمية لتحليل التدفق الخلوي.
النتائج
ويبين الشكل 1 مخطط هذا البروتوكول. بعد ثمانية أيام من تلقيح الورم، تم حقن خلايا CD45.1+ وCD45.1+CD45.2+ OT-I في الفئران C57BL/6 الحاملة للورم B16F10-OVA. تم تشريح الورم جراحيا من الفئران المزروعة بالخلايا CD45.1+ OT-I (المتبرع) في اليوم 8 بعد النقل وزرعها في الفئران المطابقة للورم CD45.1 + CD45.2 + OT-I المزروعة بالخلايا (المتلقي) في الجناح الظهري على نفس جانب الورم المزروع. من خلال تحليل قياس التدفق الخلوي (استراتيجية البوابات الموضحة في الشكل 2) ، يمكن بسهولة تحديد مجموعتين من الخلايا التائية الخاصة بمستضدات الورم CD44 + CD8 + في TME ، بما في ذلك CD45.1 + المشتقة من المتبرع و CD45.1 + CD45.2 + TILs المشتقة من المتلقي. في وقت لاحق ، تم تحليل نسب هاتين المجموعتين داخل اللوغاريت في نقاط زمنية محددة لدراسة ديناميكيات الخلايا التائية CD8 + الخاصة بالمستضدات. في اليوم 2 بعد الزرع ، كان هناك ~ 83٪ من خلايا CD8 + T الخاصة بالمستضدات المشتقة من المتبرع داخل الورم المزروع ، وهي أكثر شيوعا من نظيراتها المشتقة من المتلقي. ومع ذلك ، كانت نسبة خلايا OT-I المشتقة من المتلقي مرتفعة في المرحلة المتأخرة من تكوين الورم ، متجاوزة خلايا OT-I المتأصلة في الورم المشتقة من المتبرع. (الشكل 3).
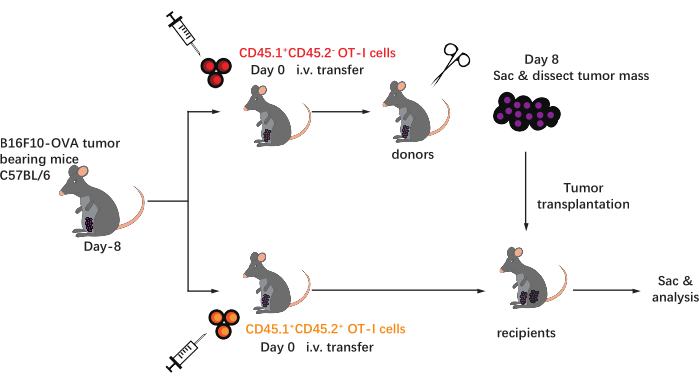
الشكل 1: مخطط التصميم التجريبي. يتم تحدي C57BL/6mice مع ورم B16F10-OVA في المنطقة الأربية. بعد ثمانية أيام ، يتم نقل خلايا OT-I المختلفة ذات العلامات الخلقية (CD45.1 + أو CD45.1 + CD45.2 +) إلى الفئران الحاملة للورم. في اليوم الثامن بعد النقل ، يتم تشريح الورم الموجود على الفئران المزروعة بخلية CD45.1 + OT-I جراحيا وزرعها تحت الجلد في متلقي CD45.1 + CD45.2 + OT-I المزروع بالخلايا في الجناح على نفس جانب الورم الحالي. بعد ذلك ، يتم التضحية بالفئران ، ويتم تحليل الخلايا التائية الخاصة بالمستضدات (خلايا OT-I) داخل اللوغاريت في النقاط الزمنية المحددة. الاختصارات: CD = مجموعة من التمايز; i.v. = عن طريق الوريد; ساك = تضحية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
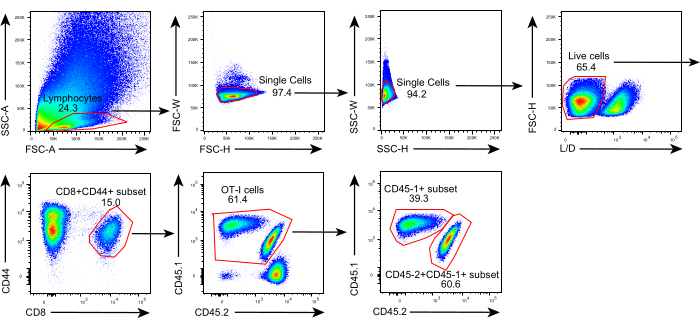
الشكل 2: استراتيجية البوابات لتحليل التدفق الخلوي. تستخدم استراتيجية البوابات لتحديد الخلايا التائية CD44+) المشتقة من المتبرع (CD45.1+CD45.2+) المشتقة من المتبرع (CD45.1+CD8+) داخل اللوغاريتات. الاختصارات: SSC-A = منطقة التشتت الجانبية. FSC-A = منطقة التشتت الأمامي ؛ FSC-W = عرض التشتت الأمامي ؛ FSC-H = ارتفاع التشتت الأمامي ؛ SSC-W = عرض التشتت الجانبي ؛ SSC-H = ارتفاع التشتت الجانبي. L / D = حي / ميت ؛ CD = مجموعة من التمايز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: نسبة الخلايا التائية CD8+ المستمدة من المستضدات المشتقة من المتبرع والمتلقي داخل أطواف الورم. مخططات قياس التدفق الخلوي التمثيلية التي تظهر التعبير عن العلامات الوراثية CD45.1 و CD45.2 المستخدمة لتحديد خلايا OT-I المشتقة من المتبرع والمتلقي داخل اللوغرافات السرطانية في الأيام 2 و 8 و 15 بعد الزرع. تمثل الأرقام النسب المئوية للمجموعتين الفرعيتين في مجموعة الخلايا التائية CD44 + CD8 + . يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تلعب المناعة بوساطة الخلايا التائية دورا حاسما في الاستجابات المناعية ضد الأورام ، حيث تلعب CTLs الدور الرائد في القضاء على الخلايا السرطانية. ومع ذلك ، لم يتم توضيح أصول CTLs الخاصة بمستضدات الورم داخل TME30. قدم استخدام بروتوكول زرع الورم هذا دليلا مهما على أن خلايا CD8 + T الخاصة بالمستضد داخل الرحم قد لا تستمر لفترة طويلة ، على الرغم من وجود خلايا سلف CD8 + T الشبيهة بالجذع TCF1 +. والجدير بالذكر أن هناك تدفقا مستمرا للخلايا التائية CD8+ الخاصة بالورم المشتق من المحيط إلى كتلة الورم.
على حد علمنا ، هذه طريقة مريحة ومقنعة نسبيا تؤكد أن الحفاظ على خلايا CD8 + T الخاصة بالمستضدات داخل TME يعتمد في الغالب على تجديد خلايا CD8 + T الخاصة بالورم المشتق من المحيط بدلا من التجديد الذاتي ل TILs المقيمة في الورم. على الرغم من أن البروتوكول المعروض هنا يركز فقط على نسب TILs المشتقة من الجهات المانحة والمشتقة من المتلقي ، إلا أنه يمكن فحص الخصائص الظاهرية والوظيفية والنسخية لهاتين المجموعتين بسهولة باستخدام قياس التدفق الخلوي. علاوة على ذلك ، من الممكن الجمع بين الأجسام المضادة ICB للتحقيق في استجابات مجموعة فرعية من الخلايا المحددة لعلاج ICB.
في هذا البروتوكول، يتم زرع أنسجة الورم المشتقة من المتبرع على الفأر المتلقي مع ورم أصلي موجود. سيؤدي ورمان في الفأر المتلقي إلى توزيع الخلايا التائية المتولدة عن المحيط إلى كتلتين من الورم. علاوة على ذلك ، سيتم مضاعفة عبء الورم تقريبا مقارنة بالحيوانات التي لا تحتوي على عمليات زرع. في التجارب التجريبية ، حاولنا استئصال الورم الأصلي على الفئران المتلقية قبل الزرع. ومع ذلك ، كان من الصعب تقنيا القضاء على جميع الخلايا السرطانية عن طريق الجراحة الدقيقة. الخلايا السرطانية المتبقية سوف تشكل بسرعة وتشكل أنسجة ورم جديدة قريبا. وبالتالي ، هناك قيود على هذا النظام عند مقارنة الاستجابات المناعية للخلايا التائية مع تلك الموجودة في الفئران غير المزروعة. ومع ذلك ، لا يزال هذا النظام مفيدا لمقارنة الخلايا التائية المهاجرة حديثا والموجودة داخل نفس TME التي يتم زرعها من الفئران الحاملة للورم من المتبرعين. إلى جانب ذلك ، لا يمكن إنكار أن زرع أنسجة الورم قد يؤدي إلى التهاب ، مما قد يؤثر على ديناميكيات الخلايا المناعية داخل الورم. على الرغم من أنه يمكن استبعاد تأثير الجراحة على تسلل خلايا OT-I من خلال عناصر تحكم غير مشغلة وصورية ، إلا أننا لم نقيم آثار الاستجابات الالتهابية المحلية لديناميكيات خلايا OT-I.
يجب أن تؤخذ بعض الاعتبارات في الاعتبار ، أحدها هو استخدام السيكلوفوسفاميد. سيكلوفوسفاميد31 هو عامل ألكيلات يستخدم على نطاق واسع لعلاج الأورام الخبيثة في الأعضاء الصلبة واضطرابات التكاثر اللمفاوي والمناعة الذاتية. بعد ستة إلى ثمانية أيام من تلقيح B16F10-OVA ، يتم إعطاء السيكلوفوسفاميد قبل النقل بالتبني للحث على الاستنزاف اللمفاوي للفئران المضيفة وتعزيز نشاط خلايا OT-I المنقولة29. على الرغم من أن سرطان الجلد ليس حساسا لهذا الكاشف ، إلا أن بعض خطوط الخلايا السرطانية ، مثل EG732 ، وهو خط خلية سرطان الغدد الليمفاوية الزعترية الفئرانية ، تستجيب للسيكلوفوسفاميد. يؤدي علاج الفئران الحاملة ل EG7 بالسيكلوفوسفاميد إلى القضاء على الأورام ، مما يشير إلى أنه يجب استخدام السيكلوفوسفاميد بعناية أو معايرته لنماذج الأورام الحساسة. الطريقة البديلة الموصى بها هي جرعة واحدة دون قاتلة من الإشعاع (4.5-5.5 Gy) قبل يوم واحد من النقل ، ويعتمد الاختيار الأمثل على خصائص خطوط الخلايا السرطانية.
يجب اتخاذ خطوات أخرى بحذر ، بما في ذلك الاختيار الدقيق للفئران المانحة الحاملة للورم والعملية الجراحية الدقيقة أثناء زرع الورم. ستتم إزالة الأورام المزروعة جراحيا وزرعها في الفئران المتلقية المطابقة للورم بعد 8-10 أيام من النقل. قبل الزرع ، يجب اختيار حجم مماثل من كتلة الورم التي يبلغ قطرها ~ 5 مم كمجموعة كبيرة لتقليل التناقضات بين الفئران الفردية وجعل البيانات المكتسبة أكثر موثوقية. علاوة على ذلك ، أثناء الجراحة ، يجب أن يكون الشق بالقرب من خط الوسط للفأر مرة أخرى للحفاظ على allograft على مسافة من الورم الموجود بالفعل في الفأر المتلقي. يقترح أيضا تشريح لطيف لمنع الإصابات في العقدة الليمفاوية الإربية والأنسجة المحيطة بها.
يتطلب القتل الفعال للخلايا السرطانية تنسيق المكونات المختلفة داخل TME33. يمكن توسيع البروتوكول المقدم هنا ليشمل التحقيق في الخلايا المناعية التكيفية والفطرية مثل الخلايا القاتلة الطبيعية والبلاعم المرتبطة بالورم والخلايا المتغصنة. علاوة على ذلك ، بالإضافة إلى B16F10-OVA المستخدم هنا ، يمكن تطبيق هذا البروتوكول على نماذج الأورام تحت الجلد الأخرى. في الختام ، يقدم اختبار زرع الورم المذكور أعلاه نهجا جديدا لدراسة التحولات التفاعلية لأنواع معينة من الخلايا المناعية أثناء الاستجابات المضادة للأورام وهو مفيد للباحثين في علم مناعة الورم.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال منح من الصندوق الوطني للعلوم الطبيعية للباحثين الشباب المتميزين (رقم 31825011 إلى LY) والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 31900643 إلى QH ، رقم 31900656 إلى ZW).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
References
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867 (2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794 (2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507 (2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169 (2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806 (2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved