Method Article
השתלת גידול להערכת הדינמיקה של תאי T המסתננים לגידולים CD8+ בעכברים
In This Article
Erratum Notice
Summary
כאן אנו מציגים פרוטוקול השתלת גידול לאפיון לימפוציטים חודרים לגידולים שמקורם בגידול ובפריפריה במודל גידול בעכבר. מעקב ספציפי אחר זרם תאי מערכת החיסון שמקורם במקבל עם ציטומטריה של זרימה חושף את הדינמיקה של השינויים הפנוטיפיים והתפקודיים של תאים אלה במהלך תגובות חיסוניות אנטי-סרטניות.
Abstract
חסינות המתווכת על ידי תאי T ממלאת תפקיד מכריע בתגובות חיסוניות נגד גידולים, כאשר לימפוציטים ציטוטוקסיים מסוג T (CTLs) ממלאים את התפקיד המוביל במיגור תאים סרטניים. עם זאת, המקורות והחידוש של תאי CD8+ T ספציפיים לאנטיגן הגידול בתוך המיקרו-סביבה של הגידול (TME) נותרים מעורפלים. פרוטוקול זה משתמש בקו תאי המלנומה B16F10-OVA, המבטא ביציבות את הניאו-אנטיגן הפונדקאי, אובלבומין (OVA) ועכברי TCR מהונדסים OT-I, שבהם יותר מ-90% מתאי ה-T של CD8+ מזהים באופן ספציפי את הפפטיד הנגזר מ-OVA OVA257-264 (SIINFEKL) הקשור למולקולה הגדולה מסוג I של קומפלקס היסטו-קומפטביליות (MHC) H2-Kb. תכונות אלה מאפשרות לחקור תגובות של תאי T ספציפיים לאנטיגן במהלך הגידול.
בשילוב מודל זה עם ניתוח השתלת גידולים, רקמות גידול מתורמים הושתלו בעכברים מושתלים סינגניים המותאמים לגידול כדי להתחקות במדויק אחר זרם תאי החיסון שמקורם במקבל לרקמות תורם מושתלות, מה שמאפשר ניתוח של התגובות החיסוניות של CD8+ הטבוע בגידול ומקורו בפריפריה תאי T. נמצא כי בין שתי האוכלוסיות הללו מתרחש מעבר דינמי. באופן קולקטיבי, תכנון ניסיוני זה סיפק גישה נוספת כדי לחקור במדויק את התגובה החיסונית של תאי CD8+ T ב- TME, אשר ישפוך אור חדש על אימונולוגיה של גידולים.
Introduction
לתגובה חיסונית בתיווך תאי T CD8+ יש תפקיד מרכזי בשליטה על צמיחת הגידול. במהלך הגידול, תאי T תמימים מסוג CD8+ מופעלים עם זיהוי אנטיגן באופן מוגבל I מסוג MHC ולאחר מכן מתמיינים לתאים אפקטיביים ומסתננים למסת הגידול 1,2. עם זאת, בתוך המיקרו-סביבה של הגידול (TME), חשיפה ממושכת לאנטיגן, כמו גם גורמים מדכאי חיסון, דוחפים תאי CD8+ T ספציפיים לגידולים חודרים למצב היפו-רספונסיבי המכונה "תשישות"3. תאי T מותשים (Tex) נבדלים מתאי T משפיעים או זיכרון הנוצרים בזיהום נגיפי חריף, הן מבחינה שעתוקית והן מבחינה אפיגנטית. תאי טקס אלה מאופיינים בעיקר בביטוי מתמשך ומוגבה של סדרה של קולטנים מעכבים, כמו גם באובדן היררכי של תפקודי אפקטור. יתר על כן, יכולת ההתפשטות הפגומה של תאי CD8+ T מותשים גורמת לירידה במספר תאי ה-T הספציפיים לגידול, כך שתאי ה-CD8+ T השיוריים בתוך ה-TME בקושי יכולים לספק חסינות מגנה מספקת מפני התקדמות הגידול3. לפיכך, תחזוקה או חיזוק של תאי T ספציפיים לאנטיגן תוך-סרטניים מסוג CD8+ חיוניים להדחקת הגידול.
יתר על כן, טיפול בחסימת מחסום חיסוני (ICB) הוא האמין להמריץ מחדש את טקס בגידולים על ידי הגדלת חדירת תאי T ומכאן, מספרי תאי T וחידוש תפקודי תאי T להגברת דיכוי הגידול. היישום הנרחב של טיפול ICB שינה את נוף הטיפול בסרטן, עם תת-קבוצה משמעותית של חולים שחוו תגובות עמידות 4,5,6. עם זאת, רוב החולים וסוגי הסרטן אינם מגיבים או רק באופן זמני ל- ICB. חדירה לא מספקת של תאי T ב-TME הונחה כאחד המנגנונים הבסיסיים האחראים להתנגדות ל-ICB 7,8.
מספר מחקרים הדגימו את ההטרוגניות של תאי T מסתננים לגידולים מסוג CD8+ (TILs) הן בחולים והן במודלים של עכברים 9,10,11,12. אושר כי תת-קבוצה של תאי T מסוג CD8+ המבטאים את פקטור תאי T 1 (TCF1) במסת הגידול מפגינים תכונות דמויות תאי גזע, מה שעלול להוליד עוד יותר תאי T מותשים סופניים ואחראי להתפרצות ההתפשטות לאחר טיפול ICB 12,13,14,15,16,17,18,19,20, 21,22. עם זאת, הוכח כי רק חלק קטן מתאי TCF1+CD8+ T הספציפיים לאנטיגן קיימים ב-TME ומייצרים מאגר מורחב של צאצאים ממוינים בתגובה ל-ICB 23,24,25,26. האם הגודל המוגבל של אוכלוסייה זו מספיק כדי להבטיח את ההתמדה של לימפוציטים T ציטוטוקסיים (CTLs) כדי לשלוט בהתקדמות הגידול עדיין לא ידוע, והאם יש חידוש מרקמות פריפריה דורש חקירה נוספת. יתר על כן, מחקרים עדכניים מצביעים על יכולת ההתחדשות הבלתי מספקת של תאי T ספציפיים לגידול הקיימים מראש ועל הופעתם של קלונוטיפים חדשים, שבעבר לא היו קיימים, לאחר טיפול אנטי-מתוכנת בחלבון מוות תאי 1. זה מצביע על כך שתגובת תאי T לחסימת מחסום עשויה לנבוע מהזרם החדש של רפרטואר מובהק של שיבוטים של תאי T27. יחד עם הימצאותו של שבר תאי T ציטוטוקסיים שאינם תגובתיים לגידולים ב-TME, ממצאים אלה הניעו את הקמתו של מודל אלוגרפט גידולי כדי לחקור את תפקידם של תאי CD8+ T שמקורם בפריפריה11.
עד כה, מספר סוגים של השתלת גידול, כמו גם העברה מאמצת של תאים חיסוניים, היו בשימוש נרחב בתחום האימונולוגיה של הגידול28. TILs, תאים חד-גרעיניים בדם היקפי ותאי חיסון תגובתיים לגידול שמקורם ברקמות אחרות יכולים להיות מאופיינים היטב בשיטות אלה. עם זאת, כאשר חוקרים את יחסי הגומלין בין חסינות מערכתית לחסינות מקומית נגד סרטנים, נראה כי מודלים אלה אינם מספיקים כדי לבחון את האינטראקציות בין תאי מערכת החיסון שמקורם בפריפריה לבין ה-TME. כאן, רקמות הגידול הושתלו מתורמים לעכברים מושתלים המותאמים לגידול כדי להתחקות במדויק אחר זרם תאי החיסון שמקורם במקבלי ההשתנה ולבחון את התאים שמקורם בתורמים ב-TME במקביל.
במחקר זה, מודל סיgeneic של מורין של מלנומה נקבע עם קו תאי מלנומה B16F10-OVA, אשר מבטא ביציבות את הפונדקאית neoantigen ovalbumin. עכברי TCR מהונדסים OT-I, שבהם יותר מ-90% מתאי ה-T של CD8+ מזהים באופן ספציפי את הפפטיד OVA OVA257-264 שמקורו ב-OVA (SIINFEKL) הקשור למולקולת ה-MHC H2-Kb מסוג I, מאפשרים לחקור את תגובות תאי ה-T הספציפיים לאנטיגן שפותחו במודל הגידול B16F10-OVA. בשילוב מודל זה עם השתלת גידולים, הושוו התגובה החיסונית של תאי CD8+ T הטבועים בגידול ובפריפריה כדי לחשוף מעבר דינמי בין שתי אוכלוסיות אלה. באופן קולקטיבי, תכנון ניסיוני זה סיפק גישה נוספת כדי לחקור במדויק את התגובות החיסוניות של תאי CD8+ T ב-TME, מה ששופך אור חדש על הדינמיקה של תגובות חיסוניות של תאי T ספציפיים לגידול ב-TME.
Protocol
כל הניסויים בעכברים בוצעו בהתאם להנחיות הוועדות המוסדיות לטיפול בבעלי חיים ולשימוש בהם של האוניברסיטה הצבאית השלישית לרפואה. השתמש בעכברי C57BL/6 בני 6-8 שבועות ובעכברים מהונדסים OT-I תמימים במשקל 18-22 גרם. השתמש גם בזכר וגם בנקבה ללא אקראיות או "עיוורון".
1. הכנת בינוניים וריאגנטים
- הכן את מדיום תרביות התאים D10 כפי שתואר קודם לכן29 על ידי הוספת 10% סרום בקר עוברי (FBS), 100 פניצילין U/mL, סטרפטומיצין 100 מ"ג/מ"ל ו-2 mM L-גלוטמין לתוך מדיום הנשר המהונדס של Dulbecco.
- הכינו את תרבית התאים הבינונית R10 על ידי תוספת RPMI-1640 עם 10% FBS, 100 פניצילין U/mL ו-100 מ"ג/מ"ל סטרפטומיצין.
הערה: מדיית התרבות, D10 ו- R10, יכולה להישאר סטרילית ויציבה למשך שבועיים לפחות כאשר היא מאוחסנת בטמפרטורה של 2-4 מעלות צלזיוס. - הכן חיץ מיון תאים המופעל על ידי פלואורסצנציה (FACS) על ידי תוספת של 1x מי מלח עם מאגר פוספט (PBS) עם 2% FBS ו-0.01% של נתרן אזיד.
הערה: עם תוספת של נתרן אזיד, ניתן לאחסן את מאגר FACS בטמפרטורה של 2-4 מעלות צלזיוס במשך חודשים. - הכן חיץ ליזיס של תאי דם אדומים (RBL) על ידי הוספת 155 mM NH4Cl, 10 mM KHCO3 ו- 0.1 mM חומצה אתילנדיאמין טטראצטית (EDTA) למים מזוקקים כפולים, והתאם את ה- pH שלו ל- 7.3.
הערה: מאגר RBL יציב עד 3 חודשים בטמפרטורת החדר (RT). - הכינו מאגר מיון תאים המופעל על ידי מגנטיקה (MACS) על ידי הוספת PBS עם אלבומין בסרום בקר (BSA) של 0.5% ו-2 mM EDTA.
הערה: יש להעביר את התמיסה דרך מסנן של 0.22 מיקרומטר לאחר שהריאגנט מומס ומשתמר באספסיס. - הכינו פתרון עבודה של 2,2,2-טריברומואתנול.
- ממיסים 2.5 גרם של 2,2,2-טריברומואתנול ב-5 מ"ל של אלכוהול טרט-עמיל (2-מתיל-2-בוטנול). מערבבים פנימה ויברטור שטוף אדים בטמפרטורה קבועה ב-180 סל"ד, 40 מעלות צלזיוס למשך הלילה.
- סנן את התמיסה דרך מסנן 0.22 מיקרומטר לתוך מיכל סטרילי. מוסיפים מים מזוקקים כפולים עד לנפח סופי של 200 מ"ל, ומערבבים ביסודיות וברציפות עד שהתמיסה הופכת ברורה ושקופה.
- קבע והתאם את ערך ה- pH של הפתרון ל- 7.3. עטוף לחלוטין את המיכל בנייר אלומיניום כדי לא לכלול אור ולאחסן בטמפרטורה של 4 מעלות צלזיוס.
הערה: הריכוז הסופי של תמיסת העבודה של 2,2,2,2-טריברומואתנול הוא 12.5 מ"ג/מ"ל. פתרון מרוכז יותר אינו מומלץ מכיוון שהחומר מגרה בריכוזים גבוהים יותר. בדוק את ערך ה- pH של הפתרון העובד לפני כל שימוש, והשלך אותו אם ה- pH קטן מ- 5.
2. הכנת השעיית תא B16F10-OVA
הערה: תרבית תאים צריכה להתבצע במכסה מנוע של בטיחות ביולוגית בתנאים אספטיים מחמירים.
- להפשיר ולתרבות בקבוקון של תאי B16F10-OVA עם D10 באינקובטור תרבית תאים ב-37 °C ו-5% CO2.
- כאשר התאים מגיעים למפגש של כ-80-90%, תת-התרבות של התאים.
- הסר את מדיום התרבית באמצעות פיפטטור, ושטפו את התאים פעמיים באמצעות PBS.
הערה: אין להוסיף PBS בכוח נגד התאים הדבקים בבקבוקון או בתרבית התאים. במקום זאת, פיפטמו את ה-PBS לכיוון הדופן או הוסיפו אותו בצורה טיפה-חכמה לתוך הבקבוקון או המנה. - הסר את ה- PBS, והוסף 1-2 מ"ל של תמיסת טריפסין-EDTA של 0.25% לתוך הבקבוקון או המנה. נדנדו אותו קדימה ואחורה כדי לכסות את כל פני התא. מניחים את הבקבוקון או המנה באינקובטור בטמפרטורה של 37 מעלות צלזיוס למשך כדקה אחת או ב-RT עד שהתאים מתנתקים.
הערה: ניתן להשתמש במיקרוסקופ הפוך כדי לבדוק אם התאים התנתקו. - הוסף D10 טרי כדי לעצור את ה-trypsinization. פיפט את ההשעיה למעלה ולמטה כדי להבטיח שכל התאים מנותקים מהבקבוקון או ממשטח המנה.
- העבר את תרחיף התא B16F10-OVA לצינור חרוטי של 15 מ"ל. צנטריפוגה של התאים ב-125 × גרם למשך 5-7 דקות ב-RT.
- יש להשליך את הסופרנטנט, ולהחזיר את גלולת התא עם D10. מחלקים את ההשעיה של תאי B16F10-OVA לתוך בקבוקון חדש או צלחת תרבית תאים המכילה D10 ואינקובציה בחממת תרביות תאים בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2.
- הסר את מדיום התרבית באמצעות פיפטטור, ושטפו את התאים פעמיים באמצעות PBS.
- ביום השתלת הגידול, לקצור תאי B16F10-OVA שהם כ-90% מפגש כמתואר בשלבים 2.2.1 עד 2.2.4. השליכו את הסופרנטנט, והחזירו את גלולת התא עם 1 מ"ל של PBS.
- ספרו את התאים בני הקיימא עם המוציטומטר באמצעות 0.4% טריפאן כחול. התאם את צפיפות התא ל- 1 × 106 תאים לכל 100 μL על-ידי הוספת PBS. שמור את התאים על קרח.
3. השתלת גידולים חוץ רחמיים של תאי B16F10-OVA באזור המפשעה של עכברים
- השתמשו בעכברים בני 6-8 שבועות מסוג C57BL/6 במשקל 18-22 גרם. השתמש גם בזכר וגם בנקבה ללא אקראיות או "עיוורון".
- למשוך 100 μL של תרחיף התא B16F10-OVA מוכן לתוך מזרק שחפת 1 מ"ל. הקישו על הקנה כדי להזיז בועות למעלה, ודחפו בעדינות את הבוכנה כדי להסיר בועות אוויר.
- לרסן את העכבר ולחשוף את בטנו. לחץ על הרגל האחורית השמאלית עם האצבע הקטנה כדי להדק את העור של האזור המפשעה השמאלי.
- הסר את שיער העכבר מבטנו התחתונה השמאלית באמצעות מכונת גילוח חשמלית. השתמשו בכותנה ספוגה ב-75% אתנול כדי לנקות את הרביע האחורי של הבטן השמאלית.
- מחזיקים את המזרק בזווית רדודה מאוד (0-15 מעלות) כאשר שיפוע המחט פונה כלפי מעלה, מכניסים אותו לאתר הירך העליונה השמאלית, ומתקדמים 0.5-1 ס"מ דרך הרקמה התת עורית לאזור המפשעתי.
- משכו לאחור את הבוכנה לפני ההזרקה. אם יש לחץ שלילי, לדכא את הבוכנה לחלוטין, ולראות בולוס קטן (היווצרות של כיס נוזל) ב subcutis לצוץ.
הערה: אם הדם נשאב בחזרה לתוך רכזת המחט, נסוגו ונסו שוב באתר אחר. - הסר את המחט לאחר ביצוע ההזרקה והיפטר ממנה כראוי. שחררו והחזירו את העכבר לכלוב.
- מדוד את גודל הגידול בימים 6-8 באמצעות סולם ורנייה לאחר השתלת B16F10-OVA. בחר עכברים עם גידול בקוטר של כ-3 מ"מ (בגודל שעועית מש) וחלק אותם באופן שווה ואקראי לשתי קבוצות.
הערה: עכברים עם גידולים בגודל דומה מוקצים באופן אקראי כעכברים תורמים ומקבלים; רקמת הגידול המותאמת שנכרתה מעכברים תורמים תושתל בעכברים המושתלים. יתר על כן, יש לכלול בקרות שאינן מנותחות ובקרות המופעלות על ידי שומה כדי להעריך את ההשפעות של ניתוח על העברת תאים מאמצים ועל הבריאות הכללית של עכברים. לפיכך, קבוצה אחת של עכברים נושאי גידול משמשת כבקרות שאינן מנותחות, ומקבלת תאי CD45.1+CD45.2+ או CD45.1+ OT-I אך ללא ניתוח. קבוצת העכברים השנייה משמשת כבקרות המופעלות על ידי שיימינג, ומקבלת תאי CD45.1+CD45.2+ או CD45.1+ OT-I וניתוחים נוספים הדומים לקבוצת הניסוי אך ללא השתלת אלוגרפט.
4. העברה מאמצת של תאי OT-I T המסומנים באופן קונגני לתוך עכברים נושאי גידול
- ביום שלפני ההעברה, תן 4 מ"ג של ציקלופוספמיד מומס ב-200 μL של PBS באמצעות הזרקה תוך-צפקית לכל עכבר נושא גידול.
הערה: הטיפול בציקלופופוספמיד נועד לגרום ללימפופניה בפונדקאי שמייצרת "מקום" לתאים המועברים, מקדמת את הישרדותם ומעודדת את פעילותם לאיברים לימפואידיים כדי לתפקד ביעילות. - השתמש בעכברים מהונדסים OT-I נאיביים עם סמנים קונגניים מובהקים (בני 6-8 שבועות, 18-22 גרם, אותו המין כמו העכברים נושאי הגידול). השתמש בעכברי CD45.1+ OT-I ובעכברי CD45.1+CD45.2+ OT-I כדי להעביר באופן מאמץ תאי T ספציפיים לאנטיגן OVA257-264 לעכברים תורמים נושאי גידול ומקבלים, בהתאמה.
הערה: ניתן לזהות בקלות את מקורם של תאי OT-I המועברים במאמץ אם הם מציגים סמנים קונגניים או פלואורסצנטיים מובהקים. לדוגמה, הזריקו תאי CD45.1+ OT-I T לעכברים תורמים נושאי B16F10-OVA תוך הזרקת תאי CD45.1+CD45.2+ OT-I T לעכברים מושתלים נושאי B16F10-OVA. CD45.1 ו- CD45.2 הם שניהם איזופורמים של סמן הפאן-לימפוציטים CD45 (Ly5). סמנים קונגניים נפוצים אחרים כוללים איזופורמים שונים של CD90 (Thy1). פרוטוקול זה יכול לשמש עבור עכברים הנושאים סמנים קונגניים שונים. עכברי OT-I צריכים להיות מאותו המין כמו העכברים המקבלים העברת תאי OT-I כדי למנוע בעיות דחייה. - לבודד את הלימפוציטים מן הטחול ובלוטות הלימפה של עכבר OT-I.
הערה: ההליכים הבאים בשלב זה חייבים להתבצע בארון בטיחות ביולוגית כדי לשמור על אספסיס קפדני.- הכינו שתי צלחות פטרי 60 מ"מ × 10 מ"מ. מוסיפים 3 מ"ל של R10 בינוני למנה אחת תוך הוספת 3 מ"ל של חיץ RBL למנה אחרת. מניחים מסננת תאי ניילון של 70 מיקרומטר בצלחת המכילה חיץ RBL.
- המתת חסד עכבר OT-I בתא איזופלורן ולאחר מכן נקע צוואר הרחם.
- קוצרים את הטחול, המפשעה (subiliac) ובלוטות הלימפה בבית השחי של העכבר ומעבירים אותם למנה של 60 מ"מ × 10 מ"מ עם 3 מ"ל של R10 על קרח.
הערה: מספר העכברים OT-I שהוקרבו עשוי להיות מותאם בהתאם למספר העכברים נושאי הגידול שיש להעביר. תפוקה אופיינית של תאי OT-I CD8+ T מטחול ובלוטות לימפה מפשעתיות ובתי השחי דו-צדדיים של תאי OT-I CD8+ T היא ~ 30-100 × 106 תאים לכל עכבר. - באמצעות קנה הקצה של מזרק 1 מ"ל, macerate הטחול ב 3 מ"ל של חיץ RBL דרך המסננת. דגירה למשך 3 דקות ב- RT, וסיום התגובה על ידי הוספת 3 מ"ל של מדיום R10 קר.
- מועכים את בלוטות הלימפה עד שנותרו רק רקמות חיבור. שטפו את המסנן עם R10. מעבירים את תרחיף התא לצינור חרוטי חדש של 15 מ"ל. צנטריפוגה ב 500 × גרם, 4 מעלות צלזיוס למשך 6 דקות.
- נקו את הסופרנטנט, והחזירו את התאים ב-3 מ"ל של מאגר MACS. מעבירים את תרחיף התא דרך מסננת תאים חדשה של 70 מיקרומטר כדי להסיר את כל הפלוקים.
- צנטריפוגה את מתלה התא ב 500 × גרם במשך 5 דקות ב 4 °C (64 °F). דקאנט הסופרנאטנט.
- השתמש בערכת בידוד תאי CD8+ T של עכבר (ראה טבלת החומרים) כדי לטהר תאי CD8+ T על ידי בחירה שלילית, בהתאם לפרוטוקול היצרן.
הערה: בעת שימוש בערכות של חברות אחרות, בצע את הוראות היצרן. - שמור את תרחיף התא המטוהר על קרח. קחו דגימה קטנה של תאים וערבבו עם טריפאן כחול כדי לספור תאים באמצעות המוציטומטר.
- קבע את אחוז תאי ה-OT-I (חי/מת-CD8+Va2+) על-ידי ציטומטריית זרימה.
הערה: יש לבצע צביעה סימולטנית של סמנים קוגניים ושל ה-TCR המהונדס כדי לאמת את הפנוטיפ הנכון של התאים לפני ההעברה.- הוסף 5 × 104-1 × 105 תאים לתוך 1 מ"ל של מאגר FACS בצינור צנטריפוגה של 1.5 מ"ל, וצנטריפוגה את תרחיף התא ב 350 × גרם, 4 מעלות צלזיוס למשך 3 דקות.
- השליכו את ה-supernatant, ופזרו את התאים על ידי הסטת החלק התחתון של הצינור. הניחו את הצינור על קרח.
- הכן את תערובות הנוגדנים המצומדות הבאות (מדוללות במאגר FACS של 100 μL): אנטי CD8, 1:200; נגד TCR Vα2, 1:100; אנטי-CD45.1, 1:200; אנטי-CD45.2, 1:200; וחיים/מתים, 1:200 (עיין בטבלת החומרים).
- וורטקס קוקטייל הנוגדנים והצנטריפוגה ב-15,000 × גרם במשך 3 דקות כדי לכדור נוגדנים מצטברים. אחסנו את הקוקטייל על קרח והגנו עליו מפני אור.
- יש להחיות את התאים עם 100 μL של קוקטייל נוגדנים ולערבב היטב על ידי הסטת הצינור. דגירה בחושך במשך 30 דקות על קרח.
הערה: הימנעו מהפרעה לאגרגטי הנוגדנים בתחתית הצינור. - שטפו את הכדורים פעמיים עם 1 מ"ל של מאגר FACS. צנטריפוגה ב 350 × גרם, 4 מעלות צלזיוס למשך 3 דקות. בצעו שימוש חוזר בתאים ב-200 μL של מאגר FACS, והעבירו את תרחיף התא לצינור FACS.
הערה: כדי לשמור על הכדאיות של תאי ה- OT-I שיש להעביר, בדוק את הדגימה בהקדם האפשרי. אם לא ניתן לבדוק את תאי ה-OT-I המוכתמים באופן מיידי, שמרו את התאים בחושך על קרח או שמרו בקירור בטמפרטורה של 4 מעלות צלזיוס עד לניתוח. לחלופין, ניתן לבצע שימוש חוזר בדגימות ב-1-4% paraformaldehyde לאחסון ממושך (16 שעות) כדי למנוע הידרדרות. - הפעל את הדגימה על ציטומטר זרימה. חשב את אחוז התאים החיים/מתים-CD8+Va2+ על-ידי חלוקת מספר התאים החיים/מתים-CD8+Vα2+ במספר התאים החיים/מתים.
- קבע את המספר המוחלט של תאי OT-I (חי/מת-CD8+Va2+) על-ידי הכפלת אחוז התאים החיים/מתים-CD8+Va2+ במספר התאים הישים המתקבל בשלב 4.3.9.
- התאם את הריכוז של תאי OT-I (חי/מת-CD8+Va2+) ל-1.5 ×-106/מ"ל עם PBS.
- הזריקו 3 × 105 תאי OT-I המסומנים באופן קוגני (חי/מת-CD8+Va2+) ב-200 μL של PBS תוך ורידי לשתי קבוצות של עכברים נושאי B16F10-OVA המסומנים באופן קונגני (עכברים נושאי גידול המחולקים לעכברים תורמים ומקבלים משלב 3.8).
- משכו 200 μL של תרחיף של תא OT-I (חי/מת CD8+Va2+) למזרק אינסולין של 100 U (29 גרם), והסירו בועות כמו בשלב 3.2.
- מניחים את העכבר בנפרד בכלוב עם מנורת אינפרא אדום מעל הכלוב למשך 5-10 דקות כדי להרחיב את וריד הזנב. לשתק את העכבר עם מכשיר מרסן בגודל מתאים. משכו את הזנב כדי ליישר אותו ומרססים ב-75% אתנול כדי להפוך את הווריד לנראה לעין.
- החזיקו את המזרק במקביל לווריד והכניסו אותו לווריד בזווית של 0-15 מעלות. משכו מעט את הבוכנה לאחור, ואם הדם נכנס לחבית, הזריקו לאט ובהתמדה את ההשעיה בקצב של לא יותר מ-1 מ"ל/דקה.
הערה: התנגדות או נפיחות באתר ההזרקה מצביעה על כך שהמחט אינה בתוך הווריד; יש להזיז את אתר ההזרקה באופן פרוקסימלי. - לאחר השלמת ההזרקה, הסר את המזרק, ולחץ על אזור ההחדרה בעדינות במשך 3-5 שניות כדי לעצור את הדימום. מחזירים את העכבר לכלוב ומתבוננים בו מקרוב במשך כמה דקות לתגובות שליליות. אם יש לו ניידות תקינה והפרשות מהאף, הניחו אותו בחזרה בחברת העכברים האחרים.
5. נתחו את מסת הגידול מעכברים תורמים נושאי גידול
הערה: לשמור על מצבים סטריליים במהלך הניתוח בסעיפים 5 ו-6. לעקר את כל כלי הניתוח על ידי autoclaving לפני ואחרי כל שימוש. יש לחטא את אזור ההפעלה בארון הבטיחות הביולוגית עם 75% אתנול ולאחר מכן הקרנה אולטרה סגולה. לבשו שמלה נקייה, כובע, מסכת פנים וכפפות סטריליות.
- שמונה עד עשרה ימים לאחר ההעברה המאמצת, בחרו עכברים תורמים הנושאים מסת גידול דומה בקוטר של כ-5 מ"מ (בגודל סויה) לניתוח השתלה.
- מכינים צלחת 100 מ"מ × 20 מ"מ בארון בטיחות ביולוגית, ומוסיפים 10 מ"ל של PBS סטרילי קר כקרח.
- המתת עכבר תורם נושא גידול בתא איזופלורן ולאחר מכן נקע צוואר הרחם. יש לטבול את העכבר ב-75% אתנול למשך 3-5 דקות ולהעביר לארון הבטיחות הביולוגית.
הערה: ההליכים הבאים בשלב זה חייבים להתבצע בארון בטיחות ביולוגית כדי לשמור על אספסיס קפדני. - הניחו את העכבר על לוח דיסקציה המכוסה בנייר סופג נקי במצב שכיבה. לרסן את איברי העכבר עם מחטי דיסקציה.
- חותכים את העור לאורך קו האמצע מלמעלה לפתח השופכה ועד לקסיפואיד עם מספריים. למתוח את העור לכיוון הצד השמאלי של גוף העכבר עם פינצטה ולרסן את העור עם מחטי דיסקציה.
- לבלות את הגידול, תוך שמירה על הקפסולה שלו שלמה ככל האפשר. בזהירות ובעדינות להסיר את רקמת החיבור ליד הגידול עם מספריים כירורגיים.
הערה: כדי לשמור על שלמות הגידול, אין לקלף את כמוסת הגידול או לחתוך את רקמת הגידול לחתיכות. - מניחים את רקמת הגידול בצלחת של 100 מ"מ × 20 מ"מ המכילה 10 מ"ל של PBS קר כקרח סטרילי להשתלה לאחר מכן.
6. השתלה תת עורית של גידול שמקורו בתורמים על העכברים המושתלים המותאמים לגידול
הערה: ה- allograft אמור להיות מושתל באגף התחתון של העכבר באותו צד כמו הגידול שהיה קיים בעבר כדי לגרום לשני גידולים להתנקז לצומת הלימפה הזהה. בפרוטוקול שהוצג כאן, מכיוון שגידול B16F10-OVA הושתל באופן תת עורי באזור המפשעתי השמאלי של העכבר (סעיף 3), רקמת הגידול שמקורה בתורם הושתלה באגף השמאלי של המושתל בשלב זה. ניתן להתאים את אתר ההשתלה לאתר הגידול המושתל הראשון.
- הרדמה עכבר מושתל המותאם לגידול עם 250 מ"ג/ק"ג של 2,2,2,2-טריברומואתנול באמצעות הזרקה תוך-צפקית. לצבוט את הבוהן של איבר extensor של העכבר כדי להעריך את רמת ההרדמה ולהמתין לחוסר רפלקס הכאב, אשר מציין את עומק ההרדמה הנכון לביצוע הניתוח. אם נצפתה נסיגה קולית או גפיים אחוריות, הזריקו עוד 0.01−0.03 מ"ל של 2,2,2,2-טריברומואתנול.
הערה: העכבר המקבל התואם לגידול צריך להיות באותו המין כמו העכבר התורם המספק את האלוגרפט כדי למנוע בעיות דחייה. - השתמשו במשחה וטרינרית על העיניים כדי למנוע יובש. לגלח את האגף השמאלי של העכבר באמצעות מכונת גילוח חשמלית. יש למרוח קרם דקפילטורי כדי להסיר את השיער שנותר.
הערה: הימנעו מפגיעה בעור, שעלולה להגביר את הסיכון לזיהום ולזיהום. - הניחו את העכבר בארון הבטיחות הביולוגית. מניחים אותו במצב נוטה על לוח דיסקציה מכוסה בנייר סופג נקי, כאשר הציר האנכי של העכבר מקביל לראשו לצדו הימני של הנסיין.
הערה: ההליכים הבאים בשלב זה חייבים להתבצע בארון בטיחות ביולוגית כדי לשמור על אספסיס קפדני. - לשפשף את העור של האזור המגולח עם כותנה ספוגה פובידון-יוד.
הערה: השתמש בפובידון-יוד במקום 75% אתנול לעיקור כדי למנוע אובדן חום גוף. - הרימו את העור בנקודת המרכז בין מפרקי הירך של העכבר עם פינצטה כירורגית. השתמש במספריים כדי לבצע כריתה אנכית באורך 5 מ"מ. הרחיבו את החתך לאורך קו האמצע הגבי ל-10-15 מ"מ.
- בצע ניתוח חד על ידי החדרת הקצות הסגורים של המספריים לתוך החתך ולאחר מכן פתיחה כדי להפריד את הצפק של האגף השמאלי מהעור והרקמה הרכה.
הערה: כדי למנוע גרימת נזק לרקמה התת עורית ולצפק, הרימו את העור במרכז החתך, ולאחר מכן החדירו את המספריים הסגורים קרוב ככל האפשר לעור. - הכינו כיס עור באגף השמאלי על ידי ביצוע דיסקציה חדה מספר פעמים. הפקידו את מסת הגידול הדחוסה, השלמה, שמקורה בתורמים, לתוך הקפסולה.
הערה: עכברים בקבוצת הביקורת המופעלת על ידי הבושה עוברים את אותו ניתוח ללא השתלת הגידול שמקורה בתורם. - סגור את החתך על ידי תפר מופרע (ראה רשימת חומרים). יש להניח 2-3 תפרים לכל חתך. יש לחטא את העור סביב החתך בכותנה ספוגה בפובידון-יוד.
הערה: צריך להיות 5 מ"מ בין שני תפרים עוקבים ומרחק של 3 מ"מ מהחתך. - מניחים את העכבר במצב לרוחב בכלוב נקי וחם. עקוב אחריו ברציפות עד שהוא חזר להכרה מספקת כדי לשמור על התאוששות הסטרנלית.
- יש לתת בופרנורפין תת עורית במינון של 0.1 מ"ג/ק"ג משקל גוף כל 8 שעות שלוש פעמים לאחר הניתוח כדי להקל על הכאב. עקוב אחר אכילת העכבר, שתייתו, תנועתו, תנועתו והאזור שבו פעל. החזירו את המושתל לחברתם של בעלי חיים אחרים רק לאחר שהחלים לחלוטין.
הערה: העכבר בדרך כלל מתאושש מהטראומה של הניתוח תוך 3 ימים. אם העכבר אינו חוזר להאכלה ולניידות רגילה ומראה ביטויים כלשהם של זיהום, יש להתייעץ עם וטרינר לקבלת התערבויות או להרדים אותו. - להקריב (להרדים את בעלי החיים כמו בשלב 4.3.2) את העכברים בנקודות הזמן שצוינו, ולשחזר את התאים המעניינים לניתוח ציטומטרי של זרימה.
תוצאות
הסכימה של פרוטוקול זה מוצגת באיור 1. שמונה ימים לאחר חיסון הגידול, CD45.1+ ותאי CD45.1+CD45.2+ OT-I הוזרקו לעכברי C57BL/6 נושאי גידול B16F10-OVA. הגידול נותח בניתוח מ-CD45.1+ עכברים מושתלים בתאי OT-I (תורם) ביום ה-8 שלאחר ההעברה והושתל בעכברים מושתלים (מושתלים) של תאי CD45.1+CD45.2+ OT-I המותאמים לגידול, באגף הגבי באותו צד של הגידול המושתל. באמצעות ניתוח ציטומטריה של זרימה (אסטרטגיית גיטינג המוצגת באיור 2), ניתן לזהות בקלות שתי אוכלוסיות של תאי T ספציפיים לאנטיגן סרטני CD44+CD8+ ב-TME, כולל TILs שמקורם ב-CD45.1+ שמקורם בתורמים ו-CD45.1+CD45.2+ של TILs שמקורם במקבל. לאחר מכן, הפרופורציות של שתי האוכלוסיות הללו בתוך האלוגרפטים נותחו בנקודות זמן מסומנות כדי לחקור את הדינמיקה של תאי ה-CD8+ T הספציפיים לאנטיגן. ביום השני שלאחר ההשתלה, היו כ-83% מתאי ה-CD8+ T הספציפיים לאנטיגן שמקורם בתורמים בתוך הגידול המושתל, יותר דומיננטיים ממקביליהם שמקורם במקבל. עם זאת, שיעור תאי ה-OT-I שמקורם במקבל היה גבוה בשלב המאוחר של הגידול, וחרג מתאי OT-I הטבועים בגידול שמקורם בתורם. (איור 3).
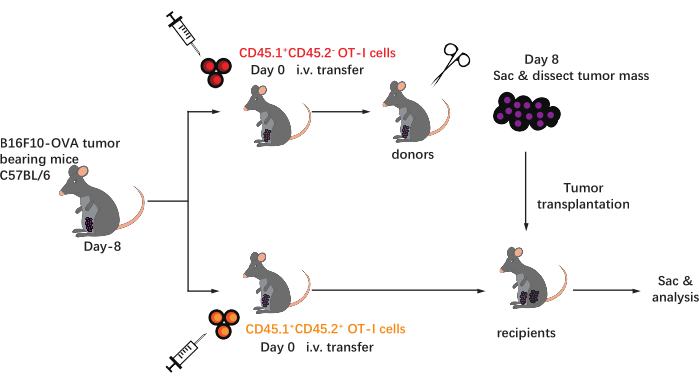
איור 1: שרטוט של תכנון הניסוי. C57BL/6mice מאותגרים עם גידול B16F10-OVA באזור המפשעה. שמונה ימים לאחר מכן, תאי OT-I שונים המסומנים באופן קונגני (CD45.1+ או CD45.1+CD45.2+) מועברים לעכברים נושאי גידול. ביום ה-8 לאחר ההעברה, הגידול בעכברים המושתלים בתאי CD45.1+ OT-I מנותח בניתוח ומושתל באופן תת-עורי במשתלי CD45.1+CD45.2+ מושתלים בתאי OT-I באגף באותו צד של הגידול הקיים. לאחר מכן, העכברים מוקרבים, ותאי T ספציפיים לאנטיגן (תאי OT-I) בתוך האלוגרפטים מנותחים בנקודות הזמן שצוינו. קיצורים: CD = אשכול של הבחנה; i.v. = תוך ורידי; שק = קורבן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
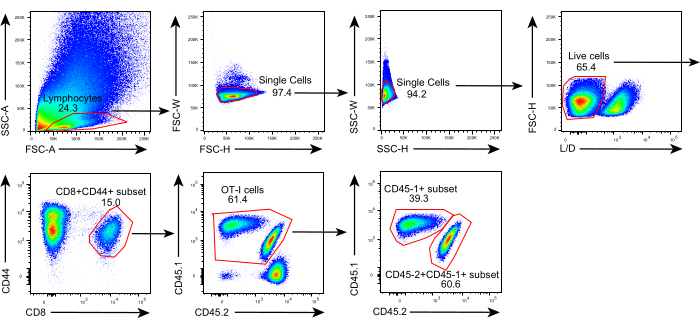
איור 2: אסטרטגיית גידור של ניתוח ציטומטריה של זרימה. אסטרטגיית Gating המשמשת לזיהוי תאי CD44+CD8+ T שמקורם בתורמים (CD45.1+CD45.2+) שמקורם בתורמים (CD45.1+) בתוך אלוגרפטים. קיצורים: SSC-A = אזור פיזור צד; FSC-A = אזור פיזור קדימה; FSC-W = רוחב פיזור קדימה; FSC-H = גובה פיזור קדימה; SSC-W = רוחב פיזור צד; SSC-H = גובה פיזור צד; L/D = חי/מת; CD = אשכול של דיפרנציאציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: היחס בין תאי CD8+ T ספציפיים לאנטיגן שמקורם בתורמים ובמקבלים בתוך אלוגרפטים של גידולים. חלקות ציטומטריה של זרימה מייצגת המציגות ביטוי של הסמנים הקונגניים CD45.1 ו- CD45.2 המשמשים לזיהוי תאי OT-I שמקורם בתורמים ובמקבל בתוך אלוגרפטים של הגידול בימים 2, 8 ו-15 לאחר ההשתלה. המספרים מייצגים את האחוזים של שתי תת-הקבוצות באוכלוסיית תאי ה-T CD44+CD8+ T. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
חסינות המתווכת על ידי תאי T ממלאת תפקיד מכריע בתגובות חיסוניות נגד גידולים, כאשר CTLs ממלאים את התפקיד המוביל במיגור תאים סרטניים. עם זאת, המקורות של CTLs ספציפיים לאנטיגן הגידול בתוך TME לא הובהרו30. השימוש בפרוטוקול השתלת גידול זה סיפק רמז חשוב לכך שתאי CD8+ T ספציפיים לאנטיגן תוך-סרטניים עשויים שלא להימשך זמן רב, למרות קיומם של תאי TCF1+ דמויי גזע מסוג TCF1+ CD8+ T. יש לציין כי קיים זרם מתמשך של תאי CD8+ T ספציפיים לגידול שמקורם בפריפריה לתוך מסת הגידול.
למיטב ידיעתנו, זוהי שיטה נוחה ומשכנעת יחסית המאשרת כי תחזוקת תאי CD8+ T ספציפיים לאנטיגן בתוך ה- TME תלויה בעיקר בחידוש מחדש של תאי CD8+ T ספציפיים לגידולים שמקורם בפריפריה במקום בחידוש עצמי של TILs תושבי הגידול. למרות שהפרוטוקול המוצג כאן מתמקד רק בפרופורציות של TILs שמקורם בתורמים ובנגזרת המקבל, ניתן לבחון בקלות את התכונות הפנוטיפיות, הפונקציונליות והשעתוק של שתי אוכלוסיות אלה באמצעות ציטומטריה של זרימה. יתר על כן, ניתן לשלב נוגדני ICB כדי לחקור את התגובות של תת-קבוצה מסוימת של תאים לטיפול ב- ICB.
בפרוטוקול זה, רקמת גידול שמקורה בתורמים מושתלת בעכבר המושתל עם גידול מקורי קיים. שני גידולים בעכבר מושתל יובילו להתפלגות תאי T הנוצרים בפריפריה לשתי מסות גידול. יתר על כן, נטל הגידול כמעט יוכפל בהשוואה לבעלי חיים ללא השתלות. בניסויי פיילוט ניסינו לכרות את הגידול המקורי על עכברים מושתלים לפני ההשתלה; עם זאת, זה היה מאתגר מבחינה טכנית לחסל את כל תאי הגידול על ידי ניתוח ביסודיות. שאריות תאי הגידול ייצרו במהירות רקמת גידול חדשה בקרוב. לפיכך, קיימת מגבלה למערכת זו כאשר משווים את התגובות החיסוניות של תאי T עם אלה שבעכברים שאינם מושתלים. עם זאת, מערכת זו עדיין שימושית להשוואה בין תאי T שנדדו לאחרונה וקיימים בתוך אותו TME המושתל מעכברים נושאי גידול תורמים. חוץ מזה, אין להכחיש כי השתלת רקמת הגידול עלולה להוביל לדלקת, מה שעלול להשפיע על הדינמיקה של תאי החיסון בתוך הגידול. אף על פי שניתן היה לכלול את ההשפעה של ניתוח על חדירת תאי OT-I באמצעות בקרות שאינן מנותחות ומנוהלות על ידי שיימינג, לא הערכנו את ההשפעות של תגובות דלקתיות מקומיות לדינמיקה של תאי OT-I.
כמה שיקולים יש לקחת בחשבון, אחד מהם הוא השימוש של cyclophosphamide. ציקלופוספמיד31 הוא סוכן אלקילציה הנמצא בשימוש נרחב לטיפול בממאירות איברים מוצקים ובהפרעות לימפופרוליפרטיביות ואוטואימוניות. שישה עד שמונה ימים לאחר חיסון B16F10-OVA, ציקלופוספמיד ניתן לפני העברה מאמצת כדי לגרום ללימפודופלציה של עכברים מארחים ולשפר את הפעילות של תאי OT-I המועברים29. למרות שמלנומה אינה רגישה לריאגנט זה, כמה קווי תאים סרטניים, כגון EG732, קו תאי לימפומה תימי מורין, מגיבים לציקלופוספמיד. טיפול בעכברים נושאי EG7 עם ציקלופוספמיד מביא למיגור הגידולים, מה שמרמז על כך שיש להשתמש בציקלופוספמיד בזהירות או לטייטל עבור מודלים רגישים של גידולים. השיטה החלופית המומלצת היא מינון תת-קרקעי יחיד של קרינה (4.5-5.5 Gy) יום אחד לפני ההעברה, והבחירה האופטימלית תלויה במאפיין של קווי תאי הגידול.
יש לנקוט צעדים אחרים בזהירות, כולל בחירה זהירה של עכברים תורמים נושאי גידול והפעולה הכירורגית העדינה במהלך השתלת הגידול. גידולים מושתלים יוסרו בניתוח ויושתלו בעכברים מושתלים תואמי גידול 8-10 ימים לאחר ההעברה. לפני ההשתלה, יש לבחור בגודל דומה של מסת גידול בקוטר של כ-5 מ"מ כאלוגרפט כדי לצמצם את הפערים בין עכברים בודדים ולהפוך את הנתונים הנרכשים לאמינים יותר. יתר על כן, במהלך הניתוח, החתך צריך להיות ליד קו האמצע של העכבר בחזרה כדי לשמור על allograft במרחק מהגידול שכבר קיים בעכבר המקבל. כריתה עדינה מוצעת גם כדי למנוע פציעות בבלוטת הלימפה המפשעתית וברקמות הסובבות אותה.
הרג יעיל של תאים סרטניים דורש תיאום של מרכיבים שונים בתוך TME33. ניתן להרחיב את הפרוטוקול המוצג כאן לחקירת תאי חיסון מסתגלים ומולדת כגון תאי הרג טבעיים, מקרופאגים הקשורים לגידול ותאים דנדריטיים. יתר על כן, בנוסף ל- B16F10-OVA המשמש כאן, פרוטוקול זה יכול להיות מיושם על מודלים אחרים של גידול תת עורי. לסיכום, בדיקת השתלת הגידול הנ"ל מציעה גישה חדשה לחקר מעברים אינטראקטיביים של סוגים מסוימים של תאי חיסון במהלך תגובות אנטי-סרטניות והיא שימושית לחוקרים באימונולוגיה של הגידול.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
מחקר זה נתמך על ידי מענקים מהקרן הלאומית למדעי הטבע לחוקרים צעירים מצטיינים (מס '31825011 ל- LY) ומהקרן הלאומית למדעי הטבע של סין (מס '31900643 ל- QH, מס ' 31900656 עד ZW).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
References
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867(2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794(2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507(2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169(2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806(2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved