Method Article
Trapianto di tumore per valutare la dinamica delle cellule T CD8+ infiltranti il tumore nei topi
In questo articolo
Erratum Notice
Riepilogo
Qui, presentiamo un protocollo di trapianto tumorale per la caratterizzazione di linfociti infiltrati tumorali intrinseci e periferici derivati dal tumore in un modello di tumore murino. Il tracciamento specifico dell'afflusso di cellule immunitarie derivate dal ricevente con citometria a flusso rivela la dinamica dei cambiamenti fenotipici e funzionali di queste cellule durante le risposte immunitarie antitumorali.
Abstract
L'immunità mediata dalle cellule T svolge un ruolo cruciale nelle risposte immunitarie contro i tumori, con i linfociti T citotossici (CTL) che svolgono un ruolo di primo piano nell'eradicazione delle cellule cancerose. Tuttavia, le origini e il rifornimento delle cellule T CD8+ specifiche dell'antigene tumorale all'interno del microambiente tumorale (TME) rimangono oscuri. Questo protocollo impiega la linea cellulare di melanoma B16F10-OVA, che esprime stabilmente il neoantigene surrogato, l'ovoalbumina (OVA) e i topi transgenici OT-I TCR, in cui oltre il 90% delle cellule T CD8 + riconosce specificamente il peptide OVAOVA 257-264 derivato (SIINFEKL) legato alla molecola del complesso maggiore di istocompatibilità (MHC) di classe I H2-Kb. Queste caratteristiche consentono lo studio delle risposte delle cellule T antigene-specifiche durante la tumorigenesi.
Combinando questo modello con la chirurgia del trapianto di tumore, i tessuti tumorali dei donatori sono stati trapiantati in topi riceventi singenici abbinati al tumore per tracciare con precisione l'afflusso di cellule immunitarie derivate dal ricevente nei tessuti dei donatori trapiantati, consentendo l'analisi delle risposte immunitarie del CD8+ antigene specifico intrinseco al tumore e alla periferia Cellule T. È stata riscontrata una transizione dinamica tra queste due popolazioni. Collettivamente, questo progetto sperimentale ha fornito un altro approccio per studiare con precisione le risposte immunitarie delle cellule T CD8 + nella TME, che getterà nuova luce sull'immunologia tumorale.
Introduzione
La risposta immunitaria mediata dalle cellule T CD8 + svolge un ruolo fondamentale nel controllo della crescita tumorale. Durante la tumorigenesi, le cellule T CD8+ naïve vengono attivate al momento del riconoscimento dell'antigene in modo limitato alla classe I MHC e successivamente si differenziano in cellule effettrici e si infiltrano nella massa tumorale 1,2. Tuttavia, all'interno del microambiente tumorale (TME), l'esposizione prolungata all'antigene, così come i fattori immunosoppressivi, guidano le cellule T CD8+ specifiche del tumore infiltrate in uno stato iporesponsivo noto come "esaurimento"3. Le cellule T esauste (Tex) sono distinte dalle cellule T effettrici o di memoria generate nell'infezione virale acuta, sia trascrizionalmente che epigeneticamente. Queste cellule Tex sono principalmente caratterizzate dall'espressione sostenuta ed elevata di una serie di recettori inibitori e dalla perdita gerarchica delle funzioni effettrici. Inoltre, la ridotta capacità proliferativa delle cellule T CD8+ esauste si traduce in una diminuzione del numero di cellule T specifiche del tumore, in modo tale che le cellule T CD8+ residue all'interno della TME possono a malapena fornire un'immunità protettiva sufficiente contro la progressione tumorale3. Pertanto, il mantenimento o il rinforzo delle cellule T CD8+ specifiche dell'antigene intratumorale è indispensabile per la repressione del tumore.
Inoltre, si ritiene che la terapia di blocco del checkpoint immunitario (ICB) rinvigorisca Tex nei tumori aumentando l'infiltrazione delle cellule T e, quindi, il numero di cellule T e ringiovanendo le funzioni delle cellule T per aumentare la repressione del tumore. L'applicazione diffusa del trattamento con ICB ha cambiato il panorama della terapia del cancro, con un sottogruppo sostanziale di pazienti che hanno sperimentato risposte durature 4,5,6. Tuttavia, la maggior parte dei pazienti e dei tipi di cancro non risponde o risponde solo temporaneamente al CNB. L'inadeguata infiltrazione di cellule T nella TME è stata postulata come uno dei meccanismi sottostanti alla resistenza del CNB 7,8.
Diversi studi hanno dimostrato l'eterogeneità delle cellule T CD8+ infiltranti il tumore (TIL) sia nei pazienti che nei modelli murini 9,10,11,12. È stato confermato che un sottogruppo di cellule T CD8+ che esprimono il fattore 1 delle cellule T (TCF1) in una massa tumorale presenta proprietà simili a quelle delle cellule staminali, che potrebbero ulteriormente dare origine a cellule T esaurite terminalmente ed è responsabile dello scoppio della proliferazione dopo la terapia con ICB 12,13,14,15,16,17,18,19,20, 21,22. Tuttavia, è stato dimostrato che solo una piccola percentuale di cellule TCF1+CD8+ antigene-specifiche esiste nella TME e genera un pool ampliato di progenie differenziata in risposta all'ICB 23,24,25,26. Se la dimensione limitata di questa popolazione sia sufficiente a garantire la persistenza dei linfociti T citotossici (CTL) per controllare la progressione del tumore rimane sconosciuto e se vi sia un rifornimento dai tessuti periferici richiede ulteriori indagini. Inoltre, recenti ricerche suggeriscono l'insufficiente capacità di rinvigorimento delle cellule T tumorali specifiche preesistenti e la comparsa di nuovi clonotipi precedentemente inesistenti dopo il trattamento con proteina 1 di morte cellulare anti-programmata. Ciò indica che la risposta delle cellule T al blocco del checkpoint potrebbe essere dovuta al nuovo afflusso di un repertorio distinto di cloni di cellule T27. Insieme alla presenza di frazioni di cellule T citotossiche non reattive al tumore nella TME, questi risultati hanno spinto la creazione di un modello di allotrapianto tumorale per studiare il ruolo delle cellule T CD8+ 11 derivate dalla periferia.
Fino ad ora, diversi tipi di impianto tumorale, così come il trasferimento adottivo delle cellule immunitarie, sono stati ampiamente utilizzati nel campo dell'immunologia tumorale28. I TIL, le cellule mononucleate del sangue periferico e le cellule immunitarie reattive al tumore originate da altri tessuti possono essere ben caratterizzate utilizzando questi metodi. Tuttavia, quando si studiano le interazioni tra immunità antitumorale sistemica e locale, questi modelli appaiono inadeguati per esaminare le interazioni tra le cellule immunitarie derivate dalla periferia e la TME. Qui, i tessuti tumorali sono stati trapiantati da donatori in topi riceventi abbinati al tumore per tracciare con precisione l'afflusso di cellule immunitarie derivate dal ricevente e osservare contemporaneamente le cellule derivate dal donatore nella TME.
In questo studio, è stato stabilito un modello singenico murino di melanoma con la linea cellulare di melanoma B16F10-OVA, che esprime stabilmente l'ovalbumina neoantigena surrogata. I topi ot-I transgenici TCR, in cui oltre il 90% delle cellule T CD8+ riconoscono specificamente il peptide OVAOVA 257-264 (SIINFEKL) legato alla molecola MHC di classe I H2-Kb, consentono lo studio delle risposte delle cellule T antigene-specifiche sviluppate nel modello tumorale B16F10-OVA. Combinando questo modello con il trapianto di tumore, le risposte immunitarie delle cellule T CD8+ antigene-specifiche intrinseche e periferiche intrinseche del tumore sono state confrontate per rivelare una transizione dinamica tra queste due popolazioni. Collettivamente, questo progetto sperimentale ha fornito un altro approccio per studiare con precisione le risposte immunitarie delle cellule T CD8 + nella TME, che getta nuova luce sulla dinamica delle risposte immunitarie delle cellule T specifiche del tumore nella TME.
Protocollo
Tutti gli esperimenti sui topi sono stati eseguiti in conformità con le linee guida dei comitati istituzionali per la cura e l'uso degli animali della Terza Università medica militare. Utilizzare topi C57BL/6 di 6-8 settimane e topi transgenici OT-I naïve del peso di 18-22 g. Usa sia maschio che femmina senza randomizzazione o "accecamento".
1. Preparazione del mezzo e dei reagenti
- Preparare il terreno di coltura cellulare D10 come descritto in precedenza29 aggiungendo il 10% di siero bovino fetale (FBS), 100 U / mL di penicillina, 100 mg / mL di streptomicina e 2 mM di L-glutammina nel Modified Eagle Medium di Dulbecco.
- Preparare il terreno di coltura cellulare R10 integrando RPMI-1640 con il 10% di FBS, 100 U / mL di penicillina e 100 mg / mL di streptomicina.
NOTA: I terreni di coltura, D10 e R10, possono rimanere sterili e stabili per almeno 2 settimane se conservati a 2-4 °C. - Preparare il tampone FACS (Fluorescence-Activated Cell Sorting) integrando 1x soluzione salina tamponata con fosfato (PBS) con il 2% di FBS e lo 0,01% di azide di sodio.
NOTA: Con l'aggiunta di azide di sodio, FACS Buffer può essere conservato a 2-4 °C per mesi. - Preparare il tampone di lisi dei globuli rossi (RBL) aggiungendo 155 mM NH4Cl, 10 mM KHCO3 e 0,1 mM di acido tetraacetico etilendiammina (EDTA) in acqua a doppia distillazione e regolare il suo pH a 7,3.
NOTA: il tampone RBL è stabile fino a 3 mesi a temperatura ambiente (RT). - Preparare il tampone MACS (Magnetic-Activated Cell Sorting) integrando PBS con albumina sierica bovina (BSA) allo 0,5% e EDTA da 2 mM.
NOTA: la soluzione deve essere fatta passare attraverso un filtro da 0,22 μm dopo che il reagente è stato sciolto e conservato in asepsi. - Preparare una soluzione di lavoro di 2,2,2-tribromoetanolo.
- Sciogliere 2,5 g di 2,2,2-tribromoetanolo in 5 ml di alcool terz-amilico (2-metil-2-butanolo). Mescolare un vibratore a temperatura costante a bagno di vapore a 180 giri/ min, 40 °C durante la notte.
- Filtrare la soluzione attraverso un filtro da 0,22 μm in un contenitore sterile. Aggiungere acqua a doppia distillazione fino a un volume finale di 200 ml e mescolare accuratamente e continuamente fino a quando la soluzione diventa chiara e trasparente.
- Determinare e regolare il valore del pH della soluzione a 7,3. Avvolgere completamente il contenitore con un foglio di alluminio per escludere la luce e conservare a 4 °C.
NOTA: La concentrazione finale della soluzione di lavoro di 2,2,2-tribromoetanolo è di 12,5 mg/ml. Una soluzione più concentrata non è raccomandata perché il materiale è irritante a concentrazioni più elevate. Testare il valore del pH della soluzione di lavoro prima di ogni utilizzo ed eliminarlo se il pH è inferiore a 5.
2. Preparazione della sospensione cellulare B16F10-OAV
NOTA: la coltura cellulare deve essere effettuata in una cappa di biosicurezza in condizioni asettiche rigorose.
- Scongelare e coltivare una fiala di cellule B16F10-OVA con D10 in un incubatore di colture cellulari a 37 °C e 5% di CO2.
- Quando le cellule raggiungono la confluenza di circa l'80-90%, sottoculturano le cellule.
- Rimuovere il terreno di coltura con un pipettor e risciacquare le cellule due volte usando PBS.
NOTA: non aggiungere PBS con forza contro le cellule aderenti nel pallone o nella parabola di coltura cellulare. Invece, pipettare il PBS verso un fianco o aggiungerlo a goccia nel pallone o nel piatto. - Rimuovere il PBS e aggiungere 1-2 ml di soluzione di tripsina-EDTA allo 0,25% nel matraccio o nel piatto. Oscillalo avanti e indietro per coprire l'intera superficie cellulare. Mettere il matraccio o il piatto in un'incubatrice a 37 °C per ~1 min o a RT fino a quando le cellule non si staccano.
NOTA: Un microscopio invertito può essere utilizzato per verificare se le cellule si sono staccate. - Aggiungi D10 fresco per interrompere la tripsinizzazione. Pipettare la sospensione su e giù per assicurarsi che tutte le cellule siano dissociate dalla superficie del pallone o del piatto.
- Trasferire la sospensione cellulare B16F10-OVA in un tubo conico da 15 mL. Centrifugare le celle a 125 × g per 5-7 min a RT.
- Scartare il surnatante e risospesciare il pellet cellulare con D10. Erogare la sospensione cellulare B16F10-OVA in un nuovo pallone o piatto di coltura cellulare contenente D10 e incubare in un incubatore di colture cellulari a 37 °C e 5% di CO2.
- Rimuovere il terreno di coltura con un pipettor e risciacquare le cellule due volte usando PBS.
- Il giorno dell'impianto del tumore, raccogliere le cellule B16F10-OAV che sono ~ 90% confluenti come descritto nei passaggi da 2.2.1 a 2.2.4. Scartare il surnatante e risospesciare il pellet cellulare con 1 mL di PBS.
- Conta le cellule vitali con un emocitometro usando lo 0,4% di tripano blu. Regolare la densità della cella a 1 × 106 celle per 100 μL aggiungendo PBS. Mantenere le cellule sul ghiaccio.
3. Impianto del tumore ectopico di cellule B16F10-OAV nella regione inguinale dei topi
- Utilizzare topi C57BL/6 di 6-8 settimane del peso di 18-22 g. Usa sia maschio che femmina senza randomizzazione o "accecamento".
- Prelevare 100 μL della sospensione cellulare B16F10-OAV preparata in una siringa tubercolina da 1 mL. Toccare la canna per spostare le bolle verso l'alto e spingere delicatamente lo stantuffo per rimuovere le bolle d'aria.
- Trattenere il mouse ed esporre il suo addome. Premere la zampa posteriore sinistra con il mignolo per stringere la pelle della regione inguinale sinistra.
- Rimuovere i peli del topo dal suo basso addome sinistro con un rasoio elettrico. Utilizzare cotone imbevuto di etanolo al 75% per pulire il quadrante posteriore dell'addome sinistro.
- Tenendo la siringa ad un angolo molto basso (0-15°) con la smussatura dell'ago rivolta verso l'alto, inserirla nel sito della parte superiore della coscia sinistra e avanzare di 0,5-1 cm attraverso il tessuto sottocutaneo nella regione inguinale.
- Tirare indietro lo stantuffo prima dell'iniezione. Se c'è una pressione negativa, premere completamente lo stantuffo e osservare emergere un piccolo bolo (formazione di tasca fluida) nel sottocute.
NOTA: se il sangue viene aspirato nel mozzo dell'ago, ritirare e riprovare in un altro sito. - Rimuovere l'ago dopo l'iniezione e smaltirlo in modo appropriato. Rilascia e rimetti il mouse nella gabbia.
- Misurare le dimensioni del tumore nei giorni 6-8 utilizzando una scala vernier dopo l'impianto di B16F10-OVA. Seleziona i topi con un tumore di circa 3 mm di diametro (delle dimensioni di un fagiolo mung) e dividili equamente e casualmente in due gruppi.
NOTA: I topi con tumori di dimensioni simili sono assegnati in modo casuale come topi donatori e riceventi; il tessuto tumorale abbinato asportato dai topi donatori sarà trapiantato nei topi riceventi. Inoltre, dovrebbero essere inclusi controlli non operati e controlli operati da sham per valutare gli effetti della chirurgia sul trasferimento di cellule adottive e sulla salute generale dei topi. Pertanto, un gruppo di topi portatori di tumore funge da controllo non operato, ricevendo cellule CD45.1 + CD45.2 + o CD45.1 + OT-I ma nessun intervento chirurgico. L'altro gruppo di topi funge da controllo fittizio, ricevendo cellule CD45.1 + CD45.2 + o CD45.1 + OT-I e successivo intervento chirurgico simile al gruppo sperimentale ma nessun trapianto di allotrapianto.
4. Trasferimento adottivo di cellule T OT-I marcate con antigenicamente in topi portatori di tumore
- Il giorno prima del trasferimento, somministrare 4 mg di ciclofosfamide disciolta in 200 μL di PBS tramite iniezione intraperitoneale a ciascun topo tumore.
NOTA: Il trattamento con ciclofosfamide mira a indurre la linfopenia nell'ospite che produce "spazio" per le cellule trasferite, promuovendo la loro sopravvivenza e l'homing agli organi linfoidi per funzionare in modo efficiente. - Utilizzare topi transgenici OT-I naïve con marcatori congenici distinti (6-8 settimane, 18-22 g, dello stesso sesso dei topi portatori di tumore). Utilizzare topi CD45.1+ OT-I e CD45.1+CD45.2+ OT-I per trasferire adottivamente le cellule T antigene-specifiche OVA257-264 rispettivamente in topi donatori e riceventi portatori di tumore.
NOTA: L'origine delle cellule OT-I trasferite adottivamente può essere facilmente identificata se presentano marcatori congenici o fluorescenti distinti. Ad esempio, iniettare cellule T CD45.1 + OT-I in topi donatori portatori di B16F10-OVA mentre iniettano cellule T CD45.1 + CD45.2 + OT-I in topi riceventi B16F10-OVA. CD45.1 e CD45.2 sono entrambe isoforme del marcatore pan-linfocitario CD45 (Ly5). Altri marcatori congenici comunemente usati includono diverse isoforme di CD90 (Thy1). Questo protocollo può essere utilizzato per topi portatori di diversi marcatori congenici. I topi OT-I dovrebbero essere dello stesso sesso dei topi che ricevono il trasferimento di cellule OT-I per evitare problemi di rigetto. - Isolare i linfociti dalla milza e dai linfonodi del topo OT-I.
NOTA: le seguenti procedure in questo passaggio devono essere eseguite in un armadio di biosicurezza per mantenere un'asepsi rigorosa.- Preparare due piastre di Petri da 60 mm × 10 mm. Aggiungere 3 ml di R10 medium in un piatto mentre si aggiungono 3 mL di tampone RBL in un altro piatto. Posizionare un filtro a celle di nylon da 70 μm nel piatto contenente il tampone RBL.
- Eutanasia di un topo OT-I in una camera isoflurano seguita da lussazione cervicale.
- Raccogliere i linfonodi della milza, dell'inguinale (subiliaco) e ascellare del topo e trasferirli in un piatto da 60 mm × 10 mm con 3 ml di R10 sul ghiaccio.
NOTA: Il numero di topi OT-I sacrificati può essere regolato in base al numero di topi portatori di tumore da trasferire. Una resa tipica di cellule T OT-I CD8+ da una milza e linfonodi bilaterali inguinali e ascellari di cellule T OT-I CD8+ è di ~ 30-100 × 106 cellule per topo. - Utilizzando la canna terminale di una siringa da 1 mL, macerare la milza in 3 mL di tampone RBL attraverso il colino. Incubare per 3 minuti a RT e terminare la reazione aggiungendo 3 ml di mezzo R10 freddo.
- Schiacciare i linfonodi fino a quando rimangono solo i tessuti connettivi. Risciacquare il filtro con R10. Trasferire la sospensione cellulare in un nuovo tubo conico da 15 mL. Centrifuga a 500 × g, 4 °C per 6 min.
- Decantare il surnatante e risospesciare le cellule in 3 ml di tampone MACS. Passare la sospensione cellulare attraverso un nuovo filtro cellulare da 70 μm per rimuovere eventuali flop.
- Centrifugare la sospensione cellulare a 500 × g per 5 min a 4 °C. Decantare il surnatante.
- Utilizzare un kit di isolamento delle cellule T CD8+ del mouse (vedere la Tabella dei materiali) per purificare le cellule T CD8+ mediante selezione negativa, secondo il protocollo del produttore.
NOTA: quando si utilizzano kit di altre aziende, seguire le istruzioni del produttore. - Mantenere la sospensione cellulare purificata sul ghiaccio. Prendi un piccolo campione di cellule e mescola con il tripano blu per contare le cellule usando un emocitometro.
- Determinare la percentuale di cellule OT-I (live/dead-CD8+Va2+) mediante citometria a flusso.
NOTA: La colorazione simultanea dei marcatori congenici e del TCR transgenico deve essere eseguita per verificare il fenotipo corretto delle cellule prima del trasferimento.- Aggiungere 5 × 104-1 × 105 celle in 1 mL di tampone FACS in un tubo centrifuga da 1,5 mL e centrifugare la sospensione cellulare a 350 × g, 4 °C per 3 min.
- Scartare il surnatante e disperdere le cellule facendo scorrere il fondo del tubo. Posizionare il tubo sul ghiaccio.
- Preparare le seguenti miscele di anticorpi coniugati (diluite in tampone FACS da 100 μL): anti-CD8, 1:200; anti-TCR Vα2, 1:100; anti-CD45.1, 1:200; anti-CD45.2, 1:200; e vivi/morti, 1:200 (fare riferimento alla Tabella dei Materiali).
- Vortice del cocktail di anticorpi e centrifuga a 15.000 × g per 3 minuti agli aggregati di anticorpi del pellet. Conservare il cocktail sul ghiaccio e proteggerlo dalla luce.
- Risospesciare le cellule con 100 μL di cocktail di anticorpi e mescolare accuratamente facendo scorrere il tubo. Incubare al buio per 30 minuti sul ghiaccio.
NOTA: Evitare di disturbare gli aggregati anticorpali nella parte inferiore del tubo. - Lavare il pellet due volte con 1 mL di tampone FACS. Centrifugare a 350 × g, 4 °C per 3 min. Risospesciare le celle in 200 μL di tampone FACS e trasferire la sospensione cellulare in un tubo FACS.
NOTA: Per mantenere la vitalità delle cellule OT-I da trasferire, testare il campione il prima possibile. Se le celle OT-I colorate non possono essere testate immediatamente, tenere le celle al buio sul ghiaccio o conservare in frigorifero a 4 °C fino all'analisi. In alternativa, i campioni possono essere risospesi in paraformaldeide all'1-4% per una conservazione prolungata (16 ore) per prevenire il deterioramento. - Eseguire il campione su un citometro a flusso. Calcola la percentuale di cellule vive/morte-CD8+Va2+ dividendo il numero di cellule vive/morte-CD8+Vα2+ per il numero di cellule vive/morte.
- Determinare il numero assoluto di cellule OT-I (live/dead-CD8+Va2+) moltiplicando la percentuale di cellule vive/dead-CD8+Va2+ per il numero di cellule vitali ottenuto nel passaggio 4.3.9.
- Regolare la concentrazione di cellule OT-I (live/dead-CD8+Va2+) a 1,5 × 106 /mL con PBS.
- Iniettare 3 × 105 distinte cellule OT-I marcate congenicamente (vivi/morti-CD8+Va2+) in 200 μL di PBS per via endovenosa in due gruppi di topi portatori di OAV B16F10 (topi portatori di tumore divisi in topi donatori e riceventi dal passo 3.8).
- Prelevare 200 μL di sospensione di cellule OT-I (live/dead-CD8+Va2+) in una siringa da insulina da 100 U (29 G) e rimuovere le bolle come nel passaggio 3.2.
- Posizionare il mouse separatamente in una gabbia con una lampada a infrarossi sopra la gabbia per 5-10 minuti per dilatare la vena della coda. Immobilizzare il mouse con un dispositivo di ritenuta di dimensioni appropriate. Tirare la coda per raddrizzarla e spruzzare con etanolo al 75% per rendere visibile la vena.
- Tenere la siringa parallela alla vena e inserirla nella vena con un angolo di 0-15°. Tirare leggermente indietro lo stantuffo e, se il sangue entra nella canna, iniettare lentamente e costantemente la sospensione ad una velocità non superiore a 1 ml / min.
NOTA: La resistenza o il gonfiore nel sito di iniezione indica che l'ago non è all'interno della vena; il sito di iniezione deve essere spostato prossimalmente. - Al termine dell'iniezione, rimuovere la siringa e premere delicatamente l'area di inserimento per 3-5 s per fermare il sanguinamento. Riportare il topo nella gabbia e osservarlo attentamente per alcuni minuti per le reazioni avverse. Se ha una normale mobilità e secrezione nasale, rimettilo in compagnia degli altri topi.
5. Sezionare la massa tumorale da topi donatori portatori di tumore
NOTA: Mantenere condizioni sterili durante l'intervento chirurgico nelle sezioni 5 e 6. Sterilizzare tutti gli strumenti chirurgici mediante autoclave prima e dopo ogni utilizzo. Disinfettare l'area operativa nell'armadio di biosicurezza con il 75% di etanolo seguito da irradiazione ultravioletta. Indossare un abito pulito, berretto, maschera facciale e guanti sterili.
- Da otto a dieci giorni dopo il trasferimento adottivo, selezionare topi donatori con massa tumorale comparabile di ~ 5 mm di diametro (dimensioni di soia) per la chirurgia di trapianto.
- Preparare un piatto da 100 mm × 20 mm in un armadio di biosicurezza e aggiungere 10 ml di PBS sterile ghiacciato.
- Eutanasia di un topo donatore portatore di tumore in una camera isoflurano seguita da lussazione cervicale. Immergere il mouse in etanolo al 75% per 3-5 minuti e trasferirlo nell'armadio di biosicurezza.
NOTA: le seguenti procedure in questo passaggio devono essere eseguite in un armadio di biosicurezza per mantenere un'asepsi rigorosa. - Posizionare il mouse su una scheda di dissezione ricoperta di carta assorbente pulita in posizione supina. Trattenere gli arti del topo con aghi di dissezione.
- Tagliare la pelle lungo la linea mediana da sopra l'orifizio uretrale allo xifoide con le forbici. Allungare la pelle verso il lato sinistro del corpo del topo con una pinzetta e trattenere la pelle con aghi di dissezione.
- Asportare il tumore, mantenendo la sua capsula il più intatta possibile. Rimuovere con cura e delicatezza il tessuto connettivo vicino al tumore con le forbici chirurgiche.
NOTA: Per mantenere l'integrità del tumore, non staccare la capsula tumorale o tagliare il tessuto tumorale in pezzi. - Posizionare il tessuto tumorale in un piatto da 100 mm × 20 mm contenente 10 ml di PBS sterile ghiacciato per il successivo trapianto.
6. Trapianto sottocutaneo di tumore derivato da donatore sui topi riceventi abbinati al tumore
NOTA: L'allotrapianto dovrebbe essere impiantato nel fianco inferiore del topo sullo stesso lato del tumore precedentemente esistente per far defluire due tumori al linfonodo identico. Nel protocollo qui presentato, poiché il tumore B16F10-OVA è stato impiantato per via sottocutanea sulla regione inguinale sinistra del topo (sezione 3), il tessuto tumorale derivato dal donatore è stato trapiantato sul fianco sinistro del ricevente in questa fase. Il sito di trapianto può essere adattato al sito tumorale impiantato per la prima volta.
- Anestetizzare un topo ricevente abbinato al tumore con 250 mg/kg di 2,2,2-tribromoetanolo tramite iniezione intraperitoneale. Pizzicare la punta di un arto estensore del topo per valutare il livello di anestesia e attendere la mancanza di riflesso del dolore, che indica la giusta profondità dell'anestesia per l'esecuzione dell'intervento chirurgico. Se si osserva vocalizzazione o astinenza degli arti posteriori, iniettare ulteriormente 0,01-0,03 ml di 2,2,2-tribromoetanolo.
NOTA: Il topo ricevente abbinato al tumore deve essere dello stesso sesso del topo donatore che fornisce l'allotrapianto per evitare problemi di rigetto. - Utilizzare unguento veterinario sugli occhi per prevenire la secchezza. Rasare il fianco sinistro del mouse con un rasoio elettrico. Applicare una crema depilatoria per rimuovere i capelli rimanenti.
NOTA: Evitare di abradere la pelle, che può aumentare il rischio di contaminazione e infezione. - Posizionare il mouse nell'armadio di biosicurezza. Posizionalo in posizione prona su un pannello di dissezione coperto di carta assorbente pulita, con l'asse verticale del mouse parallelo e la sua testa sul lato destro dello sperimentatore.
NOTA: le seguenti procedure in questo passaggio devono essere eseguite in un armadio di biosicurezza per mantenere un'asepsi rigorosa. - Strofinare la pelle dell'area rasata con cotone imbevuto di povidone-iodio.
NOTA: Utilizzare povidone-iodio invece di etanolo al 75% per la sterilizzazione per prevenire la perdita di calore corporeo. - Sollevare la pelle nel punto centrale tra le articolazioni dell'anca del topo con una pinzetta chirurgica. Usa le forbici per effettuare un'escissione verticale lunga 5 mm. Estendere il taglio rostralmente lungo la linea mediana dorsale a ~ 10-15 mm.
- Eseguire una dissezione acuta inserendo le punte chiuse delle forbici nell'incisione e quindi aprendo per separare il peritoneo del fianco sinistro dalla pelle e dai tessuti molli.
NOTA: Per evitare di causare danni al tessuto sottocutaneo e al peritoneo, sollevare la pelle al centro dell'incisione, quindi inserire le forbici chiuse il più vicino possibile alla pelle. - Crea una tasca per la pelle sul fianco sinistro eseguendo più volte una dissezione acuta. Depositare la massa tumorale incapsulata e intatta derivata dal donatore nella capsula.
NOTA: I topi nel gruppo di controllo a chirurgia fittizia ricevono la stessa operazione chirurgica senza il trapianto di tumore derivato dal donatore. - Chiudere l'incisione mediante sutura interrotta (vedere Elenco dei materiali). Posizionare 2-3 punti di sutura per ogni incisione. Disinfettare la pelle intorno al taglio con cotone imbevuto di povidone-iodio.
NOTA: Ci dovrebbero essere 5 mm tra due punti consecutivi e una distanza di 3 mm dall'incisione. - Posizionare il mouse in posizione laterale in una gabbia pulita e calda. Monitoralo continuamente fino a quando non ha riacquistato una coscienza sufficiente per mantenere la reclinazione sternale.
- Somministrare buprenorfina per via sottocutanea alla dose di 0,1 mg/kg di peso corporeo ogni 8 ore tre volte dopo l'intervento chirurgico per alleviare il dolore. Monitora il consumo, il bere, il movimento e l'area operata dal mouse. Restituire il ricevente del trapianto alla compagnia di altri animali solo dopo che si è completamente ripreso.
NOTA: Il topo in genere si riprende dal trauma dell'intervento entro 3 giorni. Se il topo non è tornato alla normale alimentazione e mobilità e mostra manifestazioni di infezione, consultare un veterinario per interventi o eutanasizzare. - Sacrificare (eutanasizzare gli animali come nel passaggio 4.3.2) i topi nei punti temporali indicati e recuperare le cellule di interesse per l'analisi citometrica a flusso.
Risultati
Lo schema di questo protocollo è mostrato nella Figura 1. Otto giorni dopo l'inoculazione tumorale, le cellule CD45.1+ e CD45.1+CD45.2+ OT-I sono state iniettate in topi C57BL/6 contenenti tumore B16F10-OVA. Il tumore è stato sezionato chirurgicamente da topi impiantati con cellule CD45.1+ OT-I (donatore) il giorno 8 post-trasferimento e trapiantato in topi impiantati con cellule OT-I CD45.1 + CD45.2 + abbinati al tumore (ricevente) nel fianco dorsale sullo stesso lato del tumore impiantato. Attraverso l'analisi della citometria a flusso (strategia di gating mostrata nella Figura 2), due popolazioni di cellule T antigene tumorali cd44 +CD8 + possono essere facilmente identificate nella TME, inclusi i TIL CD45.1+ derivati da donatori e CD45.1 + CD45.2 + derivati dal ricevente. Successivamente, le proporzioni di queste due popolazioni all'interno degli alloinnesti sono state analizzate nei punti temporali indicati per studiare la dinamica delle cellule T CD8+ antigene-specifiche. Al giorno 2 post-trapianto, c'erano circa l'83% delle cellule T CD8+ antigene-specifiche derivate dal donatore all'interno del tumore trapiantato, più predominanti rispetto alle loro controparti derivate dal ricevente. Tuttavia, la percentuale di cellule OT-I derivate dal ricevente era elevata nella fase avanzata della tumorigenesi, superando le cellule OT-I intrinseche del tumore derivate dal donatore. (Figura 3).
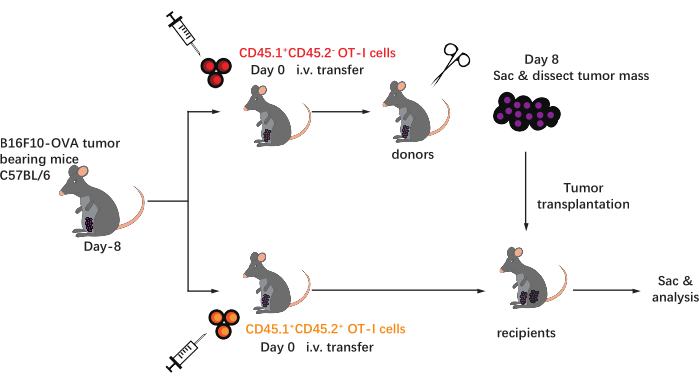
Figura 1: Schema del progetto sperimentale. C57BL/6mice sono sfidati con tumore B16F10-OVA sull'area inguinale. Otto giorni dopo, diverse cellule OT-I marcate congenicamente (CD45.1+ o CD45.1 + CD45.2+) vengono trasferite in topi portatori di tumore. Il giorno 8 post-trasferimento, il tumore sui topi impiantati con cellule CD45.1+ OT-I viene sezionato chirurgicamente e trapiantato per via sottocutanea in riceventi impiantati con cellule OT-I CD45.1 + CD45.2 + abbinati al tumore nello stesso lato del tumore esistente. Quindi, i topi vengono sacrificati e le cellule T antigene-specifiche (cellule OT-I) all'interno degli alloinnesti vengono analizzate nei punti temporali indicati. Abbreviazioni: CD = cluster di differenziazione; i.v. = per via endovenosa; Sac = sacrificio. Fare clic qui per visualizzare una versione più grande di questa figura.
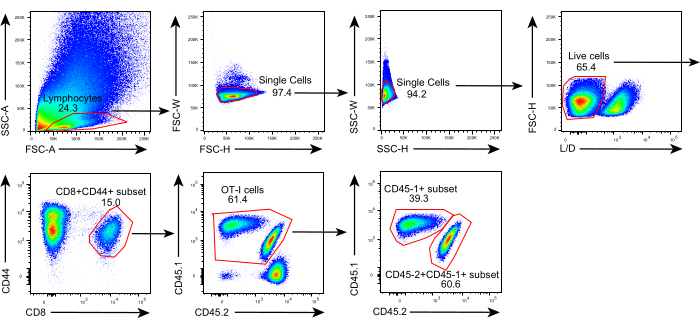
Figura 2: Strategia di Gating dell'analisi della citometria a flusso. Strategia di Gating utilizzata per identificare le cellule T CD44+CD8+ antigene-specifiche derivate dal donatore (CD45.1+CD45.2+) derivate dal donatore (CD45.1+) all'interno degli alloinnesti. Abbreviazioni: SSC-A = side scattering-area; FSC-A = area di scattering in avanti; FSC-W = larghezza di dispersione in avanti; FSC-H = altezza di scattering in avanti; SSC-W = larghezza di scattering laterale; SSC-H = altezza di scattering laterale; L/D = vivi/morti; CD = cluster di differenziazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Il rapporto tra cellule T CD8+ antigene-specifiche derivate da donatori e riceventi all'interno di alloinnesti tumorali. Grafici rappresentativi di citometria a flusso che mostrano l'espressione dei marcatori congeniti CD45.1 e CD45.2 utilizzati per identificare le cellule OT-I derivate da donatore e derivate dal ricevente all'interno di alloinnesti tumorali ai giorni 2, 8 e 15 dopo il trapianto. I numeri rappresentano le percentuali dei due sottoinsiemi nella popolazione di cellule T CD44+CD8+. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
L'immunità mediata dalle cellule T svolge un ruolo cruciale nelle risposte immunitarie contro i tumori, con le CTL che svolgono il ruolo principale nell'eradicazione delle cellule cancerose. Tuttavia, le origini delle CTL antigene tumorale specifiche all'interno della TME non sono state chiarite30. L'uso di questo protocollo di trapianto tumorale ha fornito un indizio importante sul fatto che le cellule T CD8+ specifiche dell'antigene intratumorale potrebbero non persistere a lungo, nonostante l'esistenza di cellule T CD8+ progenitrici TCF1+ simili allo staminale. In particolare, c'è un afflusso continuo di cellule T CD8 + specifiche del tumore derivate dalla periferia nella massa tumorale.
Per quanto ne sappiamo, questo è un metodo relativamente conveniente e convincente che conferma che il mantenimento delle cellule T CD8+ antigene-specifiche all'interno della TME dipende prevalentemente dal rifornimento di cellule T CD8+ specifiche del tumore derivate dalla periferia invece dell'auto-rinnovo dei TIL residenti nel tumore. Sebbene il protocollo qui presentato si concentri solo sulle proporzioni di TIL derivati da donatori e derivati dal ricevente, le proprietà fenotipiche, funzionali e trascrizionali di queste due popolazioni possono essere prontamente esaminate con la citometria a flusso. Inoltre, è possibile combinare gli anticorpi ICB per studiare le risposte di uno specifico sottogruppo cellulare alla terapia ICB.
In questo protocollo, il tessuto tumorale derivato dal donatore viene trapiantato sul topo ricevente con un tumore originale esistente. Due tumori in un topo ricevente porteranno alla distribuzione delle cellule T generate dalla periferia in due masse tumorali. Inoltre, il carico tumorale sarà quasi raddoppiato rispetto agli animali senza trapianti. In esperimenti pilota, abbiamo tentato di asportare il tumore originale sui topi riceventi prima del trapianto; tuttavia, è stato tecnicamente difficile eliminare completamente tutte le cellule tumorali chirurgicamente. Le cellule tumorali residue si assumerebbero rapidamente e presto formerebbero un nuovo tessuto tumorale. Pertanto, esiste una limitazione per questo sistema quando si confrontano le risposte immunitarie delle cellule T con quelle dei topi non trapiantati. Tuttavia, questo sistema è ancora utile per il confronto tra cellule T migrate di recente ed esistenti all'interno della stessa TME trapiantata da topi portatori di tumore donatore. Inoltre, non si può negare che il trapianto di tessuto tumorale possa portare a infiammazione, che potrebbe influenzare la dinamica delle cellule immunitarie all'interno del tumore. Sebbene l'impatto della chirurgia sull'infiltrazione delle cellule OT-I possa essere escluso attraverso controlli non operati e operati da sham, non abbiamo valutato gli effetti delle risposte infiammatorie locali alla dinamica delle cellule OT-I.
Alcune considerazioni dovrebbero essere prese in considerazione, una delle quali è l'uso della ciclofosfamide. La ciclofosfamide31 è un agente alchilante ampiamente usato per trattare tumori maligni di organi solidi e disturbi linfoproliferativi e autoimmuni. Da sei a otto giorni dopo l'inoculazione B16F10-OVA, la ciclofosfamide viene somministrata prima del trasferimento adottivo per indurre la linfodeplezione dei topi ospiti e migliorare l'attività delle cellule OT-I trasferite29. Sebbene il melanoma non sia sensibile a questo reagente, alcune linee cellulari tumorali, come EG732, una linea cellulare di linfoma timico murino, rispondono alla ciclofosfamide. Il trattamento dei topi portatori di EG7 con ciclofosfamide provoca l'eradicazione dei tumori, il che suggerisce che la ciclofosfamide deve essere attentamente utilizzata o titolata per modelli tumorali sensibili. Il metodo alternativo raccomandato è una singola dose subletale di radiazioni (4,5-5,5 Gy) un giorno prima del trasferimento e la scelta ottimale dipende dalle caratteristiche delle linee cellulari tumorali.
Altre misure devono essere prese con cautela, tra cui l'attenta selezione di topi donatori portatori di tumore e la delicata operazione chirurgica durante il trapianto di tumore. I tumori impiantati verrebbero rimossi chirurgicamente e trapiantati in topi riceventi abbinati al tumore 8-10 giorni dopo il trasferimento. Prima del trapianto, una dimensione comparabile della massa tumorale di ~ 5 mm di diametro deve essere scelta come allotrapianto per ridurre le discrepanze tra i singoli topi e rendere più affidabili i dati acquisiti. Inoltre, durante l'intervento chirurgico, l'incisione dovrebbe essere vicino alla linea mediana del topo indietro per mantenere l'alloinnesto a una distanza dal tumore già esistente nel topo ricevente. La dissezione delicata è anche suggerita per prevenire lesioni sul linfonodo inguinale e sui tessuti circostanti.
L'uccisione efficace delle cellule cancerose richiede il coordinamento di vari componenti all'interno della TME33. Il protocollo qui presentato può essere esteso allo studio di cellule immunitarie adattive e innate come cellule natural killer, macrofagi associati al tumore e cellule dendritiche. Inoltre, oltre al B16F10-OVA qui utilizzato, questo protocollo può essere applicato ad altri modelli di tumore sottocutaneo. Per concludere, il suddetto test di trapianto di tumore offre un nuovo approccio per lo studio delle transizioni interattive di alcuni tipi di cellule immunitarie durante le risposte antitumorali ed è utile per i ricercatori in immunologia tumorale.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questo studio è stato supportato da sovvenzioni del National Natural Science Fund for Distinguished Young Scholars (n. 31825011 a LY) e della National Natural Science Foundation of China (n. 31900643 a QH, n. 31900656 a ZW).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore | SLGPR33RB | |
| 1 mL tuberculin syringe | KDL | BB000925 | |
| 1.5 mL centrifuge tube | KIRGEN | KG2211 | |
| 100 U insulin syringe | BD Biosciences | 320310 | |
| 15 mL conical tube | BEAVER | 43008 | |
| 2,2,2-Tribromoethanol (Avertin) | Sigma | T48402-25G | |
| 2-Methyl-2-butanol | Sigma | 240486-100ML | |
| 70 μm nylon cell strainer | BD Falcon | 352350 | |
| APC anti-mouse CD45.1 | BioLegend | 110714 | Clone:A20 |
| B16F10-OVA cell line | bluefbio | BFN607200447 | |
| BSA-V (bovine serum albumin) | Bioss | bs-0292P | |
| BV421 Mouse Anti-Mouse CD45.2 | BD Horizon | 562895 | Clone:104 |
| cell culture dish | BEAVER | 43701/43702/43703 | |
| centrifuge | Eppendorf | 5810R-A462/5424R | |
| cyclophosphamide | Sigma | C0768-25G | |
| Dulbecco's Modified Eagle Medium | Gibco | C11995500BT | |
| EasySep Mouse CD8+ T Cell Isolation Kit | Stemcell Technologies | 19853 | |
| EDTA | Sigma | EDS-500g | |
| FACS tubes | BD Falcon | 352052 | |
| fetal bovine serum | Gibco | 10270-106 | |
| flow cytometer | BD | FACSCanto II | |
| hemocytometer | PorLab Scientific | HM330 | |
| isoflurane | RWD life science | R510-22-16 | |
| KHCO3 | Sangon Biotech | A501195-0500 | |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit, for 633 or 635 nm excitation | Life Technologies | L10199 | |
| needle carrier | RWD Life Science | F31034-14 | |
| NH4Cl | Sangon Biotech | A501569-0500 | |
| paraformaldehyde | Beyotime | P0099-500ml | |
| PE anti-mouse TCR Vα2 | BioLegend | 127808 | Clone:B20.1 |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PerCP/Cy5.5 anti-mouse CD8a | BioLegend | 100734 | Clone:53-6.7 |
| RPMI-1640 | Sigma | R8758-500ML | |
| sodium azide | Sigma | S2002 | |
| surgical forceps | RWD Life Science | F12005-10 | |
| surgical scissors | RWD Life Science | S12003-09 | |
| suture thread | RWD Life Science | F34004-30 | |
| trypsin-EDTA | Sigma | T4049-100ml |
Riferimenti
- Blank, C. U., et al. Defining 'T cell exhaustion. Nature Reviews Immunology. 19 (11), 665-674 (2019).
- Leko, V., Rosenberg, S. A. Identifying and targeting human tumor antigens for T cell-based immunotherapy of solid tumors. Cancer Cell. 38 (4), 454-472 (2020).
- McLane, L. M., Abdel-Hakeem, M. S., Wherry, E. J. CD8 T cell exhaustion during chronic viral infection and cancer. Annual Review of Immunology. 37, 457-495 (2019).
- Davis, M. M., Brodin, P. Rebooting human immunology. Annual Review of Immunology. 36, 843-864 (2018).
- Sharma, P., Allison, J. P. The future of immune checkpoint therapy. Science. 348 (6230), 56-61 (2015).
- Littman, D. R. Releasing the brakes on cancer immunotherapy. Cell. 373 (16), 1490-1492 (2015).
- Verma, V., et al. PD-1 blockade in subprimed CD8 cells induces dysfunctional PD-1(+)CD38(hi) cells and anti-PD-1 resistance. Nature Immunology. 20, 1231-1243 (2019).
- Hashimoto, M., et al. CD8 T cell exhaustion in chronic infection and cancer: opportunities for interventions. Annual Review of Medicine. 69, 301-318 (2018).
- Dammeijer, F., et al. The PD-1/PD-L1-checkpoint restrains T cell immunity in tumor-draining lymph nodes. Cancer Cell. 38 (5), 685-700 (2020).
- Buchwald, Z. S., et al. Tumor-draining lymph node is important for a robust abscopal effect stimulated by radiotherapy. Journal for ImmunoTherapy of Cancer. 8 (2), 000867(2020).
- Philip, M., Schietinger, A. Heterogeneity and fate choice: T cell exhaustion in cancer and chronic infections. Current Opinion in Immunology. 58, 98-103 (2019).
- Miller, B. C., et al. Subsets of exhausted CD8(+) T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. 20, 326-336 (2019).
- Wu, T. D., et al. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 579, 274-278 (2020).
- Im, S. J., Konieczny, B. T., Hudson, W. H., Masopust, D., Ahmed, R. PD-1+ stemlike CD8 T cells are resident in lymphoid tissues during persistent LCMV infection. Proceedings of the National Academy of Sciences of the United State of America. 117 (8), 4292-4299 (2020).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Myers, L. M., et al. A functional subset of CD8(+) T cells during chronic exhaustion is defined by SIRPalpha expression. Nature Communications. 10 (1), 794(2019).
- Jansen, C. S., et al. An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature. 576, 465-470 (2019).
- Jadhav, R. R., et al. Epigenetic signature of PD-1+ TCF1+ CD8 T cells that act as resource cells during chronic viral infection and respond to PD-1 blockade. Proceedings of the National Academy of Sciences of the United State of America. 116 (28), 14113-14118 (2019).
- Li, H., et al. Dysfunctional CD8 T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 176 (4), 775-789 (2018).
- Kurtulus, S., et al. Checkpoint blockade immunotherapy induces dynamic changes in PD-1(-)CD8(+) tumor-infiltrating T cells. Immunity. 50 (1), 181-194 (2019).
- Fransen, M. F., et al. Tumor-draining lymph nodes are pivotal in PD-1/PD-L1 checkpoint therapy. JCI Insight. 3 (23), 124507(2018).
- E, J. F., et al. CD8(+)CXCR5(+) T cells in tumor-draining lymph nodes are highly activated and predict better prognosis in colorectal cancer. Human Immunology. 79 (6), 446-452 (2018).
- Snell, L. M., et al. CD8(+) T cell priming in established chronic viral infection preferentially directs differentiation of memory-like cells for sustained immunity. Immunity. 49 (4), 678-694 (2018).
- Siddiqui, I., et al. Intratumoral Tcf1(+)PD-1(+)CD8(+) T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy. Immunity. 50 (1), 195-211 (2019).
- Wang, Y., et al. The transcription factor TCF1 preserves the effector function of exhausted CD8 T cells during chronic viral infection. Frontiers in Immunology. 10, 169(2019).
- Krishna, S., et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 370 (6522), 1328-1334 (2020).
- Yost, K. E., et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nature Medicine. 25, 1251-1259 (2019).
- Zitvogel, L., Pitt, J. M., Daillere, R., Smyth, M. J., Kroemer, G. Mouse models in oncoimmunology. Nature Reviews Cancer. 16 (12), 759-773 (2016).
- Li, Y., et al. Bcl6 preserves the suppressive function of regulatory T cells during tumorigenesis. Frontiers in Immunology. 11, 806(2020).
- Yu, D., Ye, L. A portrait of CXCR5(+) follicular cytotoxic CD8(+) T cells. Trends in Immunology. 39 (12), 965-979 (2018).
- Bracci, L., et al. Cyclophosphamide enhances the antitumor efficacy of adoptively transferred immune cells through the induction of cytokine expression, B-cell and T-cell homeostatic proliferation, and specific tumor infiltration. Clinical Cancer Research. 13 (2), 644-653 (2007).
- Salem, M. L., El-Naggar, S. A., Mahmoud, H. A., Elgharabawy, R. M., Bader, A. M. Cyclophosphamide eradicates murine immunogenic tumor coding for a non-self-antigen and induces antitumor immunity. International Journal of Immunopathology and Pharmacology. 32, 1-5 (2018).
- Thorsson, V., et al. The Immune landscape of cancer. Immunity. 48 (4), 812-830 (2018).
Erratum
Formal Correction: Erratum: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice
Posted by JoVE Editors on 4/29/2022. Citeable Link.
An erratum was issued for: Tumor Transplantation for Assessing the Dynamics of Tumor-Infiltrating CD8+ T Cells in Mice. The Protocol was updated.
Step 6.10 of the Protocol was updated from:
Administer penicillin every 8-12 h after the surgery for 3 days. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The administration of buprenorphine is suggested to prevent post-surgical pain [delete sentence]. The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
to:
Administer buprenorphine subcutaneously at a dose of 0.1 mg/kg body weight every 8 h three times after surgery to alleviate the pain. Monitor the mouse's eating, drinking, moving, and the area operated on. Return the transplant recipient to the company of other animals only after it has fully recovered.
NOTE: The mouse typically recovers from the trauma of the surgery within 3 days. If the mouse is not back to normal feeding and mobility and shows any manifestations of infection, consult a veterinarian for interventions or euthanize it.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.
